【整理】基因编辑最新进展
1.Nature发布PSCK9碱基编辑疗法最新数据:一次注射PCSK9降低约90%,持续长达10个月
据6月26日报道,首个人体基因编辑临床试验数据刊登在新英格兰医学杂志上,效果突出、副作用良好,全球医药界兴奋不已,正在开启一针治愈遗传病的新时代。0.3mg/kg剂量组的3名病人,注射28天后,血浆ATTR蛋白平均下降87%,这个结果已经优于目前终身药物治疗的效果(约80%),而且正在试验1mg/kg剂量组,效果有望进一步提升。另外,人体起效剂量大约只有猴子试验剂量的十分之一。临床前基因测序的结果显示,该药基因编辑不会造成有效的基因脱靶。该试验中安全性非常好,没有1级以上副作用。
2.据2021-06-25报道,Journal of Genetics and Genomics在线发表了河北农业大学生命科学学院李君教授团队题为“The CRISPR/Cas9 revolution continues: from base editing to prime editing in plant science”的综述文章。该论文系统阐述了基于CRISPR/Cas9的精准基因编辑在植物中的技术优化研究进展及应用前景。
CRISPR/Cas是细菌抵抗噬菌体入侵的适应性免疫系统。科学家将其改造,使其在体外具有DNA编辑能力。2013年,CRISPR/Cas9首次用于动植物基因组编辑,成为继ZFN和TALEN之后的第三代基因组编辑技术并被迅速推广。自CRISPR/Cas9基因编辑技术问世以来,基因组编辑领域发展十分迅速,极大地促进生命科学的发展。除了用于疾病治疗、药物研发、基因功能研究,该技术在农作物的遗传改良领域也有不可估量的作用。
该论文主要从以下三方面介绍CRISPR/Cas9在植物中的最新研究进展,包括:1、CRISPR/Cas9基因编辑技术及其在植物中的应用。利用该技术构造大量突变体,为植物基因功能解析及作物遗传改良提供丰富的遗传材料。2、基于CRISPR/Cas9开发的包括单碱基编辑和引导编辑等在内的精准基因编辑技术。利用单碱基编辑技术在植物基因组特定位点可以实现C•G碱基对向T•A碱基对的转换、A•T碱基对向G•C碱基对的转换。引导编辑可以在植物基因组的特定位点引入12种碱基—碱基转换、少量碱基的定点缺失和插入,将基因组编辑提升到了一个新的水平。3、精准基因编辑技术在植物中的应用。利用单碱基编辑技术构造功能缺失、功能获得性突变体等,对解析植物基因功能、构建优良作物材料尤为重要。例如,使用单碱基编辑和引导编辑技术构建对多种除草剂有广谱抗性的水稻和小麦材料,为杂草防控提供新的育种资源。CRISPR/Cas9作为一种不产生外源基因的基因编辑方法,使其免受转基因作物相关的种植与销售法律监管,具有广阔的应用前景。
基于CRISPR/Cas9的精准基因编辑技术
首都师范大学生命科学学院李岩博士和河北农业大学生命科学学院硕士研究生李文静为该论文的共同第一作者,李君教授为该论文的通讯作者。相关工作得到国家自然科学基金、河北省优秀青年科学基金、河北省教育厅拔尖人才项目和河北农业大学引进人才项目的资助。
论文链接:
https://www.sciencedirect.com/science/article/pii/S1673852721001302
3.科研人员利用基因编辑技术创制出新的小麦品质基因资源
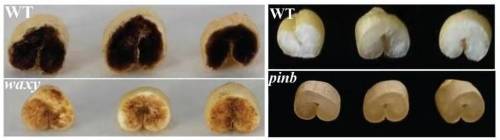
据6月23日报道, 山东省农科院作物所小麦分子育种创新团队在《Plant Biotechnology Journal》发表了题名《CRISPR/Cas9-mediated genome editing for wheat grain quality improvement》的研究论文。本研究利用农杆菌介导的CRISPR/Cas9系统分别对与面粉吸水率密切相关的籽粒硬度Pinb基因、与淀粉品质相关的Waxy基因、与面团褐变相关的Ppo基因以及面粉黄色素含量相关的Psy基因进行精准打靶,获得了一批具有新优异等位基因的小麦新资源。
编辑后的Pinb基因编码区缺失34bp,这是迄今为止在小麦pinb基因中创制的第一个大片段缺失材料,突变体的硬度指数由18.2提高到73.4,大大提高其籽粒硬度,一步将软质小麦变成了硬质小麦。编辑后的Waxy基因在编码区缺失1bp,纯合突变体籽粒碘染色变为红棕色,这是糯小麦的典型特征,表明1个碱基的缺失就可以将非糯小麦转化为糯小麦。编辑后的Ppo基因编码区缺失2bp,其籽粒PPO活性由9.0Ug-1min-1降低到1.24Ug-1min-1,活性降低了90%,显着降低了面制品褐变水平。编辑后的Psy基因突变体的黄色素含量平均值由2.81mg/kg降低到1.68mg/kg,面粉白度显着提高。
作物所李根英博士和李玉莲博士为论文的共同通讯作者,张淑娟博士和张荣志博士为该文共同第一作者,美国马里兰大学的戚益平副教授参与了本研究。该研究由山东省农业良种工程、国家自然科学基金、山东省重点研发计划(重大科技创新工程)、院农业科技创新工程和马里兰大学启动基金资助。
4.Science子刊:利用脂质体纳米颗粒递送靶向IL1RAP基因的CRISPR/Cas9,可让白血病干细胞无处可逃
2021年6月18日讯,在一项新的研究中,来自美国和韩国的研究人员开发出一种攻击白血病的最新方法,该方法有点像消灭蟑螂。它是一个三步骤过程:使用尖端技术诱导、诱捕和杀死白血病细胞的根源:白血病干细胞(leukemia stem cell, LSC),又称为白血病起始细胞(leukemia-initiating cell, LIC)。这一发现对于治疗AML患者具有重要的临床意义。相关研究结果近期发表在Sciences Advances期刊上,论文标题为“Scaffold-mediated CRISPR-Cas9 delivery system for acute myeloid leukemia therapy”。
论文第一作者、美国罗彻斯特大学医学中心威尔莫特癌症研究所血液学/肿瘤学研究助理教授Tzu-Chieh (Kate) Ho博士说,尽管这项研究还处于早期阶段,只在小鼠和人类细胞培养物中进行了测试,但它与化疗等标准方法有很大不同,因为它使科学家能够校正那些助长癌症的错误基因。
这些作者开发的这种新方法使用可以编辑细胞内基因的CRISPR/Cas9技术。具体而言,他们使用一种生物还原性脂质体封装的Cas9/单向导RNA(sgRNA)核糖核蛋白[脂质体纳米颗粒(LNP)-Cas9 RNP]来靶向人类LSC中的关键基因:白细胞介素-1受体辅助蛋白(IL1RAP)。为了增强对LSC的靶向性,他们将LNP-Cas9 RNP和趋化因子CXCL12α装载到模拟骨髓微环境的涂有间充质干细胞膜的纳米纤丝(mesenchymal stem cell membrane–coated nanofibril, MSCM-NF)支架上。
在体外,CXCL12α释放诱导LSC迁移到MSCM-NF支架上,LNP-Cas9 RNP就高效地对LSC中的IL1RAP基因进行编辑,从而实现IL1RAP基因敲除。IL1RAP基因敲除会降低LSC集落生成能力和白血病负荷。基于MSCM-NF支架的递送可增加LNP-Cas9在骨髓腔中的停留时间。总之,通过装载CXCL12α的LNP/MSCM-NF支架局部持续递送Cas9/IL1RAP sgRNA提供了一种高效减少LSC生长的策略,从而改善AML疗法。
Cas9 RNP递送系统原理图,图片来自Science Advances, 2021, doi:10.1126/sciadv.abg3217。
能够靶向LSC是非常重要的;众所周知,白血病即使在长期缓解后也会复发,这是因为LSC可以从休眠中苏醒过来。因此,现代科学的一大发展方向是使用最先进的材料来寻找并直接消灭LSC细胞群体。
几年前,当Ho在罗切斯特大学医学中心进行博士学位研究时,她在LSC的细胞表面上发现了一种重要的蛋白质:IL1RAP,此外,这种蛋白在正常的造血干细胞/祖细胞中极少表达,这使得它有望成为抗癌药物的作用靶标。
Ho继续在纪念斯隆-凯特琳癌症中心和哥伦比亚大学开发创新的小鼠模型和生物医学工程材料,以便可以更有效地和直接地递送靶向IL1RAP等蛋白靶点的药物。一年前,她回到威尔莫特癌症研究所,在Michael Becker实验室从事研究工作。该实验室几年来一直在研究恶性LSC细胞群体。
在患者身上进行临床试验还需要几年时间。这些作者还在与制药公司发展合作关系,以寻找能够靶向IL1RAP蛋白的药物。(生物谷 Bioon.com)
参考资料:Tzu-Chieh Ho et al. Scaffold-mediated CRISPR-Cas9 delivery system for acute myeloid leukemia therapy. Science Advances, 2021, doi:10.1126/sciadv.abg3217.
据6月5日报道,瑞士苏黎世联邦理工学院Gerald Schwank与加拿大Acuitas治疗公司Sean C. Semple团队合作,在国际学术期刊《自然-生物技术》杂志上在线发表了题为“In vivo adenine base editing of PCSK9 in macaques reduces LDL cholesterol levels”的文章,研究表明在猕猴体内对PCSK9进行腺嘌呤碱基编辑可降低低密度脂蛋白(LDL)水平。
可编程CRISPR-Cas核酸酶通过在目标位置使双链DNA断裂来实现基因组编辑,但在有丝分裂后的细胞中十分低效。而碱基编辑器是最近开发的基因组工程工具,能在转换率低的组织中进行精确有效的编辑。
对于碱基编辑的临床应用,其主要的局限性在于产生潜在的非靶突变。非靶突变可以是单导向RNA (sgRNA)依赖的或sgRNA独立的,并受碱基编辑器表达水平和持续时间的影响。此外,体内碱基编辑尚未在大型动物模型中得到证实。
瑞士苏黎世联邦理工学院Gerald Schwank与加拿大Acuitas治疗公司Sean C. Semple团队合作,在国际学术期刊《自然-生物技术》杂志上在线发表了题为“In vivo adenine base editing of PCSK9 in macaques reduces LDL cholesterol levels”的文章,研究表明在猕猴体内对PCSK9进行腺嘌呤碱基编辑可降低低密度脂蛋白(LDL)水平。
PCSK9,主要在肝脏中表达,是LDL受体的负调节因子。研究人员用腺嘌呤碱基编辑(ABE)在小鼠Hepa细胞中定位了几个典型的PkcK9剪接位点来试图降解PkcK9的mRNA和蛋白质,最后确定了sgRNA_mP01和sgRNA_hP01分别用于小鼠和食蟹猴的体内实验。并且通过将不同的SpCas9-TadA构建体与sgRNA_mP01一起导入小鼠的肝脏,实验表明其血浆Pcsk9水平以及血浆LDL水平显着降低。并且在小鼠中诱导了高达67%的编辑(平均61%),在猕猴中诱导了高达34%的编辑(平均26%)。小鼠血浆PCSK9和LDL水平分别稳定降低95%和58%,猕猴稳定降低32%和14%。
随后,研究人员探究了长期ABE表达产生的非靶突变,在分子水平评估了在DNA和RNA中的非靶突变。实验表明ABE mRNA的非靶效应是暂时的,在注射后第17天就不再检测到,而在基因组DNA中也未发现靶外突变。这些结果表明腺嘌呤碱基在体内编辑是有效和安全的,并有可能用于遗传性肝病患者的治疗目的。
最后,作者为了进一步评估ABE在临床相关大动物模型中的可行性,在成年食蟹猴(食蟹猴)中编辑了PCSK9。实验表明,猕猴的ABE可抑制PCSK9从而降低血液LDL。而且与小鼠实验不同的是猕猴中观察到SpCas9和TadA的特异性IgG抗体,说明产生了对ABE的体液免疫反应,这可能也是猕猴中的再给药没有增加编辑的原因。
总之,本片文章研究了小鼠和食蟹猴肝脏中ABEs降低血液低密度脂蛋白(LDL)水平的有效性和安全性。利用脂质纳米颗粒实现ABE编码基因和靶向PCSK9(LDL的负调节因子)单向导RNA的递送,这在小鼠中可实现高达67%的碱基编辑(平均61%)水平,在猕猴中也可实现高达34%的编辑(平均 26%)效率。
血浆PCSK9和LDL的含量在小鼠中分别稳定降低了95%和58%,在猕猴中分别降低了32%和14%。ABE mRNA可被迅速清除,并且在基因组DNA中未发现脱靶突变。对猕猴进行重新给药并未增加编辑,这可能是由于治疗后对ABE产生的体液免疫反应所致。这些发现都为进一步利用ABE治疗单基因突变肝病患者提供了支持。
6.Nature:重大进展!利用碱基编辑让致病性血红蛋白无害化,有望治疗镰状细胞病
据2021-06-04报道, 在一项新的研究中,由来自美国布罗德研究所和圣犹大儿童研究医院的研究人员领导的一个研究团队证实一种碱基编辑方法能够高效地校正患者造血干细胞中和小鼠体内导致SCD的基因突变。这种基因编辑治疗利用碱基编辑将致病性的血红蛋白基因转化为良性的基因变体,挽救了SCD动物模型中的疾病症状,使健康的血细胞得以持久地产生。相关研究结果于2021年6月2日在线发表在Nature期刊上,论文标题为“Base editing of haematopoietic stem cells rescues sickle cell disease in mice”。
SCD的根源是患者携带血红蛋白基因HBB的两个突变拷贝。这两个突变拷贝导致红细胞从圆盘状转变为镰刀状,引发一连串事件,最终导致器官损伤、复发性疼痛和早期死亡。在这项研究中,这些作者使用了一种称为碱基编辑的分子技术,在人类造血干细胞中和SCD小鼠模型体内直接将致病性的HBB基因(HBBS)转换成无害的望加锡(Makassar)HBB基因变体(HBBG)。
论文共同通讯作者、布罗德研究所梅金医疗转化技术研究所主任、哈佛大学教授、霍华德-休斯医学研究所研究员David Liu说,“我们能够在细胞模型和动物模型中使用定制的碱基编辑器来校正致病性的基因变体,而不需要诱导双链DNA断裂或在基因组中插入新的DNA片段。这是一项重大的团队努力,我们希望碱基编辑将为SCD治疗策略提供一个有希望的基础。我们的研究说明了多学科合作在开发基于机制的新型遗传疾病治疗方法方面的力量和和兴奋点。特别是,我们结合了蛋白质工程、碱基编辑和红血球生物学方面的专业知识,从而构建出一种治疗和可能治愈SCD的新方法。”
7.链霉菌碱基编辑研究获进展
中国科学院天津 工业生物技术 研究所研究员王猛带领的高通量编辑与筛选平台实验室,与天津科技大学教授花而并团队合作,在模式菌株变铅青链霉菌Streptomyces lividans 66中研究了UDG与碱基编辑效率的关系,开发出新一代碱基编辑器asRNA-BE(antisense RNA interference-enhanced CRISPR/Cas9 Base Editing method)。科研人员利用融合了胞苷脱氨酶rAPOBEC1的BE系列碱基编辑器,实现基因组三个次级代谢基因的编辑。在此基础上,利用CRISPR/Cas9辅助的基因敲除手段,分别构建了尿嘧啶DNA糖苷酶UDG1和UDG2的单敲和双敲菌株,发现在失活UDG1的情况下,碱基编辑效率可较原始提高3.4倍到67.4倍不等。考虑到UDG是细胞修复过程中的关键酶,其长期缺失不利于菌株基因组的稳定,科研人员利用反义RNA干扰降低基因表达水平的策略代替基因敲除,在原始的BE编辑器基础上整合了针对UDG的反义RNA干扰模块,构建了新一代碱基编辑器asRNA-BE,将编辑效率提高至原来的2.8倍到65.8倍不等。asRNA-BE编辑器可以在碱基编辑过程中瞬时抑制UDG的表达,而在编辑结束后又可以通过温敏型质粒的消除恢复UDG的表达水平,在提高编辑效率的同时避免了对于细胞不可逆的伤害。基因组测序结果也表明,与BE编辑器相比,asRNA-BE编辑器在大幅度提高编辑效率的同时,并未引起额外的脱靶,在工业菌株改造等方面具有良好的应用前景。