Brain Stimulation:经颅超声神经调控的人体研究—对其有效性和安全性的系统综述
摘要
经颅超声刺激(Transcranial ultrasound stimulation,TUS)作为一种安全、无侵入性的技术在人体研究中越来越关注。本文回顾人体研究,关注于TUS设备、超声参数、结果测量、结果和不良反应,并强调未来的研究方向。通过系统综述至2022年1月12日Web of Science和PubMed数据库中35项聚焦/非聚焦TUS的人体研究,包含677名受试者,属于不同的队列,包括健康、慢性疼痛、痴呆、癫痫、创伤性脑损伤、抑郁症的患者,刺激效果随超声参数变化不一致,评估方式包括临床、神经生理学、放射学和组织学指标。虽然研究中未报告严重的不良反应,但3.4%(14/425)的受试者观察到轻度症状,包括头痛、情绪恶化、头皮发热、认知问题、颈部疼痛、肌肉抽搐、焦虑、嗜睡和瘙痒。总之,TUS仍处于早期阶段,TUS可以改变短期的大脑兴奋性和连通性,诱导长期的可塑性并调节行为。未来应该进一步阐明其潜在机制,从而拓展应用。
1.介绍
经颅超声刺激(TUS)是一种日益受欢迎的、非侵入性的神经调节形式,正在迅速、广泛地应用。目前,TUS优势是高空间分辨率,针对脑深部结构的有效性,相对较低的成本和良好安全性。
2.进展
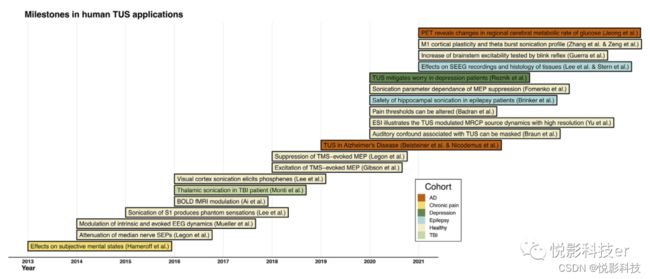
第一个TUS人类研究追溯到2013年,是一项双盲交叉研究,显示慢性疼痛患者的额叶皮质超声处理后,疼痛和情绪评分得到改善。一年后,研究表明,TUS调节了初级躯体感觉皮层(S1)的活动,以及内在的和诱发的脑电图(EEG)动态。后来,TUS直接作用在S1产生手部幻觉,并存在超声特异性诱发电位。同研究团队还发现光刺激视觉诱发电位(VEP)与初级视觉皮层(V1)的超声诱发电位相似。2016年,首个功能磁共振成像(fMRI)-TUS研究揭示了TUS诱导血氧水平依赖(BOLD)信号变化的潜力。同年,又有学者报告一例创伤性脑损伤患者接受丘脑TUS治疗得到临床改善。2018年,第一次利用TMS运动诱发电位(MEP)技术,聚焦经颅超声刺激(fTUS)减弱了TMS诱发的MEP振幅(在线效应),而另一项研究发现在诊断超声(dUS)刺激后却显示了增强的效果(离线效应)。2019年,有学者开始在痴呆症患者身上开展试验。至今,超过一半的研究都是在2020年或以后发表的,因此TUS人类研究的最近增长加快。TUS的安全性已经在两个新的患者队列-耐药癫痫和抑郁中得到了证明。对健康受试者的fTUS研究更细致发现,超声过程中MEP抑制作用取决于超声参数设置,超声可以改变疼痛阈值,TUS相关的听觉混淆可以通过耳机传递音频波形来掩盖。2021年最主要的成就是发现重复的fTUS和theta-突发fTUS刺激方案诱导运动皮层可塑性的神经生理学证据。其他的突破包括利用正电子发射断层扫描评估痴呆患者脑糖代谢,调节脑干兴奋性测试眨眼反射,和评估立体声脑电图(SEEG)记录和癫痫患者组织学变化。
图1.低强度经颅超声应用于人体受试者的里程碑,图中研究为报告调节特定神经生理结果的第一个实例,或在经颅超声的技术应用中特别重要的见解,不同颜色为特定的脑目标/患者群体。AD:阿尔茨海默病BOLD:血氧水平依赖;脑电图ESI:电生理源成像;fMRI:功能磁共振成像;MEP:运动诱发电位;MRCP:运动相关皮质电位;PET:正电子发射断层扫描;S1:初级体感觉皮层;SEEG:立体脑电图;SEP:体感诱发电位;TBI:创伤性脑损伤;TMS:经颅磁刺激;TUS经颅超声。
3. 用于人体研究的TUS原理介绍和装置
回顾一下相关的声学原理。增加基频(f0)减少了焦光斑的大小,但却导致了通过头盖骨后声波更高的衰减。一些研究表明,最佳的声学f0对于颅骨的穿透率低于700kHz。此外,焦光斑尺寸也随着传感器孔径尺寸的增大而减小。根据这些原理,fTUS系统和dUS系统之间的区别可以总结为:
a)fTUS可以将光束聚焦到一个相对较小的区域,而dUS的发散光束会影响较大的区域。
b)fTUS设备允许脉冲波模式,而dUS设备通常使用连续波模式。
c)dUS设备工作在高f0(1-15MHz)为高质量的图像分辨率,在fTUS设备中,f0通常设置为<700kHz。
d)换能器形状(声透镜聚焦凹或多通道相位聚焦平为fTUS,凸为dUS)和孔径大小不同的系统。
超声结合经颅脉冲刺激(TPS)是一种经CE批准的新技术,不同于传统的fTUS。TPS系统产生单个超短(3ms)超声脉冲,能量水平为0.2-0.3mjmm-2,脉冲频率为1-5Hz。这些类似冲击波的单脉冲有一个较大的正峰振幅,然后是一个较小的负振幅脉冲;相反,fTUS应用高频周期波和在几百毫秒范围内的长超声波训练。TPS的作用机制尚不清楚,可能与fTUS不同。有人认为,与传统的fTUS相比,TPS系统除了具有更好的颅骨穿透率,具有更低的脉冲频率,可以更好地避免危险的脑加热和二次刺激最大值。
表1总结了在人体研究中使用的设备模型。设备可大致可分为两类:聚焦经颅超声刺激(fTUS)和非聚焦诊断超声(dUS)设备。
4.刺激效应
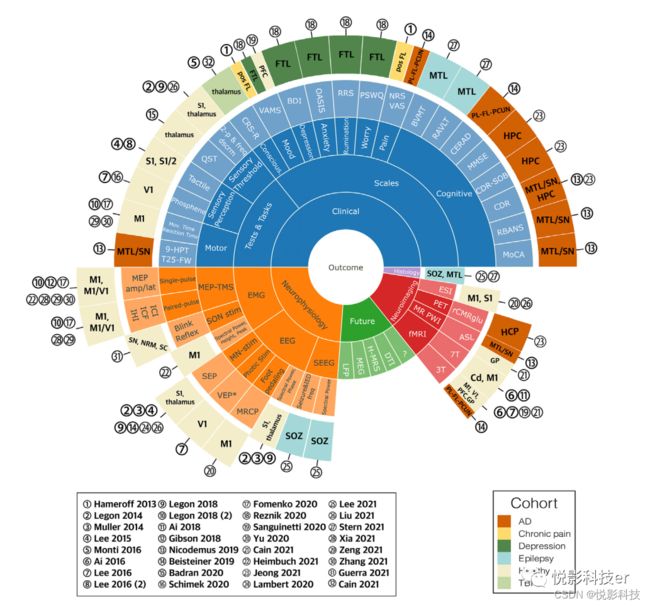
将研究分为两个主要的组;a)健康的受试者和b)患者群体。随后,根据;(1)刺激目标,(2)疾病类型,(3)结果类型(神经生理学,神经影像学,临床行为症状),(4)超声干预方案(同步干预效果评估被称为“在线效应”,而如果在超声处理后的一段时间后测量,被称为“离线效应”)。结果如图2.
图2.结果测量和目标的太阳爆发图表。
4.1
1)TUS对健康受试者M1和S1的影响总结见表2和图3。
表2 TUS对健康受试者M1和S1的影响

图3. 超声参数(f0:基频(kHz);PRF:脉冲重复频率(Hz);DC:占空比(%);SD:超声持续时间(ms);Isppa:经颅空间峰值脉冲平均强度(W/cm2)聚焦超声研究,针对初级运动皮层(M1)(初级躯体感觉皮层(S1),具有神经生理结果。NO EFF:无影响;上箭头和下箭头分别表示兴奋性和抑制性,只有标记有*的参数才有显著影响。
2) 其他大脑区域
2.1) 在线-离线效应/神经生理学
其他超声的大脑区域包括V1、前额叶皮层、丘脑和基底神经节。在线 fTUS在V1 (f0=270 kHz,PRF=500 Hz,SD=300 ms,DC=50%)的诱发电位与光刺激诱发的视觉诱发电位 (VEP)相当。与丘脑超声处理有关;在线fTUS (f0=500 kHz,PRF=1000 Hz,SD=500 ms,DC=36%)衰减SEP。离线研究表明上丘的中缝大核和黑质核增加了三叉神经眨眼反射的条件R2成分,而不是中缝大核 (SN) ,但在刺激后30分钟时没有增加,上丘dUS可以瞬间增加脑干回路的兴奋性。
2.2) 在线-离线效应/神经成像
在线V1和皮层下(尾状和苍白球) fTUS诱导超声区域和超声目标的远中枢BOLD信号变化。根据目标和参数,信号的变化可以是在两个方向上 (增加或减少)。针对额下回 (IFG)的离线功能磁共振成像研究显示,IFG与亚属扣带皮层、眶额皮层、前额下回 、背侧前扣带皮层和内嗅皮层之间的连通性降低。只有运动前皮层的连通性增加。动脉自旋标记 (ASL) 的Mri灌注加权成像技术离线评估了内侧苍白球超声治疗的效果。超声后,观察到整个大脑的相对灌注普遍下降。
2.3) 在线-线下的临床行为
在线V1-fTUS和V1-dUS 刺激都能引起主观的视觉感知。通过两项针对V1的研究评估超声可听性和声音对脑电图记录的影响。通过使用定量感觉阈值 (QST) 测试, 以评估感觉、疼痛和对热刺激的耐受性阈值,丘脑-ftus(f0=650 kHz,PRF=10 Hz,SD=30 s,DC=5%)被证明可能是通过抑制机制产生离线的抗伤害感受作用。
4.2 患者群体
-
阿尔茨海默氏症-帕金森病(PD)痴呆/离线效应
额顶叶-TPS、颞叶中叶(MTL)和SN-dUS以及海马-ftus刺激使认知测试得到改善。TPS的这种改善持续了3个月。TPS超声患者的MRI显示海马、海马旁/顶叶皮质和楔前叶的功能连通性增加,以及皮质厚度增加,与临床结果呈正相关。在22例接受dus超声治疗的患者中,14例(64%)患者至少有一个认知评分得到改善,7例(32%)患者至少有一个认知评分下降。没有患者在运动功能和灵巧性评分上都出现下降或改善。2例dUS超声患者行ASL治疗,显示海马灌注明显增加。海马-ftus后,额上回、中扣带回和梭状回的局部脑葡萄糖代谢率增加。 -
耐药性癫痫/在线-离线效应
癫痫发作区(额叶、颞叶、岛叶或扣带皮质)fTUS(PRF=100Hz,SD=10m,DC=30%,Ispta=2.8W/cm2)降低或增加了不同患者的癫痫发作频率和发作间期癫痫样放电。5/6例患者在10min超声过程中,目标电极的SEEG光谱功率在4个频带之一增加,3/6例患者在超声后10分钟下降。离线MTL-fTUS(f0=650kHz,PRF=100/250Hz,SD=0.5/30s,DC=5/50%,Ispta=
720/5760mW/cm2)在神经心理测试中没有产生任何变化。手术切除超声脑组织,除了嗜酸神经元和外渗外,没有发现任何损伤。然而,由于对照样本也显示了这些变化,因此结果可能与超声处理本身无关。
- 意识障碍/离线效应
三名患者接受两次一周一次的丘脑fTUS治疗,第一个患者6个月的昏迷恢复量表修订评分最初有所改善,但后有所下降,第二个有所改善,第三个有所下降。
- 慢性疼痛/离线效应
与安慰剂相比,额叶dUS在10和40min时的主观情绪评分显著改善;然而,疼痛评分并没有改变。
- 抑郁/离线效应
额颞叶fTUS后10-30分钟抑郁评分没有变化,但特质忧虑随着fTUS的增加而降低,安慰剂组则增加。
5.不良反应
在704例接受TUS治疗的受试者中(27例来源于未发表的试验中),没有记录与超声治疗相关的严重不良事件;然而,有10项研究没有报告存在或不存在不良事件。14例患者报告了轻度/中度(主要为短暂性)症状,包括头痛、情绪恶化、头皮发热、认知问题、颈部疼痛、肌肉抽搐、焦虑、嗜睡和瘙痒。
6.未来方向
6.1 新的潜在结果衡量指标
利用局部场电位(LFP)(特别是PD患者的beta振荡)、质子磁共振波谱学(一种用于检测和定量脑中代谢物的非侵入性神经成像方法)、扩散加权MRI(dMRI)(一种基于水分子[56]扩散映射的微观结构成像技术)、脑电图和皮质电图(ECoG)(可以测量神经活动的亚秒变化)、MEG(可以理想地连接所需的时空连续体)于TFUS技术结合。
6.2 潜在的新研究人群
TUS可能在未来用于中风、头痛、耳鸣等情况。特别是运动障碍和儿科患者。TUS诱导脑可塑性、高空间分辨率和深度靶向能力在MDs的治疗中发挥了巨大的潜力。TUS对经典DBS靶点(STN、GP、丘脑)的调节显示出了潜力,但针对这些小细胞核的特异性靶向技术可能需要验证。其他运动障碍,如抽动障碍和不宁腿综合征,也可能通过分别针对基底神经节和运动前区进行调节。目前,MD-TUS研究仅限于啮齿动物研究,TUS是MD患者尚未探索的领域。除了单独使用TUS外,它还可作为DBS植入患者的辅助治疗,以进一步控制症状。TUS的神经调节方面可以通过靶向脑室周围白质束来减少新生儿缺血性或出血性脑损伤后的永久性运动损伤。在生命早期瞄准神经可塑性,可能不仅对运动发展,而且对认知和心理发展都有显著的收益,从而导致成年期更高的生活质量。
7.结论
TUS是一种很有前途的非侵入性神经调节方法,已在健康受试者以及包括抑郁症、癫痫、痴呆、慢性疼痛和创伤性脑损伤在内的神经和精神疾病患者中进行了研究。对TUS的直接物理反映在触觉和视觉感知上,而运动功能尚未见副作用反应(如肌肉抽搐)报道。神经调节作用,在本质上可能是兴奋性或抑制性的,取决于超声参数和刺激靶点。此外,新的方案已经发展来诱导运动皮层的可塑性。未来的研究可能会利用新的结果测量方法,以更好的定义TUS的潜在神经生理机制。此外,新的患者队列,如运动障碍或儿童患者,可以评估治疗作用。
参考文献:Human Studies of Transcranial Ultrasound neuromodulation: A systematic review of effectiveness and safety