意识障碍的大尺度脑动力学研究(2014)
Nicholas D Schiff1,2, Tanya Nauvel1 and Jonathan D Victor1
1美国纽约州约克大道1300号威尔康奈尔医学院脑与心智研究所;
2美国纽约州约克大道1300号威尔康奈尔医学院神经学系,纽约州10065
目录
摘要
引言
判断意识需要的不仅仅是行为观察
为什么要关注全局动态?
对脑电图分析的看法
结构性脑损伤的大规模脑电图动态变化
现象
病理生理学机制
表述全局动态的其他方法
结论
摘要
脑损伤深刻地影响全局脑动力学,这些变化在脑电图(EEG)中表现出来。尽管损伤机制的异质性和脑功能的模块化,但脑电图在从昏迷到恢复的整个过程中具有共同的动力学特征。在最严重的损伤后,脑电图活动集中在1hz以下。在清醒期间的最低意识状态下,有一个在3-7 Hz范围内的活动峰值,通常在整个大脑内一致,也经常在beta (15-30 Hz)范围内活动。这些频谱变化可能是由于丘脑和皮质水平不同程度的功能性传入缺失造成的。基于脑电图的脑动力学指数超越了这些简单的频谱测量,可以提供进一步的诊断信息和生理学见解。
引言
从严重脑损伤中幸存下来的病人通常会留下慢性意识障碍。随之而来的痛苦和残疾对患者个人及其家庭产生重大影响。两个因素加重了对社会的总体负担:创伤性脑损伤主要影响年轻人,医疗重症监护的不断改进提高了存活率,特别是在非常严重的损伤之后。在过去的十年中,越来越明显的是,即使最初有严重的缺陷,前景也不是没有希望的:许多患者自发的晚期康复(甚至在许多年后),一些治疗方案显示出希望。因此,提高对这些障碍的生理基础和现象学的理解至关重要:以提供准确的诊断和预测,并指导和评估潜在的治疗方法。
判断意识需要的不仅仅是行为观察
在严重的脑损伤中,即使是做出基本的诊断区分都是具有挑战性的。植物人状态(VS)和最小意识状态(MCS)之间的关键区别是至少存在一些意识元素,即使不一致(见方框1这些状态和相关实体的定义和特征)。依赖临床观察来识别意识要素是值得怀疑的[1]:它假定运动系统完整,但运动系统严重受损在该人群中很常见。这使得不依赖于运动输出的脑功能评估方法更加重要[2-5]。
其中一种方法是功能性成像。功能性磁共振成像(fMRI)研究表明,一些VS和MCS患者可以产生与运动想象一致的复杂激活,甚至可以通过这种信号进行交流[2,3,6],尽管他们缺乏语言或手势交流系统。将这种方法转换为脑电图(EEG)表明,与运动图像相关的大脑信号也可以使用这种方式在脑损伤受试者中测量 [4]。然而,在短时间内进行的fMRI和EEG测量对严重脑损伤患者的价值是有限的,因为他们的状态波动明显而频繁。由于这种状态的波动,认知反应的证据可能在某个时间出现,而在另一个时间则没有[4]。此外,不考虑背景活动的状态波动的统计方法可能导致严重脑损伤受试者的EEG评估出现假阳性结果[7]。
这些考虑促使人们直接通过测量大脑活动来加强行为观察,不仅可以评估与环境的互动,还可以评估状态和状态波动。为此,脑电图是一种特别有吸引力的方式:它是非侵入性的,相对便宜,它允许在床边重复或延长测量,并且它可以解决神经元活动时间尺度的动态。(关于脑电图的全面介绍,见[8]。)因此,我们的评论侧重于脑电图对大脑活动的测量,以及将这些测量与正常和受伤大脑的神经生理学联系起来的新兴框架。
为什么要关注全局动态?
由于许多认知和行为功能是模块化和本地化的,强调全局动态可能会乍看之下令人费解。我们这样做的原因有两个方面。首先,尽管脑损伤经常影响模块功能,但这些影响往往取决于具体的损伤模式(例如,涉及的血管区域,或创伤的位置)。相反,脑损伤对唤醒和注意力调控的影响是普遍的和一般的,而且,正如我们在下面提出的,可能有一个潜在的病理生理学,与损伤的模式或细节无关。第二个原因是,全局性的缺陷对于功能恢复可以说是更重要的:在缺乏完整的唤醒机制的情况下,保留特定的模块功能是一种破坏性的伤害[9],而失去一个模块功能可能容易通过假肢和功能替代来补救。
对脑电图分析的看法
作为对大脑动态的测量,脑电图在某种意义上是一种丰富的尴尬:典型的记录提供的信号带宽范围很广(如1-70Hz),在几分钟至数小时的时间内,在几十个甚至数百个头皮位置记录。将这些高维数据减少到少数真正有意义的数量是一个关键的挑战。由于非稳态性的存在(即上面提到的状态变化)和许多环境和生理伪影污染了临床记录,以及状态变化和伪影可能相互关联的可能性,使这一挑战变得更加严峻。
虽然没有简单的解决方案,但我们想提出一套准则。首先,为了识别状态变化和伪影,必须检查原始信号本身,以及病人的视频图像。其次,对于降维来说,只对特定的生理模型有最小的依赖性,并且有良好的统计特性的方法是有优势的—频谱分析(图1A)就是一个最好的例子[10-12],我们在下面说明。最后,虽然统计审查是必要的,但这种验证可能高度依赖于统计模型[7]。因此,对脑电图观察指标的生理学或机械学解释提供了重要的保证,即一组推论的基础不只是偶然的关联。基于这些考虑,本文不仅回顾了受伤大脑中EEG动态的现象学,而且还总结了目前对机制的思考。
结构性脑损伤的大规模脑电图动态变化
我们首先考虑了严重受伤的大脑中全局EEG动态的现象学,这些现象描述并区分了从昏迷到正常功能的各种状态。我们将重点放在功率谱和相关措施上[10-12],因为这可以与可能的病理生理学基础联系起来,然后我们将对其进行描述。最后,我们考虑从脑电图中得出的其他定量指标,这些指标显示有希望作为严重脑损伤中全局动态的探针。
现象
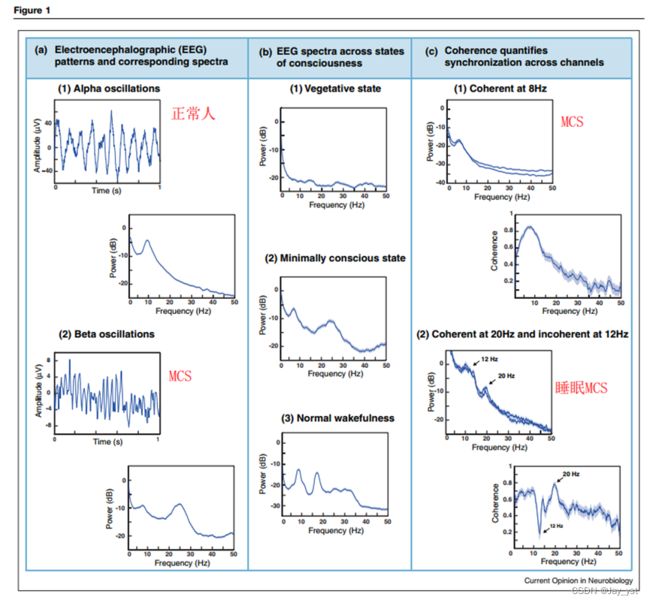
不同意识状态下的脑电图(EEG)模式。(A) 功率谱描述了脑电图单通道的频率内容。面板A1的例子显示,在原始跟踪(左)和功率谱(右)中,在大约10Hz(α范围)的突出振荡。面板A2的例子显示在大约25Hz(β范围)的振荡,叠加在较小和较慢的波动上;相应地,功率谱有两个主要的峰值,一个大的在大约25Hz,一个小的在7Hz。A1:正常受试者,通道Oz(拉普拉斯推导);A2:最小意识的病人受试者,双极通道Fz-Cz。请注意,功率谱是由许多脑电图样本计算出来的,A1的样本总数为489s,A2为348s,但只显示了原始轨迹的一个典型秒数。(B) 脑电图功率谱确定了不同意识水平下大脑动态的主要特征。在植物人状态(B1面板),功率集中在1Hz以下,其余的频谱基本上没有特征。在最小意识状态下(面板B2,但也包括面板A2和C1),在3-7Hz范围内有一个突出的峰值,并且通常在15-30Hz(β)范围内有一个峰值。在正常的清醒状态下(面板B3),在α范围内有一个峰值(8-12Hz),在β范围内有不同的峰值。B1:患者主体,通道Oz(拉普拉斯派生);B2:患者主体,通道Fz(拉普拉斯派生);B3:正常主体,通道Pz(拉普拉斯派生)。(C) 相干性确定了成对脑电图通道活动的同步程度。面板C1:来自两个位置的脑电图谱(POz,上图,和P4,下图,拉普拉斯派生)具有相似的动态(左图),相干性(右图)显示这些通道上的主导θ-范围峰值是高度同步的。面板C2。两个位置的EEG频谱(F8-FC6,上图,和F4-FC2,下图)也有类似的动态(左图),但相干性(右图)显示,20Hz范围内的活动是同步的,而12Hz范围内的活动则不是(箭头)。在这个病人中,12Hz的活动对应于睡眠主轴,是不同步的。睡眠主轴的这种不同步性是一种异常的发现,可能是由于中央丘脑梗塞的存在。C1:在清醒状态下记录的意识模糊的病人主体;C2。另一个意识模糊的病人在睡眠时的记录。所有的功率谱和一致性都是在Chronux(http://chronux.org/)[11]中进行的,误差条(在面板A和B中几乎不可见)表示95%的置信区间。
尽管在结构性脑损伤中,甚至在正常的清醒和睡眠状态下,都可能出现各种各样的EEG模式,但广泛的规律性是很容易识别的,尤其是在非常严重的损伤和正常脑功能的极端情况下[8,13]。图1B显示了从昏迷、MCS和正常清醒状态下的人类受试者获得的典型EEG功率谱。在昏迷中(图1B1),功率集中在非常低的(<1 Hz)频率;超过3 Hz,有一个逐渐下降的趋势。这个例子取自一个非常严重缺氧损伤后的VS病人,代表了这个对象的所有EEG通道。这种功率谱(功率集中在1Hz以下,整个头皮均匀)是由创伤、缺氧或其他原因造成的最严重形式的结构性损伤患者的特征。
相比之下,在正常的清醒状态下,EEG功率谱的例子包含一个复杂的频率组合(图1B3)。作为正常EEG功率谱的典型,在α频段(8-12Hz)和β频段(15-30Hz)都有峰值。这些峰值的相对和绝对大小通常随位置的不同而不同(α在顶叶和枕叶区更突出,而β在额叶区更突出),也随受试者的不同而不同。图1A1是另一个例子,其中α峰比较突出,β活动几乎没有。
严重结构性脑损伤后的MCS的EEG功率谱(图1A2,1B2,1C1左)显示了第三种模式:θ(4-7Hz)范围内的强峰值,通常在7Hz附近(如本例),但偶尔低至3Hz,并在整个头皮上广泛存在。虽然θ节律可以出现在正常人身上,但它们只在特定情况下出现:要么在努力认知时短暂地出现在额中线,要么在嗜睡时更广泛地出现在额中枢脑电图通道上[8]。图1B2中θ节律的弥漫性空间分布,以及它在清醒时的存在,使其成为病理模式,是MCS患者的特征(Drover等,摘要,神经科学学会,华盛顿特区,2011年11月;Forgacs等,摘要,神经科学学会,圣地亚哥,2013年11月)。
病理生理学机制
来自生理学和临床研究的综合证据表明,图1B中看到的脑电图动态变化,以及严重脑损伤时脑电图的其他特征,与不同程度的传入神经阻滞和脱节的后果之间存在着联系。
低频活动
在VS中看到的低于1Hz的功率集中(图1B1)可能反映了大脑皮层的完全失传。已知这种慢速振荡出现在两种非常不同的情况下:在猫科动物 "板块 "模型中的完全解剖性失传,即所有通往皮质区域的长程白质被横切[14],以及深度麻醉的完全功能性失传[15]。类似的慢速振荡模式也出现在另外两种以严重功能失调为特征的情况下:在颞叶癫痫发作期间,跨越结构完整的额叶皮层[16,17],以及在正常慢波睡眠期间,功能性传入神经阻滞是由新皮层神经元的功能障碍引起的[18]。
虽然睡眠和麻醉有一些共同的特点,但它们在起源和机制上是非常不同的。然而,在麻醉和脑损伤产生的意识改变之间,存在着更为密切的功能关系[19]。由于麻醉是容易控制的,它为了解全局大脑动态的生理过程提供了独特的视角。
在异丙酚诱导的麻醉昏迷的背景下,慢速振荡最近成为一项详细研究的主题,包括人类的多单位记录[20]。这项工作揭示了脑电图每个慢速振荡中的神经元发射模式的局部和全局动态结构。具体来说,在<4毫米的范围内,神经元群体可以显示出在沉默和清醒时通常遇到的速率之间波动的尖峰活动。这些波动是由慢速振荡急剧控制的。此外,它们在整个大脑皮层中是不同步出现的,这表明功能隔离。
异丙酚麻醉还与另一个动态特征有关:在前中枢脑电图通道上有一个以11Hz为中心的频谱功率峰值,在整个大脑中是一致的(即同步的)[21]。计算模型表明,这种节奏可能是通过一种双重机制产生的,这种机制使正常清醒状态下典型的优势后部10Hz(α)节奏沉默,并通过投射到额叶的丘脑核产生一种 "前化 "的α范围振荡[22]。
最近的工作[23]表明,在异丙酚麻醉中看到的这些动态是昏迷中另一种病理脑电图模式的基础,即突发抑制。在严重的结构性或缺氧性脑损伤患者中出现的猝死抑制模式包括电沉默期和明显不规则的高压活动期之间的交替,每次持续几秒钟。Ching等人[23]的研究表明,猝死的频谱特征与异丙酚相关活动的频谱特征相吻合,即11Hz的全局相干振荡与整个大脑的慢波振荡是不同步的[24]。与这种活动交替出现的电沉默期似乎与整个神经元群体的ATP生成失败有关[23]。
Theta-range活动
在介于昏迷和正常觉醒之间的状态下,可以观察到各种频谱特征。最常见的是θ功率的峰值(图1A2,1B2,1C1左),这在全局性(Williams等人[25])和局部性结构脑损伤的病人中已经被发现,并且是清醒时MCS的特征。
已知有两种机制能够在大脑皮层和丘脑水平上,在严重或中等程度的失神后,产生强大的θ范围的能量。第一种是细胞性的:在新皮层切片制备中存在的去势情况下,第五层锥体细胞有大约7Hz的内在膜振荡。第二种是基于回路的:丘脑与其皮质输入的失传导致清醒状态下的爆发[27]和EEG中θ功率的增加[28,29]。这些机制有明显的特点。回路机制可能与较小程度的去势有关,而丘脑的爆发成分预计会在脑电图中产生15-30Hz(β)的功率。在细胞机制中,可能是在存在更严重的去势的情况下,内在振荡神经元的弱耦合预计会产生θ活动的长距离同步[30],表现为相干性中的θ范围峰值(如图1C1右)。在图1A2和1B2的例子中,θ-范围和β-范围峰值的存在表明,两种机制都有贡献。
模型
正常清醒和睡眠脑电图中存在的功率谱特征可以通过数学和计算模型来捕捉。神经集群模型[31- 35,36]特别适合这一目的,因为它们试图说明EEG动态的整体定性特征,而不需要详细的解剖细节,但假设特定神经元连接性的方法[23]也被证明是成功的。
神经集群模型可以构成"正向"和"反向"两种方法的基础。在正向方法中,模型的构建是基于对大脑连接性的简化描述,并对模型的分析行为进行研究,以确定这一描述是否为理解大脑动态提供了一个有用的框架。这种简化可能包括对整个大脑的连续近似[37],或者强调特定脑区的连接性的模型。Robinson等人开发的一系列模型[34]是后一种方法的典范:它侧重于四个群体的相互作用:皮质丘脑第五层神经元、皮质抑制性神经元、丘脑网状神经元和丘脑中继神经元。由于这些脑区中的每一个都被建模为独立的"集群",该模型说明了在正常清醒状态下发现的典型频谱功率分布、睡眠阶段、以θ为主的昏睡和突发抑制,此外还说明了正常脑电图在清醒状态下的空间一致性结构[38]。因此,这些模型是正式确定神经元集群的生理学和脑电图中可观察到的动态之间的联系的基础。
在Robinson框架的基础上,Drover等人[39]建立了一个由两组皮质群在丘脑水平上联系起来的缩小的皮质-丘脑系统的神经集群模型。考虑双皮层-区域模型的理由是,假设丘脑内的功能之一是建立适合特定行为的皮层互动模式[40]。这种相互作用通常将一个感觉区和一个运动区联系起来,一个区域驱动另一个区域,这取决于任务需求。当这种联系被模拟为部分共享网状核(即共享抑制)的结果时,所产生的动态显示了皮质耦合的几种模式之间的转换:一种模式是两个皮质区域都活跃并同步,另一种模式是一个皮质区域主导并驱动另一个。当这种联系包括共享的兴奋(例如,通过部分共享的丘脑中继核)时,只有同步模式是存在的。在一项试验性研究中,研究了严重慢性脑损伤患者的脑电图和使用唑吡坦的可重复行为改善[25 ,41],作者发现这种行为改善与涉及额叶脑区的模式转换数量增加有关,这与PET扫描测量的代谢活动的增加有关。
这项建模研究提供了一个理由,即不仅要研究标准(时间平均)频谱和相干性,还要研究它们如何在时间上波动[41],因为后者可能是丘脑活动的一个间接指标,无法在EEG中直接观察到。该模型对EEG活动的功率谱和相干性的预测来自于神经集群模型固定点的标准线性化分析。但重要的是,对它们随时间波动的预测--频谱图和相干图--是通过研究神经集群模型的固定点的稳定性,以及这些固定点之间的关系而得出。因此,神经集群模型的非线性性质在这个分析中发挥了关键作用。
神经集群模型也是"逆向"方法的出发点,如动态因果模型[35,42]。在这里,根据有关解剖学连接的假设,构建一系列候选的神经集群模型。然后,通过生物物理或血液动力学模型来增强质量模型,该模型将神经质量变量与观察指标(即EEG或BOLD反应)相联系。最后,一个模型选择程序("反转")被用来确定哪个候选连接模型最有可能解释观察到的数据。
这种方法最近被应用于EEG的频谱变化,这种变化是异丙酚麻醉期间向无意识过渡的基础[43]。具体来说,研究者考虑了三种复杂度越来越高的模型:(i)前后皮质团相连,(ii)增加一个与两个皮质团相连的丘脑团,以及(iii)将丘脑团细分为两部分,一部分与前皮质团相连,一部分与后皮质团相连。如上所述,向无意识的过渡与δ频段和α频段的低频活动的增加有关。贝叶斯模型选择倾向于模型(二):一个丘脑块与一个前部和一个后部皮质块相连。在这个模型的背景下,异丙酚产生了前部到后部皮质连接的选择性丧失,而保留了后部到前部的连接和丘脑皮质的连接,扩展和完善了Lewis等人的观察[24]。因此,动态因果模型超越了标准的频谱分析,寻求识别功能连接的方向,从而对因果关系进行预测。正如其他地方所回顾的那样[44],从观察到的数据信号中提取方向性信息所采取的策略依赖于神经集群模型的特定参数特征,如脑区之间的预期传播时间。这与格兰杰因果关系分析[45]的信息理论方法形成鲜明对比,后者从根本上说是非参数性的。还要注意的是,虽然基础神经集群模型本身是非线性的,但非线性对这些推论并不关键--模型是在线性化的体制下研究的,推论是基于观察到的功率谱和一致性的。
表述全局动态的其他方法
标准频谱特征的其他扩展--双谱、双相干以及它们的高阶类似物--侧重于一个频率的活动是否与另一个频率的活动相耦合[10]。相位-振幅耦合是一种特殊的跨频互动,已经引起了人们的兴趣,并为其开发了专门的指数[46]。Mukamel等人[47]将这些指数应用于异丙酚诱导麻醉期间的脑电图记录,发现α-范围活动的振幅与低频活动的相位存在状态依赖性耦合。
图论方法作为一种降维工具也得到了发展,它可以描述脑电的空间特征,在静止的清醒状态下[48]和癫痫中[33],以及最近在脑损伤中(T Nauvel等,摘要,神经科学学会,新奥尔良,2012年11月)。虽然是初步的,但这些发现表明,图形方法可能能够识别脑损伤恢复的广泛模式。
检查脑电图对刺激的反应提供了一个额外的方法来了解大脑的动态。Boly等人[49]使用动态因果模型和源定位的方法,研究了VS、MCS和健康对照组患者的错配阴性反应。从VS受试者的数据中推导出的动态因果模型与从MCS受试者和对照者的数据中推导出的模型有区别,因为缺乏从推断的额叶成分到颞叶成分的反馈。King等人[50]研究了VS、MCS和混淆状态(CS)患者的单个trial的EEG反应,发现多变量模式分类器可以区分这些状态。Rosanova等人[51]和Ferrarelli等人[52]表明,在包括VS、MCS、睡眠状态、锁定状态(LIS)和正常人在内的一系列状态中,对重复性经颅磁刺激(TMS)的EEG反应的动态显示出对意识水平的可靠和系统的依赖。在极端情况下,脑结构损伤后的VS患者的TMS反应比做梦、LIS和正常清醒时记录的反应更局部或具有更短的时间序列和更简单的动态。最后,Casali等人[53]将静止大脑的EEG测量和对经颅磁刺激(TMS)脉冲的反应结合起来,得出了一个与意识水平很相关的指数(基于算法的复杂性)。
结论
严重的脑损伤常常导致严重的残疾,其综合影响给病人、家庭和社会带来了深刻的负担。评估病人的意识水平和认知能力对预后、常规护理和临床调查至关重要。然而,行为观察是不可靠的,这在很大程度上是由于脑损伤常常伴有运动障碍。脑电图绕过了这一潜在的混淆因素。它的高时间分辨率允许对动态的关注,在确定不同程度的损伤和意识障碍所共有的大规模大脑动态的基本特征方面已经取得了很大进展。迄今为止,这些努力大多集中在标准频谱测量(即功率谱和一致性),以及将这些测量与病理生理过程联系起来。最近在理解麻醉剂引起的意识丧失方面的进展,以及计算和数学建模,表明其他类型的动态措施,对光谱特征之间的波动和相关性敏感,可能会提供进一步的诊断准确性和机制的洞察力。