1. 数据
今天将继续回顾我们在上一次中研究的 Myc ChIPseq。这包括用于 MEL 和 Ch12 细胞系的 Myc ChIPseq 及其输入对照。
- 可在此处找到 MEL 细胞系中 Myc ChIPseq 的信息和文件
- 可在此处找到 Ch12 细胞系中 Myc ChIPseq 的信息和文件
- 可以在此处找到 MEL 细胞系的输入控制
- 可在此处找到 Ch12 细胞系的输入对照。
2. 质量控制
ChIPseq 有许多潜在噪声源,包括 抗体的不同效率 非特异性结合 文库复杂性 ChIP 伪影和背景。
许多这些噪声源都可以使用一些完善的方法进行评估。
2.1. 质控参考
- Encode 质量指标。
- ChIPseq 中人工制品重复的高估。
- 什么时候 QC 有用。
2.2. 合适的输入
- 在 IP 富集之前,输入样本通常由片段化的 DNA 制成。
- 允许控制样本中出现的伪影区域。
- 切勿在不考虑使用哪个输入的情况下运行 ChIPseq。
例如:当使用肿瘤样本进行 ChIPseq 时,匹配输入样本很重要。同一组织的不同条件可能共享共同的输入。
2.3. 质量指标
ChIPQC 包将一些指标包装到 Bioconductor 包中,并注意在适当的条件下测量这些指标。
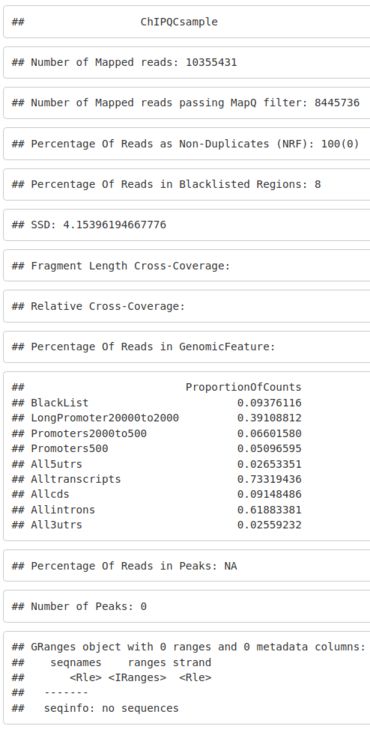
要运行单个样本,我们可以使用 ChIPQCsample() 函数、相关的未过滤 BAM 文件,我们建议提供黑名单作为 BED 文件或 GRanges 和基因组名称。
您可以在 Anshul Kundaje 的网站或直接从 Encode 网站找到大多数基因组的黑名单
QCresult <- ChIPQCsample(reads = "/pathTo/myChIPreads.bam", genome = "mm10", blacklist = "/pathTo/mm10_Blacklist.bed")我们从 Encode 下载 mm10 的黑名单。然后,我们可以使用 ChIPQC 包中的 ChIPQCsample() 函数对我们的 ChIPseq 样本质量进行初步分析。
在这里,我们评估我们在之前的会话中使用 Rsubread 对齐的样本的质量。返回的对象是 ChIPQCsample 对象。
library(ChIPQC)
toBlkList <- "~/Downloads/ENCFF547MET.bed.gz"
chipqc_MycMel_rep1 <- ChIPQCsample("SR_Myc_Mel_rep1.bam", annotation = "mm10", blacklist = toBlkList,
chromosomes = paste0("chr", 1:10))
class(chipqc_MycMel_rep1)我们可以显示我们的 ChIPQCsample 对象,它将显示我们的 ChIPseq 质量的基本摘要。
chipqc_MycMel_rep12.4. 多样本QC
最好对照您的输入对照和我们正在使用的其他 Myc 样本(如果您没有自己的数据,甚至是外部数据)检查 ChIPseq 质量。
这将使我们能够识别样本与对照中 ChIPseq 富集的预期模式,并通过这些指标发现任何异常样本。
我们可以使用 lapply 对所有感兴趣的样本运行 ChIPQCsample()。
bamsToQC <- c("Sorted_Myc_Ch12_1.bam", "Sorted_Myc_Ch12_2.bam", "Sorted_Myc_MEL_1.bam",
"Sorted_Myc_MEL_2.bam", "Sorted_Input_MEL.bam", "Sorted_Input_Ch12.bam")
myQC <- bplapply(bamsToQC, ChIPQCsample, annotation = "mm10", blacklist = toBlkList,
chromosomes = paste0("chr", 1:10))
names(myQC) <- bamsToQC所有 ChIPQC 函数都可以与 ChIPQCsample 对象的命名列表一起使用,以将分数聚合到表和图中。
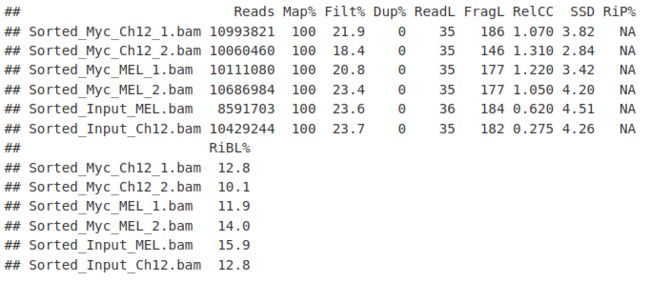
在这里,我们使用 QCmetrics() 函数来概述质量指标。
QCmetrics(myQC)本文由mdnice多平台发布