易基因:ChIP-seq等组学分析揭示Hippo-YAP信号调控动物胚胎干细胞(ESC)分化机制:NAR
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
2020年07月27日,中山大学王金凯教授课题组与袁平教授课题组合作以“Hippo-YAP signaling controls lineage differentiation of mouse embryonic stem cells through modulating the formation of super-enhancers”为题在《Nucleic Acids Research》(NAR)杂志上发表研究论文。该研究通过ChIP-seq、RNA-seq等实验揭示了Hippo-YAP信号通路通过调控新型超级增强子(super-enhancer,SE)的形成来调控ESC(embryonic stem cell)分化的表观遗传机制。
标题:Hippo-YAP signaling controls lineage differentiation of mouse embryonic stem cells through modulating the formation of super-enhancers. Hippo-YAP信号通过调控超级增强子形成调节小鼠胚胎干细胞(ESC)分化
时间:2020-07-27
期刊:Nucleic Acids Research
影响因子:IF 19.16
技术平台:ChIP-seq、RNA-seq、RT-qPCR、ChIP-qPCR等
研究目的:
Hippo-YAP信号通路在多能干细胞早期谱系分化中起作用,但其具体机制尚不清楚。先前研究表明小鼠胚胎干细胞(ESCs)中Hippo信号的两个关键组分Mst1和Mst2敲除(KO)导致了分化为中胚层谱系的中断。为了进一步揭示潜在的调控机制,本研究利用分别在ES(embryonic stem)和第4天胚状体(embryoid body,EB)阶段使用野生型和Mst KO样品进行一系列针对YAP、ESC主转录因子和一些特异性组蛋白修饰标记物的ChIP-seq实验,以及对应的转录组RNA-seq分析。研究结果表明YAP优先与超级增强子(SE)标记在ESC中共定位,如Nanog、Sox2、Oct4和H3K27ac。Mst KO ESCs中核YAP的过度激活促进了Nanog、Sox2和Oct4的结合以及YAP结合位点的H3K27ac修饰。此外,Mst缺失导致了新的SE形成和增强的液-液相分离Med1在谱系相关基因上的凝聚,导致这些基因的上调和ESC分化。本研究揭示了Hippo-YAP信号通路调控ESC谱系分化的新机制。
项目设计:
(1) 样本选取:
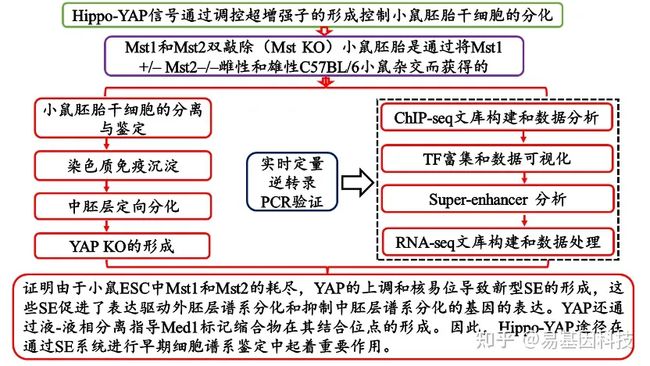
Mst1和Mst2双敲除(Mst KO)小鼠胚胎通过将Mst1+/- Mst2- /-雌性和雄性C57BL/6小鼠杂交而获得。
(2)项目设计流程图:
实验结果:
(1)Mst KO ESC分化过程中受干扰的谱系基因表达
通过比较Mst KO和野生型(WT)第4天EB的转录组数据(RNA-seq),发现具有多个中胚层和内胚层基因的明显基因表达改变。结果表明,Mst 1/2缺失导致早期腹膜内胚层分化。
(2)YAP与超增强剂相关因子在ESCs中的共存
利用ChIP-seq分析研究了YAP在ESC中的作用。分析结果表明YAP在基因体和基因间区域都富集,对远离转录起始位点(TSSs)的远端区域具有很强的偏好;GO分析表明,YAP优先结合与胚胎发育、干细胞群体维持和干细胞分化相关的基因;进一步将YAP结合位点与染色质状态进行重叠分析,发现YAP在乙酰化增强子上的富集最为显著,同时在启动子和中度乙酰化增强子有明显富集。表明YAP可能通过参与ESC的SE调节而在谱系分化中发挥作用。
(3)YAP诱导Nanog/Oct4/Sox2和H3K27ac修饰的YAP结合位点
在WT和Mst KO ESC的YAP唯一且共同的结合位点内,YAP优先结合远离TSS的远端区域,特别是增强子区域,并显示出与SE相关因子的强共定位性。此外,在WT和Mst KO ESCs的YAP特异性和常见的结合位点中也鉴定出了相似的YAP结合motif。结果表明,Mst KO不会改变结合特异性,而是会改变YAP的效率。结合效率的变化导致YAP调控基因群体的变化。与WT EB相比,这些YAP结合基因在Mst KO EB中没有明显的表达变化,表明Mst KO ESC分化的缺失不是由这些基因引起的。同时,研究表明YAP丰度与基因表达呈正相关,并且这种正相关可能与YAP与Nanog、Sox2、Oct4和H3K27ac有关。这些数据表明,YAP可以选择性地诱导Nanog、Sox2、Oct4和H3K27ac的富集,从而形成新的SE,并促进这些SE调控基因在Mst KO ESC中的表达。
(4)YAP指导Mst KO ESCs中新型超级增强子的形成
OSN(Oct4、Sox2 、Nanog)和YAP在ESC中SE可能具有协同作用。这表明,Tead家族蛋白有助于招募YAP到它们的共同结合SE中。数据表明,YAP可能以与先前报道的转录因子相似的方式发挥作用,这些转录因子引发其靶基因以使其在ESC中表达改变。表明YAP与Mst KO ESC中新的SE形成有关。与WT ESC相比,Mst KO ESC中YAP结合位点的Oct4、Nanog、Sox2和H3K27ac富集也显着增加。结果显示这些基因的表达在Mst KO ESC中也被上调。这些结果表明对SE格局的重塑,将关键基因处的TE转化为SE以响应于Mst KO,。因此,在Mst KO ESCs中激活的YAP通过指导激活Nono表达的新型超级增强子的形成而间接抑制了Tbx3和中胚层的表达。MST KO ESCs的分化可能部分是由于在Mst1和Mst2缺失的情况下新构建的YAP-Nono-TBX3调节轴所致。
(5)YAP通过相分离促进Mst KO ESC中的Med1冷凝物
AP和Med1共免疫染色显示Mst KO ESC中YAP斑点比WT ESC大,YAP斑点与Med1斑点Mst KO ESCs有明显的共定位。这些结果表明,高活化的核YAP可能会刺激med1标记缩合物的3D SE结构发生改变。
这些数据表明,Mst敲除ESCs中核YAP的过度激活导致了相分离的新SE形成,导致了基因的特异性和限制性调控,特别是调节谱系分化的基因。
关键图形:
关于易基因染色质免疫共沉淀测序 (ChIP-seq)
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
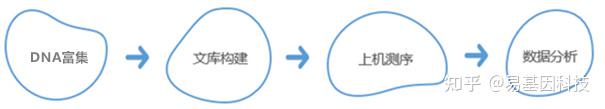
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
转录因子和辅因子结合作用
复制因子和 DNA 修复蛋白
组蛋白修饰和变异组蛋白
技术优势:
物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
技术路线:
有ChIP-seq测序或组学研究需要的老师可联系易基因。
参考文献:
Sun X, Ren Z, et al. Hippo-YAP signaling controls lineage differentiation of mouse embryonic stem cells through modulating the formation of super-enhancers. Nucleic Acids Res. 2020 Jul 27;48(13):7182-7196.
相关阅读:
干货系列:染色质免疫共沉淀测序(ChIP-seq)的数据挖掘思路
干货系列:高通量测序后的下游实验验证方法——ChIP-seq篇
项目文章 | 组蛋白ChIP-seq揭示烟粉虱共生菌Hamiltonella调控宿主生殖新机制
Nature子刊:ChIP-seq等组学研究鉴定出结直肠癌的致癌超级增强子