肠道细菌阻碍阿卡波糖的降血糖作用
我们知道,口服抗糖尿病药是治疗糖尿病的有效方式之一。然而,患者对抗糖尿病药的反应程度各不相同,例如,有些患者在长期使用阿卡波糖后会产生耐药性。
阿卡波糖通常在饭前口服。它抑制人α-葡萄糖苷酶达到降血糖作用,包括唾液和胰淀粉酶,从而减缓复杂碳水化合物的消化,并降低餐后血糖水平的升高。
大部分阿卡波糖剂量在肠道中仍未被吸收,导致与肠道微生物组的强烈相互作用。
近期发表在《自然新陈代谢》杂志上的一项研究揭示了阿卡波糖“诱导降解失活”的新机制:肠道菌群可以将阿卡波糖降解,从而破坏阿卡波糖的药效。
首先鉴定肠道细菌K. grimontii TD1,在阿卡波糖失活中起重要作用。
进一步在K. grimontii TD1 中鉴定出一种阿卡波糖首选葡萄糖苷酶 Apg ,它可以将阿卡波糖降解为小分子,并失去抑制剂功能。
由于阿卡波糖被肠道细菌降解,相对较大的人群可能存在阿卡波糖耐药性风险,这也是非抗生素耐药性的一个临床相关例子。
研究过程
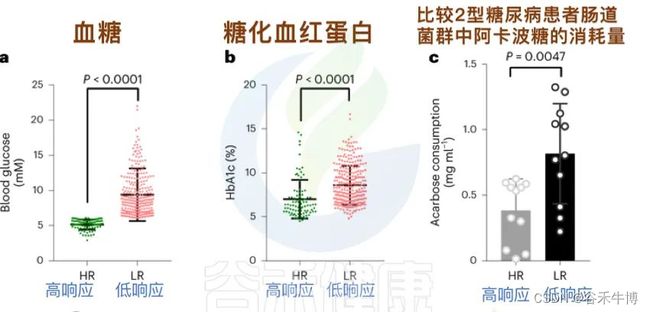
研究人员招募了 393 名2型糖尿病患者,发现:
阿卡波糖的治疗效果存在显著的个体差异。
药物对2型糖尿病患者效果不大,与药物降解相关
在接受α-葡萄糖苷酶抑制剂阿卡波糖治疗的2型糖尿病患者队列中,无应答者的粪便样本显示出明显高于有应答者的药物降解。
Tian J, et al., Nat Metab. 2023
这指向了微生物介导的药物降解途径。
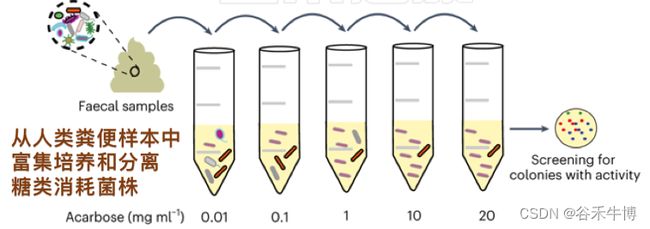
寻找和阿卡波糖降解有关的菌群
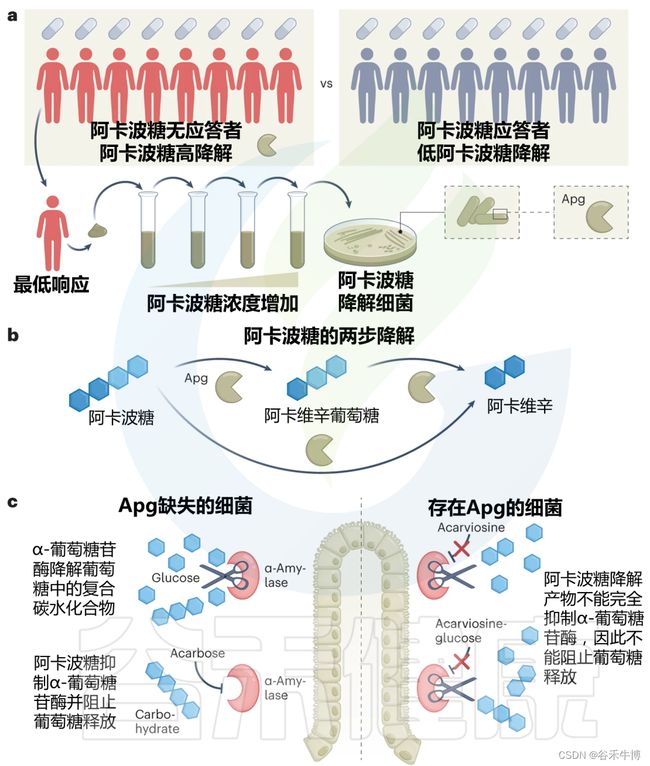
为了分离阿卡波糖降解细菌种类,作者在逐步增加阿卡波糖浓度的条件下,对药物没反应的人的粪便样本进行培养,以富集细菌。
Tian J, et al., Nat Metab. 2023
这种方法导致分离出18种阿卡波糖降解剂,所有这些降解剂都属于Klebsiella grimontii。
Klebsiella grimontii 是兼性厌氧菌,属于变形菌门,肠杆菌科,产酸克雷伯菌复合体的一种,主要分布于小肠。
产酸克雷伯菌是人类肠道中的共生菌群,但也是一种机会致病菌,在近年来的临床分离的微生物样本中呈逐年上升的趋势。产酸克雷伯菌复合体可产生许多毒素,因其携带较多的毒力因子,并且具备携带和获得耐药基因的能力,故未来可能成为威胁人类健康的潜在病原菌,需要更多研究。
K. grimontii 这种兼性厌氧细菌主要定植于小肠,巧合的是,阿卡波糖主要靶向小肠上皮细胞中的多种淀粉酶和葡萄糖苷酶,这在空间上有利于其与K. grimontii TD1 的相互作用以及该菌株的代谢降解。
▶▷▶▷
事实上,在糖尿病小鼠模型中:
K. grimontii TD1菌株削弱了阿卡波糖的降血糖作用。
作者制作了一个T2DM小鼠模型。将小鼠分为四组,并用磷酸盐缓冲盐水、阿卡波糖、K. grimontii TD1或阿卡波糖和K. grimontii TD1处理。
阿卡波糖单独可以降低淀粉负荷后的血清葡萄糖水平;然而,这种作用在接受阿卡波糖和K. grimontii TD1的组中不太明显。这些发现表明,K. grimontii TD1降低了阿卡波糖的抗糖尿病作用。
由此,确定了降解阿卡波糖的细菌。
K. grimontii TD1菌株如何分解阿卡波糖?
利用转录组学,研究人员在以淀粉为唯一碳源的最低培养基中培养了K. grimontii TD1,使细菌生长依赖于淀粉酶。通过添加阿卡波糖来抑制淀粉酶活性,迫使K. grimontii TD1上调有助于降解阿卡波糖的基因,这可以通过RNA测序进行量化。
同时,利用蛋白质组学,作者分离出细胞裂解物和具有高阿卡波糖降解活性的分离部分。这些组分中的蛋白质通过质谱法鉴定。
转录组学和蛋白质组学的发现都指向一个共同的候选者:一种新的葡萄糖苷酶,作者将其命名为阿卡波糖首选葡萄糖苷酶(简称Apg)。这是由K. grimontii TD1引起的阿卡波糖失活的关键。
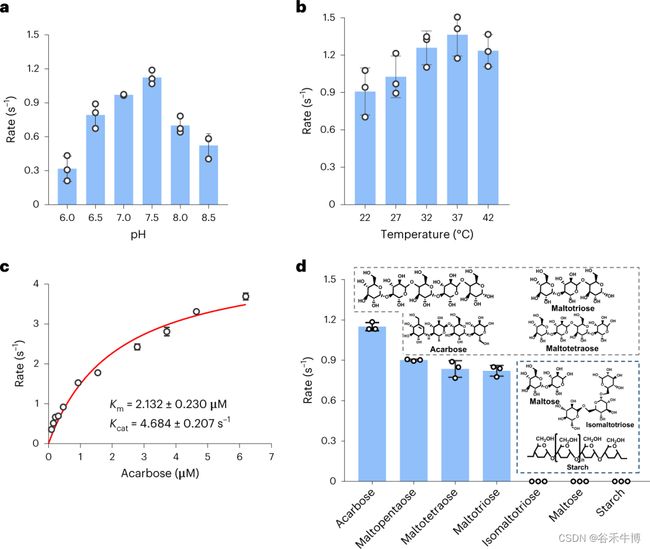
在体外测定中或当在大肠杆菌中异源表达时,该酶能够将阿卡波糖水解为阿卡波糖葡萄糖和阿卡波糖。这两种产物在很大程度上都不能抑制猪α-淀粉酶。
很有意思的是,该酶在pH为7.5和温度为37°C的厌氧条件下表现最好,这些条件与人类肠道的生理学相似。
Tian J, et al., Nat Metab. 2023
那么这就引发了一个问题:
阿卡波糖如何成为细菌葡萄糖苷酶的底物,但又是人类葡萄糖苷酶(如α-淀粉酶)的抑制剂?
通过3D分子建模,作者发现葡萄糖苷酶Apg催化位点的残基与人类α-淀粉酶中的残基位置不同,这使得阿卡波糖能够水解裂解。
阿卡波糖的降解产物太小,无法有效地占据人类α-淀粉酶的配体结合口袋,导致酶的抑制作用降低。
这种独特的蛋白质结构不仅有助于理解这种酶的独特催化机制,而且为设计能够在体内阻断这种酶的抑制剂提供了潜在的靶点。
阿卡波糖降解的临床相关性
在上述2型糖尿病患者队列中,超过98%的阿卡波糖治疗患者携带具有Apg样酶的细菌,相比之下,约14.2%的健康个体携带Apg+细菌。
地理位置、性别、BMI等因素决定了其患病率和丰度的个体间差异,在分析中,Apg的丰度在不同人群之间有所不同,在中国人中最为普遍。
这些发现表明,肠道微生物群中的Apg和Apg样酶可能会影响许多患者的药物疗效和治疗成功率。
Brauny MM, et al., Nat Metab. 2023
该研究的重要发现及意义
▶ 01
作者确定了灭活阿卡波糖的新途径,需要药物的水解。
这与已经描述的涉及阿卡波糖磷酸化的途径不同。阿卡波糖激酶在人类微生物组中广泛存在。这表明阿卡波糖抗性是一种常见的防御策略,在不同的肠道微生物中独立出现。为什么阿卡波糖抗性是肠道中的一个有益特征尚不清楚;也许是为了解毒相关的内源性化合物,或者成功地确保复合碳水化合物作为食物来源。
▶ 02
鉴定了一种新的能降解阿卡波糖的细菌葡萄糖苷酶
其他阿卡波糖降解葡萄糖苷酶以前也有描述,但从未与处理结果直接相关。由于碳水化合物代谢的基因经常过度表达,并且在肠道细菌的基因组中表现出相当大的差异,可以想象,很快就会发现更多这样的酶。
▶ 03
作者证明了单一α-葡萄糖苷酶抑制剂对细菌的灭活作用
预计其他α-葡萄糖苷酶抑制剂以及其他基于碳水化合物的药物和食品添加剂,都可能会经历类似的过程。因此,这项研究可能只是冰山一角,很快可能会有更多这样的观测结果。
▶ 04
作者提出了如何通过实验鉴定药物降解酶的路线图
这种方法只需要关键细菌能够被培养。在目前的研究中,作者在纯培养中工作,但这种方法在细菌群落的培养中也应该是可行的。
结 语
总的来说,很大一部分2型糖尿病患者可能由于高水平的K. grimontii TD1而对阿卡波糖产生耐药性。对于阿卡波糖反应低的患者,可以考虑调节肠道微生态或靶向代谢酶的策略,以减少耐药性的发生。肠道微生物群的分析可用于辅助指导未来的治疗。
当然,K. grimontii TD1不太可能是肠道微生物群中唯一可以降解阿卡波糖的成员,可以对阿卡波糖降解肠道细菌以及相关代谢机制进行持续研究,从而更全面地了解微生物组与阿卡波糖的相互作用。
在一定条件下,肠道菌群可能利用一种主要机制,或几种共存方式来支持其生存,这需要更多的临床病例分析和深入研究来阐明其潜在机制,从而指导精准医疗。
微生物药物代谢很重要。更好地了解微生物组编码的药物降解途径,对于药物开发、个性化治疗及有效的治疗策略等方面具有巨大潜力。
本文提供了一种研究思路,微生物研究人员可以从中学习如何通过实验设计鉴定药物降解酶,这有助于开发个性化及有效的治疗策略。
药物开发相关人员可以考虑微生物代谢途径对药物吸收、代谢和治疗效果的影响,并在此基础上加强药物设计和开发过程中的微生物学考虑。
一些具体实验细节设计,详见原文:
Tian J, Li C, Dong Z, et al., Inactivation of the antidiabetic drug acarbose by human intestinal microbial-mediated degradation. Nat Metab. 2023 May;5(5):896-909.