- 如何解决ubuntu 中DNS无法修改导致无法联网的问题
BTU_YC
linuxubuntuubuntulinux服务器
写在前面:在刚开始遇到这个问题的时候,在网上搜了很多资料,都无法解决DNS总是无法修改,一些文章中提到过,直接修改的/etc/resolv.conf,之后确实能够通过pingwww.baidu.com的方式解决,但是当重启电脑的时候,网络有无法使用了。之前的方法就不提了,直接介绍一下我这解决的方法吧如何解决:先使用这个命令进入编辑页面vim/etc/systemd/resolved.conf输入命
- 样本量计算:配对样本定量资料——平均值法
今天介绍的是配对样本定量资料采用平均值法的样本量计算。先来看一下案例。一、案例为明确某种新的训练计划是否能显著提高运动员的100米短跑成绩,欲招募一批志愿者,分别记录运动员在进行新训练计划前后的100米短跑成绩(秒)。据早期研究,两配对样本差值的标准差为5秒,若接受新的训练计划前后的100米短跑成绩平均值差为3秒,问至少需要招募多少志愿者?运动员的100米短跑成绩属于连续性数据。经正态性检验,成绩
- svn简介
阿业的学习之路
svn
svn简介Subversion(SVN)是一个开源的版本控制系統,也就是说Subversion管理着随时间改变的数据。这些数据放置在一个中央资料档案库(repository)中。这个档案库很像一个普通的文件服务器,不过它会记住每一次文件的变动。这样你就可以把档案恢复到旧的版本,或是浏览文件的变动历史。概念repository(源代码库):源代码统一存放的地方Checkout(提取):当你手上没有源
- Python实例题:基于 Flask 的在线聊天系统
目录Python实例题题目要求:解题思路:代码实现:Python实例题题目基于Flask的在线聊天系统要求:使用Flask框架构建一个实时在线聊天系统,支持以下功能:用户注册、登录和个人资料管理一对一实时聊天功能群聊功能消息通知和未读消息提示在线用户状态显示使用Flask-SocketIO实现实时通信。使用SQLite数据库存储用户、聊天记录等信息。添加美观的前端界面,支持响应式设计。解题思路:使
- Kafka的消费消息是如何传递的?
java1234_小锋
javakafka分布式
大家好,我是锋哥。今天分享关于【Kafka的消费消息是如何传递的?】面试题。希望对大家有帮助;Kafka的消费消息是如何传递的?超硬核AI学习资料,现在永久免费了!在Kafka中,消息的消费传递是通过**消费者(Consumer)和消费者组(ConsumerGroup)**的机制来实现的。以下是Kafka消息消费传递的详细过程:1.Kafka的基本结构Kafka由生产者(Producer)、消费者
- 前端开发核心:HTML、CSS与JavaScript学习指南
Randy Rhoads
本文还有配套的精品资源,点击获取简介:HTML、CSS和JavaScript是前端开发的基础,分别负责网页的结构、样式和动态行为。学习这三种技术需要理解它们之间的关系及其协同工作的机制。本笔记提供了一个全面的复习资料,包括标签使用、CSS布局技巧、JavaScript基础语法和DOM操作,旨在帮助巩固知识点和发现潜在的学习盲点。同时,介绍了响应式设计、Web组件、ServiceWorker等现代前
- 图解操作系统资料 - 小林Coding整理
图解操作系统资料-小林Coding整理去发现同类优质开源项目:https://gitcode.com/欢迎使用小林Coding精心整理的《图解操作系统》资料,版本号为v1.0。本资源文件以直观、易懂的方式,详细介绍了操作系统的基本原理与运作机制。资料概述本压缩包(小林Coding-图解操作系统-v1.0.rar)包含了以下内容:操作系统概述:介绍操作系统的定义、作用、发展历程及分类。进程管理:详细
- SFT(监督微调)详解:零基础入门到精通,一篇详细的入门教程!
AGI大模型老王
人工智能程序员大模型学习AI大模型大模型微调SFT
文章目录具体步骤如下:应用场景优点举例步骤1:预训练模型的选择步骤2:数据收集与标注步骤3:数据预处理步骤4:数据集划分步骤5:加载预训练模型步骤6:数据编码步骤7:创建数据加载器步骤8:定义训练过程步骤9:模型评估步骤10:模型保存零基础入门AI大模型一、全套AGI大模型学习路线二、640套AI大模型报告合集三、AI大模型经典PDF籍四、AI大模型商业化落地方案学习计划:资料领取SFT(监督微调
- REACT (Web开发框架 : react)极速入门
masterphp
react.js前端前端框架
前面讲过了很多后端,今天复习一下前端,为啥要讲React?对咯!我这边又被借调到前端组了,和前端的同学一起做React,以前有基础加上前端同学只做过Vue,所以我毫无疑问的又被借过去了......,这个是复习资料,高级玩家可略过。首先我要说一下,有Vue框架和JS原生的同学学习React会特别的快速,所以基础稍微差一点的同学可以先复习一下JS,特别说一下是JS老生常谈的,说明一下啥是Reac
- 《支持向量机(SVM)在医疗领域的变革性应用》
CodeJourney.
支持向量机算法机器学习
在医疗科技日新月异的今天,先进的数据分析与机器学习技术正逐渐成为提升诊疗水平、助力医学研究的关键力量。支持向量机(SVM),凭借其独特的优势,在医疗这片复杂且对精准度要求极高的领域崭露头角,带来诸多令人瞩目的应用成果。一、疾病诊断:癌症早期筛查的“火眼金睛”癌症,作为全球健康的“头号杀手”,早期诊断对提升患者生存率意义非凡。在乳腺癌筛查领域,SVM发挥着重要作用。医疗科研人员收集大量乳腺组织的影像
- 支持向量机(SVM)在肝脏CT/MRI图像分类(肝癌检测)中的应用及实现
猿享天开
医学影像支持向量机机器学习人工智能算法
博主简介:CSDN博客专家、CSDN平台优质创作者,高级开发工程师,数学专业,10年以上C/C++,C#,Java等多种编程语言开发经验,拥有高级工程师证书;擅长C/C++、C#等开发语言,熟悉Java常用开发技术,能熟练应用常用数据库SQLserver,Oracle,mysql,postgresql等进行开发应用,熟悉DICOM医学影像及DICOM协议,业余时间自学JavaScript,Vue,
- 【STM32项目】基于Stm32c8t6-镭射激光打印机的设计(完整工程资料源码)
物联网设计-妄北y
物联网嵌入式开发项目课程设计stm32嵌入式硬件单片机镭射打印机机器设计嵌入式开发
基于Stm32c8t6-镭射激光打印机的设计演示效果基于STM32-镭射激光打印机的设计前言:随着打印技术的快速发展,镭射打印技术也开始得到越来越广泛的应用。这种技术可以被用于在木材、塑料、皮革、织物等各种材料上进行图形打印,并且通常比传统机器更快、更准确和更灵活。目录:目录基于Stm32c8t6-镭射激光打印机的设计演示效果前言:目录:一、系统方案1.1项目背景1.2项目目标1.3需求分析1.4
- GitHub Pages上的个人技术展示网站
Rubix-Kai
本文还有配套的精品资源,点击获取简介:"weirufish.github.io"是一个托管在GitHubPages上的个人技术网站,可能包含个人资料、项目展示、博客文章等内容。该网站可能采用Markdown、HTML和CSS技术构建,提供了一个展示技术能力及分享学习笔记和见解的平台。此外,"weirufish.github.io-master"可能是该项目的主要分支或版本。网站特别注重样式设计,使
- 【数据分析】Python实现线性回归和多元线性回归(全代码)
干了这一碗BUG
线性回归回归算法
老规矩,涉及到的数学原理,想深入了解的可以自行查阅相关资料,这里直接上干货用Python实现。目录逻辑回归中涉及的术语线性回归Python实现多元线性回归Python实现逻辑回归中涉及的术语以下是逻辑回归中一些常见的术语:自变量:应用于因变量预测的输入特征或预测因子。因变量:逻辑回归模型中的目标变量,即我们试图预测的变量。逻辑函数:用于表示自变量和因变量之间关系的公式。逻辑函数将输入变量转换为0到
- 文末含资料链接!YOLOv11性能飞跃:深度融合iRMB注意力机制,实战教程助你突破检测极限!
博导ai君
深度学习教学-附源码YOLO
文章目录1.介绍:揭秘iRMB——轻量化与高性能的完美融合1.1摘要:洞察iRMB的设计哲学与卓越表现1.2简单描述:深入剖析iRMB的构造与工作原理核心灵感:CNN与Transformer的珠联璧合iRMB的核心结构:短距离与长距离的协同设计理念:实用、统一、有效、高效1.3模块结构:iRMB的内部构造图(概念描述)2.代码解析:逐行揭秘iRMB的魔法2.1`LayerNorm2d`:为2D数据
- 设计开发实时聊天系统的技术实现与最佳实践
悉地网
phpuniappvue.jswebsocket
实时聊天系统是现代应用中的重要组成部分,从社交平台到企业协作工具,聊天功能的实现可以大大提升用户体验。本文将从技术选型、架构设计、实现细节及优化建议等方面,详细阐述如何开发一个功能完善的聊天系统。最近我也开发了一套即时通讯聊天系统,我叫它xidichat,已经发布上线,前端基于uniapp,服务器端基于php开发环境。具体效果可以查看我的演示站点http://chat.xidicom.cn/也可以
- 计算机毕业设计之springboot书法字典小程序的设计与实现
2301_77990509
课程设计springboot小程序
本项目旨在设计与实现一个基于SpringBoot的书法字典小程序,通过整合现代互联网技术与传统书法艺术,为用户提供一个便捷的书法字典查询平台。该小程序主要功能包括书法字的查询、学习资料、字帖的存储及分享等。首先,项目采用SpringBoot框架进行后端开发,利用其简化的配置和强大的模块支持,提高开发效率。为了实现高效的数据存储与查询,系统使用了MySQL数据库,存储书法字的基本信息、释义及相关图片
- ElasticSearch中的分片是什么?
java1234_小锋
javaelasticsearch大数据搜索引擎
大家好,我是锋哥。今天分享关于【ElasticSearch中的分片是什么?】面试题。希望对大家有帮助;ElasticSearch中的分片是什么?超硬核AI学习资料,现在永久免费了!在Elasticsearch中,分片(Shard)是将数据拆分成更小的部分,允许在分布式环境中并行处理和存储数据的机制。它是Elasticsearch在水平扩展时用于管理大量数据的关键概念。主要概念:主分片(Primar
- 目前比较主流的内网穿透方式 你用过几个
weixin_34365417
嵌入式数据库c#
有时候,我们在外想要访问家里或公司主机的资料,要么由于主机处于内网下,要么就是是运营商随机分配的一个公网IP,都很难直接连上主机获取资料。那么,有什么办法可以解决这一难题?答案就是内网穿透。当内网中的主机没有静态IP地址要被外网稳定访问时可以使用内网穿透NATAPP基于ngrok的国内收费内网穿透工具,免费版本:提供http,https,tcp全隧道穿透,随机域名/TCP端口,不定时强制更换域名/
- 学生选课系统(11457)
codercode2022
visualstudiocodespringboot开发语言matlabjavalaravelobjective-c
有需要的同学,源代码和配套文档领取,加文章最下方的名片哦一、项目演示项目演示视频二、资料介绍完整源代码(前后端源代码+SQL脚本)配套文档(LW+PPT+开题报告)远程调试控屏包运行三、技术介绍Java语言SSM框架SpringBoot框架Vue框架JSP页面Mysql数据库IDEA/Eclipse开发有需要的同学,源代码和配套文档领取,加文章最下方的名片哦!
- 医疗影像诊断新范式:多模态AI在癌症早筛中的落地难题
HeartException
人工智能
前言前些天发现了一个巨牛的人工智能免费学习网站,通俗易懂,风趣幽默,忍不住分享一下给大家。点击跳转到网站医疗影像诊断新范式:多模态AI在癌症早筛中的落地难题——2025年临床转化瓶颈突破与多中心验证报告残酷现实:FDA2025Q1报告显示,87%的AI影像工具因临床转化失败止步于III期试验破局曙光:斯坦福-梅奥联合研究证实,多模态融合使肺结节良恶性判别AUC提升至0.98(单模态上限0.91)一
- 有符号位的数据表示法以及位运算
有符号位的数据表示法与位运算无套路、关注即可领。持续更新中关注公众号:搜【架构研究站】回复:资料领取,即可获取全部面试题以及1000+份学习资料前言:在计算机底层,数据的运算主要通过“补码”来进行。每个数据都有原码、反码和补码三种表示形式。一、有符号位的数据表示法(一)正数在计算机中,通常以固定的位数来表示整数,例如8位、16位或32位等。以8位二进制表示为例,正数的原码、反码和补码都相同。例如数
- Alpha系统联结大数据、GPT两大功能,助力律所管理降本增效
资讯分享周
大数据gpt
如何通过AI工具实现法律服务的提质增效,是每一位法律人都积极关注和学习的课题。但从AI技术火爆一下,法律人一直缺乏系统、实用的学习资料,来掌握在法律场景下AI的使用技巧。今年5月,iCourt携手贵阳律协大数据与人工智能专业委员会,联合举办了《人工智能助力律师行业高质量发展巡回讲座》,超过100家律所的律师参与活动。讲座上,iCourtAIGC研究员、AlphaGPT产品研发负责人兰洋,为贵州律协
- 大学生社交平台-开题报告
yh1340327157
计算机开题报告参考案例java大数据jvmspringboot开发语言intellij-ideamaven
1.结合毕业设计课题情况,根据所查阅的文献资料,每人撰写1500字左右的文献综述(包括研究进展,选题依据、目的、意义)(1)选题依据随着互联网的发展,网络技术角已深深嵌入社会生活的各个层面,网络已然成为我们日常生活中不可或缺的一部分。大学生群体作为对新事物接受度极高的群体,受互联网影响尤为显著,这其中社交服务平台则是大学生在网络中进行互动和沟通的重要渠道和组成部分。但以往传统的大学生社交论坛往往只
- 虚拟数据室:数据管理的创新解决方案
办公效能师
人工智能网络大数据
在当今数字化驱动的商业世界里,数据已然成为企业最具价值的资产之一。从机密的商业计划、敏感的财务报表,到关乎知识产权的研发资料,海量且多样的数据贯穿于企业运营的每一个环节。然而,传统的数据管理方式在面对日益增长的数据量、复杂的协作需求以及严苛的安全监管要求时,显得力不从心。此时,虚拟数据室作为一种创新的数据管理解决方案,正以前沿的科技手段和卓越的管理效能,重塑数据管理格局,为企业筑牢数据根基、释放数
- 展锐 ISP 模块功能特点与应用场景评估:轻量化影像处理方案的实战能力分析
展锐ISP模块功能特点与应用场景评估:轻量化影像处理方案的实战能力分析关键词:展锐ISP、图像信号处理、3DNR、HDR合成、YUV输出、图像管线、降噪算法、调色引擎、应用场景评估、移动终端影像系统摘要:作为国产SoC平台中的关键影像处理核心,展锐ISP(ImageSignalProcessor)聚焦轻量化、低功耗与快速集成三大特性,广泛应用于中低端移动终端、AIoT摄像头及定制化影像设备。相较于
- (慎点/1w字+警告/刚入坑必看请自带水杯)后端入门玩家的第一个项目保姆级笔记包教包会
她是我的青春
项目学习javamavenintellij-idea
目前学习了项目的后端功能开发,针对前段时间的学习进行系统总结提升,根据项目开发流程总结1.资料中所给的前端界面是存放在/backend和/front之中,而springboot自带的是static,故需要做一层映射才可以访问到publicclasswebMvcConfigextendsWebMvcConfigurationSupport{@OverrideprotectedvoidaddResou
- 目标检测:从基础原理到前沿技术全面解析
随机森林404
计算机视觉目标检测人工智能计算机视觉
引言在计算机视觉领域,目标检测是一项核心且极具挑战性的任务,它不仅要识别图像中有什么物体,还要确定这些物体在图像中的具体位置。随着人工智能技术的快速发展,目标检测已成为智能监控、自动驾驶、医疗影像分析等众多应用的基础技术。本文将全面介绍目标检测的基础概念、发展历程、关键技术、实践应用以及未来趋势,为读者提供系统性的知识框架。第一章目标检测概述1.1目标检测的定义与重要性目标检测(ObjectDet
- 5G MEC四大核心挑战技术解析报告
码农老gou
5G5G网络
一、MEC园区部署挑战:数据本地化与低时延接入痛点深度解析数据不出园区:工业质检、医疗影像等敏感业务需数据在本地闭环处理。但运营商基站与企业MEC间若经公网绕行,时延超50ms且存在泄露风险。L2网络局限:传统L2接入网无法实现基站→UPF的智能路由,导致业务流绕行城域网核心节点(平均增加20ms时延)。创新解决方案▍最短路径转发架构(图1)
- 网络安全人士必备的30个安全工具_在网络安全方面,有哪些必备的安全软件和工具(非常详细)从零基础到精通,收藏这篇就够了!
1.WiresharkWireshark(前称Ethereal)是一个网络封包分析软件。网络封包分析软件的功能是截取网络封包,并尽可能显示出最为详细的网络封包资料。Wireshark使用WinPCAP作为接口,直接与网卡进行数据报文交换。2.MetasploitMetasploit是一个免费的、可下载的框架,通过它可以很容易地获取、开发并对计算机软件漏洞实施攻击。它本身附带数百个已知软件漏洞的专业
- java Illegal overloaded getter method with ambiguous type for propert的解决
zwllxs
javajdk
好久不来iteye,今天又来看看,哈哈,今天碰到在编码时,反射中会抛出
Illegal overloaded getter method with ambiguous type for propert这么个东东,从字面意思看,是反射在获取getter时迷惑了,然后回想起java在boolean值在生成getter时,分别有is和getter,也许我们的反射对象中就有is开头的方法迷惑了jdk,
- IT人应当知道的10个行业小内幕
beijingjava
工作互联网
10. 虽然IT业的薪酬比其他很多行业要好,但有公司因此视你为其“佣人”。
尽管IT人士的薪水没有互联网泡沫之前要好,但和其他行业人士比较,IT人的薪资还算好点。在接下的几十年中,科技在商业和社会发展中所占分量会一直增加,所以我们完全有理由相信,IT专业人才的需求量也不会减少。
然而,正因为IT人士的薪水普遍较高,所以有些公司认为给了你这么多钱,就把你看成是公司的“佣人”,拥有你的支配
- java 实现自定义链表
CrazyMizzz
java数据结构
1.链表结构
链表是链式的结构
2.链表的组成
链表是由头节点,中间节点和尾节点组成
节点是由两个部分组成:
1.数据域
2.引用域
3.链表的实现
&nbs
- web项目发布到服务器后图片过一会儿消失
麦田的设计者
struts2上传图片永久保存
作为一名学习了android和j2ee的程序员,我们必须要意识到,客服端和服务器端的交互是很有必要的,比如你用eclipse写了一个web工程,并且发布到了服务器(tomcat)上,这时你在webapps目录下看到了你发布的web工程,你可以打开电脑的浏览器输入http://localhost:8080/工程/路径访问里面的资源。但是,有时你会突然的发现之前用struts2上传的图片
- CodeIgniter框架Cart类 name 不能设置中文的解决方法
IT独行者
CodeIgniterCart框架
今天试用了一下CodeIgniter的Cart类时遇到了个小问题,发现当name的值为中文时,就写入不了session。在这里特别提醒一下。 在CI手册里也有说明,如下:
$data = array(
'id' => 'sku_123ABC',
'qty' => 1,
'
- linux回收站
_wy_
linux回收站
今天一不小心在ubuntu下把一个文件移动到了回收站,我并不想删,手误了。我急忙到Nautilus下的回收站中准备恢复它,但是里面居然什么都没有。 后来我发现这是由于我删文件的地方不在HOME所在的分区,而是在另一个独立的Linux分区下,这是我专门用于开发的分区。而我删除的东东在分区根目录下的.Trash-1000/file目录下,相关的删除信息(删除时间和文件所在
- jquery回到页面顶端
知了ing
htmljquerycss
html代码:
<h1 id="anchor">页面标题</h1>
<div id="container">页面内容</div>
<p><a href="#anchor" class="topLink">回到顶端</a><
- B树、B-树、B+树、B*树
矮蛋蛋
B树
原文地址:
http://www.cnblogs.com/oldhorse/archive/2009/11/16/1604009.html
B树
即二叉搜索树:
1.所有非叶子结点至多拥有两个儿子(Left和Right);
&nb
- 数据库连接池
alafqq
数据库连接池
http://www.cnblogs.com/xdp-gacl/p/4002804.html
@Anthor:孤傲苍狼
数据库连接池
用MySQLv5版本的数据库驱动没有问题,使用MySQLv6和Oracle的数据库驱动时候报如下错误:
java.lang.ClassCastException: $Proxy0 cannot be cast to java.sql.Connec
- java泛型
百合不是茶
java泛型
泛型
在Java SE 1.5之前,没有泛型的情况的下,通过对类型Object的引用来实现参数的“任意化”,任意化的缺点就是要实行强制转换,这种强制转换可能会带来不安全的隐患
泛型的特点:消除强制转换 确保类型安全 向后兼容
简单泛型的定义:
泛型:就是在类中将其模糊化,在创建对象的时候再具体定义
class fan
- javascript闭包[两个小测试例子]
bijian1013
JavaScriptJavaScript
一.程序一
<script>
var name = "The Window";
var Object_a = {
name : "My Object",
getNameFunc : function(){
var that = this;
return function(){
- 探索JUnit4扩展:假设机制(Assumption)
bijian1013
javaAssumptionJUnit单元测试
一.假设机制(Assumption)概述 理想情况下,写测试用例的开发人员可以明确的知道所有导致他们所写的测试用例不通过的地方,但是有的时候,这些导致测试用例不通过的地方并不是很容易的被发现,可能隐藏得很深,从而导致开发人员在写测试用例时很难预测到这些因素,而且往往这些因素并不是开发人员当初设计测试用例时真正目的,
- 【Gson四】范型POJO的反序列化
bit1129
POJO
在下面这个例子中,POJO(Data类)是一个范型类,在Tests中,指定范型类为PieceData,POJO初始化完成后,通过
String str = new Gson().toJson(data);
得到范型化的POJO序列化得到的JSON串,然后将这个JSON串反序列化为POJO
import com.google.gson.Gson;
import java.
- 【Spark八十五】Spark Streaming分析结果落地到MySQL
bit1129
Stream
几点总结:
1. DStream.foreachRDD是一个Output Operation,类似于RDD的action,会触发Job的提交。DStream.foreachRDD是数据落地很常用的方法
2. 获取MySQL Connection的操作应该放在foreachRDD的参数(是一个RDD[T]=>Unit的函数类型),这样,当foreachRDD方法在每个Worker上执行时,
- NGINX + LUA实现复杂的控制
ronin47
nginx lua
安装lua_nginx_module 模块
lua_nginx_module 可以一步步的安装,也可以直接用淘宝的OpenResty
Centos和debian的安装就简单了。。
这里说下freebsd的安装:
fetch http://www.lua.org/ftp/lua-5.1.4.tar.gz
tar zxvf lua-5.1.4.tar.gz
cd lua-5.1.4
ma
- java-递归判断数组是否升序
bylijinnan
java
public class IsAccendListRecursive {
/*递归判断数组是否升序
* if a Integer array is ascending,return true
* use recursion
*/
public static void main(String[] args){
IsAccendListRecursiv
- Netty源码学习-DefaultChannelPipeline2
bylijinnan
javanetty
Netty3的API
http://docs.jboss.org/netty/3.2/api/org/jboss/netty/channel/ChannelPipeline.html
里面提到ChannelPipeline的一个“pitfall”:
如果ChannelPipeline只有一个handler(假设为handlerA)且希望用另一handler(假设为handlerB)
来
- Java工具之JPS
chinrui
java
JPS使用
熟悉Linux的朋友们都知道,Linux下有一个常用的命令叫做ps(Process Status),是用来查看Linux环境下进程信息的。同样的,在Java Virtual Machine里面也提供了类似的工具供广大Java开发人员使用,它就是jps(Java Process Status),它可以用来
- window.print分页打印
ctrain
window
function init() {
var tt = document.getElementById("tt");
var childNodes = tt.childNodes[0].childNodes;
var level = 0;
for (var i = 0; i < childNodes.length; i++) {
- 安装hadoop时 执行jps命令Error occurred during initialization of VM
daizj
jdkhadoopjps
在安装hadoop时,执行JPS出现下面错误
[slave16]
[email protected]:/tmp/hsperfdata_hdfs# jps
Error occurred during initialization of VM
java.lang.Error: Properties init: Could not determine current working
- PHP开发大型项目的一点经验
dcj3sjt126com
PHP重构
一、变量 最好是把所有的变量存储在一个数组中,这样在程序的开发中可以带来很多的方便,特别是当程序很大的时候。变量的命名就当适合自己的习惯,不管是用拼音还是英语,至少应当有一定的意义,以便适合记忆。变量的命名尽量规范化,不要与PHP中的关键字相冲突。 二、函数 PHP自带了很多函数,这给我们程序的编写带来了很多的方便。当然,在大型程序中我们往往自己要定义许多个函数,几十
- android笔记之--向网络发送GET/POST请求参数
dcj3sjt126com
android
使用GET方法发送请求
private static boolean sendGETRequest (String path,
Map<String, String> params) throws Exception{
//发送地http://192.168.100.91:8080/videoServi
- linux复习笔记 之bash shell (3) 通配符
eksliang
linux 通配符linux通配符
转载请出自出处:
http://eksliang.iteye.com/blog/2104387
在bash的操作环境中有一个非常有用的功能,那就是通配符。
下面列出一些常用的通配符,如下表所示 符号 意义 * 万用字符,代表0个到无穷个任意字符 ? 万用字符,代表一定有一个任意字符 [] 代表一定有一个在中括号内的字符。例如:[abcd]代表一定有一个字符,可能是a、b、c
- Android关于短信加密
gqdy365
android
关于Android短信加密功能,我初步了解的如下(只在Android应用层试验):
1、因为Android有短信收发接口,可以调用接口完成短信收发;
发送过程:APP(基于短信应用修改)接受用户输入号码、内容——>APP对短信内容加密——>调用短信发送方法Sm
- asp.net在网站根目录下创建文件夹
hvt
.netC#hovertreeasp.netWeb Forms
假设要在asp.net网站的根目录下建立文件夹hovertree,C#代码如下:
string m_keleyiFolderName = Server.MapPath("/hovertree");
if (Directory.Exists(m_keleyiFolderName))
{
//文件夹已经存在
return;
}
else
{
try
{
D
- 一个合格的程序员应该读过哪些书
justjavac
程序员书籍
编者按:2008年8月4日,StackOverflow 网友 Bert F 发帖提问:哪本最具影响力的书,是每个程序员都应该读的?
“如果能时光倒流,回到过去,作为一个开发人员,你可以告诉自己在职业生涯初期应该读一本, 你会选择哪本书呢?我希望这个书单列表内容丰富,可以涵盖很多东西。”
很多程序员响应,他们在推荐时也写下自己的评语。 以前就有国内网友介绍这个程序员书单,不过都是推荐数
- 单实例实践
跑龙套_az
单例
1、内部类
public class Singleton {
private static class SingletonHolder {
public static Singleton singleton = new Singleton();
}
public Singleton getRes
- PO VO BEAN 理解
q137681467
VODTOpo
PO:
全称是 persistant object持久对象 最形象的理解就是一个PO就是数据库中的一条记录。 好处是可以把一条记录作为一个对象处理,可以方便的转为其它对象。
BO:
全称是 business object:业务对象 主要作用是把业务逻辑封装为一个对象。这个对
- 战胜惰性,暗自努力
金笛子
努力
偶然看到一句很贴近生活的话:“别人都在你看不到的地方暗自努力,在你看得到的地方,他们也和你一样显得吊儿郎当,和你一样会抱怨,而只有你自己相信这些都是真的,最后也只有你一人继续不思进取。”很多句子总在不经意中就会戳中一部分人的软肋,我想我们每个人的周围总是有那么些表现得“吊儿郎当”的存在,是否你就真的相信他们如此不思进取,而开始放松了对自己的要求随波逐流呢?
我有个朋友是搞技术的,平时嘻嘻哈哈,以
- NDK/JNI二维数组多维数组传递
wenzongliang
二维数组jniNDK
多维数组和对象数组一样处理,例如二维数组里的每个元素还是一个数组 用jArray表示,直到数组变为一维的,且里面元素为基本类型,去获得一维数组指针。给大家提供个例子。已经测试通过。
Java_cn_wzl_FiveChessView_checkWin( JNIEnv* env,jobject thiz,jobjectArray qizidata)
{
jint i,j;
int s
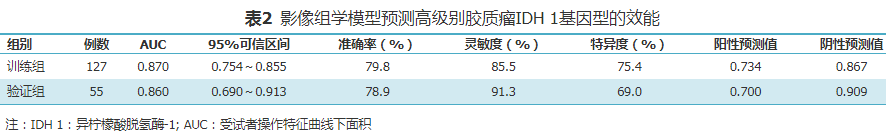
图1, 2 影像组学特征提取示意图。图1为胶质瘤最大截面的原始图像。图2为在GE A.K (Analysis-Kinetics)分析软件上手动勾勒感兴趣区(ROI) 图3, 4 使用Lasso-logistic回归模型对影像组学特征进行筛选。图3为Lasso模型中使用十倍交叉验证方法,筛选出效能最好的特征集:基于最小标准,通过十倍交叉验证在Lasso模型中选择调整参数(λ)。将来自Lasso回归交叉验证模型的二项式偏差绘制为log (λ)函数。y轴表示二项式偏差,x轴表示log(λ)。沿x轴上方的数字表示预测变量的平均数。红点表示具有给定λ的每个模型的平均偏差值,而通过红点表示的垂直线表示偏差的上升值和下限值。垂直虚线为定义λ的最佳值。图4为Lasso模型中使用十倍交叉验证方法筛选特征的特征系数收敛图。x轴λ的最佳值对应筛选出的最佳非零特征 图5, 6 训练组和验证组的受试者操作特征(ROC)曲线图。图5为影像组学鉴别IDH 1突变型和野生型胶质瘤训练组的ROC曲线,曲线下面积(AUC)值为0.870,说明影像组学模型可以很好地鉴别IDH 1突变型和IDH 1野生型。图6为影像组学鉴别IDH 1突变型和野生型胶质瘤验证组的ROC曲线,AUC值为0.860,说明本研究所建立的影像组学模型具有较高的效能四、统计学分析1.特征筛选和影像组学标签建立: 按7∶3比例将数据随机分为训练组(127例,IDH 1突变型55例,IDH 1野生型72例)和验证组(55例,IDH 1突变型24例,IDH 1野生型31例)[12]。采用Kruskal-Wallis非参数检验比较IDH 1突变型和野生型胶质瘤的影像组学特征,并通过Spearman相关性分析进行特征降维去冗余,获取最终特征参数。采用Lasso-logistic回归模型挑选基于T1WI增强图像提取的影像组学特征,通过选取的特征与对应加权系数乘积的线性组合依次形成每个患者的影像组学标签,通过各自系数加权选定特征线性组合来计算每一例患者的影像组学评分。采用受试者操作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)对模型的鉴别效能进行评估,0.50.9诊断效能较高。2.影像组学模型的建立及效能评价: 利用R语言软件包(https://www.r-project.org/)中的"GLM"函数将获得的特征纹理参数建立线性回归(logistic linear regression,LLR)模型。以交叉验证方法对模型进行检验,并绘制ROC曲线,计算其鉴别IDH 1突变型和野生型胶质瘤的准确率、灵敏度、特异度、阳性预测值和阴性预测值。3.人口年龄和性别统计学比较: 使用SPSS 23.0统计软件进行分析。计数资料用频数表示,符合正态分布的计量资料数用
±s表示,不符合正态分布的计量资料用中位数(上、下四分位数)表示。采用独立样本t检验比较IDH 1突变型与野生型胶质瘤患者的年龄差异。采用χ2检验比较IDH 1突变型与野生型胶质瘤患者的性别差异。P<0.05为差异有统计学意义。
三、影像组学模型及鉴别预测效能 在本研究中,联合影像组学标签特征与病理结果进行二分类建模,以评估影像组学模型对IDH 1基因突变型胶质瘤和IDH 1野生型胶质瘤的鉴别效能(图5, 图6;表2),结果显示影像组学模型具有较好的鉴别诊断能力。