【2020年】CRISPR基因编辑技术最新进展盘点解读
即将过去的2020,有哪些重大的CRISPR/Cas研究或发现呢?
小编梳理了一下CRISPR/Cas研究方面的新闻,供大家阅读。
需要了解更多原文信息,请搜索“泽平科技”公众号,发送具体论文名称获取哦!
【12月】
1.CRISPR-Cas9技术编辑的CAR-T细胞或能增强机体抵御血液癌症的潜力
近日,在2020年第62届美国血液学会年会(ASH)上,来自宾夕法尼亚大学的科学家们展示了他们最新的临床前研究结果,他们发现,利用CRISPR/Cas9技术敲除CAR-T细胞上能抑制T细胞激活的特殊蛋白或能增强工程化T细胞清除血液癌症的能力。研究人员敲除了CAR-T细胞上名为CD5的基因,随后将其输注回携带T细胞和B细胞白血病/淋巴瘤的小鼠体内,CD5基因能编码T细胞表面的CD5蛋白,而且还会抑制其激活。相比输注了非编辑CAR-T细胞的小鼠而言,输注了CD5被剔除的CAR-T细胞的小鼠机体外周血中的T细胞增殖水平较高,而且肿瘤尺寸发生了明显下降,且小鼠有更好的生存结局。
CRISPR技术能帮助科学家们锁定并编辑任何不需要的基因,以癌症为例,该技术就能通过剔除T细胞中的特殊基因来帮其更好地抵御肿瘤,这种方法与CAR-T细胞疗法密切相关,即研究人员通过收集患者机体自身的T细胞,对其进行工程化修饰表达新型受体从而寻找并攻击癌细胞。医学博士Marco Ruella说道,我们通过研究首次表明,我们可以成功利用CRISPR/Cas9技术来敲除CAR-T细胞表面的CD5,从而增强其攻击癌症的能力,在多种癌症模型中,编辑和非编辑CAR-T细胞之间的差异非常惊人。
图片来源:CC0 Public Domain
2.我国科学家利用CRISPR-Cas13完成对环形RNA功能的筛选和研究
中国科学院上海营养与健康研究所(中科院-马普学会计算生物学伙伴研究所)研究员杨力研究组与中科院分子细胞科学卓越创新中心研究员陈玲玲研究组、研究员李劲松研究组合作,在Nature Methods上,发表了关于环形RNA研究的最新进展——Screening for functional circular RNAs using the CRISPR-Cas13 system。
外显子反向剪接形成的环形RNA是一类不具有5' 帽子和3' 尾巴的共价闭合RNA分子,其与对应的线形RNA在一级序列上完全重复。研究人员构建并优化了一系列环形RNA计算生物学研究体系,通过在转录组高通量测序数据中寻找环形RNA特异的反向剪接位点,揭示了环形RNA的广谱表达、其特殊加工机制和功能作用等(Zhang et al,Cell 2014;Zhang et al,Genome Res 2016;Dong et al,Cell Res 2016;Zhang et al,Cell Rep 2016;Dong et al,RNA Biol 2017;Li et al,Mol Cell2017;Liu et al,Cell 2019;etc)。近期,研究人员还构建了全新的CIRCexplorer3-CLEAR分析流程,通过直接比较环形与线形RNA表达,获取了具有生物潜能的高表达环形RNA(Ma et al. Genomics Proteomics Bioinformatics2019)。然而,迄今仍没有一种高效的方法可以在体内直接区分一级序列重复的环形RNA与线形RNA,这影响了针对环形RNA的功能研究。
3.基于CRISPR-Cas9的侧流分析法实现SARS-CoV-2的同时双基因诊断
近日,华南师范大学周小明课题组报道了一种基于CRISPR-Cas9的新冠病毒双基因诊断技术。这一研究成果于2020年12月09日发表在国际顶尖学术期刊《德国应用化学》上。
在该研究中,课题组开发了一种由CRISPR-Cas9介导的三线侧流分析方法,与多重逆转录-重组酶聚合酶扩增相结合,以实现在单张检测试纸上进行新冠病毒的快速同时双基因检测。该检测方法的特点是检测细胞培养的新冠病毒及新冠病毒RNA标准中的信封蛋白(E)和开放阅读框1ab(ORF1ab)基因,敏感度可达每反应(25 μL)100个RNA副本。
进一步研究表明,对64个鼻咽拭子临床样本的双基因分析显示该方法的阴性预测率为100%,而阳性预测率为97.14%。正如预料中的那样,这一先进平台将为在资源不足的地区开展新冠病毒或其他疾病检测提供了一条准确方便的途径。
据介绍,对感染人群进行大规模准确筛查已被证明是有效控制新冠肺炎传播的方法。目前,已有许多分析方法被开发出来以满足在不同测试环境中的广大测试需求。然而,极少有方法侧重于在一个检测中同时检测两个基因,而这是RT-qPCR的检测金标准中所采用的保证检测准确性的重要条件。
【11月】
1.解读!科学家开发出一种安全更具靶向性的方法来运输CRISPR基因疗法!
doi:10.1021/acsami.0c16380
近日,一篇发表在国际杂志ACS applied Materials & Interfaces上题为“Spatial and Temporal Control of CRISPR-Cas9-Mediated Gene Editing Delivered via a Light-Triggered Liposome System”的研究报告中,来自新南威尔士大学等机构的科学家们通过研究揭示了一种安全且更具靶向性的方法来运输CRISPR基因疗法,研究者指出,这种光激活的脂质体能够帮助运输CRISPR基因疗法,而且相比当前方法而言,这种方法更加安全且直接。
研究者发现,通常在药理学中用于包裹药物或基因的脂质体能被光记过从而在机体特定部位释放“货物”;本文研究是研究人员在细胞系和动物模型中得到的结果,后期他们还需要进一步研究来检测并在人类机体中证实这种方法的可靠性。截至目前为止,CRISPR基因疗法已经能够使用CRISPR分子装载的病毒在机体中移动来寻找靶向细胞了。尽管该技术被证明具有革命性的意义,但由于其存在潜在的不良免疫反应和毒性效应,使用病毒作为载体似乎并不太理想。
2.Science子刊:重大突破!首次利用CRISPR/Cas9基因组编辑系统在体内破坏癌细胞
doi:10.1126/sciadv.abc9450
在一项新的研究中,来自以色列特拉维夫大学等研究机构的研究人员证实CRISPR/Cas9系统在治疗转移性癌症方面非常有效,这是在寻找癌症治愈方法的道路上迈出的重要一步。他们开发出一种基于脂质纳米颗粒的新型递送系统,该递送系统专门针对癌细胞,并通过基因操纵破坏它们。这种称为CRISPR-LNP的递送系统携带一种编码Cas9的信使RNA(mRNA),其中Cas9作为分子剪刀切割细胞中的DNA。相关研究结果发表在2020年11月18日的Science Advances期刊上,论文标题为“CRISPR-Cas9 genome editing using targeted lipid nanoparticles for cancer therapy”。论文通讯作者为特拉维夫大学史姆尼斯生物医学与癌症研究学院精密纳米医学实验室研发副总裁Dan Peer教授。
设计和构建CRISPR-LNP,图片来自Science Advances, 2020, doi:10.1126/sciadv.abc9450。
Peer教授说,“这是世界上第一个证明CRISPR基因组编辑系统可以在活体动物中有效治疗癌症的研究。必须强调的是,这不是化疗。没有任何副作用,用这种方法治疗的癌细胞将永远不会再活跃起来。Cas9的分子剪刀剪断了癌细胞的DNA,从而永久地阻止了它们的复制。”
为了研究利用这种技术治疗癌症的可行性,Peer教授和他的团队选择了两种最致命的癌症:胶质母细胞瘤和转移性卵巢癌。胶质母细胞瘤是最具侵略性的脑癌类型,确诊后的预期寿命为15个月,5年生存率仅为3%。这些研究人员证明,用CRISPR-LNP进行一次治疗,胶质母细胞瘤小鼠的平均寿命就会延长一倍,总体生存率提高约30%。
3.Human Gene Therapy:肝脏再生促进基因修复
doi:10.1089/hum.2020.042
根据最近发表的一项研究,使用甲状腺激素促进肝细胞增殖提高了小鼠肝脏中CRISPR / Cas9介导的基因编辑的效率。相关结果发表在《Human Gene Therapy》杂志上。研究表明,这种饮食诱导的肝细胞再生可能是增强肝脏基因修复的可行临床策略。
这项研究是在1型酪氨酸血症小鼠模型中完成的。“在新生小鼠中,获得了大约10.8%的肝细胞基因校正频率,”俄勒冈健康与科学大学的作者Qingshuo Zhang说。 “成年小鼠的效率显著降低,大约为1.6%。”
4.Science:重大进展!利用新开发的CRISPR-LICHT技术筛选出决定人类大脑大小的基因
doi:10.1126/science.abb5390
在果蝇和线虫身上可以常规地进行遗传筛选。在人类中,存在着丰富的关于遗传病和疾病相关突变后果的知识,但对人类进行系统性分析是不可能的。如今,在一项新的研究中,来自奥地利维也纳生物中心(Vienna BioCenter)、维也纳大学和维也纳医科大学的研究人 员开发出一种突破性的技术,这种技术允许在人类组织中并行分析数百个基因。他们将这种新技术命名为CRISPR-LICHT。相关研究结果近期发表在Science期刊上,论文标题为“A human tissue screen identifies a regulator of ER secretion as a brain size determinant”。
论文共同第一作者、IMBA博士生Dominik Lindenhofer解释说,“这种技术是基于众所周知的在2020年10月获得诺贝尔奖的CRISPR-Cas9技术和双条码方法的结合。关键的技巧是使用向导RNA(gRNA),同时也使用一种基因条形码,即我们添加到用来培养类器官的细胞基因 组中的DNA片段。这让我们可以看到每个类器官的完整细胞谱系,而第二种条形码让我们可以计算每个起始细胞产生的细胞数量。这降低了噪音,因此我们可以确定每种gRNA对类器官生长过程中产生的细胞数量的影响。为了描述我们的方法,我们将之称为CRISPR-LICHT( CRIPSR-Lineage Tracing at Cellular resolution in Heterogenous Tissue,利用CRipsR在异质组织中进行细胞分辨率下的谱系追踪)。”
这些研究人员将CRISPR-LICHT应用于小头畸形(microcephaly),即一种以患者大脑尺寸缩小和严重智力障碍为典型特征的遗传性疾病。通过这种革命性的新技术,他们筛选出了所有疑似在这种疾病中发挥作用的基因。
5.Cell解读!科学家们真能利用CRISPR/Cas9技术来纠正人类胚胎中的突变?或许为时尚早!
doi:10.1016/j.cell.2020.10.025
近日,一篇刊登在国际杂志Cell上题为“Allele-Specific Chromosome Removal after Cas9 Cleavage in Human Embryos”的研究报告中,来自哥伦比亚大学等机构的科学家们通过研究描述了CRISPR基因编辑技术对人类胚胎中基因进行编辑后所出现的意想不到的不良结果。
对人类胚胎中致病基因突变的修正或许有望减少人类遗传性疾病的负担,并能改善携带致病性突变夫妇的生育疗法(以此能代替对胚胎的选择),这项研究中,研究人员评估了在父源性染色体EYS位点上引入Cas9诱导的双链断裂(DSB)所产生的修复结果,EYS位点携带有一种会诱发失明的移码突变(frameshift mutation),研究者发现,最常见的修复结局都是微同源性介导的末端连接,而该过程发生在胚胎发育的第一个细胞周期中,其会导致胚胎出现读码阅读框的非镶嵌型修复,而值得注意的是,大约一半的断裂并不会被修复,从而就会产生未检测到的父源性等位基因的出现,且会在优势分裂后失去一条或两条染色体臂。相应地,Cas9脱靶的断裂则会导致染色体丢失及半合子不整合的出现(因为两个等位基因发生了断裂),相关研究结果揭示了科学家操控染色体内容物的能力,同时也提出了修正人类胚胎中突变所面临的重大挑战。
6.Cell:通过CRISPR筛选鉴定出抵抗新冠病毒感染的基因和药物靶标
doi:10.1016/j.cell.2020.10.030
在一项新的研究中,为了确定SARS-CoV-2的新的潜在治疗靶点,来自美国纽约大学、纽约基因组中心和西奈山伊坎医学院等研究机构的研究人员进行了全基因组范围内的功能缺失CRISPR筛选,以便系统地敲除人类基因组中的基因。他们研究了哪些基因修饰使得人肺细胞对SARS-CoV-2感染更具抵抗力。他们的研究结果揭示了人类基因组中的哪些基因和基因调控网络是SARS-CoV-2感染所需的,抑制这些基因赋予了对这种冠状病毒感染的抵抗力。他们描述了一系列以前没有被认为是SARS-CoV-2治疗靶点的基因。相关研究结果近期发表在Cell期刊上,论文标题为“Identification of required host factors for SARS-CoV-2 infection in human cells”。
为了更好地理解宿主和病毒遗传依赖性之间的复杂关系,这些作者使用了一系列分析和实验方法来验证他们的结果。这种综合方法包括基因组编辑、单细胞测序、共聚焦成像以及基因表达和蛋白质组数据集的计算分析。他们发现,这些新的基因靶点在使用小分子(药物)加以抑制后,可显著降低病毒载量,其中的有些药物降低病毒载量高达1000倍。他们的研究结果为可能开发有效治疗COVID-19的新型药物提供了重要见解,并揭示它们的分子靶点。
7.Cell:全基因组CRISPR筛选鉴定出对新冠病毒感染至关重要的宿主因子
doi:10.1016/j.cell.2020.10.028
在一项新的研究中,来自美国耶鲁大学和布罗德研究所等研究机构的研究人员对暴露于SARS-CoV-2和MERS-CoV冠状病毒的数亿个细胞进行了筛选,鉴定出几十个能使这两种病毒在细胞中复制的基因,也鉴定出一些似乎抑制这些病毒的基因。他们表示,这些基因的促病毒作用和抗病毒作用将有助于指导科学家们开发新的疗法来对抗COVID-19。相关研究结果近期发表在Cell期刊上,论文标题为“Genome-wide CRISPR screens reveal host factors critical for SARS-CoV-2 infection”。
图片来自NIH。
在这项新的研究中,这些研究人员对绿猴细胞进行了全基因组CRISPR筛选,其中与常用的人类细胞系相比,绿猴细胞在暴露于SARS-CoV-2后更容易死亡。这种筛选首次允许他们同时跟踪病毒和细胞之间的相互作用。这种筛选证实了早先的发现,即编码细胞表面受体的ACE-2基因能促进SARS-CoV-2感染宿主细胞。
然而,这种筛选还发现了两种新的促病毒蛋白复合物和第三种似乎有助于阻止感染的蛋白复合物。他们发现,能开启和关闭基因的SWI/SNF复合物和具有包括调节炎症在内的许多功能的HMGB1与感染后细胞死亡增加有关。
这些研究人员随后加入了抑制已发现的这两种基因产物功能的小分子药物,并发现它们可以增加培养皿中的细胞在感染后的存活率。相比之下,有助于调节细胞核内基因表达的组蛋白H3复合物似乎提供了一种保护作用,这会抑制SARS-CoV-2感染和杀死细胞的能力。
【10月】
1.Nat Commun:在小鼠体内利用CRISPR/Cas9成功地选择性消除肿瘤细胞而不影响健康细胞
doi:10.1038/s41467-020-18875-x
CRISPR/Cas9基因编辑工具是推进包括癌症在内的遗传性疾病治疗的最有前途的方法之一,这一研究领域正在不断取得进展。如今,在一项新的研究中,西班牙国家癌症研究中心(CNIO)的Sandra Rodríguez-Perales博士及其研究团队取得了新的进展:利用这种技术消除了所谓的融合基因,这为在未来开发专门破坏肿瘤而不影响健康细胞的癌症疗法打开了大门。相关研究结果近期发表在Nature Communications期刊上,论文标题为“In vivo CRISPR/Cas9 targeting of fusion oncogenes for selective elimination of cancer cells”。
图片来自Nature Communications, 2020, doi:10.1038/s41467-020-18875-x。
融合基因是来自两个不同基因的DNA片段不正确连接在一起的异常结果,这是细胞分裂过程中偶然发生的事件。如果细胞不能从这个错误中获益,它们就会死亡,融合基因也会被淘汰。但当这个错误导致生殖或生存优势时,携带这种融合基因的细胞将会增殖,融合基因及其编码的蛋白会触发肿瘤形成。Rodríguez-Perales解释说,“许多染色体重排及其产生的融合基因是儿童肉瘤和白血病的起源。”融合基因也被发现存在于前列腺瘤、乳腺癌、肺瘤和脑瘤等其他癌症中。总的来说,它们存在于高达20%的癌症中。
鉴于融合基因只存在于肿瘤细胞中,它们吸引了科学界的极大兴趣,这是因为它们是高度特异性的治疗靶点,攻击它们只会影响肿瘤而对健康细胞没有影响。这正是CRISPR/Cas9技术的作用所在。通过这项技术,人们可以靶向基因组的特定序列,就像使用分子剪刀一样,将DNA片段剪断和粘贴,从而以一种可控的方式修改基因组。在这项新的研究中,Rodríguez-Perales团队在尤文氏肉瘤和慢性髓细胞白血病(CML)的细胞系和小鼠模型中,利用CRISPR/Cas9切除导致肿瘤的融合基因,从而成功地消除肿瘤细胞。
2.Nature解读!科学家有望利用CRISPR-Cas9基因疗法治疗快乐木偶综合征!
doi:10.1038/s41586-020-2835-2
出生时携带缺陷的母亲UBE3A基因的婴儿会患上一种名为快乐木偶综合征(Angelman syndrome)的罕见病,其是一种目前无法治愈且治疗非常有限的严重神经发育障碍。近日,一项刊登在国际杂志Nature上题为“Cas9 gene therapy for Angelman syndrome traps Ube3a-ATS long non-coding RNA”的研究报告中,来自北卡罗来纳大学等机构的科学家们通过研究表示,利用基因编辑和基因疗法等技术或有望恢复人类神经元培养物中UBE3A基因的功能并能有效治疗Angelman综合征模型的缺陷,相关研究结果或为后期科学家们治疗Angelman综合征提供了重要基础,同时也为治疗其它单基因障碍开辟了道路。
研究者Zylka表示,本文研究中我们揭示了如何利用CRISPR-Cas9基因疗法来治疗与Angelman综合征相关的多种疾病症状,Angelman综合征是由编码泛素蛋白连接酶E3A(UBE3A)的母源性基因拷贝的突变或剔除所引起的,父源性的UBE3A基因拷贝通常在后代机体神经元中处于沉默状态,因此母源性的UBE3A基因拷贝的缺失会导致大脑中大部分区域失去UBE3A酶类的功能,这一点非常关键,因为该酶能靶向作用蛋白进行降解,而靶向作用蛋白降解的过程对于维持大脑细胞的正常功能至关重要,当该过程出错时就会诱发Angelman综合征,这是一种脑部疾病,其症状包括严重的智力和发育障碍、癫痫发作、以及患者会出现语言、平衡、运动和睡眠等多种问题。
3.Sci Rep:科学家成功利用人工RNA编辑技术修复基因组遗传代码 有望治疗多种遗传性疾病
doi:10.1038/s41598-020-74374-5
目前并没有确定的疗法来治疗由点突变引起的多种遗传性疾病,近日,一项刊登在国际杂志Scientific Reports上的研究报告中,来自日本先进科学技术研究所等机构的科学家们通过利用人工的RNA编辑研究了一种治疗手段在治疗遗传性疾病上的可行性和有效性。尽管基因编辑技术作为一种基因修复技术备受关注,但诸如CRISPR/Cas9基因编辑技术或许会导致基因组DNAs发生永久性的改变,其可能会影响多个潜在的位点,目前想要在体内对所有靶向细胞实现精准的基因组编辑是非常困难的,所以研究人员就有可能在受精卵、胚胎或细胞中开展基因编辑工作,然而,基因编辑技术或许并不适合用于在人类中进行的基因疗法,此外,对基因组的编辑也会产生一些伦理性的问题。
研究人员认为,基因组编辑是一种适用于体外研究的方法,其或许还适用于对受精卵进行编辑,但目前仍然并不适用于患者机体;相反,RNA编辑所产生的改变并不是永久性的,因为其不会影响机体的基因组序列,而且能够按照序列特异性的方式来完成。因此,从治疗的目的来看,RNA的编辑比基因组编辑更加可取,人工定向的RNA编辑是一种重要的技术,其能修复基因并最终调节所编码蛋白质的功能,如今研究人员正在试图通过人工RNA编辑来修饰转录物的遗传密码,从而实现对遗传性疾病的治疗。
RNA编辑是生物体内广泛存在的一种生理性过程,其能通过单个基因产生具有不同功能的多种蛋白,在哺乳动物中,RNA链的C或A碱基能被碱基序列特异性地水解脱氨,即C被U替代,A被I(肌苷)替代。这些碱基的转换是A或C脱氨的结果,目前研究者发现ADAR和APOBEC家族中的酶类能催化这些碱基转换,随后还会改变RNAs中的遗传密码,这项研究中,研究人员首次利用APOBEC1成功进行了突变RNA中C-U的人工转换。
4.HGT:科学家有望利用mRNA疗法或CRISPR基因编辑技术治疗囊性纤维化
doi:10.1089/hum.2020.137
近日,一项刊登在国际杂志Human Gene Therapy上题为“Treating Cystic Fibrosis with mRNA and CRISPR”的研究报告中,来自佐治亚理工学院等机构的科学家们通过研究揭示了如何利用mRNA疗法或CRISPR技术来治疗囊性纤维化患者。
文章中,研究者表示,利用mRNA疗法或CRISPR基因编辑技术来治疗囊性纤维化(CF,Cystic Fibrosis)的潜力是可能的,这与患者机体的致病性突变似乎并无关联,目前囊性纤维化相关的临床试验结果表明,针对囊性纤维化的基因型不可知的基因疗法似乎是可行的。
5.深度解读:2020年诺贝尔化学奖授予CRISPR-Cas9基因编辑技术
2020年10月7日,瑞典皇家科学院已决定将2020年诺贝尔化学奖授予德国马克斯·普朗克病原学研究所的Emmanuelle Charpentier博士以及美国加州大学伯克利分校的Jennifer A. Doudna博士,以表彰她们在基因编辑领域的贡献。
图片来源:NobelPrize.org。
Emmanuelle Charpentier和Jennifer A. Doudna发现了基因编辑技术中最犀利的工具之一:CRISPR / Cas9基因剪刀。通过该工具,研究人员可以非常高精度地改变动物,植物和微生物的DNA。这项技术对生命科学产生了革命性的影响,并且可以为新的遗传病以及癌症的治疗做出贡献。
6.PNAS:开发出超灵敏的SHERLOCK疟疾测试方法
doi:10.1073/pnas.2010196117
目前,四种主要的疟原虫物种---恶性疟原虫、间日疟原虫、卵形疟原虫和三日疟原虫---的存在是通过对血液样本的显微镜分析来确定的,在血液样本的红细胞中可以检测到疟原虫,或者通过所谓的快速诊断测试来确定特定的疟原虫蛋白(抗原)。
美国波士顿儿童医院传染病诊断实验室副医学主任、哈佛医学院病理学与医学副教授Nira Pollock博士说,“不幸的是,现有的快速诊断方法不能将所有四种疟原虫区分开来,这对启动针对性的治疗过程很重要,最重要的是,它们无法有效地检测无症状个体中的低数量疟原虫。” 哈佛医学院儿科副教授、波士顿儿童医院传染病高级副医师Jeffrey Dvorin医学博士补充道,“这些‘无症状携带者(asymptomatic carrier)’是传播疟疾的蚊子持续传播这种疾病的潜伏库,对于正在进行的全球消除疟疾的努力极为重要。”
如今,在一项新的研究中,Pollock及其同事们开发出一种可现场应用的超灵敏诊断测试方法,可特异性地检测有症状和无症状疟疾患者体内所有疟原虫物种的DNA序列。这种新的疟疾诊断方法将优化的10分钟快速样品制备方案与基于CRISPR的SHERLOCK系统相结合,在简单的报告装置中,再过60分钟就能实现高度特异性和灵敏度的疟原虫检测。相关研究结果近期发表在PNAS期刊上,论文标题为“Ultrasensitive CRISPR-based diagnostic for field-applicable detection of Plasmodium species in symptomatic and asymptomatic malaria”。
论文通讯作者、哈佛医学院怀斯生物启发工程研究所创始核心成员James Collins博士说,“这种可用于现场的SHERLOCK疟疾检测方法超越了世界卫生组织设定的理想测试方法的灵敏度和特异性要求,可用于检测所有主要疟原虫物种的无症状携带者中的低密度疟原虫。它的高度精简的设计可以为目前消除疟疾道路上的诊断瓶颈提供一种可行的解决方案,以便更广泛地实现低资源环境下的疟疾监测。”
7.Nat Immunol:关键基因调节免疫系统“刹车”
doi:10.1038/s41590-020-0784-4
与大多数T细胞发起针对外来分子的免疫反应不同,调节性T细胞是人类免疫系统的和平使者,可在不需要时抑制炎症反应。现在,格拉德斯通研究所的研究人员与加州大学旧金山分校(UCSF)和慕尼黑工业大学(TUM)的科学家合作,绘制了有助于区分调节性T细胞与其他T细胞的基因网络。他们的发现可能导致增强或削弱调节性T细胞功能的免疫疗法。
Gladstone-UCSF基因免疫研究所所长Alex Marson表示:“将调节性T细胞生物学的遗传网络整合在一起,是寻找可改变这些细胞功能以治疗癌症和自身免疫疾病的药物靶标的第一步。”
在这项发表在《Nature Immunology》杂志上的新研究中,Marson及其合作者使用了基于CRISPR的基因编辑技术来改变调节性T细胞,选择性地去除了40种不同的转录因子。
然后,研究人员集中研究了在最初的筛选中作用最强的10个转录因子,并查看了成千上万个基因,以查看在改变的细胞中哪些基因被打开或关闭。他们总共对54,424个单个调节性T细胞进行了分析。
通过分析被这10个原始转录因子激活或沉默的基因类群,研究小组将涉及调控T细胞生物学的大量遗传程序网络整合在一起。研究表明,此前研究较少的转录因子HIVEP2对调节性T细胞功能有很强的作用。在小鼠的后续研究中,科学家发现去除HIVEP2基因会降低调节性T细胞平息炎症的能力。
【8-9月】
1.Nat Commun:利用AIOD-CRISPR超灵敏地可视化检测新冠病毒
doi:10.1038/s41467-020-18575-6
在一项新的研究中,在康涅狄格大学健康中心生物医学工程系副教授Changchun Liu博士的领导下,研究人员开发出的这种称为“All-In-One-Dual CRISPR-Cas12a(AIOD-CRISPR)”的方法简单地、快速地、超灵敏地可视化检测SARS-CoV-2,可在家庭或小诊所使用。相关研究结果于2020年9月18日发表在Nature Communications期刊上,论文标题为“Ultrasensitive and visual detection of SARS-CoV-2 using all-in-one dual CRISPR-Cas12a assay”。
AIOD-CRISPR测试方法的设计与工作原理,图片来自Nature Communications, 2020, doi:10.1038/s41467-020-18575-6。
在这项新的研究中,Liu和他的研究团队使用28个临床COVID-19拭子样本的RNA提取物评估了他们的AIOD-CRISPR方法,其中包括8个COVID-19阳性样本。为了确保检测的可靠性,每个样本都在两个独立的实验中测试了两次。所有8个COVID-19阳性样本均在40分钟内确诊为阳性,而且是通过目视检测予以确认的。这些结果也与美国疾控中心(CDC)批准的RT-PCR方法的结果一致。
这些研究人员还使用低成本的暖手宝作为孵育器来检测患者样本,以消除对电孵育器的需求。AIOD-CRISPR试管被直接放置在一个气动的暖手宝上,在LED灯下用肉眼就可以看到检测结果。
2.Mol Cell:新研究揭示DNA损伤后的组蛋白降解促进DNA修复
doi:10.1016/j.molcel.2020.09.002
DNA损伤可能发生在基因组的任何地方,但大多数DNA被包裹在核小体上,这就使得修复复合体无法进入。如今,在一项新的研究中,来自瑞士弗雷德里希米歇尔生物医学研究所和巴塞尔大学等研究机构的研究人员发现DNA会诱导组蛋白耗竭,这增加了DNA纤维的可访问性和灵活性,并提高了同源重组修复过程中的同源搜索速度。相关研究结果于2020年9月23日在线发表在Molecular Cell期刊上,论文标题为“DNA Damage-Induced Nucleosome Depletion Enhances Homology Search Independently of Local Break Movement”。论文通讯作者为Susan M.Gasser博士。
在这项新的研究中,Cheblal及其同事们强调,组蛋白降解和随后的染色质解压缩(chromatin decompaction)确实会提高DNA修复效率和动力学。Cheblal总结了这项研究的主要发现:“我们发现,DNA双链断裂可以通过组蛋白的受控降解引发异位的染色质解压缩[指的是在远处未受损的位点,而非局部],这对基于同源重组的DNA修复至关重要。我们还发现,局部断裂动态对DNA修复不那么重要,可以通过增加异位染色质移动来加以弥补,而异位染色质移动与染色质解压缩相关。此外,我们排除了之前的一个假设:染色体从核外周脱离是DNA损伤反应的一部分。”
当被问及这项研究的更广泛影响时,Cheblal说,“我们的研究将对CRISPR介导的基因疗法至关重要,目前这种疗法的效率太低,无法用于临床。我们的研究结果表明将这项技术与经过适当上调的因子结合起来诱导组蛋白降解,可能会提高CRISPR-Cas9的编辑效率。”
通过同源重组修复DNA是CRISPR-Cas9靶向基因组编辑的基本原理。CRISPR-Cas9编辑技术主要作为研究工具,但也用于基因治疗。初步研究表明,在哺乳动物细胞中,随着组蛋白的耗竭,CRISPR-Cas9的编辑效率可以提高。
3.Nature子刊:经改进靶向毒性RNA的CRISPR-Cas9有望治疗强直性肌营养不良I型
doi:10.1038/s41551-020-00607-7
CRISPR-Cas9是一种越来越多地用于校正导致各种疾病的基因(DNA)缺陷的技术。几年前,美国加州大学圣地亚哥医学院的研究人员改变了这种技术的作用方向:用一种他们称之为RNA靶向Cas9(RNA-targeting Cas9, RCas9)的方法来修饰RNA。
在一项新的研究中,这些研究人员证实一剂RCas9基因疗法可降解有毒的RNA,并且几乎完全逆转强直性肌营养不良小鼠模型的症状。相关研究结果于2020年9月14日在线发表在Nature Biomedical Engineering期刊上,论文标题为“The sustained expression of Cas9 targeting toxic RNAs reverses disease phenotypes in mouse models of myotonic dystrophy type 1”。
【7月】
1.Nat Biotechnol:新型DNA碱基编辑器扩大精准基因组编辑的应用领域
doi:10.1038/s41587-020-0609-x
在一项新的研究中,来自美国麻省总医院和哈佛医学院的研究人员开发出的新型基因组编辑技术有潜力有助于理解基于C→G(由胞嘧啶突变为鸟嘌呤)单碱基变化的疾病相关基因突变。这些新的碱基编辑器也可最大限度地减少可能导致不良副作用的非预期(“脱靶”)突变。相关研究结果于2020年7月20日在线发表在NatureBiotechnology期刊上,论文标题为“CRISPR C-to-G base editors forinducing targeted DNA transversions in human cells”。论文通讯作者为麻省总医院的Julian Grünewald博士和 J. Keith Joung博士。论文第一作者为麻省总医院的Ibrahim C. Kurt和Ronghao Zhou。
图片来自CC0 Public Domain
这些由CRISPR引导的新型DNA碱基编辑技术旨在高效地诱导DNA碱基的颠换(transversion,即一个嘌呤碱基被另一个嘧啶碱基替换,或者一个嘧啶碱基被另一个嘌呤碱基置换),同时将不需要的“旁观者”突变水平降至最低。在这篇论文中,这些作者描述了一种概念验证的称为CGBE1的C→G碱基编辑器,以及它的一个较小版本:miniCGBE1。
2.Science子刊:新型碱基编辑器A3G-BE可将基因编辑准确度提高高达6000倍
doi:10.1126/sciadv.aba1773
在一项新的研究中,来自中国科学院大学、中国农业科学院和美国莱斯大学的研究人员发现一种可以大幅提升基因编辑准确性的技术。与目前被认为是最先进的碱基编辑器BE4max相比,他们推出的基因编辑工具可在疾病序列模型中将基于CRISPR的编辑准确度提高高达6000倍。相关研究结果发表在2020年7月15日的Science Advances期刊上,论文标题为“Single C-to-T substitution using engineered APOBEC3G-nCas9 baseeditors with minimum genome- and transcriptome-wide off-target effects”。论文通讯作者为中国农业科学院农业基因组研究所的左二伟(Erwei Zuo)博士和莱斯大学生物分子工程师Xue Sherry Gao博士。
这些研究人员试图通过一系列的蛋白工程实验来开发一种新型的碱基编辑器。这种新的胞嘧啶碱基编辑器称为A3G-BE,通过仅编辑连续碱基C中的第二个C,大大提高了编辑精度。
3.Science:发现一种可靠的CRISPR/Cas13a系统抑制剂
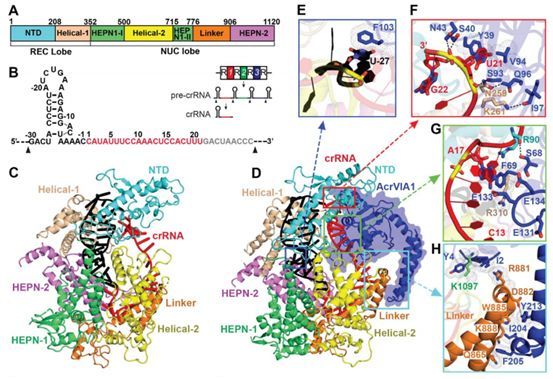
doi:10.1126/science.abb6151;doi:10.1126/science.abc8243
在VI型CRISPR-Cas抗病毒反应过程中,CRISPR RNA(crRNA)引导的Cas13核酸酶不加选择地破坏细菌细胞及其入侵者的RNA,同时阻止受感染宿主的生长和病毒的传播,从而保护细菌群体免受病毒感染。这种反应是由Cas13核酸酶介导的,它在识别到与其向导RNA(gRNA)互补的病毒转录物后,进行大量的RNA降解。然而,病毒如何对抗这种细菌免疫系统还不清楚。
在一项新的研究中,来自美国洛克菲勒大学、纪念斯隆凯特琳癌症中心和康奈尔大学的研究人员发现作为一种由噬菌体编码的抑制剂,AcrVIA1能与Cas13a结合,从而封堵gRNA和阻止这种核酸酶激活。这表明AcrVIA1可潜在地作为Cas13a核酸酶的控制开关。相关研究结果发表在2020年7月3日的Science期刊上,论文标题为“A phage-encoded anti-CRISPR enables complete evasion of type VI-ACRISPR-Cas immunity”。
图片来自Science, 2020, doi:10.1126/science.abb6151
他们发现作为一种编码抗CRISPR蛋白,AcrVIA1由李斯特菌噬菌体(ϕLS46)编码,它能够让斯氏李斯特菌(Listeria seeligeri)的VI-A型CRISPR系统失活。利用遗传学、生物化学和结构生物学,他们发现AcrVIA1与Cas13a核酸酶的向导暴露面相互作用,阻止了靶RNA的进入和这种核酸酶激活所需的构象变化。
4.Nat Biotechnol:开发出可预测基因组编辑器脱靶活性的工具---CHANGE-seq
doi:10.1038/s41587-020-0555-7
在一项新的研究中,来自美国圣犹大儿童研究医院、卡内基梅隆大学和美国国家标准技术局等研究机构的研究人员开发出一种易于使用的灵敏的高通量的方法,用于确定由CRISPR-Cas9等基因组编辑器引起的非预期的DNA双链断裂的位置。他们将这种方法称为CHANGE-seq(Circularization forHigh-throughput Analysis of Nuclease Genome-wide Effects by Sequencing)。相关研究结果近期发表在Nature Biotechnology期刊上,论文标题为“CHANGE-seqreveals genetic and epigenetic effects on CRISPR–Cas9 genome-wide activity”。
论文通讯作者、圣犹大儿童研究医院的Shengdar Tsai博士说,“CHANGE-seq是第一个真正可扩展的用于阐明CRISPR-Cas核酸酶的非预期活性的方法。有了这种方法,科学家们如今可以快速挑选出最好的、最安全的基因组编辑和靶点,用于治疗性编辑,比如用于治疗镰状细胞疾病和用于癌症免疫疗法。”
5.Nat Biotechnol:中科院高彩霞团队开发出针对植物的新型可预测的多核苷酸缺失系统
doi:10.1038/s41587-020-0566-4
CRISPR-Cas9系统已在基因组工程中得到广泛应用。在这种系统中,sgRNA引导的Cas9核酸酶产生染色体双链断裂(DSB),DSB主要通过非同源末端连接(nonhomologousend joining, NHEJ)进行修复,从而导致频繁的长1~3 bp的短插入和缺失(indel)产生。然而,这些小 indel的异质性使得破坏这些调节性 DNA 在技术上具有挑战性。因此,开发一种精确的、可预测的多核苷酸缺失系统对这些调节性DNA的基因功能分析和应用具有重要意义。
图片来自Nature Biotechnology, 2020,doi:10.1038/s41587-020-0566-4
中国科学院遗传与发育生物学研究所的高彩霞(Gao Caixia)教授及其研究团队一直致力于开发新技术,以实现高效、特异的基因组工程。在一项新的研究中,这些研究人员基于胞嘧啶脱氨和碱基切除修复(base excision repair, BER)机制,开发出一系列APOBEC-Cas9融合诱导缺失系统(APOBEC-Cas9 fusion-induced deletion system, AFID),将Cas9与人APOBEC3A(A3A)、尿嘧啶DNA-葡糖苷酶(UDG)和AP裂解酶结合,成功在水稻和小麦基因组中诱导出新型的精准、可预测的多核苷酸缺失。相关研究结果近期发表在Nature Biotechnology期刊上,论文标题为“Precise,predictable multi-nucleotide deletions in rice and wheat using APOBEC–Cas9”。
6.Nat Metab: 新研究有助于治疗I型糖尿病
doi:10.1038/s42255-020-0254-1
当人自身的免疫系统破坏胰腺中产生胰岛素的β细胞时,就会导致1型糖尿病的发生。近年来,科学家们已经学会了如何生长大量的替代β细胞,但研究人员仍在尝试许多方法来保护这些细胞免受免疫攻击。近日,Joslin糖尿病中心的研究人员现在发现了一种新的方法,最终可能有助于保护这种移植的β细胞或减缓疾病的发作。对小鼠模型和人体细胞的研究表明,靶向一种叫做“肾酶(renalase)”的蛋白质可以通过增强β细胞抵抗力来保护自身抵抗免疫系统攻击。相关结果发表在最近的《Nature Metabolism》杂志上。
首先,作者使用一种基于CRISPR基因编辑方法的筛选技术,并使用来自“非肥胖糖尿病”(NOD)小鼠的β细胞系用于模拟1型糖尿病。“基因组CRISPR筛选是发现新靶标的有力工具,我们希望它能帮助我们找到保护β细胞的任何突变,”共同作者 Yi说。通过对存活的β细胞进行CRISPR筛选,作者得到了十几个感兴趣的基因。最引人注目的是肾酶基因,以前的研究表明它与1型糖尿病有关。
接下来,研究人员创建了NOD小鼠β细胞,其中一些 “敲除”了肾酶基因。他们将这些细胞移植到患有自身免疫性糖尿病的NOD小鼠身上。结果表明,野生型β细胞移植后最终死亡,但肾酶基因敲除的细胞最终存活下来。
7.Science新发现!巨大噬菌体或拥有一种能进行理想基因编辑操作的迷你Cas蛋白—CasΦ蛋白!
doi:10.1126/science.abb1400
近日,一篇刊登在国际杂志Science上题为“CRISPR-CasΦ from huge phages is a hypercompact genome editor”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,巨大噬菌体(megaphages)或许拥有进行理想基因编辑的mini-Cas蛋白。
CRISPR-Cas9和其相关的基因编辑工具的核心DNA切割蛋白最初来自于细菌,但最新发现的多种Cas蛋白显然是在感染细菌的病毒中进化而来的;新的Cas蛋白是在已知最大的感染细菌的病毒(噬菌体)中发现的,同时其也是迄今为止发现的最紧凑的工作Cas突变体,其只有Cas9蛋白尺寸的一半左右。更小、更为紧凑的Cas蛋白往往更容易被运送到细胞中进行基因编辑,因为其能被装入较小的运输载体中,目前最流行的一种运输载体就是腺相关病毒(AAV),超级紧凑的Cas蛋白也能在AAV内部为其它额外的“货物”留出空间,作为目前已知的最小的Cas蛋白,研究者新发现的CasΦ(Cas-phi)在被运输到细胞中来操纵作物基因或治疗人类疾病时,其要比当前的基因编辑工具更加具有优势。
图片来源:Basem Al-Shayeb and Patrick Pausch, UCBerkeley
研究者Patrick Pausch说道,腺病毒是运输基因载体完美的特洛伊木马,其能非常容易地对病毒进行编程并使其到达身体几乎任何部位,但你只能将一个很小的Cas9装入这样的病毒中来对其进行运输,如果有另外一种相比Cas9而言更为紧凑的CRISPR-Cas系统,那么就有足够的空间来容纳其它额外的元件,不同的蛋白质就会融合到Cas蛋白、DNA修复模板或其它能调节Cas蛋白并控制基因编辑结果的因子中。很显然,这些巨大噬菌体能利用CasΦ蛋白来诱骗细菌去抵御病毒,而不是自己。
8.PLoS Biol:科学家有望开发出脱靶率更低的安全CRISPR基因编辑技术
doi:10.1371/journal.pbio.3000747
CRISPR系统是一种能够靶向编辑基因组的强大工具,其具有明显的治疗潜力,然而其经常也会不恰当地编辑一些“脱靶”(off-target)位点,近日,一项刊登在国际杂志PLoS Biology上的研究报告中,来自温州医科大学等机构的科学家们通过研究表示,突变CRISPR基因编辑系统核心的酶类或许就能改善其编辑的精准度,相关研究结果或能为基因编辑提供一种相比使用未修饰酶类系统更安全的治疗性策略。
为了深入研究来自金黄色葡萄球菌的Cas9是否能被修饰以高保真性来切割预期的靶点,研究人员开发了一系列新型的Cas9突变体,同时在维持预期位点较高活性的同时检测其区分不完美配对的能力,他们发现了一种突变体,其都能区分并拒绝gRNA和DNA之间的单碱基对错误匹配,无论靶点如何,这都能使保真度相比原始酶类提高了93倍;研究者表示,这种突变影响了部分的识别结构域,即酶类的特殊区域,该区域能协调酶类和gRNA-DNA复合体之间的接触,这种突变可能会削弱这些接触,从而就能确保只有来自完美序列匹配的最强配对才能够触发酶类活性。
9.Nature重大进展!开发高效的线粒体DNA碱基编辑器!
doi:10.1038/s41586-020-2477-4
在一项近日发表在Nature上的突破性研究(A bacterial cytidine deaminase toxin enables CRISPR-freemitochondrial base editing)中,研究人员将利剑打成犁,将一种细菌毒素转化为一种基因组编辑工具,这是第一次可以对细胞的"发电厂"线粒体中的DNA进行精确的改变。该工具在人体细胞的实验室实验中发挥了作用,它可能开启一扇新的研究之门--以及未来数十种难以治疗的由线粒体DNA (mtDNA)突变引起的疾病的新疗法。这些罕见的疾病,包括Leber遗传性视神经病变和致命的婴儿心肌病,总发病率约为1 / 4000。到目前为止,对这些疾病的研究一直受到阻碍,部分原因是没有办法在小鼠品系中复制这种突变。
这项新研究中开发的这一新工具结合了CRISPR的特点和一种叫做转录激活子样效应子(TALEs)的老技术,三个团队合力创建了这个新工具。"让这个项目如此有趣并最终成功的原因是三个实验室有机地聚在一起,而正是科学让我们聚在一起。"Broad研究所研究员、该研究通讯作者David Liu说道。
10.Nat Methods:开发出CRISPR辅助的新技术来检测活细胞中的RNA结合蛋白 未来有望助力人类疾病研究
doi:10.1038/s41592-020-0866-0
尽管目前科学家们还并未完全理解RNA分子的多样性,但他们认为,与这些RNA分子结合的RNA结合蛋白或与多种机体疾病的发生直接相关,近日,一项刊登在国际杂志Nature Methods上题为“CRISPR-assisted detectionof RNA–protein interactions in living cells”的研究报告中,来自香港城市大学等机构的科学家们开发了一种名为CARPID的新型检测方法,其能识别活细胞中特殊RNAs的结合蛋白,这种新方法或能应用到多重类型的细胞研究领域,比如从识别癌症生物标志物到检测治疗多种病毒性疾病的潜在药物靶点等。
分子生物学的中心法则是DNA转录成为RNA,以及RNA最终翻译成为蛋白质,但实际上,只有大约2%的RNAs能够编码蛋白,而其余98%被称之为非编码RNAs(ncRNA)的RNA分子则由于其具有神秘的功能而被视为“暗物质”。近些年来,科学家们开始努力研究旨在揭开RNA的真实功能,尤其是长链非编码RNAs(lncRNA,长度仅有200多个核苷酸),lncRNA广泛被接受为能参与调节基因表达的重要细胞组分,同时其也是研究人员最感兴趣研究的RNA的一种。
11.Curr Gene Ther:基于ADAR的人工RNA编辑有望用于基因治疗
doi:10.2174/1566523220666200516170137
许多由点突变引起的疾病都没有现成的治疗方法。日本北陆先端科学技术大学院大学的ToshifumiTsukahara教授及其同事们正在研究一种利用人工RNA编辑的治疗方法。人工定点RNA编辑是一种修改基因并最终调控蛋白功能的重要技术。Tsukahara团队正在尝试通过人工RNA编辑来修改转录物(RNA)的遗传密码,以治疗遗传性疾病。
图片来自Current Gene Therapy
RNA编辑是一个生理过程,广泛存在于生物体内,可从单个基因中产生各种不同功能的蛋白。在哺乳动物中,RNA链中的碱基C或A可经碱基序列特异性水解后脱氨,从而使得C被U取代,A被I(肌苷)取代。鉴于I与C形成沃森-克里克(Watson-Crick)碱基对,因此在遗传密码上,I与G同义。这些碱基转换是由于A或C的脱氨而发生的,已经发现这是由ADAR和APOBEC家族酶催化的。最近,已经报道了各种利用ADAR进行人工RNA编辑的RNA修复技术。
在一篇近期发表在Current Gene Therapy期刊上的论文中,Tsukahara团队综述了应用ADAR恢复遗传密码的最新研究成果,以及在利用ADAR进行人工RNA编辑过程中涉及的不同方法。他们还谈到了ADAR各种异构体的比较研究。因此,他们将尝试对人工RNA编辑和ADAR的作用进行详细的概述,重点是酶促定点A→I编辑。
大多数的人工RNA编辑系统都是利用催化酶ADAR的活性位点和与靶标互补的向导RNA(gRNA)来招募活性位点到靶标RNA上。一种人工RNA编辑方法是使用化学方法。Vogel及其同事们采用SNAP标签将ADAR与gRNA连接起来,并报道该系统在体外和体内都是有效的。然而,这种技术需要持续供应效应物分子才能有效。据悉,它还可以利用RNA结合蛋白将gRNA与酶结合。两种源于噬菌体的拴系系统通常用于真核生物:Lambda N系统和MS2系统。利用ADAR酶与MS2系统可以实现遗传密码的恢复,在基因治疗方面具有前景。
【4月】
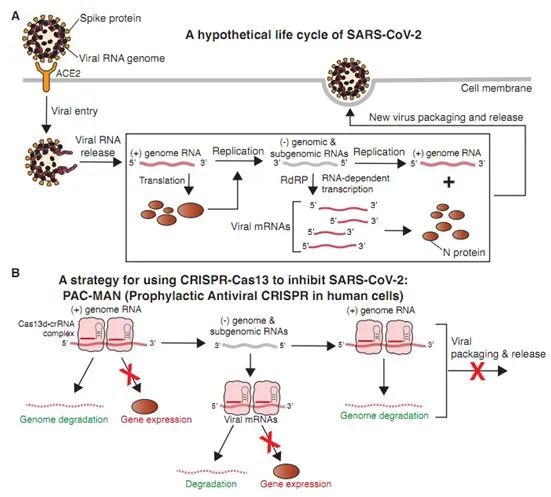
1.Cell:开发出利用CRISPR抵抗流感病毒和SARS-CoV-2的新型抗病毒策略
doi:10.1016/j.cell.2020.04.020
虽然大多数正在进行的疫苗临床试验通过诱导人类免疫系统识别冠状病毒蛋白或减毒病毒并减少病毒进入细胞来发挥作用,但是,在一项新的研究中,来自美国斯坦福大学等多家研究机构的研究人员提出一种替代性抗病毒方法,它依赖于一种基于CRISPR的系统,用于识别和降解细胞内病毒基因组及其产生的病毒mRNA(图1B)。
靶向正义基因组和病毒mRNA以同时降解用于病毒复制和基因表达的病毒基因组模板,这将有望稳健地限制病毒复制。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Development of CRISPR as an antiviral strategy to combat SARS-CoV-2 and influenza”。
图1.图片来自Cell, 2020, doi:10.1016/j.cell.2020.04.020。
在这项新的研究中,这些研究人员在人细胞中开发出一种预防性抗病毒CRISPR策略(Prophylactic Antiviral CRISPR in huMAN cells,简称PAC-MAN)。作为一种基因干预的形式,PAC-MAN靶向SARS-CoV-2和IAV,并且可能靶向所有冠状病毒。他们构建出一种生物信息学管道,在许多测序的SARS-CoV-2基因组中确定高度保守的区域,并利用CRISPR-Cas13d靶向这些保守性区域以进行病毒序列降解。
这些研究人员证实这种方法能够切割SARS-CoV-2片段,并减少人肺上皮细胞中的病毒RNA数量。他们的生物信息学分析揭示出6个crRNA能够靶向91%的已被测序的冠状病毒,以及22个crRNA能够靶向所有已被测序的冠状病毒。
通过使用靶向同一病毒的不同区域或者不同冠状病毒毒株的crRNA文库,这种方法可能会对冲病毒进化和逃逸,也可能用来抵御未来出现的相关致病病毒。虽然这一策略在临床上应用之前还有一些障碍需要克服,但PAC-MAN有可能成为一种新的抗病毒策略。
2.Nat Biomed Eng:深度剖析!基于CRISPR–Cas13的新技术有望简单快速检测肾脏移植患者的感染风险和排斥反应!doi:10.1038/s41551-020-0546-5
日前,一项刊登在国际杂志Nature Biomedical Engineering上题为“A CRISPR-based assay for the detection of opportunistic infections post-transplantation and for the monitoring of transplant rejection”的研究报告中,来自麻省理工学院等机构的科学家们通过研究基于CRISPR开发出了一种新型诊断技术来检测器官移植后患者的感染风险,同时监测患者对移植器官的排斥反应。
在器官移植过程中,感染和排斥是引发移植失败的主要原因,其是通过免疫抑制的状态联系到一起的,为了能够尽可能早地诊断并且治疗这些情况,并改善患者的长期预后,研究人员就需要对接受器官移植的患者进行持续性监测。
这项研究中,研究人员基于CRISPR–Cas13开发出了一种快速廉价的检测方法,其能准确检测来自病人机体血液和尿液样本中BK多瘤病毒(BKV)和巨细胞病毒(CMV)的DNA,以及经历急性肾移植排斥反应患者尿液中水平升高的CXCL9 mRNA(移植物排斥的标志物);BKV、CMV和CXCL9 mRNA在急性细胞肾移植排斥反应中的表达水平会升高。
这项研究中,研究人员CRISPR–Cas13技术开发出了一种检测试剂盒,在对100多名感染BKV和CMV的患者的临床样本在不同病毒载量范围内进行检测后,研究者发现了这种检测手段具有较高的诊断效率;这种试剂盒能够使用两步法,首先其能对尿液样本中的病毒靶向DNA进行扩增,以便于仅有单分子存在的情况下CRISPR也能检测到靶标。
随后研究人员使用了一种称之为SHERLOCK的特殊CRISPR–Cas13步骤来优化病毒DNA的检测过程,检测过程就好像使用一般的测孕试纸海洋,当将检测试剂条浸润到样本中时,如果检测条出现一条线就表明结果是阴性,如果是两条线就证明存在病毒感染。
此外,研究人员还利用试剂盒对排斥标志物CXCL9进行检测,作为mRNA,其能被分离并且扩增,随后利用CRISPR-Cas13对其进行靶点检测。对于非常低的目标浓度,检测试纸条也会出现不能确定的第二条条带,这或许就会导致研究人员对结果产生误判,基于此,研究人员开发出了一款智能手机app,其能客观地分析试纸条带的结果,并给出准确的结果判读。
快速有效的POCT(即时检测)技术能帮助患者在资源匮乏的环境中进行疾病的早期诊断成为可能,同时还能帮助患者实现疾病的自我监测。
这项研究中,研究人员基于CRISPR-Cas13开发的新型诊断试剂盒就能对器官移植受体患者样本中的CMV和BKV进行检测,同时研究者还运用SHERLOCK步骤成功实现了对患者样本中CXCL9 mRNA的检测;这种新型工具或有望作为器官移植患者移植后发现进行早期排斥反应和监测的工具。
3.Cell综述深度解读!基于CRISPR治疗性基因编辑领域的研究现状及未来展望!
doi:10.1016/j.cell.2020.03.023
日前,一项刊登在国际杂志Cell上题为“CRISPR-Based Therapeutic Genome Editing:Strategies and In Vivo Delivery by AAV Vectors”的综述文章中,来自马赛诸塞大学医学院等机构的科学家们描述了以CRISPR为基础的改善人类健康的策略,其重点是通过利用AAV载体将CRISPR疗法直接导入人体。
此外,研究人员还讨论了目前广泛应用基于CRISPR疗法所要面临的挑战,并强调了持续的研究和技术革新对于推动基于CRISPR疗法在人类疾病研究中的重要性。
图片来源:Dan Wang,et al. Cell,doi:10.1016/j.cell.2020.03.023。
目前应用基于CRISPR的治疗性手段能直接应用于患者体内,有望治疗多种人类疾病,尽管基于CRISPR的工具箱能够对DNA和RNA编辑及基因表达调节进行多种操作,但其药物的运输仍然是该疗法发展的瓶颈。
目前,腺相关病毒(AAV)载体是进行体内基因治疗的主要载体;AAV非常安全,其能将单链DNA(ssDNA)载体基因组运输到多个组织和细胞类型中,而且仅在一定剂量范围内具有轻度的免疫原性。
尽管载体基因组在宿主细胞内大部分处于游离状态,但通过共分化和环化来介导有丝分裂后细胞内长期的转基因表达,就能使其稳定下来并产生持久的治疗效果,AAV载体在运输基因疗法到疾病动物模型和患者中推动了基于CRISPR疗法在治疗多种疾病中的应用。
4.Cell:利用CRISPR-CasRx技术将神经胶质细胞转换为神经元或有望减缓神经性疾病的症状 doi:10.1016/j.cell.2020.03.024
日前,一项刊登在国际杂志Cell上题为“Glia-to-Neuron Conversion by CRISPR-CasRx Alleviates Symptoms of Neurological Disease in Mice”的研究报告中,来自中科院上海生命科学研究院等机构的科学家们通过研究发现,利用CRISPR-CasRx技术将神经胶质细胞转换为神经元细胞,或能有效减缓小鼠机体神经性疾病的症状。
这项研究中,研究人员指出,利用体内病毒递送的RNA靶向CRISPR-CasRx技术来下调单一RNA结合蛋白—Ptbp1(多聚嘧啶序列结合蛋白1)或能导致Muller胶质细胞高效转化为视网膜神经节细胞(RGCs,retinal ganglion cells),从而就能减缓与RGC缺失相关的疾病症状。
本文研究的主要结果包括:1)敲除Ptbp1或能将Muller胶质细胞转化为成熟视网膜组织中的视网膜神经节细胞;2)转化后的视网膜神经节细胞的中央投射或会恢复机体的视觉反应;3)在帕金森小鼠模型中揭示了具有多巴胺能特征的神经元诱导特性;4)诱导的神经元或能减缓帕金森小鼠机体的运动功能障碍。
研究者表示,这种方法还能诱导大脑纹状体中产生具有多巴胺能特性的神经元,同时还会减缓帕金森疾病小鼠模型机体中的运动缺陷。
因此,基于CRISPR-CasRx技术所介导的Ptbp1基因敲除所引发的胶质细胞向神经元细胞的转换或能在体内作为一种遗传性手段来帮助治疗因神经元功能缺失所引发的一系列神经性障碍。
5.Nat Biotechnol:开发出能同时对多个基因组位点进行编辑的超强基因编辑工具—CHyMErA doi:10.1038/s41587-020-0437-z
近日,一项刊登在国际杂志Nature Biotechnology上的研究报告中,来自多伦多大学等机构的科学家们通过研究开发了一种新技术能同时对基因组中多个位点进行编辑,从而就有望帮助研究不同DNA的组合与人类健康和疾病的关联。
基于CRISPR的DNA编辑技术能通过对任何人类基因进行精确剔除来研究其功能,从而就能彻底改变科学家们对人类基因组的研究,但目前研究人员仍然面临众多挑战,比如如何在相同细胞中同时移除多个基因或基因片段,这种类型的基因组“手术”对于科学家们而言,了解基因组不同部分在正常生理和疾病状况下是如何协同发挥作用的似乎更为重要。
如今研究人员开发了一种名为CHyMErA(Cas Hybrid for Multiplexed Editing and Screening applications)的新技术,其能应用到任何哺乳动物细胞中,同时系统性地靶向作用多个位点的DNA片段,CRISPR剪刀能通过导向RNA分子将DNA切割酶运送到基因组上的预想位点中,而使用最为广泛的DNA切割酶就是Cas9酶。
自Cas9问世以来,科学家们一直寻找其它具有独特特性的Cas酶,以寻求改进和扩展该技术的应用;与CRISPR-Cas9技术不同的是,ChyMErA技术能将Cas9和Cas12a两种不同的DNA切割酶进行结合,从而实现多种用途,Cas12a酶是一种能用来在相同细胞中产生多个导向RNA分子的关键酶类,而这是同时进行DNA编辑的关键。
研究者Thomas Gonatopoulos-Pournatzis表示,我们花费了多年来开发能同时检测Cas9和Cas12a酶的组合性基因编辑技术,随后我们将这些酶类进行结合开发出了ChyMErA系统;研究人员尝试了多种方法来诱导基因片段缺失,但并没有哪一种手段会比ChyMErA更加有效。
研究者发现,ChyMErA能够成功剔除基因片段,随后研究者在大规模筛查中利用该技术来系统性地分析基因如何进行结合来发挥作用。在ChyMErA技术的帮助下,研究人员就能够使用两种酶中最好的酶类来进行基因编辑,Cas9已经被广泛改进拥有较高的编辑效率,而Cas12a则能允许多种导向RNAs的使用,因此其在寻找能在基因组中进行位点切割上具有更大的灵活性。
6.Nature子刊重大突破:纳米颗粒实现器官特异性基因编辑!
doi:10.1038/s41565-020-0669-6
在最新一期Nature Nanotechnology上,Qiang Cheng等人提出了一种称为选择性器官靶向(SORT)的方法,通过生物工程将含有核酸疗法的LNPs诱导肝脏、脾脏和肺特异性基因调控。LNP系统通常由磷脂、胆固醇、聚乙二醇(PEG)脂质和可电离的阳离子脂质组成。每个LNP成分及其摩尔比都已被优化,以确保高效的核酸递送到肝细胞。特别是,合理设计和筛选可电离的阳离子脂质(或类脂质)文库对于实现临床应用相关剂量的肝基因沉默至关重要。
最有效的电离阳离子脂质,其特征是明显的pKa值在6.2和6.5之间,具有三种功能:(1)在LNP生产期间,酸性pH值下质子化的叔胺脂质头部促进其与带负电荷的核酸结合,(2)在生理的pH值,附近无电荷的脂质确保净中性表面电荷,以减少免疫反应和循环时间延长和(3)细胞摄取后进入酸化的内体中,正电荷脂质促进膜融合和有效的胞质递送。
在这种SORT方法中,作者添加五分之一脂质成分来通过静脉注射递送功能信使核糖核酸或基因编辑复合物道特定组织。使用一个快速的混合过程,这种SORT脂质 (永久的阳离子和阴离子或可质子化的阳离子)和不同摩尔比的其他材料生成一个脂质体文库,包载mRNA编码荧光素酶进行体内筛选。
通过增加永久性阳离子脂质1,2-二烯烃-3-三甲氨基丙烷(DOTAP)的摩尔百分比(0-100%),可使荧光素酶的表达在静脉注射后从肝脏转移到脾脏和肺。LNPs中加入10-40%的永久性阴离子脂质1,2-二烯醇化酶-sn-甘油-3-磷酸(18PA)可在脾脏中特异性表达荧光素酶。
加入20%的其他可电离的阳离子脂类,如1,2-二烯酰-3-二甲基氨基甲烷-丙烷(DODAP),不会改变生物分布,但增加了mRNA对肝脏的递送。该方法的普遍性通过将LNP与其他永久性带电或可电离的阳离子脂类功能化而得到证实,这导致了器官表达的类似变化,且表现出与脂类相关的方式。
值得注意的是,SORT-LNP的疗效离不开可电离的阳离子脂质包合。给予肺、脾脏和肝脏特异性mRNA SORT-LNP的筛选结果表明,基于荧光素酶的筛选可产生持续的治疗性蛋白,且无明显毒性。重要的是,SORT方法还允许调节LNPs组织特异性荧光素酶的表达,使其与临床批准的Onpattro配方相同。
Cheng等人也报道了使用SORT-LNPs进行组织特异性CRISPR/Cas基因编辑。相对于治疗性基因沉默或表达,基于CRISPR/Cas的基因编辑需要(至少)两个组成部分:引导RNA (guide RNA, gRNA)识别目标DNA和Cas核酸酶进行双链断裂。
作者生成了包含gRNA和Cas9 mRNA或gRNA/Cas9核糖核酸蛋白复合物的SORT-LNPs,并在肝外组织中进行了基因编辑。在红色荧光蛋白tdTomato报告小鼠中,不同种类的LNP剂型可选择性诱导肝、肺、脾特异性基因编辑。此外,作者还展示了内源性靶基因(PTEN)和治疗性靶基因(PCSK9)的组织特异性编辑。
7.Nat Cancer:Crispr技术揭示淋巴瘤弱点
doi:10.1038/s43018-020-0054-2
在最近一项研究中,美国加州大学圣地亚哥医学院和摩尔斯癌症中心的研究人员团队利用CRISPR技术鉴定出了侵袭性慢性骨髓性白血病的关键调节剂。
图片来源:Www.pixabay.com。
"我们利用CRISPR技术在白血病细胞中进行全基因组筛查,一次性阻断数千个基因。这是一个非常强大的工具,使我们能够识别出助长白血病生长的众多基因,并找到了可以在这种疾病中靶向治疗的新漏洞。"高级作者、药理学和医学系教授Tannishtha Reya博士说。"这项研究还首次表明,基于全基因组CRISPR的筛查实际上可以以更符合生理学的方式进行:使用原生癌细胞,并在原生微环境的环境中进行。"
在2020年4月20日的《Nature Cancer》杂志上发表的文章中,Reya及其同事确定了RNA结合蛋白是维持和保护耐药性白血病干细胞的一类关键蛋白。作者们重点研究了Staufen2(Stau2),这是RNA结合蛋白家族中一个相对较少研究的成员,以前只知道它能控制大脑和神经系统的发育。
该团队开发了一种小鼠模型,在该模型中,Stau2被基因删除。作者发现,丢失这种蛋白会导致白血病的癌细胞生长和繁殖能力大大降低,并明显提高了小鼠模型的整体存活率。Stau2也是白血病患者原代组织样本的持续生长所需要的,这表明在人类疾病中存在着保守的依赖性。
8.Mol Ther:研究表明基因疗法可以成功治疗青光眼
doi:10.1016/j.ymthe.2019.12.012
由布里斯托尔大学领导的一项新研究表明,一种常见的眼病--青光眼,可以通过单次注射的基因疗法成功治愈,这将改善许多患者的治疗方案、疗效和生活质量。他们测试了一种新的方法,可以提供额外的治疗选择和好处。他们的研究结果发表在《Molecular Therapy》杂志上。
研究人员设计了一种基因疗法,并利用实验性青光眼小鼠模型和人类供体组织进行了概念验证。该疗法针对眼睛的一部分称为睫状体的结构,睫状体产生的液体可以维持眼内的压力。利用最新的基因编辑技术CRISPR,作者能够使睫状体中的一种名为Aquaporin 1的基因失活,导致眼压降低。
文章作者,布里斯托尔医学院客座高级研究员Colin Chu博士说。"目前,青光眼还没有治愈的方法,如果不及早诊断和治疗,会导致视力下降。我们希望在不久的将来推进这种新疗法的临床试验。如果成功的话,可以通过单眼注射的方式长期治疗青光眼,这将改善许多患者的生活质量,同时节省时间和金钱。"
9.Science子刊:干细胞遗传修饰可改善糖尿病
doi:10.1126/scitranslmed.aax9106
根据最近一项研究,研究人员利用从一名患有罕见的胰岛素依赖型糖尿病(Wolfram综合症)的患者皮肤上提取的细胞诱导产生多能干细胞,并且将其转化为分泌胰岛素的细胞,通过基因编辑工具CRISPR-Cas9,纠正导致该综合症的基因缺陷。然后,他们将这些细胞植入小鼠体内,并治愈了这些小鼠的糖尿病。
图片来源:Www.pixabay.com。
这一来自华盛顿大学医学院圣路易斯分校的研究人员的研究结果表明,CRISPR-Cas9技术可能作为治疗糖尿病,特别是由单一基因突变引起的糖尿病的有力武器。该研究于4月22日在线发表在《Science Translational Medicine》杂志上。
"这是CRISPR首次被用于修复因基因缺陷引起的糖尿病,"共同研究者、华盛顿大学医学和生物医学工程助理教授Jeffrey R. Millman博士说。
【5】
1.多项研究开发出可增强基因组编辑范围的新型CRISPR/Cas9工具
doi:10.1038/s41467-020-16117-8; doi:10.1038/s41587-020-0517-0; doi:10.1126/sciadv.aau0766
CRISPR的应用范围从治疗遗传疾病到农作物的营养功效,它已经成为最有前景的基因组编辑工具之一。然而,Cas9酶依赖特定的DNA邮政编码来确定切割和编辑的位置。虽然来自酿脓链球菌的Cas9(SpCas9)受到最广泛使用,但是它需要靶位点旁边存在两个G碱基。只有不到10%的DNA序列符合这一要求。
在2020年5月发表在Nature Biotechnology期刊和Nature Communications期刊上的两项新的研究中,来自美国麻省理工学院等研究机构的研究人员成功设计出具有增强基因组编辑能力的新蛋白,从而极大地拓宽了可以准确有效地访问的DNA序列。这两项研究是由刚在麻省理工学院媒体实验室完成博士学位的Pranam Chatterjee、麻省理工学院媒体实验室副教授Joseph Jacobson与美国马萨诸塞大学医学院的研究人员合作完成的。论文标题分别为“An engineered ScCas9 with broad PAM range and high specificity and activity”和“A Cas9 with PAM recognition for adenine dinucleotides”。
图片来自Nature Communications, 2020, doi:10.1038/s41467-020-16117-8。
这些新发现源于这些作者早期在Cas9蛋白的计算发现方面取得的突破性成就。他们从犬链球菌(Streptococcus canis)中鉴定出了Cas9(ScCas9),并在实验中对它进行了表征。虽然与SpCas9相似,但ScCas9具有更广泛地靶向DNA序列的能力。这一发现将Cas9酶可以靶向的位置从最初的基因组上的10%位点扩大到将近50%。2018年,他们在Science Advances期刊上首次报道了这些发现(Science Advances, 24 Oct 2018, doi:10.1126/sciadv.aau0766)。
为了改进ScCas9作为基因组编辑工具的功能,这些作者通过计算方法从相似的Cas9蛋白中找出了独特的部分,从而设计出ScCas9的一个优化版本,他们将它命名为Sc++。
与此同时,这些作者成功地利用他们之前开发的SPAMALOT算法,发现了需要两个A碱基而不是两个G碱基的猕猴链球菌(Streptococcus macacae)Cas9(SmacCas9)。通过结构域交换和进一步的基因改造,他们获得新的iSpyMac酶作为首批已知的不需要G碱基的Cas9编辑器之一,这样就可以进一步靶向之前无法靶向的20%的基因组。
鉴于世界各地的实验室已经开始使用这些酶成功编辑从水稻到兔子等各种有机体的基因组,因此这两项研究的下一个目标将是开发工具来靶向剩余30%的基因组序列。Chatterjee与瑞士苏黎世大学合作,正在寻求最终的进展,从而让科学家们能够靶向任何基因组序列,并在治疗遗传疾病时解决任何类型的基因突变问题。
2.FDA批准张锋领衔开发的新冠病毒CRISPR测试:1小时出结果,如验孕纸般方便!
新闻来源:SHERLOCK-based one-step test provides rapid and sensitive COVID-19 detection
张锋等人开发的基于CRISPR的新技术可以通过一步反应在一小时内提供SARS-CoV-2的检测结果,研究人员共享了实验方案和工具包,以推进研究并向临床验证迈进。美国FDA于5月6日批准了该技术作为应急测试用于临床检测新冠病毒。
来自麻省理工学院麦戈文大脑研究所、麻省理工学院和哈佛大学的布罗德研究所、Ragon研究所和霍华德休斯医学研究所的一组研究人员开发了一种新的诊断平台,名为STOP (SHERLOCK Testing in One Pot)。该测试可以在一小时内以最少的处理过程进行单步反应,这使得基于CRISPR的SHERLOCK诊断技术更接近于一种现场或家庭测试工具。它的工作原理是通过对CRISPR进行编程,在鼻、口、喉拭子或肺部液体中检测SARS-CoV-2基因物质的片段。如果发现了病毒的遗传物质,CRISPR酶就会发出荧光。
这种新测试名为"STOPCovid",基于STOP平台。在研究中,它已被证明能够快速、准确和高度敏感地检测COVID-19病毒SARS-CoV-2,方法很简单,且只需要很少的培训,并使用简单、现成的设备,如试管和水浴。STOPCovid已在研究中得到验证,研究人员使用了诊断为COVID-19的患者的鼻咽拭子。作为原理的证明,SARS-CoV-2 RNA被添加到唾液样本中,然后用它进行检测也获得了成功。
3.Nat Med重磅!基因编辑T细胞治疗癌症是安全的!华西医院全球首个基因编辑T细胞治疗癌症的临床试验结果公布!
doi:10.1038/s41591-020-0840-5
对免疫检查点基因进行CRISPR-Cas9介导的基因编辑可以提高T细胞治疗的疗效,但首先必须了解其安全性和可行性。近日发表的利用CRISPR基因编辑技术对细胞进行的首次人体试验结果表明,这种疗法是安全且持久的。
近日来自四川大学华西医院的卢铀教授领衔的研究团队在Nature Medicine上报告了全球首个基因编辑免疫细胞的临床试验结果,该研究报道了CRISPR-Cas9介导PD-1编辑的T细胞在晚期非小细胞肺癌患者中的第一期临床试验结果(ClinicalTrials.gov NCT02793856)。该研究的主要终点是安全性和可行性,次要终点是有效性。探索的目标包括追踪编辑过的T细胞。结果表明研究满足了所有预先指定的终点。
研究人员从肺癌患者身上提取了T淋巴细胞,然后利用电穿孔介导的Cas9和单导RNA质粒共转染,使这些T细胞的PD-1失效,从而在体外制造PD-1编辑的T细胞。通常情况下,PD-1蛋白会发出信号,阻止免疫细胞对人体自身组织发起攻击,而活跃的PD-1会打开癌症扩散的大门。
该研究共纳入22例患者;其中17人获得了足够的编辑T细胞进行输注,12人能够接受治疗。研究人员发现所有与治疗相关的不良事件均为1/2级。经编辑的T细胞输注后可在外周血中检测到。基因编辑后的T细胞在血液中至少停留了4周,这表明这种策略可能会产生持久的效果。
这些病人的中位无进展生存期为7.7周(95%置信区间,6.9 - 8.5周),中位总生存期为42.6周(95%置信区间,10.3-74.9周)。研究人员通过对18个候选位点进行下一代测序,发现脱靶事件的中位突变频率为0.05%(范围为0-0.25%)。
4.Nature:鉴别出新型T细胞免疫疗法靶点 有望帮助开发抵御癌症和自身免疫性疾病的新型疗法
doi:10.1038/s41586-020-2246-4
近日,一项刊登在国际杂志Nature上题为“CRISPR screen in regulatory T cells reveals modulators of Foxp3”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究表示,对调节性T细胞进行CRISRP筛选或有望揭示Foxp3分子的调节子,Foxp3是控制Treg细胞(调节性T细胞)发育和功能的关键转录因子之一,它的是Treg免疫生物学重要的进步,也为科学家们进一步了解Treg功能和作用机制打开了一扇“门”。
图片来源:Frontiers。
这项研究中,研究人员开发出了一种用于初级小鼠Treg细胞表型研究的基于CRISPR的联合筛选平台,同时研究人员利用该技术对大约500和核因子进行了靶向功能缺失的筛选分析,从而识别出能促进或干扰Foxp3表达的基因调节程序。研究者Jessica T. Cortez说道,我们发现了多个Foxp3表达的调节子,其中就包括泛素特异性肽酶22(Usp22)和环指蛋白20(Rnf20);Usp22是SAGA染色质修饰复合体去泛素化模块的成员,其能作为一种正向调节因子来稳定Foxp3的表达,然而,筛选结果表明,作为E3泛素连接酶,Rnf20能够成为Foxp3的负向调节子。
研究者表示,在小鼠机体中对Usp22进行Treg特异性地剔除或能降低Foxp3蛋白的水平并诱发其抑制性功能的缺失,从而导致自发性自身免疫反应的产生,但在多种癌症模型中却能保护机体抵御肿瘤的生长;在Usp22缺失的Treg细胞中,Foxp3的不稳定或能被Rnf20的剔除来拯救,这就揭示了Treg细胞中或许存在一种相互的泛素化开关。
5.Nature重大突破:利用CRISPR实现病毒高通量检测,一次检测169种病毒!
doi:10.1038/s41586-020-2279-8
研究人员已经开发出一种新技术,可以灵活地扩展基于CRISPR的分子诊断学,使用微流体芯片可以同时运行数千个测试。单片芯片的能力范围可以从一次在1000多个样本中检测一种单一类型的病毒,到在少量样本中搜索160多种不同的病毒,包括COVID-19病毒。
这项技术被称为核酸多重评估的组合排列反应(Combinatorial Arrayed Reactions for Multiplexed Evaluation of Nucleic acids,CARMEN),研究人员在病人样本上进行了验证,当天就能得到结果,将来有一天可能会用于广泛的公共卫生工作。
这项研究成果发表在Nature杂志上,由麻省理工学院Broad研究所和哈佛大学博士后Cheri Ackerman和Cameron Myhrvold共同领导。Broad研究所核心成员、麻省理工学院生物工程系副教授Paul Blainey和哈佛大学教授、Broad研究所成员以及霍华德·休斯医学研究所研究员Pardis Sabeti是这篇文章的共同通讯作者。
6.Disease Models & Mechanisms:研究揭示罕见病的遗传机制
doi:10.1242/dmm.041913
在最近一项研究中,来自弗吉尼亚理工大学的研究者们通过遗传学手段将一种罕见的人类疾病与PHETA1基因突变联系起来。
通过在斑马鱼中使用CRISPR基因组编辑和其他研究工具,科学家发现斑马鱼的PHETA1同源蛋白对于斑马鱼的肾功能和颅面发育至关重要。该研究发表在最新一期的《Disease Models and Mechanisms》上。
图片来源:Www.pixabay.com。
研究作者,生物医学研究所副教授Albert Pan与美国国立卫生研究院(NIH)团队合作,研究了与患者相关的突变可能如何影响其临床表型。
在人类患者中,PHETA1突变会造成发育迟缓,面部和肾脏异常,其PHETA1蛋白发生突变。研究人员在斑马鱼中构建了类似的突变,发现它们与OCRL(Lowe综合征的致病蛋白)存在有害相互作用。
缺乏类似PHETA1的蛋白质会导致斑马鱼的肾脏生理功能和颅面发育受损,类似于患者的肾脏和颅面特征。斑马鱼的颅面缺陷可能是由组织蛋白酶K失调引起的,该酶负责降解胶原蛋白,并在骨质疏松症中起作用。
在基因组分析,蛋白质建模,颅面发育的研究过程中,许多研究小组进行了合作。Pan说:“这是一个复杂的,跨学科的项目,最终融合在一起。我们将个体的表型与潜在的基因联系在一起。我们为医学科学家提供了定义常见综合征的起点,并发展了预防和治疗方法。”
【2月】
1.Science:经过CRISPR基因编辑的CAR-T细胞在癌症患者体内是安全的+ w/ w( p( e5 t+ x
doi:10.1126/science.aba7365; doi:10.1126/science.aba9844' f+ P1 }4 \ B" P. ?7 S- w
在一项新的研究中,来自美国宾夕法尼亚大学和斯坦福大学的研究人员将两种最先进的方法---CRISPR(对DNA进行编辑)和T细胞疗法(利用免疫系统的哨兵破坏肿瘤)---结合在一起,从而在快速发展的癌症免疫疗法领域开创了新的篇章。他们报道两名女性和一名男性,年龄都在60多年,其中的一人患有肉瘤,剩余两人患有一种称为多发性骨髓瘤的血癌。这三名患者在去年接受了他们自身的经过CRISPR基因编辑的免疫细胞治疗。相关研究结果于2019年2月6日在线发表在Science期刊上,论文标题为“CRISPR-engineered T cells in patients with refractory cancer”。; u! v" F' }+ [" I" P
图片来自Science, 2020, doi:10.1126/science.aba9844。3 p$ C- r l. h5 s8 b' s" s& [
对这三名患者来说,益处是有限的:一人已经死亡,而另外两人的病情已经恶化。但是,论文通讯作者、宾夕法尼亚大学癌症研究员Carl June说,这项经过多年监管审查的临床试验并不是为了治愈癌症,相反,它的目标是表明这种策略是可行的和安全的。
这些研究人员先是寻找那些所患的肿瘤产生一种名为NY-ESO-1的蛋白的患者,以便将一个编码靶向这种蛋白的基因添加到从这些患者体内提取出的T细胞中。这些患者也需要携带一种特定类型的人类白细胞抗原(HLA),HLA是一种免疫蛋白复合物,有助于灌注回患者体内的T细胞茁壮成长。符合条件的四名患者都病得很重,这是这种新疗法经常遇到的情形。一名患有多发性骨髓瘤的女性患者接受了三次骨髓移植。另一名在三十多岁时患上肉瘤的女性患者病情太重无法接受她的在实验室中经过基因改造的T细胞治疗,她接受临床关怀,死了。
# e- n6 S- V( f. K( A$ o8 a
为了促进来自这些患者的T细胞抵抗他们所患的疾病,这些研究人员使用CRISPR敲除了两个编码所谓T细胞受体(TCR)的基因。此外,他们还削弱了第三个基因,它编码一种称为PD-1的蛋白。他们推测,PD-1可以阻止免疫反应,清除PD-1的影响可能会丰富T细胞的功能。随后,他们将一个不同的靶向NY-ESO-1的T细胞受体编码基因插入到T细胞中。
$ W; c2 K8 I" [! k5 [/ U. _
对这三名患者的密集监测,包括抽血以研究他们体内的经过基因改造的T细胞,结果证实了CRISPR会导致一些脱靶变化。但是它们很少,而且具有这些意想不到的DNA变化的细胞数量会随着时间的推移逐渐消失。令人鼓舞的是,这些经过CRISPR基因编辑的T细胞可在体内持续至少9个月的时间,而现有的CAR-T细胞疗法研究中,这一数字为大约2个月。影像学检查显示出“良好的健康的T细胞”,在实验室研究中,它们在输注回患者体内几个月后就可以击退癌症。
$ s: Q$ J+ h3 q+ V3 T4 ^9 t
但在这三名患者中,预后却不高。最好的反应是在一名肉瘤患者体内观察到的,他的原发性肿瘤缩小了,不过他的癌症后来又恶化了。这些研究人员提出了可能的原因,包括接受治疗的患者人数较少,以NY-ESO-1为靶标可能存在局限性(选择它作为靶标部分上是出于它具有较好的安全记录)以及未能在许多T细胞中敲除全部的三个基因。 . i( ^ |+ H( X/ y2 H+ O* b3 B1 @
3 f+ F1 l1 k1 T+ J% [! i- u+ I& [9 i
2.Sci Rep:携带帕金森病突变细胞有助于疾病研究2 O* \' u+ O& S* ]* i
doi:10.1038/s41598-020-60273-2" _+ o+ c/ a3 I: G4 W: |
在最近一项研究中,科学家们使用基因编辑工具,将疾病相关基因突变引入猴源干细胞中,并成功地抑制了帕金森氏症患者经常会出现细胞生化异常反应。文章作者,威斯康星大学麦迪逊分校Marina Emborg教授说:“我们现在知道如何将一个单一的突变(点突变)插入到猴源干细胞中。”相关结果发表在最近的《Scientific Reports》杂志上。在该研究中,这些研究人员使用基因编辑技术CRISPR来改变细胞遗传密码中的单个核苷酸,并将其命名为G2019S。 $ _/ Z: B6 ~6 N: t- f/ u; S
在人类帕金森氏症患者中,这种突变导致参与细胞代谢的酶LRRK2过度活跃。这项新研究首次产生了仅产生具有G2019S突变的细胞,这使得研究该突变在疾病中的作用变得更加容易。
" L5 t. @/ W) K. I
3.Science子刊:基因编辑工具CRISPR-Cas9遭遇新挫折!新研究揭示它可导致大量不想要的DNA重复. w4 X/ e8 @. w
doi:10.1126/sciadv.aax2941
9 o' k- i, X! J9 ^" |
在一项新的研究中,来自德国明斯特大学的研究人员发现,在小鼠进行常规的CRISPR-Cas9基因插入过程中,不必要的DNA重复频率很高。相关研究结果发表在2020年2月21日的Science Advances期刊上,论文标题为“Pervasive head-to-tail insertions of DNA templates mask desired CRISPR-Cas9–mediated genome editing events”。他们描述了他们如何发现不必要的DNA重复,并针对这一点提醒了其他的研究人员。
这一发现是偶然的,这是因为作为免疫学研究工作的一部分,他们当时正在研究基因S100A8编码的一种钙结合蛋白。为此,他们使用了CRISPR-Cas9来让这个基因无法表达蛋白,这是一种敲除编辑(knockout editing,即利用CRISPR-Cas9基因编辑剔除靶基因)的形式。他们先进行标准的PCR测试和随后进行更专业的PCR测试来检测靶基因,以确保一切按计划进行。研究结果表明,只有两次编辑取得了成功,这让他们感到吃惊。他们接着将一只成功进行基因编辑的小鼠与一只野生小鼠交配,以了解为何编辑成功率如此之低。通过使用一种特殊类型的PCR对小鼠后代进行的测试显示七只小鼠后代携带经过编辑的基因S100A8,其余的小鼠后代具有不想要的DNA重复。
7 i+ }* K0 z1 w& A! d# @- {. ^
这些研究人员对他们的发现感到震惊,于是他们进行了第二项研究,对小鼠的一个不同基因进行编辑。专业测试显示,在接受测试的50只小鼠中,有30只小鼠具有多个不想要的的基因组片段拷贝,而且这些拷贝是作为CRISPR-Cas9编辑的一部分插入到小鼠基因组中的。实验再次表明,标准PCR测试未能发现这些拷贝。5 O. `( ^" [ v4 t7 |! O5 k
) ^0 _$ k/ v0 H8 F' w
4.Cell Stem Cell:利用碱基编辑器可以治愈人细胞中的遗传病2 A$ p+ p& y% S
doi:10.1016/j.stem.2020.01.019- G* D0 Z1 n# e& Q
% ]6 C4 X: M9 Z* ^0 J9 Q
2012年开发的基因组编辑工具CRISPR/Cas9可以将基因中的突变片段切割掉,并用一个未发生突变的片段进行替换,而一种称为碱基编辑器的新型CRISPR可以在不切割DNA的情况下修复突变。因此,使用碱基编辑器进行基因组编辑被认为更安全。如今,在一项新的研究中,来自荷兰乌得勒支研究所和乌得勒支大学等研究机构的研究人员首次证实碱基编辑器可以安全地治愈源自患者的干细胞中的囊性纤维化(cystic fibrosis)。相关研究结果于2020年02月20日在线发表在Cell Stem Cell期刊上,论文标题为“CRISPR-Based Adenine Editors Correct Nonsense Mutations in a Cystic Fibrosis Organoid Biobank”。论文通讯作者为乌得勒支研究所的Hans Clevers和乌得勒支大学的Jeffrey Beekman。
$ ~8 ?, ^- k# [4 d$ u
图片来自Cell Stem Cell, 2020, doi:10.1016/j.stem.2020.01.019。
- X6 T( t" C5 H, P9 C/ O1 A
根据乌得勒支研究所生物学家Maarten Geurts和乌得勒支大学生物学家Eyleen de Poel的说法,2018年开发出的一种新的CRISPR酶使得CRISPR技术更精确,更不易出错。Maarten说,“在传统的CRISPR/Cas9基因组中,切割特定的DNA片段会导致DNA损伤。这样做的目的是,细胞使用实验室制造出的'健康'DNA片段来修复这种切割。在称为碱基编辑器的新型CRISPR技术中,对Cas9进行了改进,使得它不再切割DNA,但仍能检测到突变位点,因此,无需切割DNA并替换有缺陷的DNA片段,突变位点可在现场直接修复,从而使得它成为一种更有效的基因组编辑工具。”
1 [/ j- ~. D/ [: `. v
当前的这项新的研究表明CRISPR/Cas9的这种新版本(即碱基编辑器)可以安全有效地应用于人类干细胞。
5 F0 J- o# E* y+ Z
5.APL Bioeng:利用CRISPR打开DNA来消除疾病
doi:10.1063/1.5127302; p! @$ g! q8 N. Q$ }0 `
一种蛋白质编辑辅助因子正在为剪切和粘贴DNA编辑器(如CRISPR)访问以前无法访问的感兴趣基因扫清道路。打开这些遗传密码的区域对于提高CRISPR的效率和迈向未来的、基于基因的疾病治疗是至关重要的。这种DNA结合编辑辅助因子是由一个美国人设计的,他们在APL生物工程中描述了他们的设计。
来自亚利桑那州立大学和埃默里大学的主要作者Karmella Haynes说:"这篇论文的创新之处在于使用了另一种与CRISPR DNA编辑器协同传递的蛋白质,去掉了染色质包装,这样CRISPR就能更容易地获取DNA。" % s% ^, w6 V" J, O- I' k3 M
2 T! \4 F- E; H1 ~' a# `4 l0 o% X& S
他们使用了一种完善的人工系统,可以打开或关闭一个基因的染色质包装--荧光素酶基因--它编码一种容易检测到的发光蛋白。在检测染色质填充状态时,研究小组发现了几个编辑助手,他们被称为DNA结合瞬时表达激活相关蛋白(AAPs),破坏了染色质,使CRISPR能够成功编辑荧光素酶基因。
6.基因编辑大牛张锋利用基于CRISPR-Cas13的SHERLOCK系统检测冠状病毒2019-nCoV
新闻来源:A protocol for detection of COVID-19 using CRISPR diagnostics* e' Q# g/ Z6 X
最近的新型冠状病毒SARS-CoV-2(之前称为2019-nCoV,这种病毒感染导致的疾病称为COVID-19)疫情给全球健康带来了巨大挑战。为了应对这一全球挑战,美国布罗德研究所、麦戈文脑科学硏究所及其合作机构致力于提供潜在有用的信息,包括分享可能能够支持开发潜在诊断方法的信息。
作为采取的应对措施的一部分,张锋(Feng Zhang)、Omar Abudayyeh和Jonathan Gootenberg开发了适用于纯化的RNA的研究方案,这可能有助于开发基于CRISPR的诊断方法来临床检测2019-nCoV。这个研究方案包括三个步骤。它可以用于测试当前从临床样本中提取的用于定量PCR(qPCR)测试的RNA:步骤1:将提取出的RNA在42℃下等温扩增反应25分钟;步骤2:让步骤1中的扩增产物与Cas13蛋白、gRNA和报告分子在37℃下孵育30分钟;步骤3:将试纸条浸入步骤2中的反应产物溶液中,结果应当在5分钟内出现。
这种初始的研究方案并不是诊断性的测试方法,而且尚未在患者样本上进行测试。任何诊断方法都需要针对临床用途进行开发和验证,并且需要遵循所有当地法规和最佳实践。尽管如此,这种研究方案仍然为使用试纸条建立基于SHERLOCK的2019-nCoV诊断方法提供了基本框架。
3 T5 l/ g" w4 t, h+ u! T O9 V/ X
7.Nature:从地球不同环境中发现351种新的巨大噬菌体,它们模糊了病毒和细菌之间的界线 A, Z" e1 @% G; d' ?, B, H
doi:10.1038/s41586-020-2007-4
1 G. o1 L' O5 c8 V8 Z3 D+ l
在一项新的研究中,来自美国加州大学伯克利分校、科罗拉多州立大学、斯坦福大学、美国能源部联合基因组研究所、匹兹堡大学医学院、中国中山大学、南非开普敦大学、法国国家科学研究中心、英国伦敦大学学院、澳大利亚墨尔本大学、丹麦技术大学、日本原子能机构和加拿大多伦多大学的研究人员发现了数百种异常大的、能杀死细菌的病毒,它们通常具有与活的有机体相关的功能,这模糊了活的细菌与病毒之间的界线。相关研究结果于2020年2月12日在线发表在Nature期刊上,论文标题为“Clades of huge phages from across Earth’s ecosystems”。论文通讯作者为加州大学伯克利分校的Jill Banfield教授。论文第一作者为加州大学伯克利分校研究生Basem Al-Shayeb和研究助理Rohan Sachdeva。
这些研究人员通过搜索庞大的DNA数据库来发现这些巨大噬菌体(huge phage,也称为megaphage),这些DNA数据库是从将近30种不同的地球环境---从早产儿和孕妇的肠道到西藏温泉、病房、海洋、湖泊和深层地下---中产生的。他们总共鉴定出351种不同的巨大噬菌体,它们的基因组比吞噬单细胞细菌的病毒的平均基因组大4倍或更多倍。在它们当中,存在迄今为止发现的一种最大的噬菌体:它的基因组长735000个碱基(即735kb),比噬菌体的平均基因组大近15倍。这个已知最大的噬菌体基因组比许多细菌的基因组大得多。! v1 Z, n7 l$ _6 H% e
具有讽刺意味的是,在这些巨大噬菌体所携带的DNA中,存在细菌用来对抗病毒的CRISPR系统的一部分。很有可能发生的情形是,一旦这些噬菌体将它们的DNA注入细菌,这种病毒CRISPR系统就会增强宿主细菌的CRISPR系统,很可能主要是让细菌CRISPR系统靶向其他病毒。
4 X% Z0 u6 n0 f1 v
这些巨大噬菌体中的一种也能够制造一种类似于Cas9蛋白的蛋白,Cas9是由加州大学伯克利分校的Jennifer Doudna和她的欧洲同事Emmanuelle Charpentier改进的用于基因编辑的革命性工具CRISPR-Cas9的一部分。这些研究人员将这种微小的蛋白称为CasØ,这是因为希腊字母Ø或phi通常被用来表示噬菌体。" |) g, p$ G' ~2 |) u6 [
Sachdeva说,“在这些巨大噬菌体中,寻找用于基因组工程的新工具的潜力很大。我们发现的许多基因都是未知的,它们没有假定的功能,可能是工业、医学或农业应用中新蛋白的来源。”' g+ D. V3 K9 K# {) U
; v4 F: p1 M4 U; I( Y+ t& R$ E
8.Sci Adv:CRISPR基因编辑能够修复遗传性肝损伤0 q" Y& N' O Z+ w/ W" K+ c# ^
doi:10.1126/sciadv.aax5701' E# |7 Z: J6 |3 v+ k& V( j8 o
近日,来自宾夕法尼亚大学医学院的研究人员在《Science Advance》杂志上在线发表的研究表明,一项新的CRISPR基因编辑技术可预防一中由数百种不同突变驱动的遗传性肝病的发生,并改善了小鼠的临床症状。研究结果表明,这种有前途的CRISPR工具可以潜在地治疗因鸟氨酸转氨甲酰酶(OTC)缺乏以及其它同基因不同位点的突变导致的罕见代谢尿素循环异常的患者。 9 m$ c+ @7 {6 C; i- t$ {/ B$ z* f; T$ D
" k( l) j8 i2 n* q4 _+ V$ b1 _( H+ X
这种CRISPR基因编辑方法建立在以前相同研究团队开发的方法的基础上。这次,研究者们采用了一种新型的双重腺相关病毒(AAV)来传递其有效成分,通过将“小基因”插入基因组中,以在肝细胞中实现OTC的持续表达。 与此前纠正单点突变的治疗方法相比,这种“剪切”-“粘贴”的方法能够显著改善新生小鼠的临床,并且能够持续到成年。
4 {$ D+ j- I; `& z5 `/ \
“就像大多数对新生儿具有致命影响的遗传性疾病一样,长期有效的早期治疗至关重要。”文章作者,基因治疗计划和基因治疗主任James Wilson博士说。 “在这里,我们进一步改善了CRISPR技术,不仅可以维持细胞中OTC的表达,还可以扩展其治疗能力。我们的目标是最终将这种基因编辑方法向临床阶段转化,以治疗患有OTC障碍和其他遗传疾病的患者分散在整个基因中的突变,而非单个突变。”: W) q1 L+ ?$ X9 F- C6 n
9.华人科学家最新两篇Nature Biotechnology构建出超精准的碱基编辑器
doi:10.1038/s41587-020-0414-6; doi:10.1038/s41587-020-0412-8' M/ N5 F' L& U: g
基于CRISPR的基因编辑具有潜在的治疗优势,但也存在一些技术缺陷。在这些基因编辑工具中,碱基编辑器可以重写组成DNA的四个碱基---腺嘌呤(A)、胞嘧啶(C)、胸腺嘧啶(T)和鸟嘌呤(G)---之一。
7 b" K; @+ N8 g. q
如今,在两项新的研究中,来自美国布罗德研究所和霍华德休斯医学研究所的研究人员发明了新的CRISPR工具,这些工具通过改进碱基编辑器的精确度和基因组靶向能力解决了它们面临的一些挑战。相关研究结果于2020年2月10日在线发表在Nature Biotechnology期刊上的论文中,论文标题分别为“Evaluation and minimization of Cas9-independent off-target DNA editing by cytosine base editors”和“Continuous evolution of SpCas9 variants compatible with non-G PAMs”2 j/ ^6 J- W2 }+ F/ `
; M* d2 E$ I- O. |
图片来自Frontiers in Plant Science, 2018, doi:10.3389/fpls.2018.01361。8 B1 K! Y: f) j$ V7 ^4 {; F$ }
在第一项新的研究中,这些研究人员设计出新的胞嘧啶碱基编辑器,将一种难以捉摸的脱靶编辑减少了10~100倍,从而使得这些新的胞嘧啶碱基编辑器特别有望用于治疗人类疾病。在第二项新的研究中,他们通过让现有的Cas9蛋白进化而获得了新一代CRISPR-Cas9蛋白,它们能够靶向更大部分的致病突变,包括一种导致镰形细胞贫血的突变。在此之前,这种突变仍然很难通过以前的CRISPR方法加以靶向。
, E g! h. n& {
这两篇论文的通讯作者、布罗德研究员默金医疗变革技术研究所所长、哈佛大学化学与化学生物学教授、霍华德休斯医学研究所研究员David Liu说,“鉴于人类基因组编辑时代尚处于脆弱的起步阶段,因此,当我们开始将这些基因编辑器导入人体时,我们应尽一切努力将任何不良影响的风险降至最低,这一点很重要。将这种难以捉摸的脱靶编辑--- Cas9非依赖性编辑(Cas9-independent edit,即不依赖于Cas9的编辑)---减到最少是实现这一目标的重要一步。这种脱靶编辑可以在基因组的随机位置上发生。当你进行10次实验时,你会得到10个不同的答案。这使得研究这一点极具挑战性。
【1月】
1.Nature:揭示为何大约40%的细菌缺乏CRISPR-Cas系统
doi:10.1038/s41586-020-1936-2
在一项新的研究中,来自英国埃克塞特大学、法国蒙彼利埃大学和新西兰奥塔哥大学的研究人员揭示了细菌免疫系统如何对它们的宿主有害,并解释了为何在许多细菌中没有发现它们。相关研究结果于2020年1月22日在线发表在Nature期刊上,论文标题为“Targeting of temperate phages drives loss of type I CRISPR–Cas systems”。
图片来自Nature, 2020, doi:10.1038/s41586-020-1936-2。
CRISPR-Cas是一种细菌免疫系统,可保护细菌免受病毒(称为噬菌体)的感染。这种免疫系统的作用机制是窃取一小段病毒DNA并在未来的感染中利用这段病毒DNA靶向和破坏匹配的病毒基因组部分。CRISPR-Cas的靶向作用会破坏这种病毒基因组,这意味着无法产生新的病毒拷贝。
论文第一作者、Westra实验室研究员Clare Rollie和Anne Chevallereau解释道,“我们的新结果表明这种细菌免疫系统无法消除溶原性噬菌体,并且在噬菌体感染期间经常导致对宿主有害的自身免疫反应。”
这种类型的自身免疫反应是由靶向整合到宿主基因组中的病毒DNA的CRISPR-Cas系统引起的,从而导致宿主细胞死亡和病毒释放。他们发现从基因组中丢失了CRISPR-Cas系统的细菌细胞避免了自身免疫靶向引起的损伤,得以存活和增殖。因此,缺乏这种关键的免疫系统是一种优势。
2.Nat Commun:干细胞、CRISPR以及基因测序共同帮助建立脑癌模型
doi:10.1038/s41467-020-14312-1
近日,加利福尼亚大学圣地亚哥分校医学院的研究人员使用基因工程化的人类多能干细胞,创建了一种新型的癌症模型,用于体内研究胶质母细胞瘤如何随时间发展和变化。
共同资深作者Frank B. Funari博士说:“我们已经开发出经过CRISPR改造的干细胞模型,在胶质母细胞瘤中具有与肿瘤相关的基因突变,携带该突变的细胞基本上具有患者来源肿瘤的所有特征,包括染色体外DNA扩增在内。”
在最近发表在《Nature Communications》杂志上的文章中,研究人员使用CRISPR编辑技术在原本正常的基因组中进行了靶向突变,从而创造了可促进肿瘤发展的遗传变异。接受改造的肿瘤细胞在行为,病理学,转录组特征以及遗传突变进化等方面表现得与4级神经胶质瘤十分相似。
共同资深作者Gene W. Yeo说:“单细胞RNA测序和计算工具的加入使得我们能够通过大数据分析真正评估体内肿瘤的异质性。”
3.Nat Med:基因疗法治疗杜氏肌营养不良症
doi:10.1038/s41591-019-0738-2
杜氏肌营养不良症(DMD)是儿童中最常见的遗传性肌肉疾病。对此,慕尼黑工业大学(TUM)等机构的研究人员开发出一种基因疗法,可以为患有DMD的患者提供永久性的缓解。
Dystrophin蛋白是肌肉组织再生的关键。患有杜氏肌营养不良症的人由于基因突变,缺乏这种必需的蛋白质,因此他们的肌肉细胞会随着时间的流逝而退化,并逐渐被结缔组织和脂肪组织取代。DMD主要影响男性,因为关键的突变位点位于X染色体上。
由TUM的科学家通过优化Crispr-Cas9基因编辑技术,首次成功地修复了猪中突变的肌营养不良蛋白基因。TUM和德国环境健康研究中心的遗传学家Wolfgang Wurst教授说:“这些基因剪刀非常有效,并且可以纠正肌营养不良蛋白基因。”与没有接受该治疗的疾病动物相比,所治疗的动物对心律不齐的敏感性较低,并且预期寿命增加。
4.Circulation:CRISPR/Cas9基因编辑或可用于治疗LDLR突变型家族性高胆固醇血症
doi:10.1161/CIRCULATIONAHA.119.042476
低密度脂蛋白(LDL)受体(LDLR)突变是家族性高胆固醇血症的主要原因之一,可诱发动脉粥样硬化,使携带者具有较高的终生心血管疾病风险。CRISPR/Cas9系统是基因编辑纠正基因突变从而改善疾病的有效工具。
通过CRISPR/Cas9系统对体内体细胞进行基因编辑是否可治愈由Ldlr突变引起的家族性高胆固醇血症?本研究在小鼠模型中对此进行研究。研究人员基于相对应的家族性高胆固醇血症相关基因突变建立了一种无义点突变的鼠系——LdlrE208X。采用腺病毒(AAV)-CRISPR/Cas9校正肝细胞Ldlr基因上的点突变。
研究人员发现纯合突变的LdlrE208X小鼠(6只)经高脂膳食喂养后表现为严重的动脉粥样硬化表型,经AAV-CRISPR/Cas9治疗后部分肝细胞的Ldlr突变得到纠正,LDLR蛋白的表达部分恢复(6只)。与对照组相比(每组6只),靶向单导RNA的AAV-CRISPR/Cas9组(6只)的血清总胆固醇、总甘油三酯和低密度脂蛋白胆固醇均显著降低,而且主动脉粥样硬化斑块较小,巨噬细胞浸润程度较低。
5.Nat Commun:新型CRISPR基因编辑技术可用于靶向扩增的抗生素抗性基因
doi:10.1038/s41467-019-13649-6
美国加利福尼亚大学圣地亚哥分校的科学家们开发了新型基于CRISPR的基因驱动系统Pro-AG,该系统显着提高了灭活细菌耐药性基因的效率。该研究于12月16日发表在《Nature communications》杂志上。
抗生素的广泛使用已导致环境中抗菌素耐药性的上升。健康专家预测,在未来几十年中,抗生素耐药性的威胁可能会急剧增加,如果不加控制,到2050年每年将导致约一千万的耐药性疾病死亡。
Pro-AG是基于CRISPR-Cas9基因编辑技术的改进。Pro-AG系统解决了一个棘手的问题,即以质粒,环状DNA形式存在的抗生素耐药性,这种环状DNA可以独立于细菌基因组复制。携带抗生素抗性基因的质粒的多拷贝或"扩增质粒"可以存在于每个细菌中,并具有在细菌之间转移抗生素抗性的能力,从而对成功治疗提出了艰巨的挑战。Pro-AG通过插入修复机制来破坏抗生素抗性基因的活性,其效率比目前的插入和破坏方法高至少两个数量级。
6.PNAS:利用CRISPR-Cas9模拟小细胞肺癌中的靶基因突变
doi:10.1073/pnas.1821893117
小细胞肺癌(SCLC)是一种致命疾病,由于缺乏有效的新疗法,其治疗效果在30多年来未显着改善。大规模测序研究已经在人SCLC肿瘤中鉴定出许多反复突变的基因,其功能仍知之甚少。
在一项新的研究中,来自美国麻省理工学院的研究人员对CRISPR-Cas9系统进行改进,以快速地模拟SCLC小鼠模型中的靶基因突变。通过使用这种系统,他们发现基因p107在SCLC中起着肿瘤抑制基因的作用。此外,p107的丧失赋予了与p107存在密切同源关系的p130的丧失引发的肿瘤表型。这些研究结果表明,这种系统可用于更好地了解有助于SCLC进展的遗传因素。
7.Nat Commun:揭示CRISPR-Cas9系统在非人类灵长类动物中不会导致明显的脱靶效应
doi:10.1038/s41467-019-13481-y
CRISPR-Cas9是一种广泛使用的基因组编辑工具,但其脱靶效应和在靶复杂突变仍然令人担忧,尤其是考虑到未来的临床应用。非人类灵长类动物与人类有着密切的遗传和生理相似性,这使得它们成为开发基于Cas9的疗法的理想临床前模型。但是,尚未在非人类灵长类动物中进行全面的体内脱靶评估和在靶评估。
在一项新的研究中,来自中国科学院昆明动物研究所和中国科学院上海营养与健康研究所的研究人员对经过CRISPR-Cas9处理的恒河猴进行全基因组三重测序。他们仅发现少量的可用预期的自发突变来解释的新生突变,并未检测到意料之外的脱靶突变。此外,长读取测序数据未检测到靶区域中的较大结构变异。