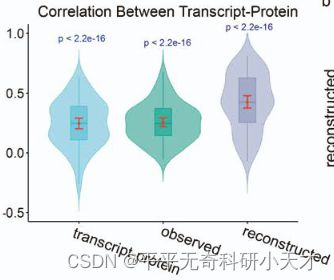
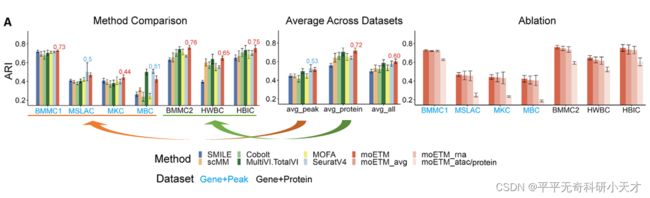
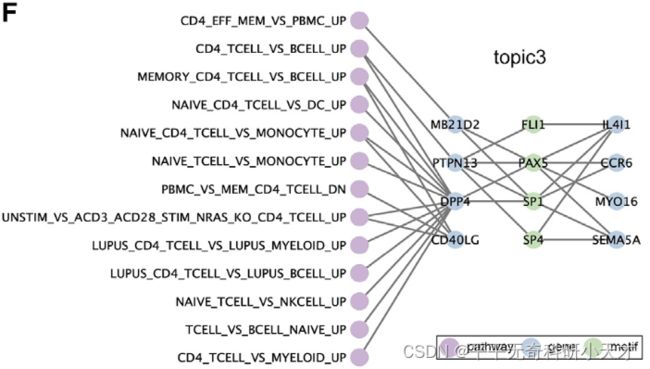
- PyTorch & TensorFlow速成复习:从基础语法到模型部署实战(附FPGA移植衔接)
阿牛的药铺
算法移植部署pytorchtensorflowfpga开发
PyTorch&TensorFlow速成复习:从基础语法到模型部署实战(附FPGA移植衔接)引言:为什么算法移植工程师必须掌握框架基础?针对光学类产品算法FPGA移植岗位需求(如可见光/红外图像处理),深度学习框架是算法落地的"桥梁"——既要用PyTorch/TensorFlow验证算法可行性,又要将训练好的模型(如CNN、目标检测)转换为FPGA可部署的格式(ONNX、TFLite)。本文采用"
- ARM嵌入式可编程控制器技术开发
拉勾科研工作室
arm开发
PLC自动化设计|毕业设计指导|工业自动化解决方案✨专业领域:PLC程序设计与调试工业自动化控制系统HMI人机界面开发工业传感器应用电气控制系统设计工业网络通信擅长工具:西门子S7系列PLC编程三菱/欧姆龙PLC应用触摸屏界面设计电气CAD制图工业现场总线技术自动化设备调试主要内容:PLC控制系统设计工业自动化方案规划电气原理图绘制控制程序编写与调试毕业论文指导毕业设计题目与程序设计✅具体问题可以
- 算法学习笔记:17.蒙特卡洛算法 ——从原理到实战,涵盖 LeetCode 与考研 408 例题
在计算机科学和数学领域,蒙特卡洛算法(MonteCarloAlgorithm)以其独特的随机抽样思想,成为解决复杂问题的有力工具。从圆周率的计算到金融风险评估,从物理模拟到人工智能,蒙特卡洛算法都发挥着不可替代的作用。本文将深入剖析蒙特卡洛算法的思想、解题思路,结合实际应用场景与Java代码实现,并融入考研408的相关考点,穿插图片辅助理解,帮助你全面掌握这一重要算法。蒙特卡洛算法的基本概念蒙特卡
- AI音乐模拟器:AIGC时代的智能音乐创作革命
lauo
人工智能AIGC开源前端机器人
AI音乐模拟器:AIGC时代的智能音乐创作革命引言:AIGC浪潮下的音乐创作新范式在数字化转型的浪潮中,人工智能生成内容(AIGC)正在重塑各个创意领域。音乐产业作为创意经济的重要组成部分,正经历着前所未有的变革。据最新市场研究数据显示,全球AI音乐市场规模预计将从2023年的5.8亿美元增长到2030年的26.8亿美元,年复合增长率高达24.3%。这一快速增长的市场背后,是AI音乐技术正在打破传
- 深度学习模型表征提取全解析
ZhangJiQun&MXP
教学2024大模型以及算力2021AIpython深度学习人工智能pythonembedding语言模型
模型内部进行表征提取的方法在自然语言处理(NLP)中,“表征(Representation)”指将文本(词、短语、句子、文档等)转化为计算机可理解的数值形式(如向量、矩阵),核心目标是捕捉语言的语义、语法、上下文依赖等信息。自然语言表征技术可按“静态/动态”“有无上下文”“是否融入知识”等维度划分一、传统静态表征(无上下文,词级为主)这类方法为每个词分配固定向量,不考虑其在具体语境中的含义(无法解
- 视频分析:让AI看懂动态画面
随机森林404
计算机视觉音视频人工智能microsoft
引言:动态视觉理解的革命在数字信息爆炸的时代,视频已成为最主要的媒介形式。据统计,每分钟有超过500小时的视频内容被上传到YouTube平台,而全球互联网流量的82%来自视频数据传输。面对如此海量的视频内容,传统的人工处理方式已无法满足需求,这正是人工智能视频分析技术大显身手的舞台。视频分析技术赋予机器"看懂"动态画面的能力,使其能够自动理解、解释甚至预测视频中的内容,这一突破正在彻底改变我们与视
- 基于Python的Google Scholar学术论文爬虫实战:最新技术与完整代码解析
Python爬虫项目
2025年爬虫实战项目python爬虫开发语言学习scrapy
摘要本文详细介绍如何使用Python构建一个高效的GoogleScholar爬虫系统,包括代理设置、反反爬策略、数据解析与存储等核心技术。文章涵盖最新Python爬虫技术栈(如Playwright、异步IO等),提供完整可运行的代码示例,并讨论学术爬虫的伦理与法律问题。通过本教程,读者将掌握从GoogleScholar批量获取学术论文信息的高级爬虫技术。关键词:Python爬虫、GoogleSch
- 【Qualcomm】高通SNPE框架简介、下载与使用
Jackilina_Stone
人工智能QualcommSNPE
目录一高通SNPE框架1SNPE简介2QNN与SNPE3Capabilities4工作流程二SNPE的安装与使用1下载2Setup3SNPE的使用概述一高通SNPE框架1SNPE简介SNPE(SnapdragonNeuralProcessingEngine),是高通公司推出的面向移动端和物联网设备的深度学习推理框架。SNPE提供了一套完整的深度学习推理框架,能够支持多种深度学习模型,包括Pytor
- 深度学习篇---昇腾NPU&CANN 工具包
Atticus-Orion
上位机知识篇图像处理篇深度学习篇深度学习人工智能NPU昇腾CANN
介绍昇腾NPU是华为推出的神经网络处理器,具有强大的AI计算能力,而CANN工具包则是面向AI场景的异构计算架构,用于发挥昇腾NPU的性能优势。以下是详细介绍:昇腾NPU架构设计:采用达芬奇架构,是一个片上系统,主要由特制的计算单元、大容量的存储单元和相应的控制单元组成。集成了多个CPU核心,包括控制CPU和AICPU,前者用于控制处理器整体运行,后者承担非矩阵类复杂计算。此外,还拥有AICore
- 深度学习图像分类数据集—桃子识别分类
AI街潜水的八角
深度学习图像数据集深度学习分类人工智能
该数据集为图像分类数据集,适用于ResNet、VGG等卷积神经网络,SENet、CBAM等注意力机制相关算法,VisionTransformer等Transformer相关算法。数据集信息介绍:桃子识别分类:['B1','M2','R0','S3']训练数据集总共有6637张图片,每个文件夹单独放一种数据各子文件夹图片统计:·B1:1601张图片·M2:1800张图片·R0:1601张图片·S3:
- 法律科技领域人工智能代理构建的十个经验教训,一位人工智能工程师通过构建、部署和维护智能代理的经验教训来优化法律工作流程的历程。
知识大胖
NVIDIAGPU和大语言模型开发教程人工智能ai
目录介绍什么是代理人?为什么它对法律如此重要?法律技术中代理用例示例-合同审查代理-法律研究代理在LegalTech中使用代理的十个教训-教训1:即使代理很酷,它们也不能解决所有问题-教训2:选择最适合您用例的框架-教训3:能够快速迭代不同的模型-教训4:从简单开始,必要时扩展-教训5:使用跟踪解决方案;您将需要它-教训6:确保跟踪成本,代理循环可能很昂贵-教训7:将控制权交给最终用户(人在环路中
- Llama-Omni会说话的人工智能“语音到语音LLM” 利用低延迟、高质量语音转语音 AI 彻底改变对话方式(教程含源码)
知识大胖
NVIDIAGPU和大语言模型开发教程llama人工智能nvidiallm
介绍“单靠技术是不够的——技术与文科、人文学科的结合,才能产生让我们心花怒放的成果。”——史蒂夫·乔布斯近年来,人机交互领域发生了重大变化,尤其是随着ChatGPT、GPT-4等大型语言模型(LLM)的出现。虽然这些模型主要基于文本,但人们对语音交互的兴趣日益浓厚,以使人机对话更加无缝和自然。然而,实现语音交互而不受语音转文本处理中常见的延迟和错误的影响仍然是一个挑战。关键字:Llama-Omni
- 什么是热力学计算?它如何帮助人工智能发展?
知识大胖
NVIDIAGPU和大语言模型开发教程人工智能量子计算
现代计算的基础是晶体管,这是一种微型电子开关,可以用它构建逻辑门,从而创建CPU或GPU等复杂的数字电路。随着技术的进步,晶体管变得越来越小。根据摩尔定律,集成电路中晶体管的数量大约每两年增加一倍。这种指数级增长使得计算技术呈指数级发展。然而,晶体管尺寸的缩小是有限度的。我们很快就会达到晶体管无法工作的阈值。此外,人工智能的进步使得对计算能力的需求比以往任何时候都更加迫切。根本问题是自然是随机的(
- 上海交大:工具增强推理agent
标题:SciMaster:TowardsGeneral-PurposeScientificAIAgentsPartI.X-MasterasFoundation-CanWeLeadonHumanity’sLastExam?来源:arXiv,2507.05241摘要人工智能代理的快速发展激发了利用它们加速科学发现的长期雄心。实现这一目标需要深入了解人类知识的前沿。因此,人类的最后一次考试(HLE)为评
- 微算法科技的前沿探索:量子机器学习算法在视觉任务中的革新应用
MicroTech2025
量子计算算法
在信息技术飞速发展的今天,计算机视觉作为人工智能领域的重要分支,正逐步渗透到我们生活的方方面面。从自动驾驶到人脸识别,从医疗影像分析到安防监控,计算机视觉技术展现了巨大的应用潜力。然而,随着视觉任务复杂度的不断提升,传统机器学习算法在处理大规模、高维度数据时遇到了计算瓶颈。在此背景下,量子计算作为一种颠覆性的计算模式,以其独特的并行处理能力和指数级增长的计算空间,为解决这一难题提供了新的思路。微算
- 中国银联豪掷1亿采购海光C86架构服务器
信创新态势
海光芯片C86国产芯片海光信息
近日,中国银联国产服务器采购大单正式敲定,基于海光C86架构的服务器产品中标,项目金额超过1亿元。接下来,C86服务器将用于支撑中国银联的虚拟化、大数据、人工智能、研发测试等技术场景,进一步提升其业务处理能力、用户服务效率和信息安全水平。作为我国重要的银行卡组织和金融基础设施,中国银联在全球183个国家和地区设有银联受理网络,境内外成员机构超过2600家,是世界三大银行卡品牌之一。此次中国银联发力
- [论文阅读]Distilling Step-by-Step! Outperforming Larger Language Models with Less Training Data and Smal
0x211
论文阅读语言模型人工智能自然语言处理
中文译名:逐步蒸馏!以较少的训练数据和较小的模型规模超越较大的语言模型发布链接:http://arxiv.org/abs/2305.02301AcceptedtoFindingsofACL2023阅读原因:近期任务需要用到蒸馏操作,了解相关知识核心思想:改变视角。原来的视角:把LLMs视为噪声标签的来源。现在的视角:把LLMs视为能够推理的代理。方法好在哪?需要的数据量少,得到的结果好。文章的方法
- AI人工智能浪潮中文心一言的独特优势
AI人工智能浪潮中文心一言的独特优势:为什么它是中国市场的“AI主力军”?关键词:文心一言,AI大模型,中文处理,多模态融合,产业落地,安全可控,百度ERNIE摘要:在全球AI大模型浪潮中,百度文心一言(ERNIEBot)凭借“懂中文、会多模态、能落地、守规矩”的四大核心优势,成为中国市场最具竞争力的AI产品之一。本文将用“超级大脑”的比喻,从中文理解、多模态能力、产业生态融合、安全可控性四个维度
- 正义的算法迷宫—人工智能重构司法体系的技术悖论与文明试炼
一、法庭的数字化迁徙当美国威斯康星州法院采纳COMPAS算法评估被告再犯风险,当中国"智慧法院"系统年处理1.2亿件案件,司法体系正经历从石柱法典到代码裁判的范式革命。这场转型的核心驱动力是司法效率与公正的永恒张力:美国重罪案件平均审理周期达18个月,中国基层法官年人均结案357件(是德国同行的6倍),而算法能在0.3秒内完成百万份文书比对。人工智能渗透司法引发三重裂变:证据分析从经验推断转向数据
- NumPy-@运算符详解
GG不是gg
numpynumpy
NumPy-@运算符详解一、@运算符的起源与设计目标1.从数学到代码:符号的统一2.设计目标二、@运算符的核心语法与运算规则1.基础用法:二维矩阵乘法2.一维向量的矩阵语义3.高维数组:批次矩阵运算4.广播机制:灵活的形状匹配三、@运算符与其他乘法方式的核心区别1.对比`np.dot()`2.对比元素级乘法`*`3.对比`np.matrix`的`*`运算符四、典型应用场景:从基础到高阶1.深度学习
- 【python实战】不玩微博,一封邮件就能知道实时热榜,天秀吃瓜
一条coding
从实战学python人工智能pythonlinux爬虫
❤️欢迎订阅《从实战学python》专栏,用python实现办公自动化、数据可视化、人工智能等各个方向的实战案例,有趣又有用!❤️更多精品专栏简介点这里有的人金玉其表败絮其中,有的人却若彩虹般绚烂,怦然心动前言哈喽,大家好,我是一条。在生活中我是一个不太喜欢逛娱乐平台的人,抖音、快手、微博我手机里都没装,甚至微信朋友圈都不看,但是自从开始写博客,有些热度不得不蹭。所以就有了这样一个需求,能不能让微
- NLP_知识图谱_大模型——个人学习记录
macken9999
自然语言处理知识图谱大模型自然语言处理知识图谱学习
1.自然语言处理、知识图谱、对话系统三大技术研究与应用https://github.com/lihanghang/NLP-Knowledge-Graph深度学习-自然语言处理(NLP)-知识图谱:知识图谱构建流程【本体构建、知识抽取(实体抽取、关系抽取、属性抽取)、知识表示、知识融合、知识存储】-元気森林-博客园https://www.cnblogs.com/-402/p/16529422.htm
- 解决 Python 包安装失败问题:以 accelerate 为例
在使用Python开发项目时,我们经常会遇到依赖包安装失败的问题。今天,我们就以accelerate包为例,详细探讨一下可能的原因以及解决方法。通过这篇文章,你将了解到Python包安装失败的常见原因、如何切换镜像源、如何手动安装包,以及一些实用的注意事项。一、问题背景在开发一个深度学习项目时,我需要安装accelerate包来优化模型的训练过程。然而,当我运行以下命令时:bash复制pipins
- MCP协议:AI时代的“万能插座”如何重构IT生态与未来
MCP协议:AI时代的“万能插座”如何重构IT生态与未来在人工智能技术爆炸式发展的浪潮中,一个名为ModelContextProtocol(MCP)的技术协议正以惊人的速度重塑IT行业的底层逻辑。2024年11月由Anthropic首次发布,MCP在短短半年内获得OpenAI、谷歌、亚马逊、阿里、腾讯等全球科技巨头的支持,被业内誉为AI时代的HTTP协议或USB-C接口,正在成为连接大模型与现实世
- 从RNN循环神经网络到Transformer注意力机制:解析神经网络架构的华丽蜕变
熊猫钓鱼>_>
神经网络rnntransformer
1.引言在自然语言处理和序列建模领域,神经网络架构经历了显著的演变。从早期的循环神经网络(RNN)到现代的Transformer架构,这一演变代表了深度学习方法在处理序列数据方面的重大进步。本文将深入比较这两种架构,分析它们的工作原理、优缺点,并通过实验结果展示它们在实际应用中的性能差异。2.循环神经网络(RNN)2.1基本原理循环神经网络是专门为处理序列数据而设计的神经网络架构。RNN的核心思想
- 《算法备案全攻略:规范与流程引领数字时代新秩序》
算法及大模型备案顾问刘老师
算法备案深度学习AIGC语言模型算法人工智能
一、算法备案:开启合规新征程(一)备案规定的起源与发展2022年国家互联网信息办公室、工业和信息化部、公安部、国家市场监督管理总局联合发布《互联网信息服务算法推荐管理规定》,自2022年3月1日起施行。此后,相关规定不断完善和演进。如国家网信办于2022年8月、10月及2023年1月先后三次公布了《境内互联网信息服务算法备案清单》。同时,2022年发布的最高人民法院《关于规范和加强人工智能司法应用
- C语言学生成绩管理系统<;自创>;(功能7有小错误,但可运行)
han_xue_feng
java
腾讯云加速企业和个人开发创新公开直播预告直播预告:07/18(周四)15:00-16:00随着人工智能与大模型的蓬勃发展,我们正步入一个由技微信实习第一天周五入职,早上早早来到了公司,发现好多人都没上班,到十点才陆陆续续有人来,办理完入职后,mentor中联夏令营遗憾没有入选不过hr的回复真的很好,辛苦啦#提前批简历挂麻了怎么办##机械制造投递记录#大数据开发的工作有点过于简单了吧sq大数据开发的
- Python 实战人工智能数学基础:推荐系统应用
AI天才研究院
AI大模型企业级应用开发实战大数据人工智能语言模型JavaPython架构设计
作者:禅与计算机程序设计艺术文章目录1.背景介绍2.核心概念与联系2.1用户画像2.2相似性计算2.2.1基于物品的相似度2.2.2基于用户的相似度2.3协同过滤算法2.3.1基于用户的协同过滤算法2.3.2基于物品的协同过滤算法2.3.3基于上下文的协同过滤算法3.核心算法原理和具体操作步骤以及数学模型公式详细讲解3.1基于用户的协同过滤算法3.2基于物品的协同过滤算法3.3混合协同过滤算法3.
- python+springboot+vue的音乐系统
QQ_511008285
pythonspringbootvue.jsdjangoflasknode.jsphp
目录技术栈介绍具体实现截图系统设计研究方法:设计步骤设计流程核心代码部分展示研究方法详细视频演示试验方案论文大纲源码获取/详细视频演示技术栈介绍Django-SpringBoot-php-Node.js-flask本课题的研究方法和研究步骤基本合理,难度适中,本选题是学生所学专业知识的延续,符合学生专业发展方向,对于提高学生的基本知识和技能以及钻研能力有益。该学生能够在预定时间内完成该课题的设计。
- python基于Hadoop的NBA球员大数据分析与可视化系统
目录技术栈介绍具体实现截图系统设计研究方法:设计步骤设计流程核心代码部分展示研究方法详细视频演示试验方案论文大纲源码获取/详细视频演示技术栈介绍Django-SpringBoot-php-Node.js-flask本课题的研究方法和研究步骤基本合理,难度适中,本选题是学生所学专业知识的延续,符合学生专业发展方向,对于提高学生的基本知识和技能以及钻研能力有益。该学生能够在预定时间内完成该课题的设计。
- 如何用ruby来写hadoop的mapreduce并生成jar包
wudixiaotie
mapreduce
ruby来写hadoop的mapreduce,我用的方法是rubydoop。怎么配置环境呢:
1.安装rvm:
不说了 网上有
2.安装ruby:
由于我以前是做ruby的,所以习惯性的先安装了ruby,起码调试起来比jruby快多了。
3.安装jruby:
rvm install jruby然后等待安
- java编程思想 -- 访问控制权限
百合不是茶
java访问控制权限单例模式
访问权限是java中一个比较中要的知识点,它规定者什么方法可以访问,什么不可以访问
一:包访问权限;
自定义包:
package com.wj.control;
//包
public class Demo {
//定义一个无参的方法
public void DemoPackage(){
System.out.println("调用
- [生物与医学]请审慎食用小龙虾
comsci
生物
现在的餐馆里面出售的小龙虾,有一些是在野外捕捉的,这些小龙虾身体里面可能带有某些病毒和细菌,人食用以后可能会导致一些疾病,严重的甚至会死亡.....
所以,参加聚餐的时候,最好不要点小龙虾...就吃养殖的猪肉,牛肉,羊肉和鱼,等动物蛋白质
- org.apache.jasper.JasperException: Unable to compile class for JSP:
商人shang
maven2.2jdk1.8
环境: jdk1.8 maven tomcat7-maven-plugin 2.0
原因: tomcat7-maven-plugin 2.0 不知吃 jdk 1.8,换成 tomcat7-maven-plugin 2.2就行,即
<plugin>
- 你的垃圾你处理掉了吗?GC
oloz
GC
前序:本人菜鸟,此文研究学习来自网络,各位牛牛多指教
1.垃圾收集算法的核心思想
Java语言建立了垃圾收集机制,用以跟踪正在使用的对象和发现并回收不再使用(引用)的对象。该机制可以有效防范动态内存分配中可能发生的两个危险:因内存垃圾过多而引发的内存耗尽,以及不恰当的内存释放所造成的内存非法引用。
垃圾收集算法的核心思想是:对虚拟机可用内存空间,即堆空间中的对象进行识别
- shiro 和 SESSSION
杨白白
shiro
shiro 在web项目里默认使用的是web容器提供的session,也就是说shiro使用的session是web容器产生的,并不是自己产生的,在用于非web环境时可用其他来源代替。在web工程启动的时候它就和容器绑定在了一起,这是通过web.xml里面的shiroFilter实现的。通过session.getSession()方法会在浏览器cokkice产生JESSIONID,当关闭浏览器,此
- 移动互联网终端 淘宝客如何实现盈利
小桔子
移動客戶端淘客淘寶App
2012年淘宝联盟平台为站长和淘宝客带来的分成收入突破30亿元,同比增长100%。而来自移动端的分成达1亿元,其中美丽说、蘑菇街、果库、口袋购物等App运营商分成近5000万元。 可以看出,虽然目前阶段PC端对于淘客而言仍旧是盈利的大头,但移动端已经呈现出爆发之势。而且这个势头将随着智能终端(手机,平板)的加速普及而更加迅猛
- wordpress小工具制作
aichenglong
wordpress小工具
wordpress 使用侧边栏的小工具,很方便调整页面结构
小工具的制作过程
1 在自己的主题文件中新建一个文件夹(如widget),在文件夹中创建一个php(AWP_posts-category.php)
小工具是一个类,想侧边栏一样,还得使用代码注册,他才可以再后台使用,基本的代码一层不变
<?php
class AWP_Post_Category extends WP_Wi
- JS微信分享
AILIKES
js
// 所有功能必须包含在 WeixinApi.ready 中进行
WeixinApi.ready(function(Api) {
// 微信分享的数据
var wxData = {
&nb
- 封装探讨
百合不是茶
JAVA面向对象 封装
//封装 属性 方法 将某些东西包装在一起,通过创建对象或使用静态的方法来调用,称为封装;封装其实就是有选择性地公开或隐藏某些信息,它解决了数据的安全性问题,增加代码的可读性和可维护性
在 Aname类中申明三个属性,将其封装在一个类中:通过对象来调用
例如 1:
//属性 将其设为私有
姓名 name 可以公开
- jquery radio/checkbox change事件不能触发的问题
bijian1013
JavaScriptjquery
我想让radio来控制当前我选择的是机动车还是特种车,如下所示:
<html>
<head>
<script src="http://ajax.googleapis.com/ajax/libs/jquery/1.7.1/jquery.min.js" type="text/javascript"><
- AngularJS中安全性措施
bijian1013
JavaScriptAngularJS安全性XSRFJSON漏洞
在使用web应用中,安全性是应该首要考虑的一个问题。AngularJS提供了一些辅助机制,用来防护来自两个常见攻击方向的网络攻击。
一.JSON漏洞
当使用一个GET请求获取JSON数组信息的时候(尤其是当这一信息非常敏感,
- [Maven学习笔记九]Maven发布web项目
bit1129
maven
基于Maven的web项目的标准项目结构
user-project
user-core
user-service
user-web
src
- 【Hive七】Hive用户自定义聚合函数(UDAF)
bit1129
hive
用户自定义聚合函数,用户提供的多个入参通过聚合计算(求和、求最大值、求最小值)得到一个聚合计算结果的函数。
问题:UDF也可以提供输入多个参数然后输出一个结果的运算,比如加法运算add(3,5),add这个UDF需要实现UDF的evaluate方法,那么UDF和UDAF的实质分别究竟是什么?
Double evaluate(Double a, Double b)
- 通过 nginx-lua 给 Nginx 增加 OAuth 支持
ronin47
前言:我们使用Nginx的Lua中间件建立了OAuth2认证和授权层。如果你也有此打算,阅读下面的文档,实现自动化并获得收益。SeatGeek 在过去几年中取得了发展,我们已经积累了不少针对各种任务的不同管理接口。我们通常为新的展示需求创建新模块,比如我们自己的博客、图表等。我们还定期开发内部工具来处理诸如部署、可视化操作及事件处理等事务。在处理这些事务中,我们使用了几个不同的接口来认证:
&n
- 利用tomcat-redis-session-manager做session同步时自定义类对象属性保存不上的解决方法
bsr1983
session
在利用tomcat-redis-session-manager做session同步时,遇到了在session保存一个自定义对象时,修改该对象中的某个属性,session未进行序列化,属性没有被存储到redis中。 在 tomcat-redis-session-manager的github上有如下说明: Session Change Tracking
As noted in the &qu
- 《代码大全》表驱动法-Table Driven Approach-1
bylijinnan
java算法
关于Table Driven Approach的一篇非常好的文章:
http://www.codeproject.com/Articles/42732/Table-driven-Approach
package com.ljn.base;
import java.util.Random;
public class TableDriven {
public
- Sybase封锁原理
chicony
Sybase
昨天在操作Sybase IQ12.7时意外操作造成了数据库表锁定,不能删除被锁定表数据也不能往其中写入数据。由于着急往该表抽入数据,因此立马着手解决该表的解锁问题。 无奈此前没有接触过Sybase IQ12.7这套数据库产品,加之当时已属于下班时间无法求助于支持人员支持,因此只有借助搜索引擎强大的
- java异常处理机制
CrazyMizzz
java
java异常关键字有以下几个,分别为 try catch final throw throws
他们的定义分别为
try: Opening exception-handling statement.
catch: Captures the exception.
finally: Runs its code before terminating
- hive 数据插入DML语法汇总
daizj
hiveDML数据插入
Hive的数据插入DML语法汇总1、Loading files into tables语法:1) LOAD DATA [LOCAL] INPATH 'filepath' [OVERWRITE] INTO TABLE tablename [PARTITION (partcol1=val1, partcol2=val2 ...)]解释:1)、上面命令执行环境为hive客户端环境下: hive>l
- 工厂设计模式
dcj3sjt126com
设计模式
使用设计模式是促进最佳实践和良好设计的好办法。设计模式可以提供针对常见的编程问题的灵活的解决方案。 工厂模式
工厂模式(Factory)允许你在代码执行时实例化对象。它之所以被称为工厂模式是因为它负责“生产”对象。工厂方法的参数是你要生成的对象对应的类名称。
Example #1 调用工厂方法(带参数)
<?phpclass Example{
- mysql字符串查找函数
dcj3sjt126com
mysql
FIND_IN_SET(str,strlist)
假如字符串str 在由N 子链组成的字符串列表strlist 中,则返回值的范围在1到 N 之间。一个字符串列表就是一个由一些被‘,’符号分开的自链组成的字符串。如果第一个参数是一个常数字符串,而第二个是type SET列,则 FIND_IN_SET() 函数被优化,使用比特计算。如果str不在strlist 或st
- jvm内存管理
easterfly
jvm
一、JVM堆内存的划分
分为年轻代和年老代。年轻代又分为三部分:一个eden,两个survivor。
工作过程是这样的:e区空间满了后,执行minor gc,存活下来的对象放入s0, 对s0仍会进行minor gc,存活下来的的对象放入s1中,对s1同样执行minor gc,依旧存活的对象就放入年老代中;
年老代满了之后会执行major gc,这个是stop the word模式,执行
- CentOS-6.3安装配置JDK-8
gengzg
centos
JAVA_HOME=/usr/java/jdk1.8.0_45
JRE_HOME=/usr/java/jdk1.8.0_45/jre
PATH=$PATH:$JAVA_HOME/bin:$JRE_HOME/bin
CLASSPATH=.:$JAVA_HOME/lib/dt.jar:$JAVA_HOME/lib/tools.jar:$JRE_HOME/lib
export JAVA_HOME
- 【转】关于web路径的获取方法
huangyc1210
Web路径
假定你的web application 名称为news,你在浏览器中输入请求路径: http://localhost:8080/news/main/list.jsp 则执行下面向行代码后打印出如下结果: 1、 System.out.println(request.getContextPath()); //可返回站点的根路径。也就是项
- php里获取第一个中文首字母并排序
远去的渡口
数据结构PHP
很久没来更新博客了,还是觉得工作需要多总结的好。今天来更新一个自己认为比较有成就的问题吧。 最近在做储值结算,需求里结算首页需要按门店的首字母A-Z排序。我的数据结构原本是这样的:
Array
(
[0] => Array
(
[sid] => 2885842
[recetcstoredpay] =&g
- java内部类
hm4123660
java内部类匿名内部类成员内部类方法内部类
在Java中,可以将一个类定义在另一个类里面或者一个方法里面,这样的类称为内部类。内部类仍然是一个独立的类,在编译之后内部类会被编译成独立的.class文件,但是前面冠以外部类的类名和$符号。内部类可以间接解决多继承问题,可以使用内部类继承一个类,外部类继承一个类,实现多继承。
&nb
- Caused by: java.lang.IncompatibleClassChangeError: class org.hibernate.cfg.Exten
zhb8015
maven pom.xml关于hibernate的配置和异常信息如下,查了好多资料,问题还是没有解决。只知道是包冲突,就是不知道是哪个包....遇到这个问题的分享下是怎么解决的。。
maven pom:
<dependency>
<groupId>org.hibernate</groupId>
<ar
- Spark 性能相关参数配置详解-任务调度篇
Stark_Summer
sparkcachecpu任务调度yarn
随着Spark的逐渐成熟完善, 越来越多的可配置参数被添加到Spark中来, 本文试图通过阐述这其中部分参数的工作原理和配置思路, 和大家一起探讨一下如何根据实际场合对Spark进行配置优化。
由于篇幅较长,所以在这里分篇组织,如果要看最新完整的网页版内容,可以戳这里:http://spark-config.readthedocs.org/,主要是便
- css3滤镜
wangkeheng
htmlcss
经常看到一些网站的底部有一些灰色的图标,鼠标移入的时候会变亮,开始以为是js操作src或者bg呢,搜索了一下,发现了一个更好的方法:通过css3的滤镜方法。
html代码:
<a href='' class='icon'><img src='utv.jpg' /></a>
css代码:
.icon{-webkit-filter: graysc