2018 Cell系列相变最强综述,未来已来,你在哪?
导读
Trends in Cell Biology (Cell系列综述, 2018 IF: 18.564)于2018年6月1日在线发表了Steven Boeynaems(PhD Biomedical sciences, Stanford University School of Medicine, 一作兼通讯)撰写的关于蛋白质相位分离综述一文《Protein Phase Separation: A New Phase in Cell Biology》。蛋白质相变做为细胞区室形成和调节生化反应的新思路而受到越来越多的关注,同时为神经退行性疾病中无膜细胞器生物合成和蛋白质聚集的研究提供了新的框架。该综述中,总结了近年来无膜细胞器的研究现状,相变的发生、发展、调控和在疾病治疗中的应用进行了探讨,并展望了未来几年相变领域的主要问题和挑战。内容丰富,见解前沿,值得相关领域的研究者细细品读。
摘要
细胞区室和细胞器是组织生物物质的基本形式。大多数熟知的细胞器通过膜结构与周围环境隔开。另外还有许多无膜结构的细胞器。最新研究表明这些无膜细胞器是蛋白质和RNA的超分子组装体,通过相位分离形成。近来研究揭示了无膜细胞器的分子特性、形成、调节和功能。细胞生物学、生物物理学、物理化学、结构生物学和生物信息学的技术融合正帮助建立该新兴领域–相变的分子调控原理,从而为找到治疗与衰老相关疾病的新方法等重要发现铺平道路。
Highlights
相位分离在多种细胞过程中起作用,包括形成经典的无膜细胞器、信号复合物、细胞骨架和许多其他超分子组装。
相位分离的概念为理解序列简并(低复杂性)和蛋白质无序区域的功能提供了新的研究方向。
越来越多的证据表明,相变和无膜细胞器的失调在蛋白聚集相关的人类疾病中发挥关键作用。
理解蛋白质相位分离背后的物理原理和分子互作机制可促进新型生物材料的研发。
名词解释
凝胶 (Gel):由大分子物质通过共价键(化学凝胶)或非共价键(物理凝胶)彼此连接构成的系统或液滴样网状结构。凝胶的物质属性取决于分子间交联的寿命、交联的程度和模式 (交联存在越久越倾向于固体,译者注)。缔合聚合物可形成物理凝胶,水溶性聚合物形成水凝胶。
内部无序蛋白质/区域 (Intrinsically disordered protein/ region):包含多种空间结构的蛋白质或在其自然状态下构象可以快速变化的区域。(通常由重复序列或低复杂度序列组成,译者注)
液体 (Liquid):物质的四个基本状态之一,具有一定的体积但没有固定的形状。液体通常形成球形液滴使其表面积最小化以降低表面张力,且两个液滴融合后仍为球形。在液体中,局部的空间秩序(主要是分子间距离和取向)不会超过邻近几个分子的尺寸,再远一些的分子都是随机组织。这导致液体结构可以实现快速重组并且还能够与周围环境进行成分交换。
液晶 (Liquid–crystalline):一种物质状态,同时具有液体和晶体的双重性质。组成液晶的分子以晶体样形式组织,但也可以像液体一样进行流动。液晶在分子尺度或至少在一个方向是有序的。液晶经常会随着温度的变化发生相变。
液-液分层 (Liquid–liquid demixing):两种液体作为单独的相共存而非混合溶液(参见相位分离)。
低复杂性结构域(Low-complexity domain , LCD):一种富含或仅由少数类型氨基酸组成的蛋白质片段。这些片段的组合通常遵循简单模式,如串联重复,并且与分子的快速进化速率相关。
物质状态 (Material state):物质可以产生的物质状态或相有四种:气体、液体、固体和等离子体。
无膜细胞器 (Membraneless organelle):没有膜结构限定的细胞区室。无膜细胞器通常由蛋白质和核酸组成,呈现多种物质状态。
相位分离 (Phase separation):相位分离反映了一种去混合的状态变化 (demixing transition),其中均匀且充分混合的溶液重新排列,使得不同的空间区域被不同浓度的物质占据。在最简单情况如二元混合体系(聚合物和溶液)中,相位分离产生高浓度区域和低浓度区域。在Flory-Huggins溶解理论中,与二元混合物相关的混合自由能变量是二元物质的作用参数(interdispersing term , x,原文单词,译者根据弗洛里-哈金斯溶液理论公式自主翻译,参数x表示高分子和溶剂作用的参数)。如果物质不互溶比低(x <0),则自由能低,组分将形成均匀的充分混合的溶液。如果物质不互溶比高(x>0),则自由能高,会出现分层明显的两相。
相变 (Phase transition):虽然相位分离是指初始均相溶液的分层,但相变描述了分子的相位或状态转变(例如,从液体到固体)。
固体 (Solid):虽然液体和固体都被称为凝聚态物质,但它们的组分组织方式和动力学系数不同。 无膜细胞器的物质状态可以是结晶的,半结晶的或液晶的,这取决于其空间有序性的程度和空间排序的定向性偏好。
1 介绍
Introduction
真核细胞由许多隔室或细胞器组成。这些细胞器负责执行特定的生物学功能,对细胞组分、代谢过程和信号传导途径起时空控制作用。例如,细胞核从物理上把转录与翻译分开,这使得真核生物形成原核生物中大部分不存在的一套复杂的转录后调控机制。其它有膜细胞器还有溶酶体,内质网和突触小泡。然而,细胞内还有不少缺乏分界膜的细胞器,它们是由蛋白质、核酸及其他分子组成的超分子组装体,如细胞核中的核仁、核斑点 (nuclear speckles),以及细胞质中的应激颗粒stress granules (SGs)、加工小体(processing bodies,P-bodies)、中心粒 (centriole)。这些大部分胞体在几十年前被发现,它们的结构也逐渐被解析。然而,关于这些胞体是如何形成的、为何形成、有着怎样的生理特征、如何促进生物功能等问题仍待探究。近年,跨学科研究手段的不断进步,推动了对它们的组织,分子特性和分子机制的深入了解,以上问题也开始得到解答。随着对驱动无膜细胞器形成的分子原理和理化动力的日益了解,可以更清晰阐明它们在各种细胞过程(如应激反应、基因表达调控和信号转导)中的多种功能。在过去的几年中,越来越多的证据表明无膜细胞器参与了衰老相关的疾病,如肌萎缩侧索硬化症(ALS)。这些发现创造了细胞生物学的新领域——专注于探索细胞物质是如何组织成有特定功能的无膜细胞器以及它们的失调如何导致疾病的产生。
在这篇综述中,我们探究了日渐火热的无膜细胞器研究现状,针对无膜细胞器相关的生物发生、组织结构、动力学及调节机制和功能提出了自己的见解,同时讨论了最近该领域的研究结果如何帮助我们解析衰老相关的疾病的分子机制,这可以为基于相位分离开发新型治疗策略奠定基础。最后,展望了未来的主要挑战以及未来几年需要解决的问题。
2 无膜细胞器通过相位分离形成
Membraneless Organelles Are Formed via Phase Separation
许多无膜细胞质和细胞核区室例如,P-bodies,SGs (stress granules),卵黄核 (the Balbiani body),胚芽颗粒 (germ granules),PML bodies,Cajal bodies,核斑点和核仁等已经研究了很长时间,然而,驱动它们形成的机制大多仍是未知的 (enigmatic,elusive 是比unknown更高规格来表示未知的词,适合多用,译者注,更多英语写作见https://mp.weixin.qq.com/s/37dMnfA6RTSybzkzKnambw)。一些早期研究强调了这些组件组装的动态特征。在2005年,有学者认为Cajal bodies表现为“悬浮在半流体核质中的半流体球”,然而,缺乏关于这些组件的物理性质的确切实验证据。2009年,Brangwynne,Jülicher和Hyman证明P颗粒 (Pgranules)(秀丽隐杆线虫胚胎中含有RNA和蛋白质的胞体)具有类似液体的特性,并证明了它是通过相位分离形成。这是一种物理过程,过饱和的组分溶液自发分离成密相和稀相两部分,然后稳定共存。P颗粒的类液体性质从它们的圆形外观(使表面张力最小化的结果)、可变形性(熔合和裂变事件)及组分的动态交换等特征中显现出来的。在此后两年,对核仁进行了类似的观察。液体本身不是“简单的液体”,而是一个具有特定含义的术语。“简单液体”,也称为范德华流体,包含通过各向同性短程电位相互作用形成的球形颗粒。蛋白质和RNA液相并不是均匀粘性的球形颗粒,它们更应被描述为缔合聚合物,并且由这种体系形成的液体具有独特的结构,这些结构由物理交联形成,从而具备一整套材料特性,包括空间组织液滴的可能性,其中一种聚合物润湿另一种聚合物。(Instead, they are best described as associative polymers and theliquids formed by such systems have distinctive structures that are defined byphysical crosslinks that give rise to a panoply of material properties,including the possibility of spatially organized droplets where one polymerwets another. 这一段不好翻译,附上原文)
相位分离是聚合物化学中常见的现象,不过,它在生物大分子中的应用是近期才出现的。前人研究发现,一些蛋白质(如血红蛋白),浓度高时在体外会发生相位分离,但这些结果的意义并不是很清楚。特别是晶体学家在结晶试验中经常观察到液-液相位分离。液滴形成降低了成核的自由能,因此是结晶实验中可预期的现象。然而,关于相位分离可能是控制无膜细胞器形成,调控生物功能和活性的认识是近几年才产生的。Rosen及其同事在2012年就这一观点提供了有力支持,他们发现含蛋白质和含RNA的结构可以从纯化的成分中重建;并进一步提供了证据表明这些重构的液体胞体可以促进肌动蛋白聚合物的成核。在这些开创性发现之后的几年中,人们逐渐认识到蛋白质和其他大分子(如RNA)可以形成充分混合或空间组织的凝聚物,并在不同的物质状态之间切换。无膜细胞器通常被称为生物分子缩合物,并且遵循与其他聚合物相同的物理原理(Box 1)。越来越多的数据支持这一过程中不同相变的多样性以及背后复杂的分子和物理相互作用。
Box 1 方框1. 无膜细胞器可以是液体,固体或凝胶
无膜细胞器通常被称为液体,但这种称号会让人联想到熟知的液体而产生混淆。值得注意的是,所有液体,甚至是由硬球体构成的所谓简单液体,都有明确定义的结构,并可以根据对关联函数 (pair-correlation functions)进行量化。这些函数表明,液体在长度尺度上采用有序排列,而非晶体固体似的排列,其尺寸数量级为典型的分子尺寸。在较长的尺度上,分子是随机组织的,其组织方式使人联想到稀释气体。非球形分子具有空间和方向顺序,水和其他分子液体(包括聚合物)也是。局部空间排序和分子间取向受不同空间幅度和方向的层级互作影响,例如远程静电,多极相互作用,氢键,力和涉及π(pi)-系统的短程相互作用。
在生物相位分离中,凝胶被认为是固体的同义词,凝胶化被认为是从液体转变为固体的过程。凝胶由分子间互作的系统网络形成,可以通过其组成型大分子的连通性来贯穿凝胶。如果凝胶具有长寿命的交联和高密度的交联,那么材料性质可以与固体的性质一致。相反,具有短寿命交联和/或低密度交联的凝胶将具有类似于液体的材料特性。
实际上,细胞器可以是液体、某种形式的固体、液体凝胶、固体凝胶、结晶固体、半结晶固体或液晶,这取决于空间排序的程度和排序的方向偏好。 为了给无膜细胞器合理的描述,必须至少测量以下5个指标,即:(i)液滴中的大分子浓度,以量化密度;(ii)分子间长程空间排序的程度,以量化液滴内的分子间组织;(iii)分子间物理交联的程度;(iv)液滴与其周围环境之间的界面张力;(v)生成和破坏液滴内键的时间尺度。 理想情况下,以上5种测量方式将分别对体外模拟的液滴和体内活细胞中相同条件下的液滴进行检测,以揭示体内外液滴的共性和差异。
ggplot2高效实用指南 (可视化脚本、工具、套路、配色)
3 体内外蛋白质相位分离的分子决定因素
Molecular Determinants of Protein Phase Separation In Vitro and In Cells
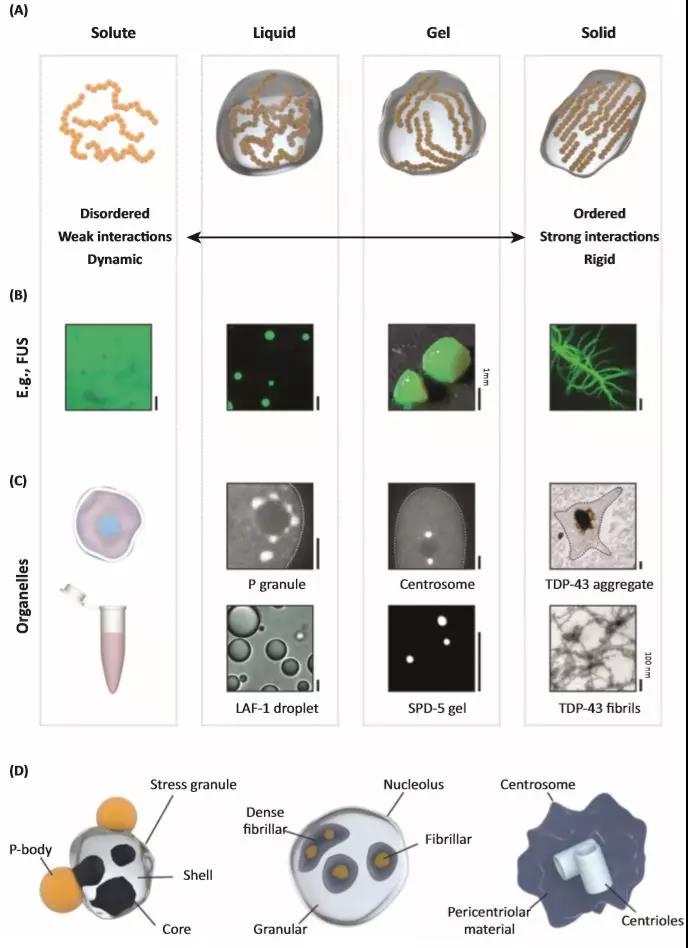
蛋白质组学和遗传学研究已经确定了几种无膜细胞器的蛋白质成分,这些研究表明,蛋白结合结构域和/或线性基序 (adhesive domains and/or linear motifs) 的多价性 (multivalency)是驱动蛋白质(或RNA分子)相变的关键。多价性可以通过以下三种方式中至少一种来实现:(i)具有特定互作界面的折叠蛋白质可以形成寡聚体,进而诱发相关元件的多价性 (associative patches),并参与空间特异性互作; (ii)折叠结构域可以通过柔性接头连接在一起产生线性多价蛋白质; (iii)内部无序区域(IDRs)可以作为多个独特的短线性基序的支架。当然,多价性也可以通过以上提到的三种方式组合或通过诸如无序区域内的结构形成等应激过程而出现。引起广泛关注的一个特征是驱动相变的蛋白质中存在IDRs(intrinsically disordered regions) 。无序区域的序列具有构象异质性(即无固定结构)被称为内部无序蛋白质/区域(IDPs/ IDRs)。大多IDRs具有氨基酸组成偏好性且可能是重复序列,因此,这些IDRs的特定子集也称为低复杂性域(LCDs)。富含IDRs / LCDs超分子组装体的形成会促进不同性质的无膜细胞器的形成(图1A-C)。一个典型的例子:IDRs、折叠结构域和核酸之间不同分子相互作用产生了一系列组装动力学特征。例如,卵母细胞中的Balbiani bodies是由β折叠相互作用结合在一的类固体状蛋白质组装;相反,许多RNA-蛋白(RNPs)颗粒是动态和类液体状的,并且遗传实验已经证明IDRs有助于它们的组装;已知RNA结合蛋白(RBPs)具有多价模块结构域,在相位分离中的起着关键作用(Box 2);通过柔性接头连接的含有多个相互作用结构域的工程蛋白在与其特定靶标相互作用时表现出自发的液-液分层。这些数据表明,这种“fuzzy”作用模式可以实现多价互作功能域之间的多种组合,这可能是蛋白质相变的通用驱动因子(Box 3)。
(A.物质状态和动态从液体到固体的广泛变化; B. 蛋白质FUS (渐冻人相关疾病蛋白)在体外可以具有所有的形态; C. 无膜细胞器机器体外重建实例;D.几个无膜细胞器展示。它们具有复杂的拓扑结构,包含可能属于不同状态的子隔室。 生物AI插图素材获取和拼装指导)
Box 2 方框2. 聚合物理论和多尺度模拟的见解
相变是一个协同转换过程,涉及来自多价蛋白质间相互作用模块的集体效应。这些多价蛋白可以进行凝胶化,从而形成物理交联的系统网络,其中交联是相关结构域/基序之间的非共价相互作用。蛋白质聚合物也可以通过密度转变缩合,从而形成与稀相共存的致密相。凝胶化的物理过程,更确切地说是溶胶-凝胶的转变,已被用于相关功能域/结合基序的效价对相变驱动的影响。相比之下,密度转变的物理特性解释了形状为球形的凝聚相的形成,并显示出许多与液体相同的特性。实际上,两种类型转变的物理特征协同作用共同促成了无膜细胞器的形成,即更熟知的生物分子缩合物的形成。
多价蛋白质是属于缔合聚合物的一类聚合物,它们可以通过相位分离或不经相位分离实现凝胶化。这里,效价(valence)是指在分子内部和分子间相互作用时互作的功能域/基序的有效数量。最近对缔合聚合物理论的计算机模拟和调整表明,多价蛋白质可以被解析成相关的结构域/基序,即所谓互作功能域(stickers, 粘着剂),并由间隔序列 (spacers)穿插。粘着剂能够实现物理交联,而间隔物 (spacers)或连接子 (linkers)决定是否通过相位分离驱动凝胶化。可溶性接头或间隔物抑制相位分离,而自缔合性或对溶解和结合无偏好的接头/间隔物将通过相位分离胶凝化。从理论,模拟和最近的实验中得出的关键结果发现,内部无序区域 (intrinsically disordered regions) (相变的决定因素)和液滴内蛋白质模块的密度和组织形式,是推动相变的关键作用。
生信宝典文章集锦,众多干货,有趣有料 (20180825版)
除了仅用作连接子之外,IDRs还可以调节“粘性”互作以促进相变。 McKnight及其同事发现,随着时间的推移,不同IDRs的浓缩液可以自发地形成水凝胶,类似于对含有FG-二氨基酸重复的核孔蛋白的观察结果。此后不久,Taylor及其同事发现了hnRNPA1和hnRNPA2B1的IDRs中的疾病突变,可以促进它们在体外加速组装成高级结构复合体。此外,这些突变体促进活细胞中SGs(应激颗粒)的自发形成和动力学显著降低。几个团队后续研究工作表明与疾病相关的IDRs蛋白质如hnRNPA1或融合肉瘤基因(Fusedin Sarcoma, FUS)可以形成液滴。这些发现引起了整个领域对IDRs在相位分离中的重要性和功能性的关注,为真核生物中众多的蛋白质无序区域存在的合理性提供了又一理论依据。
Box 3 方框3. 异质性对细胞器动力学的影响
核孔复合物在无序区域具有高频率和弱相互作用的FG基序,但在FRAP (Fluorescence recovery after photobleaching) 实验中核孔复合物表现出较长的恢复时间。需要考虑的是重复的基序或SLiM可能会产生一系列结合拓扑结构,从而产生大量的等能微观状态和更高的能量熵。这需要高度动态的连接序列(例如,IDRs)来实现结合位点之间的最小化耦合并实现多种排列。此外,弱亲和性的或非特异性的基序可以同时与多个靶位点相互作用,或甚至通过弱的短程作用与更多的配偶体结合。与一对一结合模型相反,阳离子-π(pi),π-π(pi-pi),芳香氢键和范德华相互作用通过替代靶点在不同程度上诱发多价基序之间结合方式的不确定性。基于数学理论的计算模拟实验表明,与一对一结合模型相比,部分异构交互可以将相界的形成难度降低一个数量级。从这个方面来说,高阶组件类似于先驱络合物 (encounter complex),它们有助于基序间高效的互作,同时实现快速重组装。这也意味着异质系统可以在较低的效价下经历相变。通过很大数目的结构状态生成不同的冗余交互模式。尽管意外,构象异质性也可以通过熵效应促进组装。这正与FUS组装过程中观察到的现象一致。总之,不只是组成蛋白的多价性,而且相互作用和结构异质性也可能是无膜细胞器组装和动力学的关键决定因素。由于这种异质性普遍存在于蛋白质相互作用中,因此无膜细胞器相关的分子驱动力可能与传统的蛋白质复合物和“低阶”组装没有根本的区别。
生信老司机以中心法则为主线讲解组学技术的应用和生信分析心得 - 限时免费
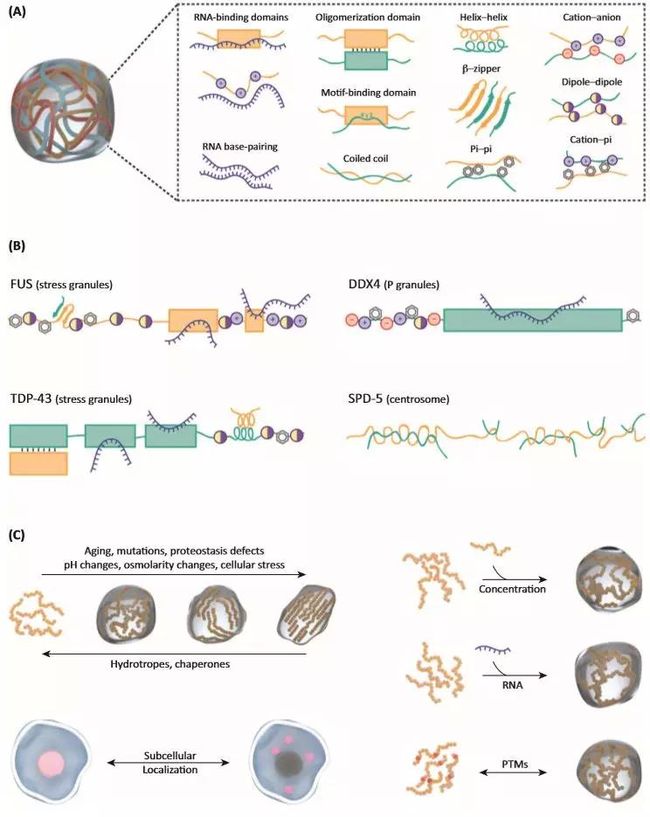
IDRs中的多价交互究竟是如何实现的?这些序列通常富含不带电荷的极性侧链(谷氨酰胺,天冬酰胺,甘氨酸,丝氨酸,脯氨酸),带电荷的氨基酸(精氨酸,赖氨酸,谷氨酸,天冬氨酸)或芳香族残基(苯丙氨酸和酪氨酸)。有趣的是,这些残基似乎不是在整个序列中随机分布的,而是常以短线性互作基序(short, linear interaction motifs, SLiM)、交互电荷块或简并重复序列的形式存在。IDRs的序列偏好性表明它们可能具有一系列驱动相变的作用力,可能包括静电,偶极-偶极,π-π(pi-pi),阳离子-π(pi),疏水和氢键相互作用等(图2 A,B)。突变研究表明,改变多种残基类型可以阻止不同LCDs的相位分离。此外,破坏交替电荷块和重复序列中的关键氨基酸突变也会干扰相位分离。
无膜细胞器通常含有核酸,尤其是RNA。此外,与无膜细胞器相关的蛋白质通常具有RNA结合结构域或结合基序,并且无膜细胞器中的RNA会促进各种RBPs的相位分离(图2C)。同时,若RNA/蛋白质的化学计量比值 (stoichiometries)高,也会抑制相位分离。RNA还调节无膜细胞器的成核和时空分布。即便是参与葡萄糖代谢的由蛋白质组成的G-bodies也需要借助RNA发挥生物活性。RNA也可以影响蛋白质液滴的材料特性。最近发现重复排列的RNA通过分子间碱基配对相互作用发生相位分离,再一次突出了多价性和结构多态性作为相位分离驱动因子的普遍性。(2018年6月Richard Young教授在Science发表超级增强子结合的相变文章 Coactivator condensation at super-enhancers links phase separation and gene control的,文章发现转录共激活因子BRD4和MED1可以在超级增强子处聚成液滴样的核斑,并且该聚合可被化学处理干扰。BRD4和MED1的IDR(intrinsically disordered regions,IDRs)区可形成相位分离液滴,进而区室化和富集转录机器,为超级增强子的转录调控在相变角度提供新的解释。从Richard Young教授的系列研究看超级增强子发现背后的故事 (附超级增强子鉴定代码))
4 无膜细胞器的物质形态:液体,水凝胶,团簇
Material States of Membraneless Organelles: Liquids, Hydrogels, and Aggregates
尽管目前科研人员已经对多种蛋白质在试管中进行了相位分离实验,但是目前关于体外或细胞内与这些相位分离状态相关的潜在分子机制还未达成共识。卵黄核 (Balbiani body)的相位分离依赖于稳定的淀粉样蛋白相互作用,而中心粒周物质 (pericentriolar material)和突触后致密物(postsynaptic density)是由形成螺旋卷曲的蛋白质之间的相互作用所介导。其它组装的机制则不明朗。为了更好的理解应激颗粒(SGs)的内部结构,科学家投入了大量的精力。SGs的形成被认为是细胞应激反应的一种形式——当细胞受到压力时SGs形成,但是是可逆的。Parker实验室最近的工作表明,仅基于试管实验来看,细胞中的情况可能远比我们想象的要复杂。SGs具有稳定的核心,可以抵抗稀释,这体现了SGs的非液体特性。尽管这一结果不能排除自发的相位分离和凝胶化相结合是形成SGs的路径之一,但数据表明,SGs的分解可能是迫使物质脱离kinetic traps的驱动过程。事实上,超分辨率显微镜和交联实验已经证实了SGs具有不稳定的液体外壳。这些结果指出了SGs有着复杂的内部结构,其他的无膜细胞器可能也是如此。
一些应激颗粒(SG)蛋白的错义突变会导致例如肌萎缩侧索硬化(ALS)等神经退行性疾病,并且突变型和野生型蛋白都会在神经元中聚集。SGs是动态组装形成的,它们的聚集物可能具有原纤维结构。 FUS和hnRNPA1是此类SG蛋白的实例,都具有长的,低复杂性的蛋白质区域,并且在ALS病人中发生了突变。McKnight及其同事的初步研究发现,这些无序的结构域可以形成可逆转的水凝胶,依赖于不稳定扭曲的 β折叠。有趣的是,胶凝/溶解的重复循环促进了水凝胶从可逆转凝胶向不可逆转凝胶的转变。通过对全长FUS和hnRNPA1或低复杂性区域形成的液滴的研究人们提出了不同的假想机制。低复杂性蛋白质区域在这样的液滴中,似乎保持其无序的倾向,这与它们的单体状态类似。然而,对于许多由低复杂性蛋白质区域形成的液滴,特别是在含有全长蛋白质的情况下,最终将发展为成熟纤维状固体聚集体。并且,ALS引起的突变可以提高成熟率。两种不稳定的凝胶和液体向固体的转变可以解释ALS中SGs向聚集体的病理转化,但它们与细胞SGs和聚集体的确切关系仍未确定。
5 特异性的产生与维持
How Is Specificity Generated and Maintained?
有趣的是,许多蛋白质同时存在于多个不同的无膜细胞器中。由于这些蛋白质在多价蛋白质中显著富集,因此不可避免地会出现什么决定了组装的特异性和完整性的问题:如何防止不同无膜细胞器的融合?如何维持无膜细胞器内的不同子隔室?(例如在核仁中:图1D)如何组装和控制核仁等多相系统?最近的研究表明,蛋白质液滴的表面张力差异可以介导这种多相液滴的形成。两个亚核区室的关键组分可以独立地发生相位分离,但所得的液滴具有不同的表面张力。当混合在一起时,这些液滴不会融合,而是以液滴内的液滴形式排列,这与核仁非常相似。这个例子揭示了一个更普遍的原则,可以作为解释其他无膜细胞器中多相行为的理论基础。
除了物理性质之外,颗粒组装的特异性可能源于蛋白质-蛋白质之间直接互作的特异性。经历相位分离的IDPs和蛋白质富含短线性互作基序(SLiM)和简并重复序列。它们都是蛋白-蛋白互作的主要参与区域 (图2A,B)(生信宝典之傻瓜式(四)蛋白蛋白互作网络在线搜索)。此外还可能与IDPs的其他特征有关,例如重复结合基序的数量和间隔(多价性),它们的翻译后修饰(PTM)或中间接头区域的动态变化 。非特异性静电相互作用,特别是与RNA的相互作用,对于液滴组装成核至关重要。并且不同的IDRs对离子强度变化的响应不同。尽管SLiMs具有一定程度的特异性,但多个SLiMs的加性效应可能共同决定了相变形成的组装复合体的物理特性和组成。
(A. 蛋白质相位分离中观察到的不同类型的接触; B. 相位分离蛋白的实例说明了多价性的重要性,高亮显示蛋白内的一系列互作模块; C. 调节蛋白质相位分离的物质状态和形成凝集核的不同机制。 高颜值可定制在线作图工具-第三版(操作更简单))
另外,无膜细胞器中的几种关键蛋白质具有可折叠的二聚或寡聚结构域。例如,G3BP1含有被SG(stress granules)靶向的可折叠二聚化结构域。类似的例子还有PML、Cajal bodies和核斑点 (nuclear speckles)。TDP-43可通过LCDs中的瞬变的α螺旋二聚化进行相位分离,并且可以通过折叠的N末端结构域进行多聚化(图2B)。这表明对于一些蛋白质,相位分离可以通过两种不同的机制发生。这两种机制是通过蛋白质结构生理的角度偶联在一起的。Brangwynne实验室的工作为这种装配机制提供了有说服力的证据。Shin等人使用植物来源的光诱导蛋白寡聚化结构域来提供驱动蛋白质-蛋白质相互作用的光遗传学研究途径。将该寡聚化结构域融合到已知驱动相位分离的LCDs产生的工程蛋白可在光刺激下在细胞中形成液滴。这些所谓的光液滴 (“optodroplets”)表明,特定的寡聚化结构域与LCDs的组合确实是介导特定细胞相变的有效机制。寡聚化结构域,卷曲螺旋 (colied-coils)和β-拉链 (β-zippers)可以提供驱动无膜细胞器形成所需的倍增粘性互作(图2B)。有趣的是,最近发现多种无序蛋白质富含不稳定的β-拉链区域,也就是推动FUS凝胶化的区域。
很明显,无膜细胞器和靶向细胞器的配体蛋白质的结构成分之间有明显的区别。然而,区分这些行为的确切分子特征目前仍然未知。对于某些组装体的偏好配体蛋白的选择可以简单地由隔室的组件引入的物理限制来介导 (Preference of client proteins for certain assemblies couldsimply be mediated by the physical restrictions introduced by the constituentcomponents of the compartment.)。蛋白质液滴/凝胶中的相互作用阵列产生具有特定网格尺寸的网络。通过允许网格尺寸以下的小分子自由扩散通过网络,同限制较大分子的进入,充当扩散屏障。另外,无膜细胞器可以锚定在空间中,从而防止扩散和融合。例如,聚集体 (Aggresomes, aggregation of misfolded proteins)是由细胞骨架在核周的错误折叠而形成的蛋白质沉积物,这阻止了错误蛋白在细胞内的扩散.
6 时空调节
Spatiotemporal Regulation
在试管中能自发进行相位分离的蛋白知道的越来越多,但是细胞是如何对这一过程进行精确控制的仍然令人费解。例如,几种RNA结合蛋白 (RBP) 在远高于其体外饱和浓度的细胞浓度下却完全可溶,但是他们只在特定条件下发生相变。简而言之,细胞如何能够避免自发和不可控的相位分离?这个问题与前面提到的相变特异性起源的观点密切相关。
不同实验室的工作都表明,丝氨酸和酪氨酸磷酸化、精氨酸甲基化和泛素化等都可以控制相位分离。重要的是,双特异性激酶DYRK3的活性被证明是SG (stress granules)溶解所必需的,这表明可能存在控制这些过程的细胞开关。有趣的是,易于发生相位分离的蛋白质似乎富含被翻译后修饰(PTM)的残基。实际上,蛋白的翻译后修饰(PTM)可以显著地改变这些IDRs/ LCDs的电荷或其他性质,从而将序列固有驱动力转变为相位分离(图2C)。
细胞控制相变的另一种方法是控制细胞浓度和细胞内物质分布(如介导相位分离的蛋白质的散在分布)(图2C)。hnRNPA1的细胞浓度高于其体外饱和浓度,但这些分子仍然可溶于细胞核的原因尚不清楚。阻断hnRNPA1的核输入,导致其在细胞质中的积累,从而致使 SGs (stress granules)的自发形成。并且,核转运因子本身就是SGs的组成部分,说明核质转运过程可能会以多种未知的方式控制相位分离。
由于RNA参与形成多个无膜细胞器,特定RNA种类的存在与否也可以在特定时空层面调节相位分离(图2C)。例如,非编码NEAT-1 RNA的表达对于散斑 (para-speckle)的形成是必需的。此外,细胞应激下的多聚核糖体解离促使细胞质包含更多游离mRNA,随后使SG (stress granules)成核。正常状态或应激响应被激活时,抑制多聚核糖体的解离都可以阻止SG的形成。此外,经典的应激颗粒标记物poly(A)结合蛋白(PAB1)在响应热应激时会发生相位分离,释放其结合的RNA。这表明翻译响应和SG形成之间存在复杂的关系。
7 疾病、病理及衰老
Disease, Pathology, and Aging
一些在神经退行性疾病中的关键蛋白是无膜细胞器的组件,因而这些组件的装配在形成、维持或清除过程中发生某些错误的调节可能导致病态聚合的形成。事实上在试管和细胞中持续数小时的观测发现,动态蛋白液滴及水凝胶会自发成熟化,形成固态聚合。此转换表明这种动态的装配可能具有亚稳定性或天然不稳定性,并且特定的细胞过程可阻止这种固化过程的发生(Figure 2C)。这种从液体到固体的相变可被疾病相关突变所促进,表明相变(phase transition)对于病理研究的重要性。这些疾病突变似乎靶向存在于内在无序区(intrinsically disordered regions,IDRs)的β拉链结构域,使其更加倾向于折叠为稳定的淀粉样结构。值得注意的是,目前还没有直接的证据表明在病人的大脑中,病态的蛋白质聚集是由应激颗粒(stress granules, SGs)或其他无膜细胞器的凝固化造成的。
疾病突变也可能通过产生异常的蛋白质和RNA种类来影响相位分离。在这方面,重复序列扩增导致的功能异常尤其有趣。其中的一些异常包括重复RNA位点的形成,后者可捕获RNA结合蛋白,导致其功能丧失。有趣的是,这种RNA重复序列自身可通过多碱基配对进行相位分离,与病人体内观察到的现象一致。此外,一些RNA重复序列可翻译并产生有重复序列的多肽。例如,引发肌萎缩侧索硬化症的GGGGCC序列重复可产生不同的二肽重复序列。其中的两个被称为甘氨酸——精氨酸、脯氨酸——精氨酸的二肽重复序列,定位于不同的无膜细胞器,包括应激颗粒体(SGs)。包含这些致病肽段的SGs (stressgranules)有较小的动态性,而且还招募了一些易于产生聚集的蛋白质,如TDP-43。
SGs (stress granules)的清除依赖于自噬。自噬基因的突变是导致各种疾病的原因,包括肌萎缩侧索硬化。另外自噬作用也随着年龄的增长而变弱。除了自噬之外,分子伴侣也都参与了保持SG (stress granules)的易变性和可清除性。这些观察结果表明,细胞若无法对这些程序进行严格控制可能导致病理聚合。核转运也因年龄老化而衰退,并且越来越多地被发现参与到蛋白质聚集引起的疾病中。
线粒体功能紊乱是衰老和神经退化的基础,因其可能会导致ATP水平下降,从而影响无膜细胞器的调节。大量的SG (stress granules)蛋白含有ATP酶结构域,并且降低细胞的ATP水平会降低细胞器的动态特性。另外,有证据表明,细胞ATP可以作为化学助溶物直接阻止相位分离和聚合。ATP的这个特征独立于它在激活细胞进程中提供能量的作用。因此在老化和疾病中,线粒体呼吸功能的缺陷可能促进蛋白质聚集,要么通过整体地减少细胞ATP水平,要么是由于依赖ATP的可维持无膜细胞器流动性的生物通路的损伤导致的。
蛋白翻译后修饰(PTMs)在相位分离调节中具有重要作用,并且值得注意的是,一些病理蛋白质聚集显示了特定的PTM特征。例如,Tau磷酸化(Tau phosphorylation)是阿尔茨海默病(ALS)病理的一个标志。有趣的是,tau磷酸化促进了体外的聚合和相位分离。
尽管蛋白质聚集和相变大多是在神经退行性疾病的背景下进行研究的,但它们与各种各样的病理条件有关,包括病毒感染和癌症。与神经退化相关的一些关键蛋白质也与不同类型的癌症有关联。例如,在ALS中参与应激颗粒 (SG)靶向和聚合的FUS蛋白(一个RNA结合蛋白)的低复杂域(low-complexity domains, LCD)已被证明在脂肪肉瘤中发生了致癌融合。事实上,癌症相关的融合蛋白通常富含无序的低复杂性功能域,表明这可能是一种常见的机制。FUS蛋白的低复杂区域的转录激活潜力,以及它的人类同源物EWSR1和TAF15蛋白(三者在一个癌症家族中有关联)的转录激活潜力,与它们在体外的水凝胶结合能力以及招募聚合酶II的C端区域到所在水凝胶的能力高度相关。FUS蛋白的低复杂域和它的同源基因介导转录激活的机制虽然还不清楚,但被认为是与相位分离过程有关的。此外,增加的SG (stress granules)和旁斑(paraspeckle)的形成与癌症存活的预后率低有关。最近的研究发现,肿瘤抑制基因p53的聚合导致其功能丧失,是癌症的主要机制,而阻止其聚合的化合物在临床前动物模型实验中取得了成功。(生信宝典之傻瓜式(六)查找转录因子的靶基因)
SGs也参与到抗病毒的应激反应中,并且病毒已经进化出了许多干扰SG装配的方法。此外,一些病毒,如虫媒病毒 (flaviviruses),包括寨卡病毒,甚至劫持了SG蛋白来辅助自身的复制。尽管还处于起步阶段,但由于蛋白质聚集和相位分离与许多人类病理状态相关,因此更好地理解这些过程将帮助在更广阔的人类医学领域中发展新的治疗策略。
8 通向新的治疗途径
Road Toward Novel Therapy?
如前所述,我们提出蛋白质相位分离与病理蛋白聚集和疾病密切相关的假说。但只有在彻底理解了背后的调控机制并研发出新的疾病治疗方式后,才能说明该假说的成立。细胞的相变可以被干扰疏水或极性相互作用的不同化学物质所调控。然而,这种非定向化合物可以靶向细胞中的大部分无膜细胞器,可能并不是疾病治疗的最佳选择。
反义寡核苷酸(Antisense oligonucleotides, ASOs)提供了一个可能合适的可选方法,可特异性地敲低异常相变中的关键参与者。虽然针对病理蛋白的ASOs在不同的小鼠模型中取得了成功,但其应用仅限于非致死性(non-essential)蛋白。对于致死性蛋白,ASOs可以靶向其非致死性的功能分子伴侣,进而调节相变。以ALS模型中致死性蛋白TDP-43为例说明该方法的可行性。Ataxin-2已在动物模型和人中被确认为是ALS疾病的调节因子。随后的研究表明,Ataxin-2直接招募TDP-43到SGs,这为它促进TDP-43的聚集提供了一种机制解释。与TDP-43敲低不同,Ataxin-2的敲低(KD)在小鼠中耐受良好。确信的是,ALS小鼠模型中敲低Ataxin-2降低了小鼠脊髓中TDP-43聚集物的数量,显著延长了存活率。类似的,敲低与Tau相互作用的SG蛋白Tia-1可在培养的神经元和啮齿动物模型中抑制Tau病理和毒性。这些研究充分表明,通过ASO技术靶向相变是阻止TDP-43和Tau蛋白病理性聚集的可行策略,也可能适用于其他蛋白聚集性疾病的治疗。(R语言学习 - 非参数法生存分析)
最后,考虑到蛋白质的聚集和相位分离受到细胞蛋白质降解及分子伴侣机制的严格控制,目前的工作重点是寻找能上调这些通路的药物,或产生能拮抗病理相变的强效工程学解聚分子。阐明蛋白的相位分离的复杂调控机制将是识别新通路的关键,进而靶向新通路矫正病理性相变。
9 结束语
Concluding Remarks
近年来,关于大量细胞器是通过相位分离形成的认识越来越清晰。虽然这些细胞器已经被研究了几十年(或者如核仁,已经研究了一个多世纪),但它们的动态性质及这种动态性与无膜细胞器的形成、功能和生理病理的关系直到最近才被揭示。利用聚合化学的先进技术优势,在快速发展的细胞生物学领域中,对无膜细胞器的认识有了显著的提高,并开发了进一步探索其潜在生物物理学行为机制的新方法。毋庸置疑,这些新发现已经为靶向人类疾病发生中的异常蛋白相变提供了新的思路。此外,了解序列和所产生的物质状态之间的关系也可能促进产生新的合成生物学材料。
然而我们必须充分意识到,我们还远未完全了解无膜细胞器背后的复杂生物学机制以及它们的功能与作用。为此列出了我们认为仍未解决的关键问题(见OutstandingQuestions)清单。解决这些问题对于进一步深入了解蛋白质的相位分离是至关重要的。开发新的分子生物学和细胞生物学工具是完成这个目标所必须的。目前,无膜细胞器的纯化和高分辨率结构研究仍是一个瓶颈,特别是在活体细胞环境中。只有开发出特异性地靶向单个颗粒体的工具,我们才能将这些颗粒体用于新的疾病治疗,并将我们的基本生物学知识应用于临床。蛋白质的相位分离还没有展示出其所有的奥秘,一个令人兴奋的未来即将到来。
Box 4 方框4. 无膜细胞器的功能是什么?
许多蛋白质似乎已经进化出驱动无膜细胞器形成或被募集到无膜细胞器的能力。然而为什么细胞需要这样的结构?他们的生化功能是什么?令人惊讶的是,这些问题基本上没有答案。
不同形式和尺度的区室划分在生物体广泛存在。 我们的胃是一个功能确定的器官,它只有一个主要目的,即通过酸水解消化食物。显然,如果身体能把食物和酸都集中到一个单独隔室中,化学反应进展更顺畅。 另外,这种区室可以保护其他器官免暴露于酸环境中。 同样,我们的细胞也进化出一种惊人相似的机制,如溶酶体产生酸性隔室以降解细胞废物。 通过膜屏障,溶酶体可以浓缩反应组分,同时保护细胞的其余部分免受伤害。器官-细胞器水平相对应的另一个例子是脂肪组织和脂滴,他们以脂质的形式储存能量供以后使用。 此外,身体和细胞可以通过区室化信号接收放大来自环境的信号:眼睛将入射光聚焦到富含光接收器的视网膜上。在亚细胞水平上,神经元也将它们的受体集中在不同的子结构中,即突触。
从以上类比中,可发现区室化的四个主要功能,即:(i)浓缩(生)化反应的成份;(ii)隔离有害成分;(iii)生物分子的储存;(iv)信号放大。有趣的是,所有这些功能都存在于无膜细胞器领域。首先,通过相位分离浓缩细胞骨架组分促进它们成核变为丝状物,并且类似地,剪接也是通过mRNA上的剪接因子的多价组装来控制的。其次,虽然疾病中的蛋白质聚集体被认为是有害的,但越来越多的证据表明它们也可能是细胞最初的拯救机制–隔离毒性更高的蛋白质寡聚体。第三,许多组件起到储存颗粒的作用,因为它们在面对应激或静息状态时可隔离蛋白质和其他生物分子,以便以后再次使用。第四,通过浓缩受体和信号分子,细胞可以放大某些信号传导途径。鉴于此,不同的膜受体可通过蛋白质相位分离实现这个功能。
虽然我们还没有完全揭示细胞中相位分离的复杂功能,但这些例子让我们大致了解了为什么细胞可以受益于无膜细胞器的形成。
教育部推出首批490门“国家精品在线开放课程”
蛋白结构预测、可视化、分子对接简明教程 1-4系列
10 重点问题
Outstanding Questions
相位分离确切的生物学功能是什么?为什么细胞会进化产生无膜细胞器?是什么让液体/凝胶组成在功能上与经典蛋白质复合物不同?
我们对驱动相位分离的物理动力有了基本的了解,但在原子水平对互作的的深入了解会帮助更好地理解这些相变的机制。
不同无膜细胞器的必须和非必须组成部分是什么,它们的序列和结构特性是什么?
尽管有一些例子,但我们对细胞中相位分离的时空调节机制知之甚少。这将是理解生物学如何调节物理学的关键。涉及哪些调控通路?
目前无膜细胞器组成的特异性程度的认知和预测完全不清楚。如什么介导蛋白质和RNA形成特定相,以及什么阻止了不同的无膜细胞器的聚结?
虽然在体外试管中确定胞体颗粒的内部结构方面取得了一些进展,但缺乏在活细胞中研究该问题的工具。即如何在体内研究无膜细胞器的内部组织?
生理和病理组装有什么区别?哪些因子驱动病变?
疾病突变和衰老如何特异性地影响无膜细胞器成分的相位分离?相关的分子事件有哪些?
为什么与蛋白质聚集相关的疾病会显示出如此明显的细胞类型特异性?什么使(特定)神经元对蛋白质稳态中的干扰特别敏感?
原文:Protein Phase Separation: A NewPhase in Cell Biology
翻译:凌路頔 刘晋芸 宋红卫
文章原文: http://blog.genesino.com/2018/08/phase/
教程合集
- 生信宝典-Linux教程.pdf
- 生信宝典Py3_course.pdf
- 生信宝典-R学习教程.pdf
系列教程
- 生物信息之程序学习
- 关于编程学习的一些思考
- 该如何自学入门生物信息学
- 如何优雅的提问
- 生信宝典视频教程
- 好色之旅-画图三字经
- 转录组分析的正确姿势
- 生信的系列教程
- 生信的系列书籍
- 文章用图的修改和排版 (1)
- 文章用图的修改和排版 (2)
- 简单强大的在线绘图
- 简单强大的在线绘图-升级版
- 论文图表基本规范
- 学术图表的基本配色方法