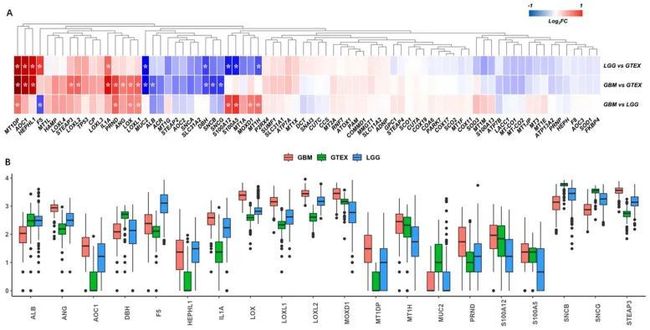
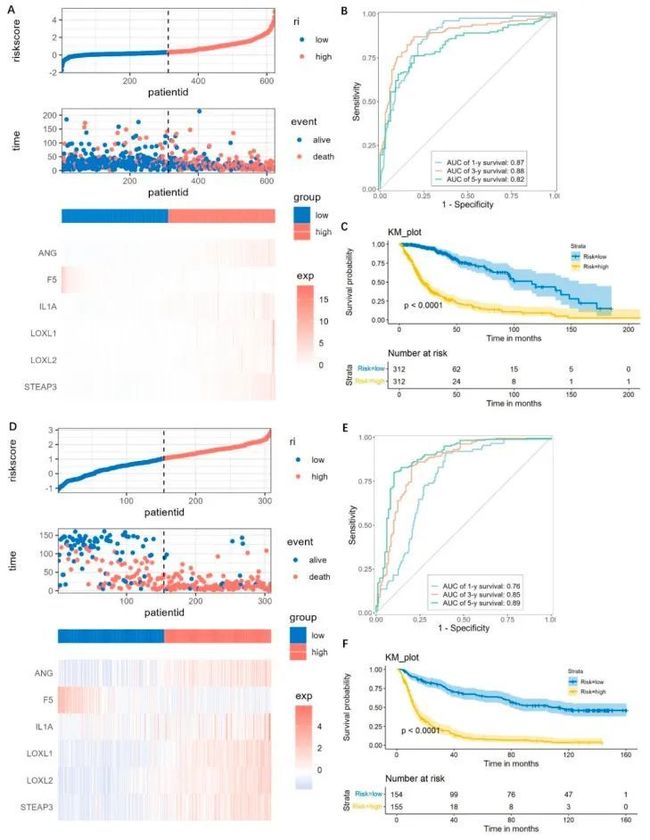
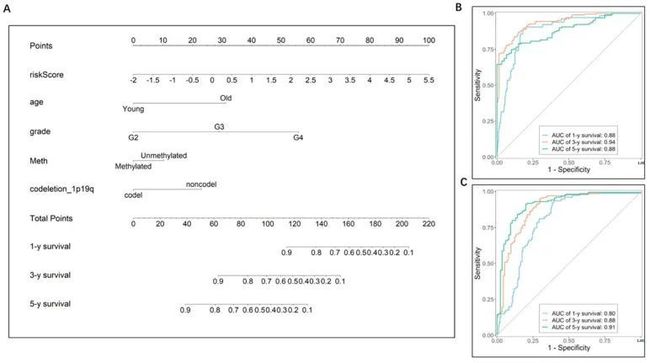
- [论文阅读] 软件工程 | 探索软件生态系统中的开发者体验关键因素
探索软件生态系统中的开发者体验关键因素:从研究到实践引文格式@article{Zacarias2025,title={ExploringDeveloperExperienceFactorsinSoftwareEcosystems},author={Zacarias,RodrigoOliveiraandAntunes,L{\'e}oCarvalhoRamosandBarros,M{\'a}rciod
- Fast Image Deconvolution using Hyper-Laplacian Priors论文阅读
青铜锁00
#退化论文阅读论文阅读图像处理
FastImageDeconvolutionusingHyper-LaplacianPriors1.论文的研究目标与实际意义2.论文的创新方法2.1核心框架:交替最小化(AlternatingMinimization)2.2x子问题:频域FFT加速2.3w子问题:高效求解的核心创新2.3.1问题形式2.3.2查找表法(LUT)2.3.3解析解法(特定α\alphaα)2.3.4通用α\alphaα
- [论文阅读] 人工智能 + 软件工程 | AI 与敏捷开发的破局之路:从挫败到成功的工作坊纪实
张较瘦_
前沿技术论文阅读人工智能软件工程
AI与敏捷开发的破局之路:从挫败到成功的工作坊纪实论文信息arXiv:2506.20159AIandAgileSoftwareDevelopment:FromFrustrationtoSuccess–XP2025WorkshopSummaryTomasHerda,VictoriaPichler,ZheyingZhang,PekkaAbrahamsson,GeirK.HanssenSubjects:
- Diff-Retinex: Rethinking Low-light Image Enhancement with A Generative Diffusion Model 论文阅读
钟屿
论文阅读人工智能深度学习学习图像处理计算机视觉
Diff-Retinex:用生成式扩散模型重新思考低光照图像增强摘要本文中,我们重新思考了低光照图像增强任务,并提出了一种物理可解释的生成式扩散模型,称为Diff-Retinex。我们的目标是整合物理模型和生成网络的优点。此外,我们希望通过生成网络补充甚至推断低光照图像中缺失的信息。因此,Diff-Retinex将低光照图像增强问题表述为Retinex分解和条件图像生成。在Retinex分解中,我
- 【论文阅读】人工智能在直升机航空电子系统中的应用
肥鼠路易
论文阅读人工智能航空电子系统应用
人工智能在直升机航空电子系统中的应用论文摘要文章结构参考文献论文摘要论文摘要:在现代战争形势日趋信息化、智能化的背景下,将人工智能应用于武器装备已经是大势所趋。针对直升机飞行任务的特征,对其发展状况进行了描述,并对其作业能力进行了分析,探索了人工智能技术在直升机航电系统中的应用方向,为推进人工智能在直升机上的转化与应用奠定基础。通过对国外先进直升机智能技术的运用现状及对其作业能力的要求进行分析,探
- [论文阅读] 人工智能+软件工程 | 用大语言模型架起软件需求形式化的桥梁
张较瘦_
前沿技术人工智能论文阅读软件工程
用大语言模型架起软件需求形式化的桥梁:一篇ACM调查草案的深度解读论文信息arXiv:2506.14627ACMSurveyDraftonFormalisingSoftwareRequirementswithLargeLanguageModelsArshadBeg,DiarmuidO’Donoghue,RosemaryMonahanComments:22pages.6summarytablesSu
- Reti-Diff: Illumination Degradation Image Restoration with Retinex-based Latent Diffusion Model论文阅读
青铜锁00
深度学习论文阅读#退化论文阅读
Reti-Diff:IlluminationDegradationImageRestorationwithRetinex-basedLatentDiffusionModel1.研究目标与实际意义1.1研究目标1.2实际意义2.创新方法与模型设计2.1整体框架2.2RetinexPriorExtraction(RPE)模块2.2.1Retinex分解2.2.2先验压缩2.3Retinex-guide
- SIMPL论文阅读
ZHANG8023ZHEN
论文阅读
论文链接:https://arxiv.org/pdf/2402.02519文章还没细看,但主要贡献点应该是SymmetricFusionTransformer和Bezier-basedMotionDecoder.对Bezier-basedMotionDecoder比较感兴趣,之后对这块细看一下
- 【论文阅读笔记】《CodeS: Towards Building Open-source Language Models for Text-to-SQL 》
柠石榴
text2sql论文论文阅读笔记语言模型
文章目录一、论文基本信息1.文章标题2.所属刊物/会议3.发表年份4.作者列表5.发表单位二、摘要三、解决问题四、创新点五、自己的见解和感想六、研究背景七、研究方法模型实验数据评估指标八、总结九、相关重要文献一、论文基本信息1.文章标题CodeS:TowardsBuildingOpen-sourceLanguageModelsforText-to-SQL2.所属刊物/会议未明确标注(会议缩写为“C
- agentformer论文阅读
ZHANG8023ZHEN
论文阅读
参考了这篇博文:https://zhuanlan.zhihu.com/p/512764984主要有这几个部分a.map_encoderi.对地图进行CNNb.ContextEncoderi.timeencoder–将时间信息用transformer和positionemb进行融合,加入到特征中ii.agent-awareattention–self和selfattentionother和other
- 【论文阅读】DynamicControl :一种新的controlnet多条件控制方法
prinTao
pytorchDiffusion论文阅读
背景现有方法要么处理条件效率低下,要么使用固定数量的条件,这并不能完全解决多个条件的复杂性及其潜在冲突。这强调了需要创新方法来有效管理多种条件,以实现更可靠和详细的图像合成。为了解决这个问题,我们提出了一个新的框架DynamicControl,它支持不同控制信号的动态组合,允许自适应选择不同数量和类型的条件。本文方法从一个双循环控制器开始,它通过利用预先训练的条件生成模型和判别模型为所有输入条件生
- 论文阅读:2018 arxiv CrowdHuman: A Benchmark for Detecting Human in a Crowd
CSPhD-winston-杨帆
论文阅读
https://www.doubao.com/chat/9226473480559618https://arxiv.org/pdf/1805.00123CrowdHuman:ABenchmarkforDetectingHumaninaCrowd文章目录论文翻译CrowdHuman:用于检测人群中人体的基准摘要1.引言2.相关工作2.1.人体检测数据集2.2.人体检测框架。论文翻译CrowdHuma
- 论文阅读:arxiv 2025 OThink-R1: Intrinsic Fast/Slow Thinking Mode Switching for Over-Reasoning Mitigation
CSPhD-winston-杨帆
论文阅读
总目录大模型安全相关研究:https://blog.csdn.net/WhiffeYF/article/details/142132328https://www.doubao.com/chat/8815924393371650https://arxiv.org/pdf/2506.02397#page=17.09OThink文章目录速览研究背景与问题核心思路与方法实验结果结论与意义速览这篇论文聚焦于
- 论文阅读:arxiv 2025 Not All Tokens Are What You Need In Thinking
总目录大模型安全相关研究:https://blog.csdn.net/WhiffeYF/article/details/142132328https://arxiv.org/pdf/2505.17827https://www.doubao.com/chat/8814790364572162文章目录速览研究背景提出的解决方案:条件token选择(CTS)实验结果核心贡献研究局限总结速览这篇论文主要探
- [论文阅读]PIDNet: A Real-time Semantic Segmentation Network Inspired by PID Controllers
颜笑晏晏
论文阅读
1.摘要双分支网络结构已显示出其对实时语义分割任务的效率性和有效性。然而,低级细节和高级语义的直接融合将导致细节特征容易被周围上下文信息淹没,即本文中的超调(overshoot),这限制了现有两个分支模型的准确性的提高。在本文中,我们在卷积神经网络(CNN)和比例积分微分(PID)控制器之间架起了桥梁,并揭示了双分支网络只是一个比例积分(PI)控制器,当然也会存在类似的超调问题。为了解决这个问题,
- [论文阅读] 人工智能+软件工程 | 用 LLM + 静态代码分析自动化提升代码质量
张较瘦_
前沿技术论文阅读人工智能软件工程
用LLM+静态代码分析自动化提升代码质量论文信息AugmentingLargeLanguageModelswithStaticCodeAnalysisforAutomatedCodeQualityImprovements@article{abtahi2025augmenting,title={AugmentingLargeLanguageModelswithStaticCodeAnalysisfo
- 经典论文阅读《A Framework for Unifying Reordering Transformations》《统一重排序变换的框架》
好好学习啊天天向上
自动性能优化
1)摘要我们提出了一个用于统一迭代重排序变换的框架,这些变换包括循环交换、循环分布、倾斜、分块、索引集拆分和语句重排序。该框架基于这样一种思想:变换可以表示为将原始迭代空间映射到新迭代空间的调度。框架旨在为变换提供一种统一的表示和推理方式。作为框架的一部分,我们提供了辅助构建和使用调度的算法,特别是用于检验调度合法性、对齐调度以及为调度生成优化代码的算法。2)优化编译器会对语句的迭代进行重新排序,
- [论文阅读] 系统架构 | 零售 IT 中的微服务与实时处理:开源工具链与部署策略综述
张较瘦_
前沿技术论文阅读大数据零售
零售IT中的微服务与实时处理:开源工具链与部署策略综述论文信息MicroservicesandReal-TimeProcessinginRetailIT:AReviewofOpen-SourceToolchainsandDeploymentStrategiesAaditaaVashisht(DepartmentofInformationScienceandEngineering,RVCollege
- [论文阅读]人工智能 | CoMemo:给大视觉语言模型装个“图像记忆”
张较瘦_
前沿技术人工智能论文阅读语言模型
【论文速览】CoMemo:给大视觉语言模型装个“图像记忆”论文信息Liu,S.,Su,W.,Zhu,X.,Wang,W.,&Dai,J.(2025).CoMemo:LVLMsNeedImageContextwithImageMemory.arXivpreprintarXiv:2506.06279.一、研究背景:当LVLMs遇到“视觉健忘症”想象一下,你在阅读一本图文并茂的小说时,随着文字篇幅越来越
- [论文阅读] 人工智能+软件工程 | 结对编程中的知识转移新图景
张较瘦_
前沿技术人工智能软件工程结对编程
当AI成为编程搭档:结对编程中的知识转移新图景论文信息论文标题:FromDeveloperPairstoAICopilots:AComparativeStudyonKnowledgeTransfer(从开发者结对到AI副驾驶:知识转移的对比研究)作者及机构:AlisaWelter等来自德国萨尔兰大学,ChristofTinnes同时隶属于西门子公司发表平台:arXiv预印本平台发表时间:2025年
- 【论文阅读笔记】HaDes幻觉检测benchmark
zsq
论文分享论文阅读笔记NLP大语言模型幻觉
0论文信息题目:AToken-levelReference-freeHallucinationDetectionBenchmarkforFree-formTextGeneration作者:TianyuLiu,YizheZhang,ChrisBrockett,YiMao,ZhifangSui,WeizhuChen,BillDolan会议:ACL,2022链接:https://arxiv.org/ab
- 论文阅读:Enhancing Retrieval and Managing Retrieval: A Four-Module Synergy for Improved Quality and Ef
clvsit
RAG论文阅读LLM
检索增强生成(RAG)技术利用大型语言模型(LLM)的上下文学习能力,生成更准确、更相关的响应。RAG框架起源于简单的“检索-阅读”方法,现已发展成为高度灵活的模块化范式。其中一个关键组件——查询重写模块,通过生成搜索友好的查询来增强知识检索。这种方法能使输入问题与知识库更紧密地结合起来。作者的研究发现了将QueryRewriter模块增强为QueryRewriter+的机会,即通过生成多个查询来
- 论文阅读:HySCDG生成式数据处理流程
论文地址:TheChangeYouWantToDetect:SemanticChangeDetectionInEarthObservationWithHybridDataGenerationAbstract摘要内容介绍问题背景“Bi-temporalchangedetectionatscalebasedonVeryHighResolution(VHR)imagesiscrucialforEarth
- [论文阅读] 人工智能 | 搜索增强LLMs的用户偏好与性能分析
张较瘦_
前沿技术人工智能论文阅读
【论文解读】SearchArena:搜索增强LLMs的用户偏好与性能分析论文信息作者:MihranMiroyan,Tsung-HanWu,LoganKing等标题:SearchArena:AnalyzingSearch-AugmentedLLMs来源:arXivpreprintarXiv:2506.05334v1,2025一、研究背景:当LLMs需要“上网查资料”时,我们如何评估它?想象你在问AI
- [论文阅读] 人工智能 | 如何快速检测LLM生成的代码?这篇论文提出了一个巧妙的方法
张较瘦_
前沿技术人工智能论文阅读
如何快速检测LLM生成的代码?这篇论文提出了一个巧妙的方法论文引文格式@misc{ashkenazi2025zero,title={Zero-ShotDetectionofLLM-GeneratedCodeviaApproximatedTaskConditioning},author={MaorAshkenaziandOfirBrennerandTalFurmanShohetandEranTrei
- [论文阅读] 人工智能+软件工程 | 理解GitGoodBench:评估AI代理在Git中表现的新基准
张较瘦_
前沿技术论文阅读人工智能软件工程
理解GitGoodBench:评估AI代理在Git中表现的新基准论文信息GitGoodBench:ANovelBenchmarkForEvaluatingAgenticPerformanceOnGitTobiasLindenbauer,EgorBogomolov,YaroslavZharovCiteas:arXiv:2505.22583[cs.SE]研究背景:当AI走进开发者的协作工具箱在软件开发
- [论文阅读] 人工智能+软件工程(软件测试) | 当大语言模型遇上APP测试:SCENGEN如何让手机应用更靠谱
张较瘦_
前沿技术人工智能论文阅读软件工程
当大语言模型遇上APP测试:SCENGEN如何让手机应用更靠谱?一、论文基础信息论文标题:LLM-GuidedScenario-basedGUITesting(《大语言模型引导的基于场景的GUI测试》)作者及机构:ShengchengYu等(德国慕尼黑工业大学、南京大学、同济大学等)发表来源:IEEETransactionsonSoftwareEngineering(IEEE软件工程汇刊)发表时间
- [论文阅读] 人工智能+软件工程 | 用大模型优化软件性能
张较瘦_
前沿技术论文阅读人工智能软件工程
用大模型优化软件性能?这篇论文让代码跑出新速度!arXiv:2506.01249SysLLMatic:LargeLanguageModelsareSoftwareSystemOptimizersHuiyunPeng,ArjunGupte,RyanHasler,NicholasJohnEliopoulos,Chien-ChouHo,RishiMantri,LeoDeng,KonstantinLäuf
- Enhanced Sparse Model for Blind Deblurring论文阅读
青铜锁00
#退化论文阅读论文阅读图像处理
EnhancedSparseModelforBlindDeblurring1.研究目标与意义1.1研究目标1.2实际意义与产业价值2.论文提出的新思路、方法及模型2.1增强稀疏模型(EnhancedSparseModel,lel_ele)模型定义与数学表达闭式解与稀疏性增强机制2.2改进的噪声建模策略噪声拟合函数的构建空间随机性建模2.3整体优化框架与半二次分裂法目标函数设计优化步骤拆分参数设置与
- [论文阅读] 人工智能+软件工程 | MemFL:给大模型装上“项目记忆”,让软件故障定位又快又准
张较瘦_
前沿技术论文阅读人工智能软件工程
【论文解读】MemFL:给大模型装上“项目记忆”,让软件故障定位又快又准论文信息arXiv:2506.03585ImprovingLLM-BasedFaultLocalizationwithExternalMemoryandProjectContextInseokYeo,DuksanRyu,JongmoonBaikSubjects:SoftwareEngineering(cs.SE)一、研究背景:
- 强大的销售团队背后 竟然是大数据分析的身影
蓝儿唯美
数据分析
Mark Roberge是HubSpot的首席财务官,在招聘销售职位时使用了大量数据分析。但是科技并没有挤走直觉。
大家都知道数理学家实际上已经渗透到了各行各业。这些热衷数据的人们通过处理数据理解商业流程的各个方面,以重组弱点,增强优势。
Mark Roberge是美国HubSpot公司的首席财务官,HubSpot公司在构架集客营销现象方面出过一份力——因此他也是一位数理学家。他使用数据分析
- Haproxy+Keepalived高可用双机单活
bylijinnan
负载均衡keepalivedhaproxy高可用
我们的应用MyApp不支持集群,但要求双机单活(两台机器:master和slave):
1.正常情况下,只有master启动MyApp并提供服务
2.当master发生故障时,slave自动启动本机的MyApp,同时虚拟IP漂移至slave,保持对外提供服务的IP和端口不变
F5据说也能满足上面的需求,但F5的通常用法都是双机双活,单活的话还没研究过
服务器资源
10.7
- eclipse编辑器中文乱码问题解决
0624chenhong
eclipse乱码
使用Eclipse编辑文件经常出现中文乱码或者文件中有中文不能保存的问题,Eclipse提供了灵活的设置文件编码格式的选项,我们可以通过设置编码 格式解决乱码问题。在Eclipse可以从几个层面设置编码格式:Workspace、Project、Content Type、File
本文以Eclipse 3.3(英文)为例加以说明:
1. 设置Workspace的编码格式:
Windows-&g
- 基础篇--resources资源
不懂事的小屁孩
android
最近一直在做java开发,偶尔敲点android代码,突然发现有些基础给忘记了,今天用半天时间温顾一下resources的资源。
String.xml 字符串资源 涉及国际化问题
http://www.2cto.com/kf/201302/190394.html
string-array
- 接上篇补上window平台自动上传证书文件的批处理问卷
酷的飞上天空
window
@echo off
: host=服务器证书域名或ip,需要和部署时服务器的域名或ip一致 ou=公司名称, o=公司名称
set host=localhost
set ou=localhost
set o=localhost
set password=123456
set validity=3650
set salias=s
- 企业物联网大潮涌动:如何做好准备?
蓝儿唯美
企业
物联网的可能性也许是无限的。要找出架构师可以做好准备的领域然后利用日益连接的世界。
尽管物联网(IoT)还很新,企业架构师现在也应该为一个连接更加紧密的未来做好计划,而不是跟上闸门被打开后的集成挑战。“问题不在于物联网正在进入哪些领域,而是哪些地方物联网没有在企业推进,” Gartner研究总监Mike Walker说。
Gartner预测到2020年物联网设备安装量将达260亿,这些设备在全
- spring学习——数据库(mybatis持久化框架配置)
a-john
mybatis
Spring提供了一组数据访问框架,集成了多种数据访问技术。无论是JDBC,iBATIS(mybatis)还是Hibernate,Spring都能够帮助消除持久化代码中单调枯燥的数据访问逻辑。可以依赖Spring来处理底层的数据访问。
mybatis是一种Spring持久化框架,要使用mybatis,就要做好相应的配置:
1,配置数据源。有很多数据源可以选择,如:DBCP,JDBC,aliba
- Java静态代理、动态代理实例
aijuans
Java静态代理
采用Java代理模式,代理类通过调用委托类对象的方法,来提供特定的服务。委托类需要实现一个业务接口,代理类返回委托类的实例接口对象。
按照代理类的创建时期,可以分为:静态代理和动态代理。
所谓静态代理: 指程序员创建好代理类,编译时直接生成代理类的字节码文件。
所谓动态代理: 在程序运行时,通过反射机制动态生成代理类。
一、静态代理类实例:
1、Serivce.ja
- Struts1与Struts2的12点区别
asia007
Struts1与Struts2
1) 在Action实现类方面的对比:Struts 1要求Action类继承一个抽象基类;Struts 1的一个具体问题是使用抽象类编程而不是接口。Struts 2 Action类可以实现一个Action接口,也可以实现其他接口,使可选和定制的服务成为可能。Struts 2提供一个ActionSupport基类去实现常用的接口。即使Action接口不是必须实现的,只有一个包含execute方法的P
- 初学者要多看看帮助文档 不要用js来写Jquery的代码
百合不是茶
jqueryjs
解析json数据的时候需要将解析的数据写到文本框中, 出现了用js来写Jquery代码的问题;
1, JQuery的赋值 有问题
代码如下: data.username 表示的是: 网易
$("#use
- 经理怎么和员工搞好关系和信任
bijian1013
团队项目管理管理
产品经理应该有坚实的专业基础,这里的基础包括产品方向和产品策略的把握,包括设计,也包括对技术的理解和见识,对运营和市场的敏感,以及良好的沟通和协作能力。换言之,既然是产品经理,整个产品的方方面面都应该能摸得出门道。这也不懂那也不懂,如何让人信服?如何让自己懂?就是不断学习,不仅仅从书本中,更从平时和各种角色的沟通
- 如何为rich:tree不同类型节点设置右键菜单
sunjing
contextMenutreeRichfaces
组合使用target和targetSelector就可以啦,如下: <rich:tree id="ruleTree" value="#{treeAction.ruleTree}" var="node" nodeType="#{node.type}"
selectionChangeListener=&qu
- 【Redis二】Redis2.8.17搭建主从复制环境
bit1129
redis
开始使用Redis2.8.17
Redis第一篇在Redis2.4.5上搭建主从复制环境,对它的主从复制的工作机制,真正的惊呆了。不知道Redis2.8.17的主从复制机制是怎样的,Redis到了2.4.5这个版本,主从复制还做成那样,Impossible is nothing! 本篇把主从复制环境再搭一遍看看效果,这次在Unbuntu上用官方支持的版本。 Ubuntu上安装Red
- JSONObject转换JSON--将Date转换为指定格式
白糖_
JSONObject
项目中,经常会用JSONObject插件将JavaBean或List<JavaBean>转换为JSON格式的字符串,而JavaBean的属性有时候会有java.util.Date这个类型的时间对象,这时JSONObject默认会将Date属性转换成这样的格式:
{"nanos":0,"time":-27076233600000,
- JavaScript语言精粹读书笔记
braveCS
JavaScript
【经典用法】:
//①定义新方法
Function .prototype.method=function(name, func){
this.prototype[name]=func;
return this;
}
//②给Object增加一个create方法,这个方法创建一个使用原对
- 编程之美-找符合条件的整数 用字符串来表示大整数避免溢出
bylijinnan
编程之美
import java.util.LinkedList;
public class FindInteger {
/**
* 编程之美 找符合条件的整数 用字符串来表示大整数避免溢出
* 题目:任意给定一个正整数N,求一个最小的正整数M(M>1),使得N*M的十进制表示形式里只含有1和0
*
* 假设当前正在搜索由0,1组成的K位十进制数
- 读书笔记
chengxuyuancsdn
读书笔记
1、Struts访问资源
2、把静态参数传递给一个动作
3、<result>type属性
4、s:iterator、s:if c:forEach
5、StringBuilder和StringBuffer
6、spring配置拦截器
1、访问资源
(1)通过ServletActionContext对象和实现ServletContextAware,ServletReque
- [通讯与电力]光网城市建设的一些问题
comsci
问题
信号防护的问题,前面已经说过了,这里要说光网交换机与市电保障的关系
我们过去用的ADSL线路,因为是电话线,在小区和街道电力中断的情况下,只要在家里用笔记本电脑+蓄电池,连接ADSL,同样可以上网........
- oracle 空间RESUMABLE
daizj
oracle空间不足RESUMABLE错误挂起
空间RESUMABLE操作 转
Oracle从9i开始引入这个功能,当出现空间不足等相关的错误时,Oracle可以不是马上返回错误信息,并回滚当前的操作,而是将操作挂起,直到挂起时间超过RESUMABLE TIMEOUT,或者空间不足的错误被解决。
这一篇简单介绍空间RESUMABLE的例子。
第一次碰到这个特性是在一次安装9i数据库的过程中,在利用D
- 重构第一次写的线程池
dieslrae
线程池 python
最近没有什么学习欲望,修改之前的线程池的计划一直搁置,这几天比较闲,还是做了一次重构,由之前的2个类拆分为现在的4个类.
1、首先是工作线程类:TaskThread,此类为一个工作线程,用于完成一个工作任务,提供等待(wait),继续(proceed),绑定任务(bindTask)等方法
#!/usr/bin/env python
# -*- coding:utf8 -*-
- C语言学习六指针
dcj3sjt126com
c
初识指针,简单示例程序:
/*
指针就是地址,地址就是指针
地址就是内存单元的编号
指针变量是存放地址的变量
指针和指针变量是两个不同的概念
但是要注意: 通常我们叙述时会把指针变量简称为指针,实际它们含义并不一样
*/
# include <stdio.h>
int main(void)
{
int * p; // p是变量的名字, int *
- yii2 beforeSave afterSave beforeDelete
dcj3sjt126com
delete
public function afterSave($insert, $changedAttributes)
{
parent::afterSave($insert, $changedAttributes);
if($insert) {
//这里是新增数据
} else {
//这里是更新数据
}
}
- timertask
shuizhaosi888
timertask
java.util.Timer timer = new java.util.Timer(true);
// true 说明这个timer以daemon方式运行(优先级低,
// 程序结束timer也自动结束),注意,javax.swing
// 包中也有一个Timer类,如果import中用到swing包,
// 要注意名字的冲突。
TimerTask task = new
- Spring Security(13)——session管理
234390216
sessionSpring Security攻击保护超时
session管理
目录
1.1 检测session超时
1.2 concurrency-control
1.3 session 固定攻击保护
- 公司项目NODEJS实践0.3[ mongo / session ...]
逐行分析JS源代码
mongodbsessionnodejs
http://www.upopen.cn
一、前言
书接上回,我们搭建了WEB服务端路由、模板等功能,完成了register 通过ajax与后端的通信,今天主要完成数据与mongodb的存取,实现注册 / 登录 /
- pojo.vo.po.domain区别
LiaoJuncai
javaVOPOJOjavabeandomain
POJO = "Plain Old Java Object",是MartinFowler等发明的一个术语,用来表示普通的Java对象,不是JavaBean, EntityBean 或者 SessionBean。POJO不但当任何特殊的角色,也不实现任何特殊的Java框架的接口如,EJB, JDBC等等。
即POJO是一个简单的普通的Java对象,它包含业务逻辑
- Windows Error Code
OhMyCC
windows
0 操作成功完成.
1 功能错误.
2 系统找不到指定的文件.
3 系统找不到指定的路径.
4 系统无法打开文件.
5 拒绝访问.
6 句柄无效.
7 存储控制块被损坏.
8 存储空间不足, 无法处理此命令.
9 存储控制块地址无效.
10 环境错误.
11 试图加载格式错误的程序.
12 访问码无效.
13 数据无效.
14 存储器不足, 无法完成此操作.
15 系
- 在storm集群环境下发布Topology
roadrunners
集群stormtopologyspoutbolt
storm的topology设计和开发就略过了。本章主要来说说如何在storm的集群环境中,通过storm的管理命令来发布和管理集群中的topology。
1、打包
打包插件是使用maven提供的maven-shade-plugin,详细见maven-shade-plugin。
<plugin>
<groupId>org.apache.maven.
- 为什么不允许代码里出现“魔数”
tomcat_oracle
java
在一个新项目中,我最先做的事情之一,就是建立使用诸如Checkstyle和Findbugs之类工具的准则。目的是制定一些代码规范,以及避免通过静态代码分析就能够检测到的bug。 迟早会有人给出案例说这样太离谱了。其中的一个案例是Checkstyle的魔数检查。它会对任何没有定义常量就使用的数字字面量给出警告,除了-1、0、1和2。 很多开发者在这个检查方面都有问题,这可以从结果
- zoj 3511 Cake Robbery(线段树)
阿尔萨斯
线段树
题目链接:zoj 3511 Cake Robbery
题目大意:就是有一个N边形的蛋糕,切M刀,从中挑选一块边数最多的,保证没有两条边重叠。
解题思路:有多少个顶点即为有多少条边,所以直接按照切刀切掉点的个数排序,然后用线段树维护剩下的还有哪些点。
#include <cstdio>
#include <cstring>
#include <vector&