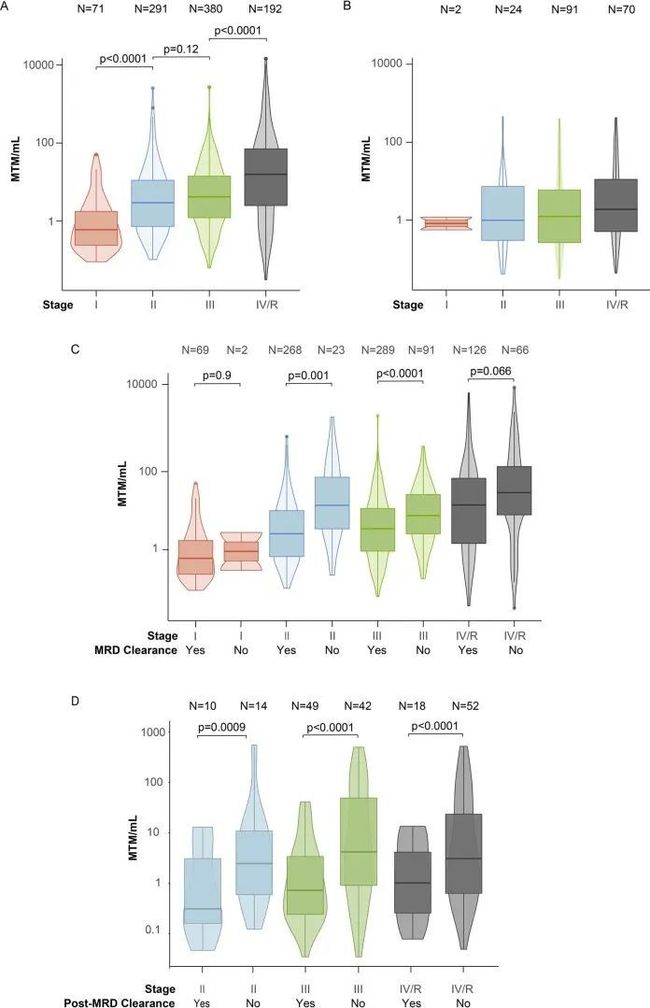
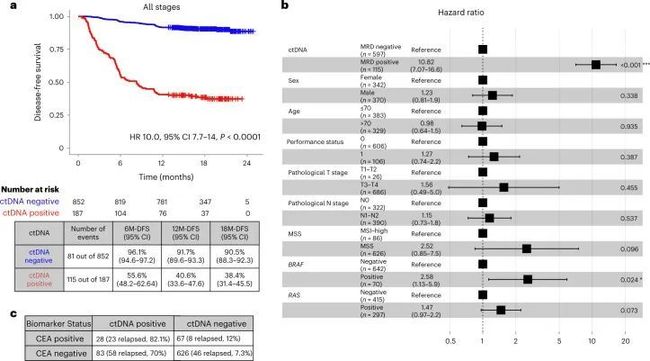
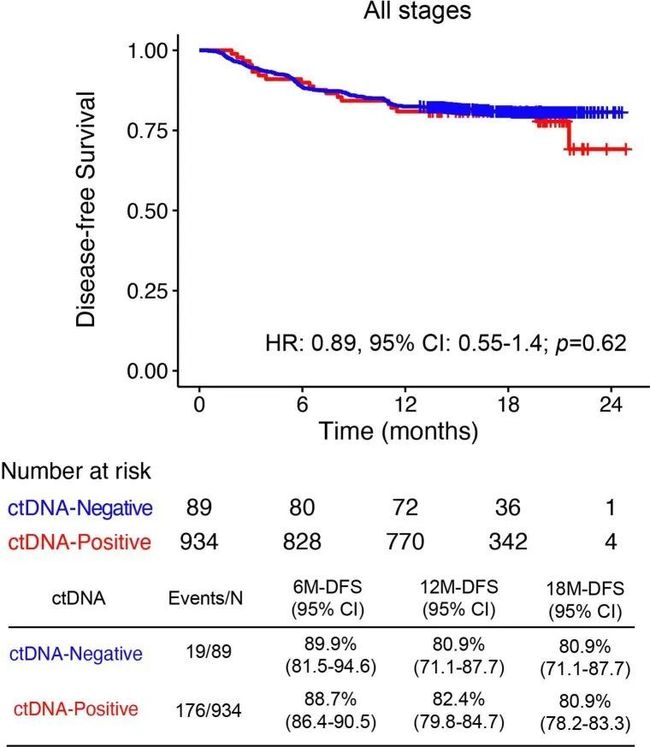
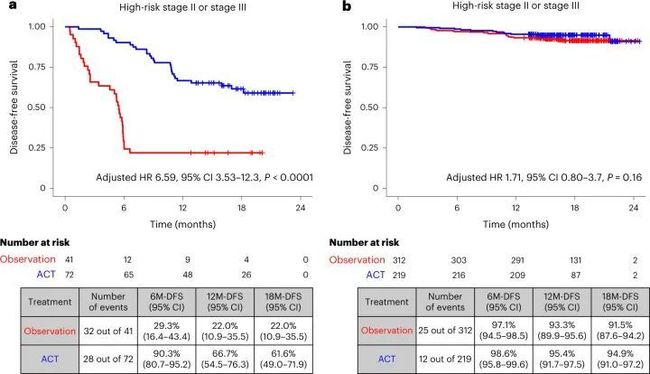
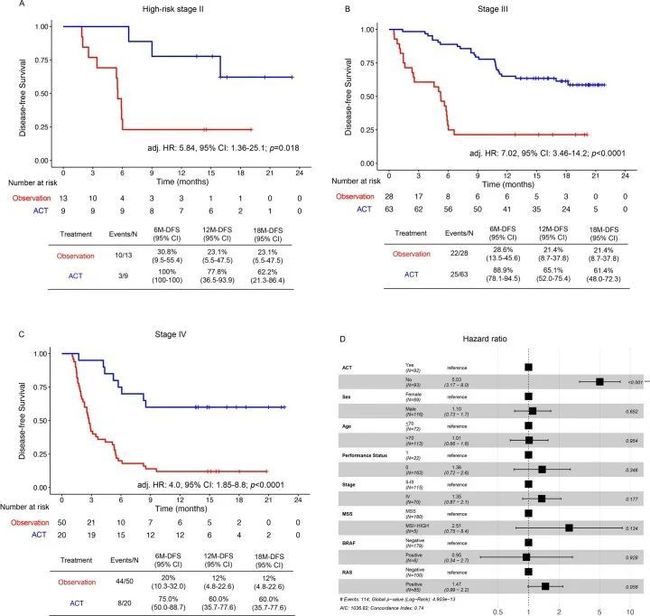
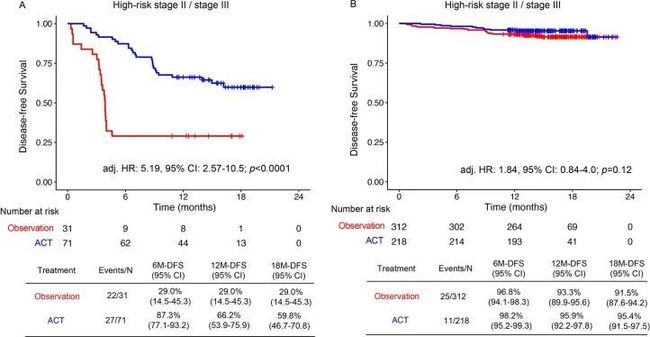
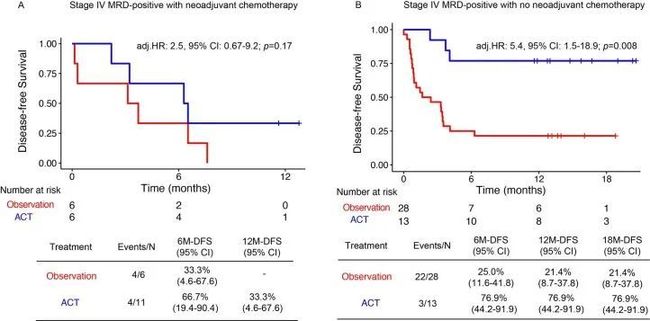
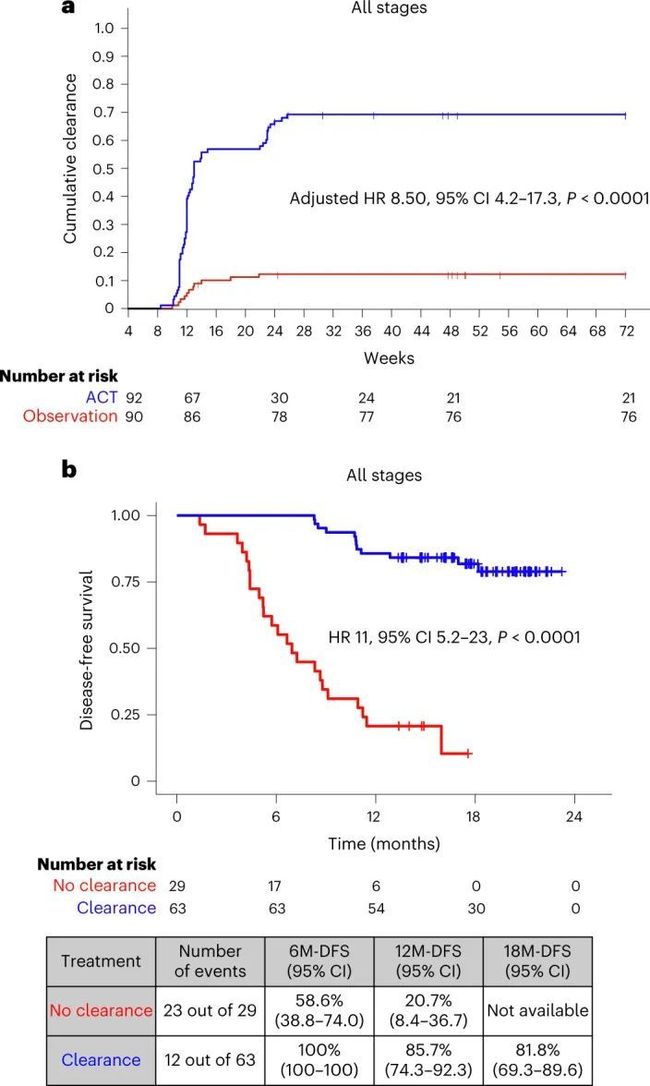
- yolov算法详解_yolo 目标检测算法个人总结(yolov1)
CHAO JIANG
yolov算法详解
yolo目标检测算法个人总结目前yolo目标检测有两个版本,分别为v1和v2。因工作需要用yolo算法检测人物,所以这段时间重点看了这两篇论文,并实现了对应的tensorflow代码。这里记录下在论文阅读过程中的一些细节信息,留给自己,同时也希望各位能指出本人理解错误的地方,谢谢!一:yolov1关于yolov1算法的详解在网上已经非常多了,在这里我大概叙述下算法的流程,以及在开发过程中遇到的一些
- 《论文阅读》GPT-3是否会产生移情对话?一种新的情境示例选择方法和用于生成同理心对话的自动评估度量 ICCL 2022
365JHWZGo
情感对话论文阅读gpt-3共情回复上下文学习提示学习大模型
《论文阅读》GPT-3是否会产生移情对话?一种新的情境示例选择方法和用于生成同理心对话的自动评估度量ICCL2022前言贡献PromptIn-contextlearningSITSMEMOSITSM新的自动指标实验前言亲身阅读感受分享,细节画图解释,再也不用担心看不懂论文啦~无抄袭,无复制,纯手工敲击键盘~今天为大家带来的是《DoesGPT-3GenerateEmpatheticDialogues
- [论文阅读] 人工智能 + 软件工程 | 揭秘ChatGPT在软件开发问题解决中的有效性:一项实证研究
张较瘦_
前沿技术论文阅读人工智能软件工程
揭秘ChatGPT在软件开发问题解决中的有效性:一项实证研究论文:WhatMakesChatGPTEffectiveforSoftwareIssueResolution?AnEmpiricalStudyofDeveloper-ChatGPTConversationsinGitHubarXiv:2506.22390WhatMakesChatGPTEffectiveforSoftwareIssueRe
- [论文阅读] 人工智能 + 软件工程 | 代码注释不一致问题研究:从数据革新到端到端解决方案
张较瘦_
前沿技术论文阅读人工智能软件工程
代码注释不一致问题研究:从数据革新到端到端解决方案原文:CCISOLVER:End-to-EndDetectionandRepairofMethod-LevelCode-CommentInconsistencyarXiv:2506.20558CCISolver:End-to-EndDetectionandRepairofMethod-LevelCode-CommentInconsistencyRe
- Learning Fully Convolutional Networks for Iterative Non-blind Deconvolution论文阅读
青铜锁00
#退化论文阅读深度学习论文阅读图像处理
LearningFullyConvolutionalNetworksforIterativeNon-blindDeconvolution1.研究目标与实际问题1.1研究目标1.2实际意义2.创新方法与模型设计2.1核心框架:迭代式梯度域处理2.1.1模型架构2.2关键技术实现2.2.1梯度域去噪网络2.2.2解卷积模块(核心公式实现)2.2.3损失函数设计2.2.4超参数端到端学习2.3与传统方法
- KAIST数据集及使用
草莓奶忻
SLAM基础#SLAM数据集ubuntu
文章目录KAIST复杂城市数据集KAIST数据集转换为rosbag1.将.gz.tar文件解压到其文件夹中2.克隆并构建此存储库3.使用路径和所需主题编辑配置文件4.为每种传感器类型创建一个rosbag文件5.将所有bag合并为一个参考KAIST复杂城市数据集KAIST-Urban-数据集-论文阅读数据集下载:ComplexUrbanDataset复杂城市数据集KAIST数据集转换为rosbag1
- [论文阅读] 软件工程 | 需求工程中领域知识研究:系统映射与创新突破
张较瘦_
前沿技术论文阅读软件工程
需求工程中领域知识研究:系统映射与创新突破论文信息DomainKnowledgeinRequirementsEngineering:ASystematicMappingStudyarXiv:2506.20754DomainKnowledgeinRequirementsEngineering:ASystematicMappingStudyMarinaAraújo,JúliaAraújo,RomeuO
- 论文阅读:2025 arxiv Qwen3 Technical Report
https://arxiv.org/pdf/2505.09388https://www.doubao.com/chat/9918384373236738文章目录论文翻译Qwen3技术报告摘要1引言论文翻译Qwen3技术报告Qwen团队摘要在这项工作中,我们介绍了Qwen模型家族的最新版本Qwen3。Qwen3包含一系列大型语言模型(LLM),旨在提升性能、效率和多语言能力。Qwen3系列包括密集型
- [论文阅读] 软件工程 | 探索软件生态系统中的开发者体验关键因素
探索软件生态系统中的开发者体验关键因素:从研究到实践引文格式@article{Zacarias2025,title={ExploringDeveloperExperienceFactorsinSoftwareEcosystems},author={Zacarias,RodrigoOliveiraandAntunes,L{\'e}oCarvalhoRamosandBarros,M{\'a}rciod
- Fast Image Deconvolution using Hyper-Laplacian Priors论文阅读
青铜锁00
#退化论文阅读论文阅读图像处理
FastImageDeconvolutionusingHyper-LaplacianPriors1.论文的研究目标与实际意义2.论文的创新方法2.1核心框架:交替最小化(AlternatingMinimization)2.2x子问题:频域FFT加速2.3w子问题:高效求解的核心创新2.3.1问题形式2.3.2查找表法(LUT)2.3.3解析解法(特定α\alphaα)2.3.4通用α\alphaα
- [论文阅读] 人工智能 + 软件工程 | AI 与敏捷开发的破局之路:从挫败到成功的工作坊纪实
张较瘦_
前沿技术论文阅读人工智能软件工程
AI与敏捷开发的破局之路:从挫败到成功的工作坊纪实论文信息arXiv:2506.20159AIandAgileSoftwareDevelopment:FromFrustrationtoSuccess–XP2025WorkshopSummaryTomasHerda,VictoriaPichler,ZheyingZhang,PekkaAbrahamsson,GeirK.HanssenSubjects:
- Diff-Retinex: Rethinking Low-light Image Enhancement with A Generative Diffusion Model 论文阅读
钟屿
论文阅读人工智能深度学习学习图像处理计算机视觉
Diff-Retinex:用生成式扩散模型重新思考低光照图像增强摘要本文中,我们重新思考了低光照图像增强任务,并提出了一种物理可解释的生成式扩散模型,称为Diff-Retinex。我们的目标是整合物理模型和生成网络的优点。此外,我们希望通过生成网络补充甚至推断低光照图像中缺失的信息。因此,Diff-Retinex将低光照图像增强问题表述为Retinex分解和条件图像生成。在Retinex分解中,我
- 【论文阅读】人工智能在直升机航空电子系统中的应用
肥鼠路易
论文阅读人工智能航空电子系统应用
人工智能在直升机航空电子系统中的应用论文摘要文章结构参考文献论文摘要论文摘要:在现代战争形势日趋信息化、智能化的背景下,将人工智能应用于武器装备已经是大势所趋。针对直升机飞行任务的特征,对其发展状况进行了描述,并对其作业能力进行了分析,探索了人工智能技术在直升机航电系统中的应用方向,为推进人工智能在直升机上的转化与应用奠定基础。通过对国外先进直升机智能技术的运用现状及对其作业能力的要求进行分析,探
- [论文阅读] 人工智能+软件工程 | 用大语言模型架起软件需求形式化的桥梁
张较瘦_
前沿技术人工智能论文阅读软件工程
用大语言模型架起软件需求形式化的桥梁:一篇ACM调查草案的深度解读论文信息arXiv:2506.14627ACMSurveyDraftonFormalisingSoftwareRequirementswithLargeLanguageModelsArshadBeg,DiarmuidO’Donoghue,RosemaryMonahanComments:22pages.6summarytablesSu
- Reti-Diff: Illumination Degradation Image Restoration with Retinex-based Latent Diffusion Model论文阅读
青铜锁00
深度学习论文阅读#退化论文阅读
Reti-Diff:IlluminationDegradationImageRestorationwithRetinex-basedLatentDiffusionModel1.研究目标与实际意义1.1研究目标1.2实际意义2.创新方法与模型设计2.1整体框架2.2RetinexPriorExtraction(RPE)模块2.2.1Retinex分解2.2.2先验压缩2.3Retinex-guide
- SIMPL论文阅读
ZHANG8023ZHEN
论文阅读
论文链接:https://arxiv.org/pdf/2402.02519文章还没细看,但主要贡献点应该是SymmetricFusionTransformer和Bezier-basedMotionDecoder.对Bezier-basedMotionDecoder比较感兴趣,之后对这块细看一下
- 【论文阅读笔记】《CodeS: Towards Building Open-source Language Models for Text-to-SQL 》
柠石榴
text2sql论文论文阅读笔记语言模型
文章目录一、论文基本信息1.文章标题2.所属刊物/会议3.发表年份4.作者列表5.发表单位二、摘要三、解决问题四、创新点五、自己的见解和感想六、研究背景七、研究方法模型实验数据评估指标八、总结九、相关重要文献一、论文基本信息1.文章标题CodeS:TowardsBuildingOpen-sourceLanguageModelsforText-to-SQL2.所属刊物/会议未明确标注(会议缩写为“C
- agentformer论文阅读
ZHANG8023ZHEN
论文阅读
参考了这篇博文:https://zhuanlan.zhihu.com/p/512764984主要有这几个部分a.map_encoderi.对地图进行CNNb.ContextEncoderi.timeencoder–将时间信息用transformer和positionemb进行融合,加入到特征中ii.agent-awareattention–self和selfattentionother和other
- 【论文阅读】DynamicControl :一种新的controlnet多条件控制方法
prinTao
pytorchDiffusion论文阅读
背景现有方法要么处理条件效率低下,要么使用固定数量的条件,这并不能完全解决多个条件的复杂性及其潜在冲突。这强调了需要创新方法来有效管理多种条件,以实现更可靠和详细的图像合成。为了解决这个问题,我们提出了一个新的框架DynamicControl,它支持不同控制信号的动态组合,允许自适应选择不同数量和类型的条件。本文方法从一个双循环控制器开始,它通过利用预先训练的条件生成模型和判别模型为所有输入条件生
- 论文阅读:2018 arxiv CrowdHuman: A Benchmark for Detecting Human in a Crowd
CSPhD-winston-杨帆
论文阅读
https://www.doubao.com/chat/9226473480559618https://arxiv.org/pdf/1805.00123CrowdHuman:ABenchmarkforDetectingHumaninaCrowd文章目录论文翻译CrowdHuman:用于检测人群中人体的基准摘要1.引言2.相关工作2.1.人体检测数据集2.2.人体检测框架。论文翻译CrowdHuma
- 论文阅读:arxiv 2025 OThink-R1: Intrinsic Fast/Slow Thinking Mode Switching for Over-Reasoning Mitigation
CSPhD-winston-杨帆
论文阅读
总目录大模型安全相关研究:https://blog.csdn.net/WhiffeYF/article/details/142132328https://www.doubao.com/chat/8815924393371650https://arxiv.org/pdf/2506.02397#page=17.09OThink文章目录速览研究背景与问题核心思路与方法实验结果结论与意义速览这篇论文聚焦于
- 论文阅读:arxiv 2025 Not All Tokens Are What You Need In Thinking
总目录大模型安全相关研究:https://blog.csdn.net/WhiffeYF/article/details/142132328https://arxiv.org/pdf/2505.17827https://www.doubao.com/chat/8814790364572162文章目录速览研究背景提出的解决方案:条件token选择(CTS)实验结果核心贡献研究局限总结速览这篇论文主要探
- [论文阅读]PIDNet: A Real-time Semantic Segmentation Network Inspired by PID Controllers
颜笑晏晏
论文阅读
1.摘要双分支网络结构已显示出其对实时语义分割任务的效率性和有效性。然而,低级细节和高级语义的直接融合将导致细节特征容易被周围上下文信息淹没,即本文中的超调(overshoot),这限制了现有两个分支模型的准确性的提高。在本文中,我们在卷积神经网络(CNN)和比例积分微分(PID)控制器之间架起了桥梁,并揭示了双分支网络只是一个比例积分(PI)控制器,当然也会存在类似的超调问题。为了解决这个问题,
- [论文阅读] 人工智能+软件工程 | 用 LLM + 静态代码分析自动化提升代码质量
张较瘦_
前沿技术论文阅读人工智能软件工程
用LLM+静态代码分析自动化提升代码质量论文信息AugmentingLargeLanguageModelswithStaticCodeAnalysisforAutomatedCodeQualityImprovements@article{abtahi2025augmenting,title={AugmentingLargeLanguageModelswithStaticCodeAnalysisfo
- 经典论文阅读《A Framework for Unifying Reordering Transformations》《统一重排序变换的框架》
好好学习啊天天向上
自动性能优化
1)摘要我们提出了一个用于统一迭代重排序变换的框架,这些变换包括循环交换、循环分布、倾斜、分块、索引集拆分和语句重排序。该框架基于这样一种思想:变换可以表示为将原始迭代空间映射到新迭代空间的调度。框架旨在为变换提供一种统一的表示和推理方式。作为框架的一部分,我们提供了辅助构建和使用调度的算法,特别是用于检验调度合法性、对齐调度以及为调度生成优化代码的算法。2)优化编译器会对语句的迭代进行重新排序,
- [论文阅读] 系统架构 | 零售 IT 中的微服务与实时处理:开源工具链与部署策略综述
张较瘦_
前沿技术论文阅读大数据零售
零售IT中的微服务与实时处理:开源工具链与部署策略综述论文信息MicroservicesandReal-TimeProcessinginRetailIT:AReviewofOpen-SourceToolchainsandDeploymentStrategiesAaditaaVashisht(DepartmentofInformationScienceandEngineering,RVCollege
- [论文阅读]人工智能 | CoMemo:给大视觉语言模型装个“图像记忆”
张较瘦_
前沿技术人工智能论文阅读语言模型
【论文速览】CoMemo:给大视觉语言模型装个“图像记忆”论文信息Liu,S.,Su,W.,Zhu,X.,Wang,W.,&Dai,J.(2025).CoMemo:LVLMsNeedImageContextwithImageMemory.arXivpreprintarXiv:2506.06279.一、研究背景:当LVLMs遇到“视觉健忘症”想象一下,你在阅读一本图文并茂的小说时,随着文字篇幅越来越
- [论文阅读] 人工智能+软件工程 | 结对编程中的知识转移新图景
张较瘦_
前沿技术人工智能软件工程结对编程
当AI成为编程搭档:结对编程中的知识转移新图景论文信息论文标题:FromDeveloperPairstoAICopilots:AComparativeStudyonKnowledgeTransfer(从开发者结对到AI副驾驶:知识转移的对比研究)作者及机构:AlisaWelter等来自德国萨尔兰大学,ChristofTinnes同时隶属于西门子公司发表平台:arXiv预印本平台发表时间:2025年
- 【论文阅读笔记】HaDes幻觉检测benchmark
zsq
论文分享论文阅读笔记NLP大语言模型幻觉
0论文信息题目:AToken-levelReference-freeHallucinationDetectionBenchmarkforFree-formTextGeneration作者:TianyuLiu,YizheZhang,ChrisBrockett,YiMao,ZhifangSui,WeizhuChen,BillDolan会议:ACL,2022链接:https://arxiv.org/ab
- 论文阅读:Enhancing Retrieval and Managing Retrieval: A Four-Module Synergy for Improved Quality and Ef
clvsit
RAG论文阅读LLM
检索增强生成(RAG)技术利用大型语言模型(LLM)的上下文学习能力,生成更准确、更相关的响应。RAG框架起源于简单的“检索-阅读”方法,现已发展成为高度灵活的模块化范式。其中一个关键组件——查询重写模块,通过生成搜索友好的查询来增强知识检索。这种方法能使输入问题与知识库更紧密地结合起来。作者的研究发现了将QueryRewriter模块增强为QueryRewriter+的机会,即通过生成多个查询来
- 枚举的构造函数中抛出异常会怎样
bylijinnan
javaenum单例
首先从使用enum实现单例说起。
为什么要用enum来实现单例?
这篇文章(
http://javarevisited.blogspot.sg/2012/07/why-enum-singleton-are-better-in-java.html)阐述了三个理由:
1.enum单例简单、容易,只需几行代码:
public enum Singleton {
INSTANCE;
- CMake 教程
aigo
C++
转自:http://xiang.lf.blog.163.com/blog/static/127733322201481114456136/
CMake是一个跨平台的程序构建工具,比如起自己编写Makefile方便很多。
介绍:http://baike.baidu.com/view/1126160.htm
本文件不介绍CMake的基本语法,下面是篇不错的入门教程:
http:
- cvc-complex-type.2.3: Element 'beans' cannot have character
Cb123456
springWebgis
cvc-complex-type.2.3: Element 'beans' cannot have character
Line 33 in XML document from ServletContext resource [/WEB-INF/backend-servlet.xml] is i
- jquery实例:随页面滚动条滚动而自动加载内容
120153216
jquery
<script language="javascript">
$(function (){
var i = 4;$(window).bind("scroll", function (event){
//滚动条到网页头部的 高度,兼容ie,ff,chrome
var top = document.documentElement.s
- 将数据库中的数据转换成dbs文件
何必如此
sqldbs
旗正规则引擎通过数据库配置器(DataBuilder)来管理数据库,无论是Oracle,还是其他主流的数据都支持,操作方式是一样的。旗正规则引擎的数据库配置器是用于编辑数据库结构信息以及管理数据库表数据,并且可以执行SQL 语句,主要功能如下。
1)数据库生成表结构信息:
主要生成数据库配置文件(.conf文
- 在IBATIS中配置SQL语句的IN方式
357029540
ibatis
在使用IBATIS进行SQL语句配置查询时,我们一定会遇到通过IN查询的地方,在使用IN查询时我们可以有两种方式进行配置参数:String和List。具体使用方式如下:
1.String:定义一个String的参数userIds,把这个参数传入IBATIS的sql配置文件,sql语句就可以这样写:
<select id="getForms" param
- Spring3 MVC 笔记(一)
7454103
springmvcbeanRESTJSF
自从 MVC 这个概念提出来之后 struts1.X struts2.X jsf 。。。。。
这个view 层的技术一个接一个! 都用过!不敢说哪个绝对的强悍!
要看业务,和整体的设计!
最近公司要求开发个新系统!
- Timer与Spring Quartz 定时执行程序
darkranger
springbean工作quartz
有时候需要定时触发某一项任务。其实在jdk1.3,java sdk就通过java.util.Timer提供相应的功能。一个简单的例子说明如何使用,很简单: 1、第一步,我们需要建立一项任务,我们的任务需要继承java.util.TimerTask package com.test; import java.text.SimpleDateFormat; import java.util.Date;
- 大端小端转换,le32_to_cpu 和cpu_to_le32
aijuans
C语言相关
大端小端转换,le32_to_cpu 和cpu_to_le32 字节序
http://oss.org.cn/kernel-book/ldd3/ch11s04.html
小心不要假设字节序. PC 存储多字节值是低字节为先(小端为先, 因此是小端), 一些高级的平台以另一种方式(大端)
- Nginx负载均衡配置实例详解
avords
[导读] 负载均衡是我们大流量网站要做的一个东西,下面我来给大家介绍在Nginx服务器上进行负载均衡配置方法,希望对有需要的同学有所帮助哦。负载均衡先来简单了解一下什么是负载均衡,单从字面上的意思来理解就可以解 负载均衡是我们大流量网站要做的一个东西,下面我来给大家介绍在Nginx服务器上进行负载均衡配置方法,希望对有需要的同学有所帮助哦。
负载均衡
先来简单了解一下什么是负载均衡
- 乱说的
houxinyou
框架敏捷开发软件测试
从很久以前,大家就研究框架,开发方法,软件工程,好多!反正我是搞不明白!
这两天看好多人研究敏捷模型,瀑布模型!也没太搞明白.
不过感觉和程序开发语言差不多,
瀑布就是顺序,敏捷就是循环.
瀑布就是需求、分析、设计、编码、测试一步一步走下来。而敏捷就是按摸块或者说迭代做个循环,第个循环中也一样是需求、分析、设计、编码、测试一步一步走下来。
也可以把软件开发理
- 欣赏的价值——一个小故事
bijian1013
有效辅导欣赏欣赏的价值
第一次参加家长会,幼儿园的老师说:"您的儿子有多动症,在板凳上连三分钟都坐不了,你最好带他去医院看一看。" 回家的路上,儿子问她老师都说了些什么,她鼻子一酸,差点流下泪来。因为全班30位小朋友,惟有他表现最差;惟有对他,老师表现出不屑,然而她还在告诉她的儿子:"老师表扬你了,说宝宝原来在板凳上坐不了一分钟,现在能坐三分钟。其他妈妈都非常羡慕妈妈,因为全班只有宝宝
- 包冲突问题的解决方法
bingyingao
eclipsemavenexclusions包冲突
包冲突是开发过程中很常见的问题:
其表现有:
1.明明在eclipse中能够索引到某个类,运行时却报出找不到类。
2.明明在eclipse中能够索引到某个类的方法,运行时却报出找不到方法。
3.类及方法都有,以正确编译成了.class文件,在本机跑的好好的,发到测试或者正式环境就
抛如下异常:
java.lang.NoClassDefFoundError: Could not in
- 【Spark七十五】Spark Streaming整合Flume-NG三之接入log4j
bit1129
Stream
先来一段废话:
实际工作中,业务系统的日志基本上是使用Log4j写入到日志文件中的,问题的关键之处在于业务日志的格式混乱,这给对日志文件中的日志进行统计分析带来了极大的困难,或者说,基本上无法进行分析,每个人写日志的习惯不同,导致日志行的格式五花八门,最后只能通过grep来查找特定的关键词缩小范围,但是在集群环境下,每个机器去grep一遍,分析一遍,这个效率如何可想之二,大好光阴都浪费在这上面了
- sudoku solver in Haskell
bookjovi
sudokuhaskell
这几天没太多的事做,想着用函数式语言来写点实用的程序,像fib和prime之类的就不想提了(就一行代码的事),写什么程序呢?在网上闲逛时发现sudoku游戏,sudoku十几年前就知道了,学生生涯时也想过用C/Java来实现个智能求解,但到最后往往没写成,主要是用C/Java写的话会很麻烦。
现在写程序,本人总是有一种思维惯性,总是想把程序写的更紧凑,更精致,代码行数最少,所以现
- java apache ftpClient
bro_feng
java
最近使用apache的ftpclient插件实现ftp下载,遇见几个问题,做如下总结。
1. 上传阻塞,一连串的上传,其中一个就阻塞了,或是用storeFile上传时返回false。查了点资料,说是FTP有主动模式和被动模式。将传出模式修改为被动模式ftp.enterLocalPassiveMode();然后就好了。
看了网上相关介绍,对主动模式和被动模式区别还是比较的模糊,不太了解被动模
- 读《研磨设计模式》-代码笔记-工厂方法模式
bylijinnan
java设计模式
声明: 本文只为方便我个人查阅和理解,详细的分析以及源代码请移步 原作者的博客http://chjavach.iteye.com/
package design.pattern;
/*
* 工厂方法模式:使一个类的实例化延迟到子类
* 某次,我在工作不知不觉中就用到了工厂方法模式(称为模板方法模式更恰当。2012-10-29):
* 有很多不同的产品,它
- 面试记录语
chenyu19891124
招聘
或许真的在一个平台上成长成什么样,都必须靠自己去努力。有了好的平台让自己展示,就该好好努力。今天是自己单独一次去面试别人,感觉有点小紧张,说话有点打结。在面试完后写面试情况表,下笔真的好难,尤其是要对面试人的情况说明真的好难。
今天面试的是自己同事的同事,现在的这个同事要离职了,介绍了我现在这位同事以前的同事来面试。今天这位求职者面试的是配置管理,期初看了简历觉得应该很适合做配置管理,但是今天面
- Fire Workflow 1.0正式版终于发布了
comsci
工作workflowGoogle
Fire Workflow 是国内另外一款开源工作流,作者是著名的非也同志,哈哈....
官方网站是 http://www.fireflow.org
经过大家努力,Fire Workflow 1.0正式版终于发布了
正式版主要变化:
1、增加IWorkItem.jumpToEx(...)方法,取消了当前环节和目标环节必须在同一条执行线的限制,使得自由流更加自由
2、增加IT
- Python向脚本传参
daizj
python脚本传参
如果想对python脚本传参数,python中对应的argc, argv(c语言的命令行参数)是什么呢?
需要模块:sys
参数个数:len(sys.argv)
脚本名: sys.argv[0]
参数1: sys.argv[1]
参数2: sys.argv[
- 管理用户分组的命令gpasswd
dongwei_6688
passwd
NAME: gpasswd - administer the /etc/group file
SYNOPSIS:
gpasswd group
gpasswd -a user group
gpasswd -d user group
gpasswd -R group
gpasswd -r group
gpasswd [-A user,...] [-M user,...] g
- 郝斌老师数据结构课程笔记
dcj3sjt126com
数据结构与算法
<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<
- yii2 cgridview加上选择框进行操作
dcj3sjt126com
GridView
页面代码
<?=Html::beginForm(['controller/bulk'],'post');?>
<?=Html::dropDownList('action','',[''=>'Mark selected as: ','c'=>'Confirmed','nc'=>'No Confirmed'],['class'=>'dropdown',])
- linux mysql
fypop
linux
enquiry mysql version in centos linux
yum list installed | grep mysql
yum -y remove mysql-libs.x86_64
enquiry mysql version in yum repositoryyum list | grep mysql oryum -y list mysql*
install mysq
- Scramble String
hcx2013
String
Given a string s1, we may represent it as a binary tree by partitioning it to two non-empty substrings recursively.
Below is one possible representation of s1 = "great":
- 跟我学Shiro目录贴
jinnianshilongnian
跟我学shiro
历经三个月左右时间,《跟我学Shiro》系列教程已经完结,暂时没有需要补充的内容,因此生成PDF版供大家下载。最近项目比较紧,没有时间解答一些疑问,暂时无法回复一些问题,很抱歉,不过可以加群(334194438/348194195)一起讨论问题。
----广告-----------------------------------------------------
- nginx日志切割并使用flume-ng收集日志
liyonghui160com
nginx的日志文件没有rotate功能。如果你不处理,日志文件将变得越来越大,还好我们可以写一个nginx日志切割脚本来自动切割日志文件。第一步就是重命名日志文件,不用担心重命名后nginx找不到日志文件而丢失日志。在你未重新打开原名字的日志文件前,nginx还是会向你重命名的文件写日志,linux是靠文件描述符而不是文件名定位文件。第二步向nginx主
- Oracle死锁解决方法
pda158
oracle
select p.spid,c.object_name,b.session_id,b.oracle_username,b.os_user_name from v$process p,v$session a, v$locked_object b,all_objects c where p.addr=a.paddr and a.process=b.process and c.object_id=b.
- java之List排序
shiguanghui
list排序
在Java Collection Framework中定义的List实现有Vector,ArrayList和LinkedList。这些集合提供了对对象组的索引访问。他们提供了元素的添加与删除支持。然而,它们并没有内置的元素排序支持。 你能够使用java.util.Collections类中的sort()方法对List元素进行排序。你既可以给方法传递
- servlet单例多线程
utopialxw
单例多线程servlet
转自http://www.cnblogs.com/yjhrem/articles/3160864.html
和 http://blog.chinaunix.net/uid-7374279-id-3687149.html
Servlet 单例多线程
Servlet如何处理多个请求访问?Servlet容器默认是采用单实例多线程的方式处理多个请求的:1.当web服务器启动的