未来饮食方向——通过精准营养降低慢性病风险
谷禾健康
营养对于身体健康和疾病预防的重要性已得到充分证实,全球膳食指南建议也得到了明确定义,以指导有效的政策。然而,吃什么、何时吃以及如何保持健康地优化饮食模式实际上非常复杂。
许多因素会影响饮食模式,包括个人的生理需求、疾病或健康状况、社会环境和文化因素,以及对饮食干预的生物、生理和社会心理反应,都需要考虑。
各种饮食可以带来积极的健康结果,但到底哪种饮食最适合个人以及这种饮食在整个生命周期中如何变化,是目前许多研究人员及临床医生迫切想要了解的。
如今“精准营养”快速发展,它强调使用个人化信息来制定针对某一特定群体的营养建议和饮食计划。其主要目标之一是提供量身定制的饮食建议以及预期的个性化反应。虽然越来越多的证据支持精准医学对于最佳个人健康和慢性病管理的需求,但“个性化”或“精准”营养干预要进行推广还需要一些路要走。
美国国立卫生研究院 (NIH) 国家心肺血液研究所(NHLBI)于2021年1月11日至12日召开了为期两天与会者讨论了四大慢性疾病领域的精准营养:1)心血管疾病,2)认知能力下降和阿尔茨海默氏病,3)2型糖尿病和血糖调节受损,以及4)与饮食相关的癌症。会议也着重阐述了对旨在影响健康和疾病的饮食调节的显著的个体差异。这突显了国际研究对于个性化营养在慢性疾病中的作用的重视。
饮食是慢性病风险的主要驱动因素,基于人群的指导应考虑个人反应。通过饮食减少慢性病需要更精确地:
(a)确定整个生命周期中健康和疾病的基本营养需求;
(b) 考虑营养素和其他食品物质对支持健康衰老的代谢、免疫、炎症和其他生理反应的影响;
(c) 考虑健康的饮食行为。
既然是精准营养,那么应该是人口亚群,而不是整个人口,可能以相似的方式对某种饮食或食物成分摄入或接触做出相似的反应,通过这种反应规律我们能给出比大人群层面更具体,更有针对性或有效解决某个反应指标的建议,这种建议是基于小且特定慢病人口亚群的遗传特征、代谢状态、生活方式、疾病状态或指标、括肠道微生态等。
本文主要讨论和阐述通过精准营养降低慢性病风险的可能性和挑战,一些可以作为慢性病精准营养的生物标志物以及减少慢性病的营养考虑因素。希望有助于精准营养这一领域更好地发展。
什么是精准营养?
精准营养(个性化营养)是根据遗传特征、生活方式、健康状况、代谢特点、微生物组成等因素来定制针对特定群体的饮食建议和营养计划的一种方法。
★ 每个人的营养需求是独特的
研究认为,由于每个人的生物学特性和环境暴露都是独一无二的,因此营养需求也是个性化的。
个性化营养的目标是为每个人提供最适合其个体化需求的营养建议,从而促进健康、预防疾病、改善生活质量。
在实现长期生活方式改变方面,个性化营养建议比传统的方法更有效。这可能是由于精准营养更进一步,它假设我们可以提供已知对个人有益的个人饮食建议,基于对个体、表型和食物消费之间关系的定量理解。
★ 个性化营养需要考虑的点
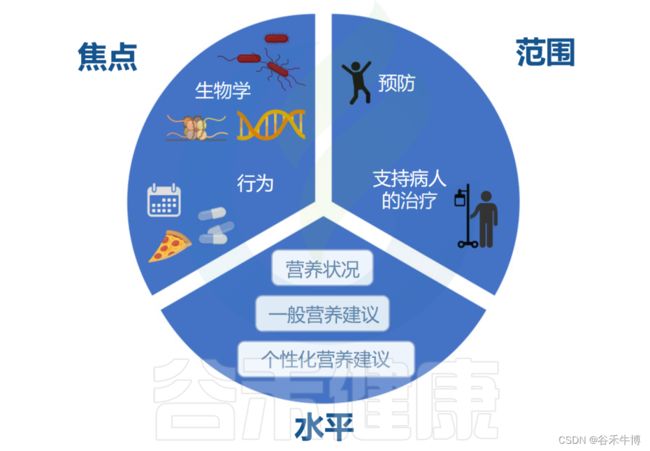
个性化饮食方案或个性化营养需要考虑三个方面:1)个性化的水平;2)个性化的重点;3)个性化的范围。
个性化营养的水平
个性化的水平有三层。在第一层或底层,我们找到了基于按年龄和性别划分的人群的一般准则的传统营养建议。这与营养科学传统上关注人群对某种饮食或营养素的平均反应相一致,可以被视为一级预防干预措施。
在第二个层面上,我们通过添加有关个人营养状况的表型信息(例如生化和人体测量数据)来添加个性化层。
在第三个层面,我们的目标是达到个性化(或精准)营养的水平,该水平考虑了多个方面,例如基因型、肠道微生物群或代谢组。与药物类似,营养素能够与生物体生理功能相互作用并调节分子机制,因此有可能帮助制定个性化的饮食建议。
个性化营养的重点
个性化营养的重点:生物学或行为。在精准医学中,我们的目标是根据遗传、表观遗传和肠道微生物等特征等了解对饮食和营养素的差异反应。这种程度的生物学理解也可以指导营养建议。
例如,更好地了解特定营养素和非营养成分在遇到特定肠道细菌菌株时如何以及哪些特定营养素和非营养成分可能诱发肠道炎症反应,可能是炎症性肠病个人建议的关键。然而,改变饮食模式应包括对当前行为、偏好、障碍和目标进行彻底评估。
个性化营养的范围
个性化营养的最后一个方面是它的范围。除了不同程度的个性化之外,其范围可以是解决公共卫生保健和疾病预防方面的新问题,也可以旨在支持患者的治疗。
Wellens J,et al.Pharmgenomics Pers Med.2023
食物和营养需求的生物学基础
纵观人类历史,食物塑造了人体基因组,以便在多种环境背景下生存和人口扩张。在许多人的食物生态系统不断变化且越来越不适应的背景下,导致了现代慢性病发病风险的变化。
✦ 食物供应和成分会影响人类遗传和表型
食物供应和食物成分是导致现代人类遗传和表型变异的主要环境选择压力之一。基因组通过遗传选择和随机漂移等过程进化,这些过程可以改变饮食与疾病的关系。
并非基因组中的所有基因都以相同的速度进化。在人类和其他物种中高度保守的基因通常编码具有维持生命的基本功能且基本上不受外部环境影响的蛋白质。
相比之下,快速进化的基因在不同人群中表现出DNA一级序列的变异,从而改变生理功能并导致人类遗传和表型变异。这种适应性基因历来允许在特定的环境中生存。
✦ 对食物环境变化的适应不良产生疾病基因
因此,涉及食物、营养、新陈代谢以及免疫功能的基因表现出一些最高的基因进化率并因此出现遗传和表型变异也就不足为奇了,因为随着时间的推移生存和扩张的人类群体必须适应当地独特的食物和致病环境。这些适应使人们能够在所处区域环境下生存,但当环境发生变化时,包括从狩猎采集社会向农业社会转变导致的食物环境变化,可能会出现适应不良,从而产生疾病等位基因。
饥荒是人类历史上的常见现象和选择压力,它以维持物种所需最低剂量的必需营养素优化了生物功能。通过细胞与营养环境的相互作用,在人类和其他哺乳动物中观察到这种选择压力的影响,其中必需营养素与酶和转运蛋白(Km、Kt)的结合亲和力在人类中(通常在哺乳动物中)高度相似并以维持生理功能的要求变化最小的方式保存下来。
✦ 食物过剩导致了慢性病发病率上升
因此,在维持基本营养充足性的基础上推导膳食参考摄入量(DRI)时,对准确性的需求更为迫切,因为建立群体亚群的需求仅限于整个生命周期生理需求的差异,而不是健康人群中独立于生命周期影响(如遗传学)的生理变化。
也有一些例外,例如常见的亚甲基四氢叶酸还原酶突变体(MTHFR C677T)对辅因子结合的影响,导致维持充足性所需的叶酸更高。
然而,我们生活的环境已经从饥荒转变为食物过剩,从解决营养缺乏症转变为解决与饮食相关的慢性病发病率上升的问题,所有这些都是在食品供应全球化的背景下进行的。
我们越来越认识到饮食与疾病关系中存在有意义的异质性,因此有必要建立饮食建议的新方法,包括识别和分类亚组的新方法(即提高精度)。
营养和食物指导的历史
预防营养缺乏和随后的营养缺乏相关疾病以及维持生理功能是营养素和其他食物物质(即能量、纤维、宏量和微量营养素)摄入量建议的目标。
✦ 膳食参考摄入量框架的提出
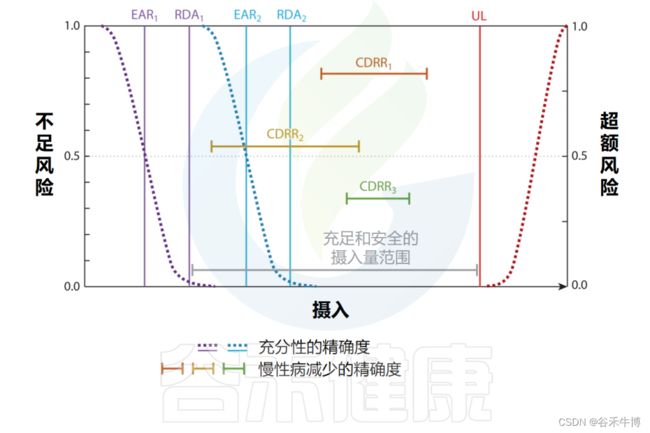
20世纪90年代末,制定了一套涵盖营养不足和营养过剩风险的建议,广泛称为膳食参考摄入量(DRI)表,如下所示:
Bailey RL,et al.Annu Rev Nutr.2023
✦ 人群中必需营养素的需求存在差异
DRI框架首先引入了精确指导的概念,承认有限数量的人群亚组中必需营养素的剂量反应关系存在差异。
鉴于与减少慢性疾病相比,预防营养缺乏和毒性状态所需的精确度较低,因此在建立基于保持特定亚组充足性的DRI时,只需要考虑有限数量的人口亚组,这符合人类自然历史。这是因为健康人群中的大多数个体往往对必需营养素暴露有类似的反应,并且因为营养素暴露是缺乏性疾病的单一根本原因,并且在健康人群中的相似时间过程中在整个人群中表现出特定症状。
例如,仅缺乏维生素C的饮食会导致坏血病的早期非特异性症状,例如大约4周内的疲劳,并在8至12周之间开始出现更具体的严重症状,包括包括瘀点和螺旋状毛发。
过高剂量可能导致毒性反应
同样,高剂量的毒性反应通常会导致人群出现相似的特征;例如超生理性摄入锌会导致胃肠道症状和疲劳,进而可能引发铜缺乏症。
采用总体、精确和个性化方法的膳食参考摄入量
Bailey RL,et al.Annu Rev Nutr.2023
✦ 整体饮食模式的分析
虽然DRI框架特别关注饮食中的其他食品物质,但美国人饮食指南(DGA)自1980年以来就提供了基于食品和饮料的建议,早期强调特定食物组,最近已转向整体饮食模式。
DGA旨在提供一套基于证据的饮食建议,以“帮助促进健康和预防慢性病”。基于食物的方法,特别是饮食模式研究,扩大了DGA的范围,并在此过程中代表了“饮食中不同食物、饮料和营养素的数量、比例、种类或组合,以及其频率”。它们被习惯性地消费”。
饮食模式可以通过多种方式得出;所有方法都可以分为独立的或依赖于特定健康结果的方法。结果依赖方法将感兴趣的结果或中间生物标志物纳入用于推导模式的模型中;示例包括降序回归和分类以及回归树分析。
尽管这些方法可用于检查饮食与特定结果之间的关系,但大多数营养研究人员使用与感兴趣的结果无关的方法来描述一般饮食质量。
开发与结果无关的饮食模式的方法有两大类:数据驱动的技术,例如因子分析或聚类分析,强调数据缩减技术或根据报告的饮食摄入量对个体进行聚类;以及基于索引的方法,它们是基于饮食指南或建议的先验模式。通过数据驱动的方法对饮食模式进行分类可能会导致研究人员在推导饮食模式时做出多种主观决定,从而使不同群体或人群中模式的比较复杂化,并降低其在定义基于食物的模式的研究中的效用。
然而,因子分析和聚类分析都是有用的数据缩减技术,可以确定复杂数据集中的基础结构,就像饮食暴露的情况一样。指数和分数的使用本质上创建了一张报告卡,说明饮食在多大程度上符合预定义的准则。虽然评分标准的制定方式存在主观性,但该方法提供了一个标准化框架来比较不同研究。
整体饮食模式和疾病风险之间存在关联
为此,2015年美国人膳食指南咨询委员会在系统审查的基础上,得出的结论是,指数和分数是捕捉饮食模式和整个饮食复杂性的首选方法。
存在各种指标和分数例如健康饮食指数、地中海饮食评分,以及控制高血压的饮食方法(DASH)得分。
使用该框架,2020年得出结论,存在强有力的证据表明较高质量的饮食模式与较低的全因死亡率风险相关和心血管疾病并且存在与2型糖尿病相关的饮食模式的适度证据、骨骼健康、超重和肥胖,以及成人结直肠癌和乳腺癌。
✦ 特殊的生命阶段具有独特的营养需求
最近采用生命阶段方法来评估现有的科学证据,包括所有生命阶段,并特别强调怀孕和哺乳期间以及婴儿和幼儿(出生至24个月)期间的独特营养需求。
除了建议遵循的食物模式外,还首次确定了与公共健康相关的特定生命阶段的其他食品物质以及所有生命阶段的公共健康问题,包括饮食暴露、生物终点或疾病患病率或经过验证的疾病替代标志物。
因此,虽然一些膳食指南是通用的,但人们认识到需要根据生命阶段向人群扩大具体建议——这代表了第一个超越DRI的、基于生命阶段针对特定群体的公共卫生营养方法。
DGA还认识到,存在多种潜在的饮食模式可实现类似的健康结果,例如地中海饮食或素食模式可预防心血管疾病。DGA审查并纳入的饮食模式并不代表膳食补充剂的使用,大大低估了使用膳食补充剂的一半成人和三分之一儿童的营养暴露量。
因此,开发了总营养指数,除了食品和饮料中的营养暴露之外,还包括补充剂中的营养暴露,与基于食品和饮料的指数结合使用,以提高暴露分类的全面性。
生物标志物:慢性病的精准营养
心血管疾病、糖尿病、癌症和关节炎等慢性疾病是全球范围内发病和死亡的重要原因,其患病率在所有年龄组、性别和种族中都在稳步上升。
★ 精准营养在预防和管理慢性病中起重要作用
越来越多的证据表明,精准营养在慢性病的预防和管理中发挥着至关重要的作用,被认为是未来十年健康研究的重点领域。
尽管如此,精准营养的主要挑战之一在于准确可靠地评估食物和营养素,特别是复杂食物和大分子。此外,需要确定这些食物和营养素如何影响个人的健康和疾病状况。
令人鼓舞的是,强有力的证据支持使用生物标志物作为中介工具,有效地建立精准营养和慢性疾病之间的联系。这种联系有助于客观评估食物消耗,并精确确定复杂食物和成分的生物效应。
尽管取得了这些进步,但我们目前对精准营养如何调节生物标志物以预防具有个体差异的慢性疾病的理解仍处于起步阶段。关键生物标志物参与慢性疾病的分子机制仍未得到充分阐明,需要进行全面和广泛的研究工作来弥补这一知识差距。
✦ 多种慢性疾病具有潜在的生物标志物
研究已确定了多种慢性疾病的新型潜在生物标志物。其中,单一物质作为生物标志物,如用于冠心病的25-羟基维生素D、用于非酒精性脂肪肝的视黄醇、2型糖尿病的荧光晚期糖基化终产物和用于烟雾病的支链氨基酸。
不同物质的比例也可作为生物标志物
此外,不同物质的比例已被提议作为生物标志物。发现肌酸与半胱氨酸蛋白酶抑制剂C(Cr/CysC)比值和白蛋白与球蛋白比值可以分别作为慢性肾病和泌尿系癌症预后的非侵入性生物标志物。
值得注意的是,研究发现Cr/CysC比率也可能是骨质疏松症的潜在生物标志物。此外,确定老年营养风险指数是老年高血压患者中风的潜在标志物。
研究还发现磷与白蛋白结合的水平可以作为全因死亡率和心血管死亡率的潜在标志。而与脱铁性贫血相关的差异表达基因可以作为新的生物标志物用于识别缺血性中风和指导治疗干预。
这些发现的生物标志物为相关慢性病的预防和管理提供了重要的理论基础,也有助于了解各种慢性病的发病机制。
✦ 一些膳食因子可以改善慢性疾病
研究表明,膳食中补充花青素、谷氨酰胺、维生素K和脂肪酸等功能因子,可以分别缓解心力衰竭、高盐高血压、血管钙化和骨矿物质损失。
控制功能性膳食因子的摄入量非常重要
然而,重要的是要谨慎控制饮食功能因子的剂量,例如过量摄入脂肪酸会导致代谢性疾病。
一些食物对各种慢性疾病存在积极影响。例如,膳食水果摄入可改善功能性便秘;以植物为基础的饮食可以用来控制代谢综合征;特定的口服营养补充剂(ONS)来解决炎症/氧化问题;藏红花缓解心血管疾病。
值得注意的是,还观察到益生菌补充剂与特定口服营养补充剂(ONS)对炎症/氧化的协同抵抗作用。
此外,联合训练,包括阻力训练和高强度间歇训练或中等强度连续训练,对非酒精性脂肪肝的治疗是有益的。除了这些预防或治疗慢性病的饮食策略外,饮食模式也会导致一些慢性疾病的发生,例如高盐饮食会加剧肠道衰老过程。
这些膳食功能因素和复合食品为慢性病的治疗提供了有效的预防措施。然而,负责调节这些生物标志物的具体机制尚未得到彻底探索,突显了该领域进一步研究的必要性。
肠道微生物群:一种生物标志物
微生物群多样性与改善脂质谱、抗炎细胞因子、肝酶以及最终的遗传途径有关,所有这些都是改善健康的代谢指标。
✦ 肠道微生物群影响宿主的新陈代谢
异常的肠道菌群和每日进食/禁食周期都会影响宿主的新陈代谢,并可能导致肥胖等代谢疾病的出现。研究发现,饮食和禁食周期会导致肠道微生物组发生周期性变化,从而充当控制宿主代谢的机制。
这些差异增加了肠道微生物群的多样性。因此,在确定微生物组对宿主生理和代谢的贡献时,进食模式、时间以及膳食的成分是需要考虑的重要特征。
肠脑之间的联系对于确定膳食量非常重要
肠道和大脑之间的沟通对于确定膳食的适当份量并向大脑发送信号以控制饥饿感和饱腹感至关重要。机械敏感性胃迷走神经传入(GVAs)在营养成分和化学途径方面表现出对食物相关刺激的昼夜节律性。这使得饱腹感信号可以通过肠脑交流在一天中的特定时间发生。
因此,GVA轴缺乏昼夜节律可能会导致食欲亢进和肥胖的增加。最近对动物和人类的研究表明,肥胖的出现与微生物群多样性降低、肠道微生物群活性改变和微生物群丰度分散相关,特别是拟杆菌门和厚壁菌门这两个门。当拟杆菌被允许留在肠道中时,它们会继续与宿主保持动态且在很大程度上是有益的关系。
✦ 肠道微生物群失调与慢性疾病相关
肠道微生物群失调是多种人类疾病出现的介质。研究表明,肥胖、动脉粥样硬化、神经系统疾病和糖尿病等代谢性疾病和炎症性疾病的患病率与拟杆菌的数量呈反比关系。
同样,拟杆菌被发现与低密度脂蛋白(LDL)和甘油三酯(TG)水平呈负相关,并且这两种细菌都表现出抗肥胖反应。在类似的模式中,小鼠体重的下降与细菌属成员的增加密切相关。
✦ 肠道微生物对人体产生的有益影响
肠道微生物群是影响时间生物学、代谢传感器、炎症细胞因子、神经功能和免疫系统的"物质工厂"。
肠道微生物消耗膳食中的营养物质来产生能量和代谢物。许多这些代谢物随后进入循环,在那里它们可能会经历额外的代谢并改变宿主的代谢和营养状况。
肠道微生物群对人体具有有益的作用。主要好处是它在维持粘膜屏障完整性方面的作用;由难以消化的纤维产生的短链脂肪酸对宿主有利的作用,包括对抗肥胖和糖尿病的活动;此外肠道微生物可以合成必需维生素,包括维生素K、烟酸、核黄素、吡哆醇、泛酸和硫胺素,以防止感染病原体;增强免疫系统;调节昼夜节律;以及身体的神经功能。
✦ 肠道菌群产生的代谢物影响宿主免疫、代谢
肠道微生物产生的许多代谢物进入血液,可以立即发挥作用,也可以通过宿主进行额外的代谢,产生可能影响宿主代谢和组织功能的生物活性化学物质。
除了促进脂肪吸收外,次级胆汁酸还会被重新吸收到血液中,作为宿主细胞法尼醇X受体(FXR)和TGR5胆汁酸受体的配体,对免疫功能和能量代谢等产生影响。
同样,由细菌产生的短链脂肪酸,如乙酸盐、丁酸盐和丙酸盐,不仅是肝脏和肠上皮的重要能量来源,而且还能够改变胰岛素分泌、免疫系统活动、食欲、大脑功能和脂肪脂肪。
这些短链脂肪酸影响身体的免疫、激素和神经系统,因为它们参与细胞因子、神经递质、内分泌信号和细胞凋亡过程的产生。
✦ 一些细菌代谢物对宿主是有害的
同时需要注意的是,一些细菌代谢物对宿主代谢的影响有时可能是有害的。
细菌从膳食蛋白质中产生的N-亚硝基化合物、氨和硫化氢会产生活性氧(ROS)并在DNA损伤中沉淀。
这些化合物还可以激活促炎途径。膳食胆碱的最终产物三甲胺-N-氧化物(TMAO)会促进动脉粥样硬化的发展,并与心血管疾病(CVD)、中风和死亡率相关。
因此,肠道微生物群落的这些改变有可能在2型糖尿病、体重增加、心血管疾病和代谢综合征等慢性疾病的出现中发挥作用。
慢性病的营养和食物指导
✦ 许多人患有慢性病
如今,大多数人患有一种或多种慢性疾病以及药物使用等相关因素可能会改变营养需求,导致营养缺乏和继发性合并症。
超过一半的人存在超重或肥胖,并且过去二十年来严重肥胖的患病率有所增加。超重和肥胖率高是一个重要的公共卫生问题,其还会增加患心脏代谢疾病和某些类型癌症的风险。
✦ 疾病会影响营养吸收、分配造成需求差异
众所周知,疾病过程会影响组织之间的营养吸收、分解代谢和营养分配,可能导致维持某些关键营养充足的需求差异。
术语“特殊营养需求”是指在疾病状态下维持充足性所需的营养需求。慢性病、遗传性疾病,包括先天性代谢错误、炎症、饮食不耐受、药物、过敏、创伤和感染等病理状态,可以改变基本营养需求的缺乏和毒性。
目前,在医学营养治疗中考虑了其他食品物质的这些差异性要求,这是一种更个性化的指导,目前超出了DRI的范围。
开发旨在减少慢性病的DRI的生物学基础并不支持将基于营养和食物的建议限制于表面健康的个体,因为对于疾病何时开始没有明确的诊断标准。慢性疾病在整个生命周期中发生和显现,与衰老以及许多静态和动态因素以及环境暴露(包括食物)密切相关。
生物系统的逐渐衰退是衰老和慢性疾病进展的标志,这些疾病从生命的最初阶段就开始了。生物网络和系统衰退导致功能侵蚀或随机行为增加,导致网络输出和系统行为的可变性/稳定性增加,从而与健康不相容。
例如,在分子水平上,这可以通过人类基因组表观遗传景观的侵蚀导致基因表达模式和网络功能的改变来量化。和血浆代谢物与年龄相关的变化,其中一些是营养状况的生物标志物,以及氧化还原电位的变化。
✦ 生活方式影响慢性疾病的发生和进展
许多生活方式、环境和内在生理危险因素都会影响生物衰老的速度以及慢性疾病的发生和进展,包括某些癌症、2型糖尿病、心脏代谢和神经退行性疾病等。
家族史(即遗传学)是寿命的主要不可改变的预测因素。慢性疾病是在人类发育的最早阶段通过基因组突变和干细胞表观遗传编程等机制引发的。在这方面,营养需求可以被视为一种动态对策,以减缓或维持与年龄相关的促进健康所需的生物系统和网络功能能力的下降,而这正是精准营养努力可能最有益的地方。
基于人群的减少生物衰老的方法需要将营养暴露、状态和功能的生物标志物与疾病和衰老的生物标志物更好地联系起来。
减少慢性病的考虑因素
2017年,开发了一个框架,正式将慢性病风险降低价值观纳入DRI。这一变化强调了饮食指导的转变,除了避免不足之外,还转向促进健康和降低慢性病风险。
这种通过饮食降低慢性病风险的范式转变及其基本原理已在其他地方发表。与缺乏症不同,大多数慢性疾病会随着时间的推移而显现出来,并且是由衰老过程以及行为和生活方式因素的累积影响造成的。
✦ 减少慢性病需要考虑多个因素的相互作用
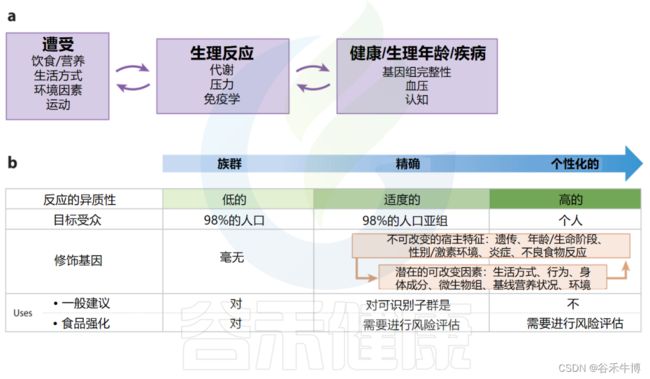
如上所述,建立减少慢性病的食物和营养摄入建议需要考虑多个独立和相互作用的因素。这些额外的生物因素增加了饮食与疾病关系中的人群异质性,进一步推动了对饮食建议更加精确的需求。
实施精确营养需要知识和工具(如生物标志物),这些知识和工具可以量化暴露(如饮食/营养、生活方式、环境因素、锻炼)与对健康和疾病(如基因组完整性、血压、认知)的生理反应(如代谢、压力、免疫)并将其联系起来。
值得注意的是,暴露和生理反应之间的联系是通过反馈循环相互影响的(例如,饮食可以影响炎症,进而影响饮食需求),并且生理反应与健康、疾病和衰老是相互影响的。
饮食与慢性病关系的原因和调节因素包括但远远超出必需营养素在维持代谢和其他功能中所发挥的作用。其他食品物质可以通过:
(a)必需营养素缺乏和过量的继发致病作用来影响慢性疾病的发作和进展;
(b) 必需营养素摄入不平衡的致病作用;
(c) 氧化应激、免疫反应和接触特定食物成分的其他反应的致病作用;
(d) 在没有必要性或毒性的情况下摄入影响慢性疾病的非必需生物活性食物成分;
(e) 饮食行为,包括时间饮食模式,也称为时间营养。
▼
必需营养素缺乏和过量
由必需营养素缺乏和毒性引起的疾病已得到临床认可和充分表征并且历史上在建立DRI(膳食参考摄入量)的过程中一直被考虑,重点是维持营养充足和生理功能。
当DRI(膳食参考摄入量)扩展到包括降低慢性病风险时,必须考虑营养物质在其已知功能作用之外的其他生理反应。饮食与慢性病的关系超越了生理功能,延伸到对饮食成分的免疫和应激反应,这些反应可以降低或增加疾病风险。
✦ 必需营养素的缺乏会引起炎症
必需营养素的缺乏和过量都会引起炎症,某些营养素的升高会改变生理过程,从而增加或降低慢性疾病的风险但不引起毒性。
例如,在动物模型中,镁缺乏会刺激氧化应激和吞噬细胞分泌促炎介质,导致慢性炎症。在人群中,膳食镁摄入量与心脏代谢疾病、代谢综合征、结直肠癌以及血清或血浆C反应蛋白(CRP)呈负相关。注:CRP是炎症的生物标志物,是许多慢性疾病的危险因素。趋化因子和CRP等炎症介质可作为生物标志物,报告衰老、运动、营养和慢性疾病,包括动脉粥样硬化、糖尿病、肥胖、肌肉减少症和阿尔茨海默病。
同样,亚临床维生素C不足与炎症、血浆C反应蛋白水平升高和免疫功能下降有关。
✦ 适当补充营养素水平可以降低炎症水平
另一方面,在不缺乏营养的情况下,大量摄入必需营养素可能会降低患有慢性疾病的人的炎症。补充维生素D可能会降低超重和肥胖儿童的血液CRP水平并改善小儿肠道综合征的炎症标志物。
叶酸和维生素B12缺乏已被证明会加剧与疾病和感染相关的炎症,而叶酸补充剂已被证明可以降低CRP血液水平。
总的来说,目前对必需营养素缺乏或过量在氧化应激和炎症中的作用的理解还是不够。需要进一步发展营养与慢性疾病关系的基础知识以及开展更多人体临床试验来验证特定营养素与慢病干预之间的关系。近年来,许多医院开设了临床营养科推进转化营养干预在疾病治疗和康复进程。
▼
必需营养素摄入不平衡
慢性疾病发生和进展的多因素病因学的特点是内在生物系统和外在环境因素(包括必需营养素)之间的相互作用,这些因素影响对维持健康至关重要的生理功能。
✦ 营养状况的不平衡会加速或加剧慢性疾病
事实上,所有代谢、信号传导和其他生理网络都涉及多种必需营养素之间的相互作用,同一系统中营养素之间营养状况的不平衡与加速或加剧慢性疾病有关。
钠/钾的平衡与血压以及心血管等疾病的风险相关
钠、钾和氯作为电解质发挥着重要作用,可调节细胞内的液体平衡,并在维持血压方面发挥关键作用。尿液中钾/钠比例的失衡反映了饮食暴露,并与成人高血压和心血管疾病的风险增加以及早产儿的发病率有关。
虽然一些人的饮食钠摄入量与血压之间没有关联,但一些人群亚组被认为对盐敏感,并且根据年龄、性别和血统,以及肾功能受损、肥胖和现有高血压的人群,更有可能对较高的钠对血压产生负向反应。
叶酸与维生素B12不平衡会致病
钠与钾的膳食比例对于高血压的影响至关重要。其他矿物质以及与饮食模式的相互作用也与健康相关。
B族维生素叶酸和维生素B12的状态不平衡及其相互作用可能会致病。叶酸介导的一碳代谢是合成核苷酸前体和将同型半胱氨酸重新甲基化为蛋氨酸所必需的代谢网络,支持100多种细胞甲基化反应。
该网络需要许多必需的微量营养素,包括维生素B12、维生素B6、叶酸、烟酸和核黄素。维生素B12缺乏情况下叶酸状态升高与单独维生素B12缺乏的神经、代谢和临床表现的恶化有关。这些潜在的有害相互作用引起了人们对叶酸摄入过量的担忧。
这些例子强调,需要考虑并推荐人群中的营养状况范围,通过优化给定生物网络中的营养素相互作用来促进健康,从而预防慢性病,为我们提供更精确指导的能力。
▼
对食品成分的免疫反应
食物不耐受和食物过敏是对食物的免疫不良反应。它们是常见的慢性炎症性疾病,其患病率正在增加,影响生活质量,并且与其他慢性病的较高风险相关。
据估计,高达20%的人表现出胃肠道食物不耐受。
✦ 食物不耐受会增加胃肠道疾病风险
食物不耐受的原因有很多,包括:(a)饮食成分的药理学作用,例如短链可发酵碳水化合物,也称为可发酵寡糖、二糖、单糖和多元醇 (FODMAP);(b) 非免疫性麸质敏感性;(c)酶和运输缺陷。它们通常通过排除饮食来管理。
食物不良反应最常见的临床表现是肠易激综合症,它会增加胃肠道癌症的风险,但食物不良反应也会对皮肤、呼吸、神经和心血管系统产生负面影响。并增加患乳腺癌的风险。
✦ 不同的食物抗原会引起独特的免疫反应
食物过敏与其他形式的食物不耐受不同,有时相同的饮食成分可能引发多种不耐受机制。当免疫球蛋白E(IgE)介导的针对特定食物成分中存在的抗原表位的免疫反应时,就会发生食物过敏。
其他食物抗原也可以介导免疫和炎症反应。数据揭示了IgG抗体对患者食物中存在的表位的反应性增加,最常见的反应性食物是酪蛋白、牛奶、小麦、麦醇溶蛋白、蛋清和大米;不太常见的是对坚果、蔬菜、鱼类、海鲜和肉制品的反应。
对麸质中的麦醇溶蛋白敏感导致乳糜泻
例如,乳糜泻是一种与遗传相关的自身免疫性肠病,它使个体对某些谷物中存在的麸质中的麦醇溶蛋白和麦谷蛋白敏感,从而导致炎症反应。它出现在大约1%的人口中。
另一方面,麸质不耐受更为常见,影响高达6%的人口,总体而言,非乳糜泻小麦敏感可能影响 10% 的人。麸质不耐受与遗传无关,也不会引发过敏反应,但由于麸质成分激活先天免疫系统和多种炎症途径,它可能会出现与乳糜泻类似的症状。
✦ 食物成分引起的不良反应还会对肠道微生物产生负面影响
对食物和食物成分还有多种其他不良反应,它们独立于免疫参与,并通过许多不同的已知和未知机制表现出来,它们被分为依赖宿主或独立于宿主。
最常见的临床表现包括荨麻疹或血管性水肿,但也包括哮喘、胃肠道症状、低血压、头痛和湿疹。非免疫性、不依赖宿主的食物不耐受涉及食物中具有药理活性的化学物质,这些化学物质会影响致敏个体,包括水杨酸盐、血管活性胺(如组胺)、谷氨酸盐和咖啡因,但其病因和管理仍然难以捉摸。
非免疫性、宿主依赖性食物不耐受通常包括缺乏宿主代谢能力,如乳糖和果糖不耐受以及对某些食物(包括FODMAP)的非特异性反应。这些化合物在胃肠道中引起渗透作用,促进结肠细菌的不良发酵,并可对微生物群的组成产生负面影响,引发炎症,并诱发肠易激综合征症状。
▼
生物活性膳食成分
✦ 摄入生物活性膳食成分可以降低慢性病风险
摄入非必需生物活性膳食成分(也称外源性成分)有可能降低慢性病风险,因此可以在建立DRI的过程中进行评估。
类胡萝卜素与眼睛健康有关
其中包括非维生素原A类胡萝卜素、叶黄素和玉米黄质素等生物活性物质,它们与眼睛健康和眼睛发育有关。
类黄酮与多酚具有抗氧化活性
类黄酮和其他多酚具有抗氧化和转录激活活性,并与保护多种慢性病有关,以及潜在的半必需营养素,例如omega-3脂肪酸。
ω-3的摄入与多种疾病存在关联
omega-3脂肪酸的摄入量与心血管疾病风险、认知功能、抑郁症风险和早产等结果有关。然而,支持这些关联的数据在文献中并不一致,这可能说明当食用不同的摄入量范围时,可能会改变健康结果。
✦ 生物活性膳食成分对于不同人群的健康益处存在差异
由于这些化合物可以改善健康,但从技术上讲并不是生命所必需的,因此与必需营养素相比,其历史区域丰度的变化和可能起作用的不同选择压力,预计其生物和健康影响会出现更大的群体异质性。
此外,生物活性膳食成分以及许多合成药物的细胞浓度受其分解代谢的调节。这些底物被细胞色素P450酶降解或生物激活,细胞色素P450酶在人群内部和人群之间表现出底物特异性和催化活性的广泛差异,导致对各种底物的功能反应存在异质性。
▼
饮食行为
人们越来越认识到一天内进食的时间和频率会影响健康结果。
进食时间和某些其他食品物质(包括咖啡因和多酚)的直接生物效应可以改变生物钟。其他食品物质与生理昼夜节律、禁食(包括每日进食频率)和其他饮食行为的相互作用都会影响代谢过程并促成饮食与疾病的关系。
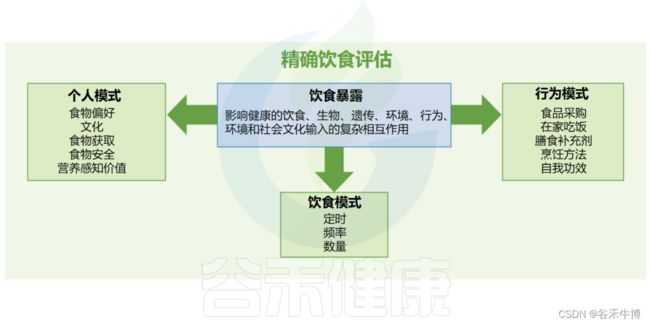
✦ 了解个人饮食及行为模式利于精确饮食评估
此外,饮食行为在生理反应中表现出个体间的差异,目前不被认为在DRI或DGA过程的范围内,但它们是饮食暴露组中的一个重要维度。
不仅要了解人们吃什么,还要了解饮食行为的这些背景因素,对于了解如何制定精准的营养建议至关重要。需要对精确饮食评估进行研究以捕获这些和其他背景因素,以提高我们提出更精确饮食建议的能力。
Bailey RL,et al.Annu Rev Nutr.2023
Bailey RL,et al.Annu Rev Nutr.2023
精准营养策略可行吗?
个体对特定饮食的反应是代谢、环境、社会和遗传等因素相互作用的结果,这表明不同的个体对相同的干预措施会有不同的反应。
例如,在最近一项针对600多人的随机对照试验中,12个月的低脂饮食导致一些人体重减轻超过30公斤,但另一些人体重增加超过10公斤,这表明单一饮食没有对所有人都有效,而精准营养可能会更有效。
饮食的良好保留和差异化,这些因素可能可以用微生物组等未测量的元素来解释。
在研究中,来自7个欧洲国家的1607名成年人被招募参加随机对照试验,该试验提供常规饮食建议(对照)或基于个人基线饮食的个性化建议;个体基线饮食加上表型(人体测量和血液生物标志物)或个体基线饮食加上表型和基因型(五种饮食反应性遗传变异)。这项研究结果表明个性化饮食优于常规饮食。
在这种情况下,为患者设计精准饮食计划可能会:
1)在治疗疾病方面更有效;
2)提高依从性,因为个性化饮食更容易被患者接受;
3)限制较少。
这些循证医学的研究证据也正是我们以及相关公司开展业务的基础——搜集、整理文献,构建数据库获得解决方案。然后,从客户的行为数据反馈中学习、进一步反哺研究。
除此之外,很多慢病和饮食模式之间的因果关系都逐渐清晰,或者反过来说,现代科学家和临床医生、营养学家(通常是几个角色兼具者)已经开发出了很多应对慢病的饮食模式(“疗效”多数远大于药物),其中最大一块就是“胃肠道慢性疾病”,FODMAP饮食、排除食物不耐受的饮食法等,就可以干预很多胃肠道疾病,胃肠道疾病也是最刚需的市场。
目前国内外已经有很多商业公司推出多种慢性病提供个性化营养计划,包括糖尿病、过敏、自身免疫问题和胃肠道问题。
不管通过怎样的数据驱动,为“任何地方的任何人提供一种方便且负担得起的方式,利用食物作为药物并实现可持续营养实践来推进个人护理“”应该是未来精准或个性化营落地的基本要求。
为“任何地方的任何人”、“方便且可负担、可持续个性化健康调理和营养方案”,也是我们谷禾健康长期追求的理念。
主要参考文献
Bailey RL, Stover PJ. Precision Nutrition: The Hype Is Exceeding the Science and Evidentiary Standards Needed to Inform Public Health Recommendations for Prevention of Chronic Disease. Annu Rev Nutr. 2023 Aug 21;43:385-407.
Rodgers GP, Collins FS. Precision Nutrition-the Answer to "What to Eat to Stay Healthy". JAMA. 2020 Aug 25;324(8):735-736.
Demetrowitsch TJ, Schlicht K, Knappe C, Zimmermann J, Jensen-Kroll J, Pisarevskaja A, Brix F, Brandes J, Geisler C, Marinos G, Sommer F, Schulte DM, Kaleta C, Andersen V, Laudes M, Schwarz K, Waschina S. Precision Nutrition in Chronic Inflammation. Front Immunol. 2020 Nov 23;11:587895.
Zeb F, Osaili T, Obaid RS, Naja F, Radwan H, Cheikh Ismail L, Hasan H, Hashim M, Alam I, Sehar B, Faris ME. Gut Microbiota and Time-Restricted Feeding/Eating: A Targeted Biomarker and Approach in Precision Nutrition. Nutrients. 2023 Jan 4;15(2):259.
Lee BY, Bartsch SM, Mui Y, Haidari LA, Spiker ML, Gittelsohn J. A systems approach to obesity. Nutr Rev. 2017 Jan;75(suppl 1):94-106.
Wellens J, Vissers E, Matthys C, Vermeire S, Sabino J. Personalized Dietary Regimens for Inflammatory Bowel Disease: Current Knowledge and Future Perspectives. Pharmgenomics Pers Med. 2023 Jan 12;16:15-27.
Zhu Z, Li YL, Song S. Editorial: Biomarkers: precision nutrition in chronic diseases. Front Nutr. 2023 Jul 24;10:1257125.
Dashti HS, Scheer FAJL, Saxena R, Garaulet M. Timing of Food Intake: Identifying Contributing Factors to Design Effective Interventions. Adv Nutr. 2019 Jul 1;10(4):606-620.