Review
Insights on the Use of α-Lipoic Acid for Therapeutic Purposes
关于α-硫辛酸用于治疗目的的洞察
Biomolecules 2019, 9, 356; doi:10.3390/biom9080356
www.mdpi.com/journal/biomolecule
摘要:
α-硫辛酸(ALA,thioctic acid)是一种由植物、动物和人类产生的有机硫成分。它具有多种性质,其中具有很强的抗氧化能力,并广泛用作糖尿病多发性神经病相关疼痛和感觉异常的外消旋药物。当然,ALA位于线粒体中,在那里它被用作丙酮酸脱氢酶(PDH)和α-酮戊二酸脱氢酶复合物的辅助因子。尽管其具有各种潜力,但由于其药代动力学特征,ALA治疗功效相对较低。数据表明ALA具有短的半衰期和生物利用度(约30%),其由于肝脏降解、溶解度降低以及胃中的不稳定性引发。然而,使用各种创新配方大大提高了ALA的生物利用度。 ALA的R对映体显示出更好的药代动力学参数,包括与其S对映体相比增加的生物利用度。实际上,两亲性基质的使用具有改善ALA生物利用度和肠吸收的能力。而且,与其固化剂型相比,ALA的液体制剂与更高的血浆浓度和生物利用度相关。因此,改进的制剂可以增加ALA吸收和生物利用度,导致治疗功效的提高。有趣的是,ALA的生物利用度将取决于年龄,而性别没有差异。本综述旨在提供从临床前研究到临床试验的最新研究,评估ALA在患有神经病变、肥胖、中枢神经系统相关疾病和妊娠异常的糖尿病患者中的用途。
关键词:α-硫辛酸;生物利用度;配方;临床试验;糖尿病神经病变;肥胖; 精神分裂症;硬化;怀孕
1.简介
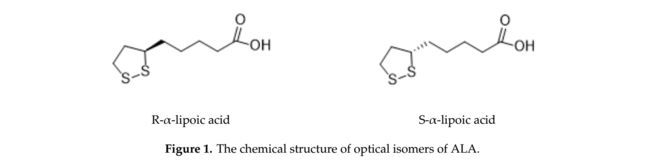
α-硫辛酸(ALA),也称为1,2-二硫戊环-3-戊酸或硫辛酸,是线粒体中常见的化合物,是不同酶功能所必需的。 ALA于1951年由Reed分离[1]作为醋酸盐替代因子,其首次临床应用可追溯至1959年,用于治疗Amanita phalloides的急性中毒,也称为死亡帽(来自蘑菇)[2]。简而言之,ALA是一种由植物、动物和人类生产的有机硫化合物,存在于自然界中。在Krebs循环中,ALA在各种化学反应中起重要作用,作为参与细胞能量产生的一些酶复合物的辅助因子。它还与蛋白质形成共价键并具有治疗潜力。它有一个手性中心和不对称碳,产生两种光学异构体:R-和S-硫辛酸(图1)[3]。因此,ALA具有两种对映体形式,称为S和R对映体,被认为是彼此的镜像。 S和R对映体均在ALA中同等存在,然而R异构形式是天然存在的,而S异构体是通过化学方法制备的。食物是R对映体的天然来源,在生物体内自然产生,与蛋白质形成共价键。虽然ALA在自然界中作为R对映体存在,但合成补充剂由R和S形式的外消旋组合物组成[4]。虽然人体以低量合成,但产生的ALA量不足以满足细胞的能量需求。因此,它主要来自饮食,特别是来自肉类和蔬菜。水果也是这种酸的来源[5]。
另一方面,ALA具有许多临床上有价值的特性[5,6]。它充当酶促辅助因子[7],还参与葡萄糖[8,9]和脂质[10]代谢并管理基因转录。 ALA还可以作为抗氧化剂,因为它不仅可以改善而且可以恢复内在的抗氧化系统,并支持它们的生产或细胞可及性[11-13]。它还能有效地去除血液中导致氧化应激[11,13,14]的重金属, ALA相对于其他抗氧化物质最独特的特征是它作为脂质和水溶性化合物反应[5,6]。毫无疑问,它是一种强抗氧化剂,但由于某些原因,禁止将其用于药用目的; 然而,在某些州,它被用作补充剂,而在其他州则用作补救措施[5,6,15]。这些限制是由于物质本身的一些内在特征,例如由于二硫戊环环的公开和分子之间二硫键的出现而引起的可变性。限制ALA口服使用的其他性质是其降低在胃肠道中溶解的能力和增加的肝代谢速率。此外,除了广泛已知的抗氧化潜力外,ALA还具有许多其他功能,因为它参与线粒体产生能量,通过作为参与代谢的各种酶的辅助因子[5]。
此外,ALA在代谢过程中的葡萄糖消耗中起着至关重要的作用。例如,ALA已被用作糖尿病多发性神经病相关疼痛和感觉异常的外消旋药物[16]。
ALA还通过线粒体在能量转导中发挥重要作用[6,17]。在ALA的小分子中存在两个还原或氧化的硫醇基团。氧化形式称为ALA或简称为硫辛酸,而还原形式称为二氢硫辛酸(DHLA)。 ALA使自由基失活,还原形式也与活性氧(ROS)相互作用[8]。当然,ALA存在于线粒体中,它与E2亚基结合,并用作丙酮酸脱氢酶(PDH)和α-酮戊二酸脱氢酶复合物的辅助因子[18]。 ALA是由半胱氨酸和脂肪酸在体内以非常少的量从头合成的,因此需要从外源来补充它[19]。 ALA可改善血糖控制[6],减轻糖尿病(DM)并发症[20,21]甚至是周围神经病变症状,同时有效减轻重金属毒性[22]。
1.1 硫辛酸的形式
1.1.1 R-α-硫辛酸
该异构体存在于自然界中,存在于动物,植物和人体中。在本质上,这是ALA证明其效果的形式[23]。
1.1.2 S-α-硫辛酸
这种异构体在自然界中不存在。它可以通过硫辛酸的许多化学方法获得,并阻止R-ALA的重要活性,例如它们与基因,酶和蛋白质的相互作用[23]。
ALA存在于许多蔬菜(菠菜,西兰花,番茄,布鲁塞尔芽和米糠),脂肪和内脏(例如肝和肾)中的脂酰赖氨酸形式(具有结合赖氨酸残基的ALA)中。此外,ALA还可以通过线粒体中的辛酸和半胱氨酸(作为硫供体)的酶促反应来合成[24,25]。 ALA和DHLA都在氧化代谢中具有决定性作用[26]。例如,已经证明ALA或其还原形式DHLA具有几种积极的健康益处,包括作为生物抗氧化剂,金属螯合剂和解毒剂,还能够减少其他抗氧化剂的氧化形式,包括谷胱甘肽、维生素C/E和调节各种信号通路,如胰岛素和核因子κB(NF-κB)[27]。它还被用于与年龄相关的心血管,认知和神经肌肉缺陷[28-30],改变内皮功能障碍[31],减少氧化应激[32]和抑制动脉粥样硬化斑块的形成[33]。
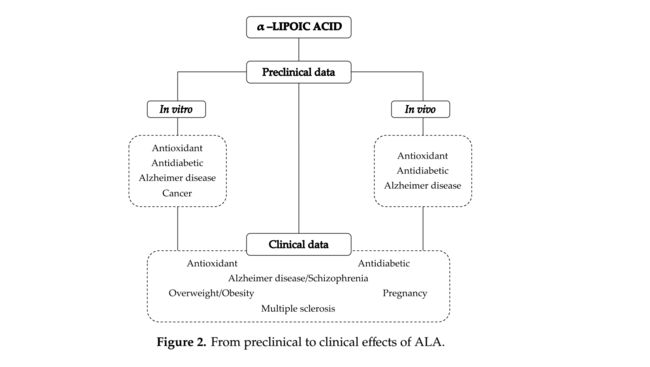
从这个意义上讲,考虑到ALA的潜在治疗作用,我们的目标是关注评估ALA药理作用的临床前和临床研究,同时还要考虑与其生物利用度相关的方面(图2)。
2.研究方法论
在PubMed数据库中搜索ALA的上述生物活性效应和临床影响,从2014年到2019年选择了以英语发表的文章。
3.α-硫辛酸药理活性:概述
多年来,ALA作为一种食品添加剂受到了相当多的关注,在治疗或治疗几种疾病方面都有益[11,34,35]。 ALA的药理作用是主要与其抗氧化活性有关,但ALA和DHLA也表现出有趣的心血管、认知、抗衰老、解毒、抗炎、抗癌和神经保护作用[35]。
3.1 α-硫辛酸抗氧化潜力
有大量关于ALA和DHLA抗氧化作用的文献数据,即作为金属螯合剂、自由基清除剂、内源性抗氧化剂的再生剂,如谷胱甘肽、维生素C和E以及氧化损伤的修复[36]。 ALA中巯基的存在是其金属螯合能力的原因[14,35]。此外,它能够增加细胞内的谷胱甘肽水平,螯合和排泄各种毒素,尤其是体内的有毒金属[35]。例如,Goralska等人的研究 [37]表明,ALA给药导致上皮细胞中铁离子的减少。这种变化与细胞对过氧化氢攻击的抗性升高有关,这意味着ALA对氧化应激的减少有直接影响[37]。简而言之,ALA被认为是一种水溶性和脂溶性的生物抗氧化剂,能够中和体内,细胞内外各处的ROS,因此,ALA被称为通用抗氧化剂[38-40】。
3.2 α-硫辛酸抗糖尿病的潜力
在代谢紊乱中,糖尿病(DM)代表严重的健康问题,目前影响全世界大约4.22亿人[41]。它由碳水化合物,脂类和蛋白质代谢紊乱造成[42]。此外,它已被认为是几种人类疾病发展的主要危险因素,包括动脉粥样硬化、高血压、心力衰竭、心肌梗塞、神经性疼痛甚至中风[43]。新出现的证据表明DM是由过量的ROS产生和抗氧化能力的损害引起的[44-46]。
一些研究强调了ALA在糖尿病中的潜在用途,因为它能够增加胰岛素敏感和胰岛素抵抗肌肉组织中的糖摄取[4,47],并通过葡萄糖转运蛋白重新分配到质膜和胰岛素受体底物-1的酪氨酸磷酸化[9]来刺激葡萄糖摄取。
3.3 α-硫辛酸和阿尔茨海默病
阿尔茨海默病(AD)是一种神经系统疾病,其特征在于认知、功能和行为改变。记忆丧失与AD患者中β-淀粉样斑块的形成和病理形式的tau升高有关[48,49]。大量证据支持氧化应激在AD发病机制中的作用[50-52]。已经提出非甾体抗炎药(NSAID)用于治疗神经变性疾病,包括AD。
然而,由于环加氧酶(COX)的抑制,延长的NSAIDs给药导致胃肠道毒性[35,53]。为了克服这种限制,已经基于氧化应激在AD发展中的预期作用来选择ALA。
体外研究表明,ALA对Aβ介导的细胞毒性具有神经保护作用[54-56],即通过保护皮质神经元免受Aβ或H2O2诱导的细胞毒作用[57],部分归因于PKB / Akt信号通路的激活。另一项研究表明,ALA具有有效保护培养的海马神经元免受Aβ肽和Fe / H2O2介导的毒性的能力[58]。
研究还表明,ALA通过激活胆碱乙酰转移酶增加乙酰胆碱(ACh)的产生,显示出抗痴呆或抗AD特性,胆碱乙酰转移酶可增加葡萄糖的吸收,从而为ACh的产生提供更多的乙酰辅酶A [59]。Haugaard和Levin(2000)报道DHLA显著提高了纯化的胆碱乙酰转移酶制剂的活性,并且通过从部分纯化的胆碱乙酰转移酶透析除去,导致酶活性完全消失,并且其添加恢复了对正常的活性。水平。当用大鼠脑和心脏以及兔膀胱组织的提取物重复实验时获得相同的发现。因此,作者得出结论,它可能作为胆碱乙酰转移酶反应中的辅酶[60]。
另一方面,炎症在AD中起关键作用。它与淀粉样蛋白斑块有关,被活化的星形胶质细胞和小胶质细胞包围,其特征是自由基和促炎细胞因子水平升高[61],TNF-α被认为是从轻度认知功能障碍到AD的指标[59,62]。 ALA以这种方式具有多种复杂的作用,即清除ROS,过渡金属离子,增加还原型谷胱甘肽的水平[59,63],清除脂质过氧化产物[62,64,65]甚至作用于信号转导通路[ 63,66]。同样,Dinicola等人[67]发现ALA通过DNA甲基化依赖性调节下调SK-N-BE人神经母细胞瘤细胞中炎性细胞因子IL-1B和IL-6的水平,为表观遗传机制在AD控制/预防中的作用铺平了道路。
3.4 α-硫辛酸和癌症
越来越多的文献强调ALA在癌症治疗中的潜在应用[68,69]。癌细胞优先将葡萄糖转化为乳酸以产生ATP,这种现象称为Warburg效应或有氧糖酵解。癌细胞中有氧糖酵解的持续激活导致癌基因激活或肿瘤抑制因子丧失,从而导致癌症进展。在这方面,有氧循环的抑制可能有助于抗癌作用[70,71]。丙酮酸脱氢酶催化丙酮酸至乙酰CoA转化,从而防止乳酸产生。 Feuerecker等。研究了ALA是否能够激活肿瘤细胞中的丙酮酸脱氢酶。结果显示,ALA抑制神经母细胞瘤细胞系Kelly、SK-N-SH、Neuro-2a和乳腺癌细胞系SkBr3中的细胞增殖,[18 F] -FDG摄取和乳酸形成以及增加的细胞凋亡。在具有皮下SkBr3细胞的小鼠异种移植模型中,每日用ALA治疗延迟肿瘤生长[72]。
ALA通过激活AMPK并随后在BCPAP,HTH-83,CAL-62和FTC-133细胞系中下调mTOR-S6信号传导途径来抑制甲状腺癌细胞的增殖和生长。在同一项研究中,还发现ALA还使用BCPAP和FTC-133细胞显着抑制小鼠异种移植模型中的肿瘤生长[73]。在肺癌细胞中,ALA通过Grb2介导的EGFR下调抑制细胞增殖[74]。
研究还表明,ALA能够产生ROS,促进肺癌[75],乳腺癌[76]和结肠癌[77,78]中ALA依赖性细胞死亡,提示它可以触发细胞凋亡的线粒体途径。癌细胞。最近,评估了ALA对乳腺癌细胞迁移和侵袭的影响[79]。结果表明ALA抑制转移性乳腺癌细胞迁移和侵袭,部分通过ERK1 / 2和AKT信号传导。总之,科学数据表明ALA可用于癌症管理和预防。
4.α-硫辛酸的临床前可行性
4.1 α-硫辛酸的抗糖尿病特性
如前所述,ALA已显示可用于增加胰岛素敏感和胰岛素抵抗肌肉组织中的糖摄取[4,47]。此外,甘油三酯在体内的储存导致2型糖尿病进展。当激活时,AMP激活的蛋白激酶(AMPK)增加糖摄取,脂肪酸氧化和线粒体生物发生。在肥胖大鼠中,肌肉AMPK水平降低。然而,当对这些大鼠进行ALA给药时,观察到骨骼肌和全身中胰岛素刺激的葡萄糖处理的增加。还发现ALA增加脂质氧化并激活AMPK。这些结果表明ALA通过AMPK激活改善胰岛素敏感性[80]。 Konrad等人 [9]已经证明ALA通过葡萄糖转运蛋白重新分配到质膜和胰岛素受体底物-1的酪氨酸磷酸化来刺激葡萄糖摄取。在Bitar等人进行的一项研究中 [81]据发现,通过信号转导途径,30天内摄入50mg / kg可避免大鼠中糖尿病介导的线粒体和内皮功能障碍。已知在DM中,通过调节内皮型一氧化氮合酶(eNOS)活性和氧化应激来降低NO生物利用度[82]。在老年大鼠的内皮细胞中,ALA摄入导致通过Akt的eNOS磷酸化降低[83]。 ALA能够触发人脐带血管内皮细胞和THP-1人单核细胞系中的Akt磷酸化[84,85]。这些研究结果表明ALA引起的内皮功能改善部分归因于eNOS再结合和NO生物利用度的提高[82]。因此,在DM管理中使用ALA作为佐剂与其抑制产生自由基的糖化的能力有关[82,86,87]。总之,本文积累的信息表明ALA治疗DM的潜在治疗价值。
4.2 α-硫辛酸和阿尔茨海默病
鉴于上述关于ALA用于神经退行性疾病的突出方面,特别是在AD中,Quinn等人。 [88]评估了补充ALA的饮食对老年Tg2576小鼠AD的海马依赖性记忆的影响。作者发现ALA导致学习和记忆保留显著改善[88],ALA治疗和未治疗的Tg2576小鼠之间的β-淀粉样蛋白水平没有显著差异[89]。
4.3 α-硫辛酸和妊娠
考虑到ALA具有广阔的抗氧化潜力及其对多种炎症状况的影响,最近的证据越来越突出其对生理过程(如妊娠)的影响。有趣的是,Micili等人 [90]评估了ALA阴道给药对雌性Wistar大鼠的影响,即测试其组织分布,对植入过程的影响以及对比诱导早产的有效性。奇怪的是,作者发布[90]阴道ALA被很好地吸收和分布,不会影响植入过程,甚至能够显著恢复米非司酮加上前列腺素E2的作用,从而延迟了分娩时间,减少了mRNA和促炎细胞因子的合成。
5.α-硫辛酸的药代动力学
尽管ALA具有各种生物活性,但研究报道由于其药代动力学特征而具有有限的治疗功效。数据表明,由于某些机制,包括肝脏降解、溶解度降低以及胃部不稳定,半衰期短,生物利用度约为30%[91]。然而,通过使用直接提高ALA生物利用度的各种创新制剂,这已得到极大改善。
5.1硫辛酸通过食物来源的生物利用度
在血浆和人体细胞中,ALA的量不足以满足身体需要,除非我们通过饮食。通过饮食口服ALA已显著增加其量以满足身体的能量需求。研究表明,在禁食(空腹)期间口服R和S异构体的混合物时,ALA吸收增加40%,而当通过食物来源摄入时,这种酸减少20%。 ALA R异构体的功效在血浆中显示出更高的稳定性并且被适当地吸收。
一项研究表明,食物摄入后ALA的生物利用度大大降低,并且建议ALA应在进食后至少2小时或之前服用; ALA给药后至少30分钟应进餐[92]。此外,已经表明胃的酸性pH有利于通过胃肠吸收ALA。因此,ALA补充剂优选在空腹服用以有益于酸性胃pH。此外,它还可以减少ALA与其他营养素的竞争吸收[91]。严重的肾损害以及食物摄入会影响ALA的药代动力学参数[93,94]。 ALA可以通过饮食来满足其身体要求,并且可以从天然来源获得。如前所述,在动物中,ALA存在于红肉,肾脏,肝脏和动物心脏中,而在植物中,它们大量存在于菠菜,西红柿,西兰花,抱子甘蓝,豌豆,马铃薯和米糠中[11]。
5.2 硫辛酸吸收和血浆浓度
观察到口服摄入50至600mg硫辛酸后ALA迅速被吸收。达到最大血浆浓度所需的时间约为0.5至1小时。此外,发现R对映体的最大血浆浓度比S对映体高40%至50%[95]。当作为与γ-环糊精的包合物给予时,硫辛酸(RLA)的R对映体通过肠更快地被吸收。与未包含的R-硫辛酸相比,RLA /γ-环糊精(CD)表现出增加的血浆暴露。此外,血浆浓度 - 时间曲线下面积(AUC)比口服施用的未包含的RLA高2.2倍,十二指肠内施用时高5.1倍。
此外,即使由于在加工过程中给予淀粉酶抑制剂和结扎胆管,吸收也不会受到影响[96]。在另一项工作中,为了评估外消旋ALA制剂600mg的吸收,发现ALA花费很少的时间达到6.86±1.29μg/ mL的最大血浆浓度。
已经注意到在人类中相似剂量的血浆RLA浓度高于SLA [93]。最近在大鼠中进行的一项研究支持了最大血浆水平的类似结果,并且与SLA相比,RLA的AUC几乎高1.26倍[97]。一些研究人员报道,在胰岛素依赖性糖尿病患者中进行的研究中发现,ALA摄取率不受胃清空时间的影响,其中对ALA生物利用度没有特别的影响[93]。
5.3 不同配方对硫辛酸生物利用度的影响
一项研究使用了两种性别的18名受试者,包括9名女性和9名男性,并且观察了药代动力学参数以评估这些受试者中ALA的生物利用度。在Mignini等人的研究中观察并记录了血浆中ALA的最大浓度,超出终末ALA半衰期的最大浓度时间 [98]。由于ALA溶解性差,卵磷脂已被用作两亲性基质以增强其生物利用度。以600mg剂量的ALA片剂和软凝胶胶囊具有相同的生物利用度和其他药代动力学参数,但是当给予人体时,其高于通常较少溶解的ALA补充剂[98]。
可以确定ALA的高生物利用度,以及其体内均匀释放和高含量可以通过使用两亲性基质增加其溶解度来增加。
同样,另一项研究通过不同的口服和静脉注射(IV)制剂确定了ALA的生物利用度。该研究通过两种给药途径使用200mg ALA来确定ALA的药代动力学参数。 IV溶液在4分钟内给药,而口服溶液由317.6mg trometanlole盐组成,相当于200mg游离ALA,4片50mg和1片200mg,给予12名健康受试者。 IV溶液与口服溶液相同。在IV给药后长达2小时可以检测到ALA,并且在口服给药后长达4小时可以检测到ALA。然而,与口服给药相比,通过IV途径确定ALA的最大血浆浓度更高;此外,这两条路线的终端半衰期相当。先前的一项研究报道,对于所有口服给药,R异构体的生物利用度大于S异构体的生物利用度,而R异构体的生物利用度通过口服溶液最大[93]。
已经表明,当以液体形式口服给药而不是固体剂型时,ALA生物利用度显着增加。此外,它具有延长的稳定性,高血浆浓度和ALA的加速吸收[5,7]。
5.4 年龄和性别依赖性α-硫辛酸生物利用度
年龄极大地影响ALA生物利用度和最大血浆浓度。实际上,与年龄在18至45岁之间的年轻人相比,平均年龄大于75岁的成人中ALA的生物利用度和峰值血浆浓度显著更高。然而,在男性和女性之间没有发现ALA生物利用度的显著变化[17]。
另一项研究表明了类似的结果,但在片剂配方(600 mg)中,两种ALA对映体的血浆浓度在女性中高于男性。在低浓度时,没有明显的差异[99]。
6.临床试验中的α-硫辛酸
自20世纪50年代以来,ALA已被广泛研究,当时它的抗氧化特性首次被发现[100]。已经证明,ALA可有效缓解某些疾病的相关症状,如糖尿病、与年龄相关的心血管和神经肌肉缺陷,抗精神病药物相关的体重增加和代谢性肥胖[29,89,101,102]。它对不同类型疾病的潜在影响引起了人们的关注,因为研究结果很有希望,即在神经退行性疾病领域[103]。此外,临床试验的数量增加,以加深对其他ALA治疗特性的了解,并发现了有希望的效果。
6.1 α-硫辛酸对糖尿病神经病变患者的影响
根据世界卫生组织(WHO)的数据,糖尿病患者人数从1980年的1.08亿增加到2014年的4.22亿;据估计,2016年有160万人死于糖尿病[41,104]。糖尿病由一组由高血糖引起的疾病组成,这种疾病的影响分为两大类:大血管和微血管并发症。视网膜病变,肾病和神经病变是充分表征的微血管并发症,神经病变的发展与高血糖的程度和持续时间密切相关[105]。糖尿病神经病变也被认为是发病率和死亡率的主要原因[106]。
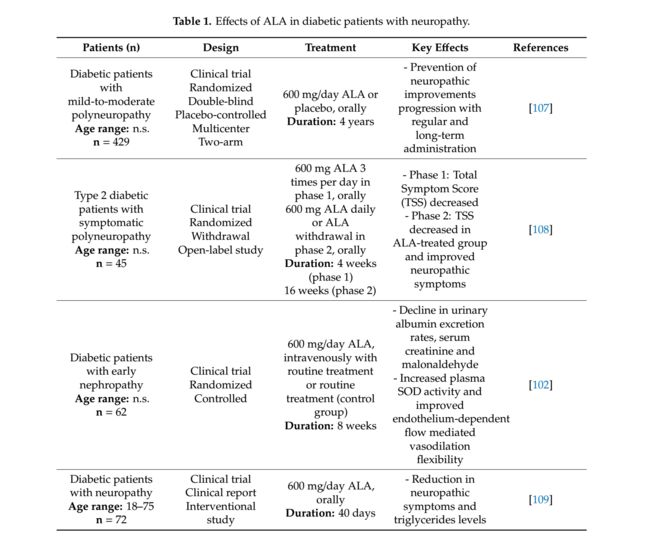
许多临床试验证实了ALA对糖尿病相关神经病变的影响(表1)。在Ziegler等人的随机,双盲,安慰剂对照,多中心,双臂,平行组试验中 [107],ALA被证明对轻度至中度糖尿病感觉运动多发性神经病(DSPN)有效。对于患有轻度至中度DSPN且每天600mg ALA的糖尿病患者,在4年后口服增加下肢神经病变损伤评分(NIS-LL)。在试验期间,增加的NISS-LL分数大于2被定义为有意义的进展。在各个治疗组亚组中测量所有统计学分析。在所有亚组中,体重指数(BMI)低于30 kg / m2的基线亚类,1型糖尿病患者,临床相关吸烟者和血管紧张素转换酶(ACE)抑制剂治疗亚组显示出平均改善(超过 - 1年后,ALA治疗组的NIS-LL治疗4年。与安慰剂组相比,亚组包括年龄超过55岁的男性患者,其心血管疾病史和神经病变超过3年的DSPN 2a期,ALA治疗组的NIS-LL显著增加。在该试验中,显示ALA可能具有通过常规长期给药来预防神经性损伤进展的潜力。然而,该试验基于轻度到中度的DSPN,可能不一致。需要进一步研究,包括更严格的DSPN阶段,以确认这些建议。
在一项随机、开放标签试验中,ALA活动分两个阶段进行了调查[108]。 45名糖尿病和有症状的多发性神经病患者参与了1期研究。所有参与者每天口服600mg ALA,持续4周,并被指示不接受任何缓解神经性疼痛的药物。由于个人原因退出患者和使用违禁药物,并非所有45名患者都完成了第1阶段。 4周后,将总症状评分(TSS)降低超过3分的患者与其基线值进行比较,并继续进入第2阶段,将参与者随机分为两组:一组继续ALA给药,另一组不给药(对照)16周。第2阶段的终点是TSS的变化,包括灼热和刺痛,感觉异常和麻木。
在第2阶段结束时,ALA组中TSS减少,而对照组没有变化。此外,灼烧疼痛和感觉异常从随机化过程到试验结束时下降;然而,在第2阶段,ALA治疗组的疼痛和麻木没有改变。此外,ALA治疗组使用止痛药(缓解疼痛)较低。
因此,该试验表明,ALA可改善神经病理症状,同时减少2型糖尿病患者出现症状性多发性神经病。在Sun等[102]的试验中,进行了一项两阶段随机对照研究。在第一阶段,将62名患有早期糖尿病肾病的患者分成对照组和ALA治疗组。两组均继续接受定期降糖治疗(常规治疗)和严格饮食;然而,他们没有给予ACE抑制剂。在ALA治疗组中,患者每天静脉内接受600mg ALA,持续2周。在第二阶段,招募21名不同的患者进行研究,并分成两组:正常白蛋白尿(尿白蛋白排泄率(UAER)低于30mg / 24h)和微量白蛋白尿(UAER 30-300mg / 24h)。在研究期间,只有一名患者有副作用(轻度恶心)。通过电子显微镜评估尿样中的外泌体质量。 ALA组血清肌酐和丙二醛水平以及UAER均降低。具有若干参数的流动介导的血管舒张(FMD)的分析显示仅与超氧化物歧化酶(SOD)活性正相关。此外,显示ALA处理组中CD63阳性外泌体的表达水平更高。该试验报道,在早期糖尿病神经病变中,ALA可以在短期使用中预防肾脏的一般氧化应激。
最近,Agathos等人进行了为期40天的前瞻性介入试验 [109]研究了ALA(600毫克/天,口服给药)对72名患有神经病变的糖尿病患者的作用,这些患者同时服用他们的处方糖尿病药物。患者计划在40天内进行2次就诊:一次在试验开始时(基线)和第四十天(结束日)。此外,还收集血液样本以获得基线和第二次访问值。根据问卷调查结果,两次访问之间神经病变症状减轻。在实验室结果中,平均空腹甘油三酯水平显着降低,而其他参数在两次随访之间没有变化。在这里,显示ALA摄入增强了糖尿病神经病变患者的生活质量,减少了主要症状和甘油三酯水平。
6.2 α-硫辛酸对超重/肥胖患者的影响
肥胖是一种复杂的疾病,包括异常的脂肪储存,可能导致严重的病理疾病,不仅在成人,而且在儿童。世界卫生组织的全球估计显示,1975年至2016年间,肥胖率几乎增加了两倍[110]。此外,超重(BMI 25- <30)和肥胖(BMI≥30)的人患糖尿病,肾脏和心血管疾病以及肥胖相关癌症的死亡风险显着增加[111]。此外,功能失调的脂肪组织是肥胖与其他继发性慢性疾病或致癌作用之间的主要合并因素,这是胰岛素抵抗,慢性炎症和脂肪因子分泌改变的结果[112]。因此,了解体重调节的生物学对于发现肥胖和肥胖相关疾病的有效介入疗法至关重要。除了经典和已知的肥胖治疗,其中包括低热量饮食和身体活动的组合,研究人员越来越多地利用新的有前景的营养补充剂来中断累积的肥胖风险[113]。
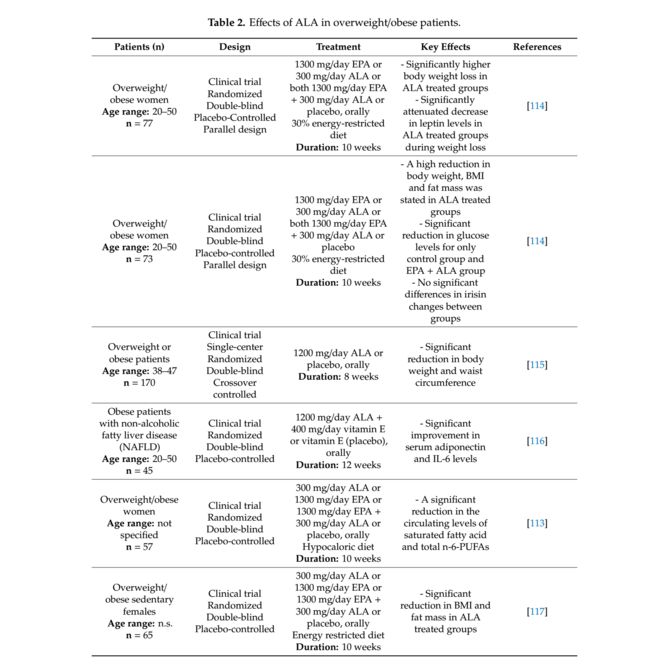
最近,ALA对体重控制的影响已经通过临床试验进行了研究,结果值得一提(表2)。在Huerta等人的研究中。 [114]研究了77名BMI值在27.5至40 kg / m2之间的健康超重/肥胖女性。所有参与者随机分为4组,每天用1300mg二十碳五烯酸(EPA)或300mg ALA或1300mg EPA加300mg ALA或安慰剂治疗10周。在此期间,所有个体均适应30%能量限制饮食。因此,尽管没有显著降低其静息代谢率,但ALA治疗组显示出更高的体重减轻和从治疗的第一周起瘦素水平的显著下降。在EPA加ALA补充组中发现甘油三酯水平和舒张压(DBP)显著下降。一般而言,除EPA补充的一组外,所有组在口服葡萄糖耐量试验(OGTT)期间瘦素水平显著降低并且胰岛素水平显著改善。在临床试验期间没有表现出不利影响。
Huerta等[114]也研究了循环鸢尾素和葡萄糖代谢之间的潜在关系以及ALA或EPA对它们的影响。 Irisin是一个肌动力;然而,到目前为止,它在肥胖中的作用尚不清楚。对73名健康超重或肥胖女性进行了平行设计的随机,安慰剂对照,双盲临床试验。治疗组设计,EPA、ALA的补充剂量和EPA / ALA的组合与上述研究相同。血糖水平仅在对照组和EPA和ALA组合组中显示出显著降低。与对照组和仅EPA治疗组相比,在ALA补充组中报告了体重,臀围和脂肪量的显著降低。减肥后,所有组均显示鸢尾素水平下降;然而,其浓度未显示组间的显着差异。此外,除了胰岛素水平的变化之外,干扰素水平变化的分析与干预10周后的体重减轻,脂肪量和无脂肪量没有显著的相关性。对于肥胖受试者中的鸢尾素水平降低,没有获得ALA施用的实质效果。因此,肥胖患者需要更多的临床干预来临床证明ALA在鸢尾素生成中的作用。
在另一项研究中,Li等人[115]研究了ALA治疗对一百七十名超重或肥胖患者(体重指数≥25kg/ m2)的体重、腰围和脂质代谢的作用。 ALA组每天口服1200mg ALA,持续8周,然后经过4周的清洗干预后,该组继续接受安慰剂治疗8周。 ALA和安慰剂干预的完全相反的序列用于安慰剂组。根据混合模型统计分析,ALA给药显示出显著的体重和腰围减少。然而,两组间瘦素水平,脂质谱和不良反应无显著差异。只有一名女性受试者在ALA组中出现严重的荨麻疹。
Hosseinpour-Arjmand等[116]评估了ALA对非酒精性脂肪性肝病(NAFLD)的肝酶和炎症标志物的影响,后者与肥胖的炎症成分高度配合。对45名NAFLD肥胖患者进行了临床试验,这些患者接受1200mg ALA加400mg维生素E或安慰剂,每天服用400 mg维生素E,持续12周。与安慰剂相比,ALA补充导致血清脂联素水平显著增加和IL-6以及胰岛素水平降低。与其基线值相比,ALA治疗组(91.3%)和安慰剂组(54.5%)均检测到肝脂肪变性等级显著改善;然而,两组之间的变化没有统计学差异。在试验中,结果表明每天补充1200毫克ALA是良好耐受的,没有任何不利影响。在Escoté等人的研究中。 [113],ALA给药参与了另一项临床试验,以确定成纤维细胞生长因子21(FGF21)之间的关系,后者在代谢和脂肪酸谱中起到能量稳态调节剂的作用。根据四个不同的能量限制饮食干预组10周,每天给57名超重或肥胖女性服用1300mg EPA或300mg ALA或1300mg EPA加300mg ALA或安慰剂。在试验结束时,所有实验组的血浆FGF21水平与体重减轻或总脂肪量之间没有显著关系。
Romo-Hualde等。 [117]通过遵循能量限制饮食10周,研究了67名健康超重/肥胖久坐的女性每天补充1300 mg EPA或300 mg ALA或1300 mg EPA加300 mg ALA或安慰剂时发生的代谢组学变化。在该研究中,尿样通过主成分分析和偏最小二乘判别分析用于模式识别和特征代谢物鉴定。与EPA治疗组和安慰剂组相比,所有ALA补充组的BMI和脂肪量均有较高的降低。因此,ALA给药可能对减轻体重有益,但是有必要进一步研究。
6.3 α-硫辛酸对精神分裂症患者的影响
精神分裂症是一种严重的精神疾病和功能失调性疾病,涉及许多症状。幻觉,妄想和许多神经认知缺陷,包括注意力和记忆力减退,都是公认的症状[118]。抗精神病药物的使用在一定程度上缓解了这些症状[119],但它们也可能导致一些副作用,如代谢综合征和体重增加[120,121]。在此,总结了描述ALA在精神分裂症患者中的作用的试验(表3)。在Kim等人的临床试验中。 [101],22名精神分裂症患者在一项双盲,随机安慰剂对照试验中随访12周。患者分为ALA治疗组(n = 10)和安慰剂组(n = 12)。患者在试验期间继续使用抗精神病药物。每餐前30分钟每天口服ALA。 ALA剂量从1200mg /天开始,然后如果效果不充分则增加,或者如果观察到副作用则减少。 ALA的总剂量范围为600-1800mg /天。主要结果是体重减轻和ALA治疗组的BMI降低。在试验的第一天和最后一天测定血浆葡萄糖和脂质谱以及脂肪计算机断层扫描的腹部脂肪面积。
因此,发现只有内脏脂肪区域在组间明显不同;然而,在糖和脂肪酸谱中均未检测到显着变化。因此,在该试验中,显示ALA似乎对抗精神病药物相关的体重增加有效。然而,只有少数患者参与了这项试验;因此,需要更大的患者群体的研究来支持这些发现。 Vidovi'c等[123]研究了18例精神分裂症患者ALA的影响,观察血浆脂联素水平和一些代谢危险因素在对照临床试验中的变化。
在早餐前将ALA以500mg /天的剂量给予所有患者3个月,并建议患者继续其通常的饮食习惯,抗精神病药物和生活方式。在开始(基线),中间和试验结束时处理血液采样。在血清样品中测定空腹葡萄糖,脂质状态参数和肝酶。此外,还分析了人体测量值,包括体重、身高、腰围和体脂肪。据报道,ALA治疗3个月后,血浆脂联素水平显着增加,而其他因素没有显着变化。此外,发现空腹血清葡萄糖和天冬氨酸氨基转移酶活性显着降低。因此,该试验表明ALA可能在精神分裂症的某些代谢危险因素的治疗中具有显着效果。尽管如此,由于该试验不包括对照组和开放标签设计,因此需要对较大患者组进行随机对照试验以确认结果。
最近,一项开放标签试验报告了ALA对10名稳定的慢性精神分裂症患者的影响[122]。试验进行4个月,每天补充100mg ALA,同时使用规定的抗精神病药物。有五次访问,也获得了精神病测量。在访问1和5时,神经认知评估(Trail Making Test,Block Corsi Test,Subtest Digit Span,Category(Animal)Fluency and Controlled Oral Word Association Test,COWA(FAS test)和Rey Auditory Verbal Learning Test),血液收集样品,腹围测量和体重指数(BMI)进行。消极/紊乱症状减少至少25%,包括兴奋(兴奋,敌意,紧张,羞怯和不合作),抑郁(抑郁情绪,内疚感和运动迟缓)和阳性症状(不寻常的思想内容,可疑和在第一次和最后一次访问之间观察到幻觉行为。此外,除了类别(动物)流畅性和FAS测试外,所有神经认知测试都有显著改善。腹围,BMI,全血细胞计数,肝酶水平和其他参数无显著差异。然而,需要具有较大群体的新试验以及随机,双盲和可控设计以获得可靠的结论。
6.4 α-硫辛酸对多发性硬化患者的影响
多发性硬化症是已知的中枢神经系统(CNS)致残疾病,并且归因于CNS的多中心炎症和脱髓鞘[124]。 MS中的炎症是通过T细胞侵入CNS而产生的,然后它们产生基质金属蛋白酶-9(MMP-9),这是与MS复发相关的重要蛋白酶。一些研究提出ALA可能是一种有用的MS药物,因为它对T细胞和炎症调节剂的迁移具有抑制作用[125,126]。
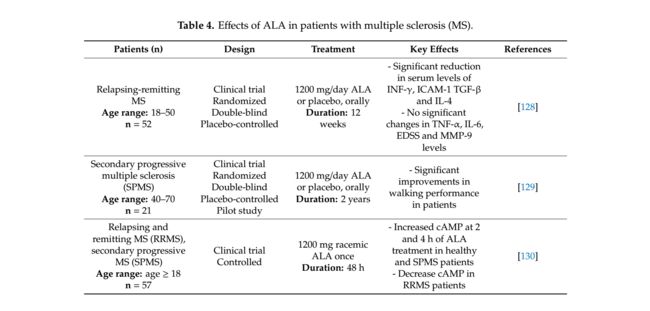
具有神经障碍和恢复期的变化周期的MS被描述为复发缓解型MS(RRMS),其是最熟悉的MS类型。另外,如果神经损伤,例如通过炎症介导的脱髓鞘的轴突丧失在RRMS患者中增加,则该疾病通常返回到继发进展性疾病过程(SPMS)或甚至很少进入原发进展型MS(PPMS)。因此,近年来关注改善治疗剂以抑制MS的进行性阶段[127]。 ALA在这方面的作用也通过一些临床试验进行了研究,总结在表4中。
在Khalili等人的研究中 [128]研究了每日ALA消耗对RRMS患者的抗炎作用。将46名患者随机分为ALA组,其中接受1200 mg ALA或安慰剂组,每天接受安慰剂治疗12周。与安慰剂组相比,在ALA组中观察到INF-γ,TGF-β,ICAM-1和IL-4水平的显著降低。然而,通过ALA施用,一些细胞因子(包括TNF-α,IL-6,EDSS和MMP-9)的水平没有显著变化。因此,本研究揭示了ALA对RRMS患者抗炎作用的初步支持数据;然而,更大的患者组需要进一步的研究来证实这些结果。
Loy等人研究了ALA对步态和平衡恶化的治疗效果,这是SPMS患者的两个关键症状 [129]。检查每日口服1200mg ALA,并在2年内对21名受试者与安慰剂进行比较,并通过Timed Up and Go(TUG)和特定时期的安静站立任务评估身体功能的改善。因此,据报道,ALA治疗的残疾较少的患者在TUG快速任务中显示出明显更好的转换时间,该任务测量患者与安慰剂组相比快速行走的能力。因此,该试点研究使得针对SPMS患者的行走障碍的ALA治疗的扩展临床试验成为可能。
Fiedler等[130]设计了第一个临床试验,通过使用健康对照,RRMS和SPMS受试者来研究ALA和cAMP产生之间的关系以及ALA的口服生物利用度。该研究由57名接受1200mg ALA口服一次的受试者完成。
在ALA给药的1,2,3,4,24和48小时之前和之后采集血液探针用于cAMP测量和通过药代动力学分析的ALA血浆水平。在MS患者中关注cAMP的原因是其对促炎细胞因子表达和T细胞活化的抑制作用。在健康对照组,RRMS组和SPMS组之间比较血浆ALA浓度的药代动力学,并且显示半衰期,Tmax,Cmax,分布体积和口腔清除参数没有显着差异。另一方面,与基线相比,在ALA治疗后2和4小时,在健康和SPMS受试者中观察到cAMP浓度增加。此外,通过测量血浆前列腺素E2(PGE2)水平来分析ALA对cAMP的刺激作用,其被称为cAMP刺激物并且与RRMS受试者相比在ALA服用后4小时显示女性健康和SPMS受试者中显着更高的浓度。总之,这些获得的数据得出结论,虽然ALMS对cAMP产生的刺激活性在RRMS患者中是不同的,但cAMP可用作追踪SPMS患者中ALA的药用作用的生物标志物。
6.5 α-硫辛酸对妊娠期异常的影响
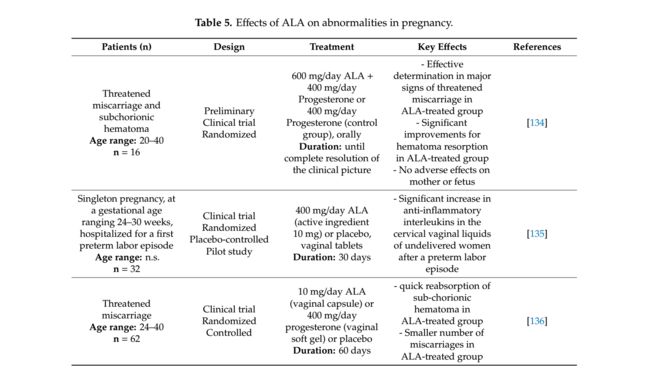
妊娠期异常,如宫内出血或绒毛膜下血肿,往往与受威胁的流产有关,特别是在怀孕的头三个月。亚绒毛膜血肿是超声检查的消声区,其镰状形状增加了自然流产的风险[131]。胎盘功能障碍,血管生成不足和慢性炎症是早期妊娠出血的根本原因,这些因素甚至可导致早产或围产期死亡[132]。孕酮在胎儿成熟和细胞因子平衡方面具有重要作用。因此,孕激素的使用主要用于预防受威胁的流产[133]。另一方面,最近通过一些临床试验研究了ALA治疗,以解释其在预防流产方面的功效(表5)。
Porcora等人进行了一项初步的随机临床试验[134]评估ALA与黄体酮治疗对16例受威胁流产患者亚绒毛膜血肿恢复的支持作用。受试者在怀孕第6周和第13周之间出现盆腔疼痛,阴道出血和绒毛膜下血肿。他们被随机分成两组。因此,对照组和病例组均以阴道栓剂形式给予400mg黄体酮/天。此外,壳体组另外用600毫克ALA /天治疗,直到临床图象的完整分辨率。所有受试者的医学检查在入组一周后进行,之后每十五天进行一次,直至症状消失。在治疗期间,未在母亲或胎儿中报告不良作用。与单独的孕酮相比,在ALA加黄体酮治疗组中检测到亚绒毛膜血肿症状的早期和更好的改善。然而,软组织的变化,这是一种流行性威胁的症状,两组均无统计学意义。这项研究可能表明ALA可能对母亲和胎儿的健康有益,以防发生流产。 Grandi等[135]的一项试验性,随机,安慰剂对照,平行组和单中心研究研究了ALA对原发性宫缩患者宫颈炎症和缩短后的抗炎活性。 32名孕妇单胎妊娠,孕龄24-30周,第一次早产住院治疗,随机招募400毫克/天的ALA阴道硬片(活性成分10毫克) )或安慰剂,睡前30天。他们的宫颈阴道液通过宫颈拭子获得,以量化两组治疗前后促炎细胞因子的水平。此外,颈部长度追踪[122],其缩短是早产的线索,是通过经阴道超声法在治疗前后实现的。这些分析显示,与安慰剂相比,阴道ALA治疗在IL4和IL10水平方面均显着增强,而组之间的促炎细胞因子比率没有显着变化。在CL测量中观察到ALA的另一个重要作用。因此,据报道,阴道ALA中的子宫颈缩短比对照组更有效。总体而言,这些结果鼓励对该主题进行更大规模的随机对照临床试验。
在一项研究中,Costantino等人 [136]比较阴道ALA或黄体酮治疗对62例孕妇流产的亚绒毛膜血肿吸收的作用。定义了两个治疗组(1:1比例):一组每天接受400毫克阴道黄体酮(阴道软胶)或10毫克阴道ALA(阴道胶囊)和一个对照组,在60天内未经治疗(根据他们的要求)。在20天和60天后通过阴道超声扫描控制绒毛膜下血肿的发展,并且没有记录对胎儿的不利影响。与孕酮组相比,在ALA治疗组中观察到亚绒毛膜血肿再吸收的显著改善和较少的流产。然而,在任何组中没有记录到盆腔疼痛和阴道出血值的显著变化。因此,这些主要数据支持ALA可以成为治疗先兆流产患者的有效医疗途径;然而,需要更多的研究来证实这种用法。
6.6 其他试验
有少量试验评估ALA在器官移植和化疗中的作用。在Ambrosi等人的工作中 [137]研究了ALA对同时肾胰移植后发生的缺血再灌注损伤(IRI)的影响。将26名患有糖尿病性多发性神经病的患者分成三组:未治疗,供体和受体ALA治疗且仅接受ALA治疗组。手术前将600mg ALA给予ALA治疗组。包括两个治疗组(受治疗者 - 接受者和供体治疗者)的目的是找出在IRI的不同阶段产生的ROS的影响。在手术结束时进行胰腺和肾脏活组织检查以进行聚合酶链反应(RT-PCR);然而,活检组织的量不足以进行免疫组织化学染色。在手术前后获得血液探针。进行血清炎性细胞因子水平和其他测量。报道了肾脏中TNFα和C3的低水平,以及胰腺活检中高水平的血红素加氧酶-1(HMOX-1)和C3。此外,在IL-8的减少,IL-6,分泌性白细胞蛋白酶抑制剂,和再生胰岛衍生蛋白3β/胰腺炎相关蛋白水平记录在供体 - 受体治疗组英寸该研究表明,ALA可有效减少移植后患者的炎症标志物,肾功能障碍和临床胰腺炎。然而,很少有研究包括器官移植。因此,需要进一步的随机,安慰剂对照研究以获得关于ALA有效性的更可靠的结果。
最近,Casciato等人 [138]在40名肝移植患者中进行了临床试验。患者分为两组:ALA治疗组和安慰剂组。在冷缺血时间之前立即给供体门静脉中的患者施用600mg ALA;然后,在再灌注前15分钟给予另外600mg ALA。在再灌注后2小时从供体和患者收集肝组织样品。在手术前和手术结束时采集血液探针。手术后一个月内收集样品5次。还测量了生化肝脏参数。在ALA治疗组的肝脏活组织检查中报告了高水平的缺氧诱导因子-1(HIF-1α)和脯氨酰羟化酶-2(PHD2),而其他缺氧相关参数没有显着差异。此外,显示在ALA处理组中含有2(Birc2)转录水平的杆状病毒IAP重复也更高。此外,ALA治疗患者的血浆警报水平较低。总体而言,这些结果表明在肝移植中使用ALA是安全的,因为它可以通过诱导mRNA水平的基因表达的变化来保护免受缺氧和氧化应激。
最后,郭等人 [139]评估了ALA对预防化疗引起的周围神经病变的影响。四十名癌症患者完成了试验。他们分为两组:ALA治疗组和安慰剂组。此外,根据它们的铂暴露水平将这些组分成三组。每天口服1800mg ALA或安慰剂,除了在给予每剂铂后2天至4天期间,以避免可能干扰铂的抗肿瘤作用。在基线时测量神经性症状,然后在治疗24,36和48周时测量。此外,还向患者提供了简短疼痛清单(BPI)部分表格(包括三项问卷),以了解他们在试验期间的疼痛症状。对于测量的所有参数,组之间没有记录显着变化。结论是ALA对奥沙利铂或顺铂作用引起的神经毒性无效,因此有必要进行未来的研究。
7.结论
ALA具有多种益处,包括抗氧化能力;然而,已经表明,由于与其药代动力学特征相关的限制,ALA的治疗功效受到限制。数据显示,由于涉及肝降解,ALA溶解度降低以及胃中不稳定的机制,ALA的半衰期和生物利用度约为30%。然而,已证明使用各种创新制剂可有效增强ALA生物利用度。已经通过研究表明,通过使用两亲性基质可以增强ALA的生物利用度,能够增强其在肠中的溶解性和吸收性。此外,与固体剂量相比,ALA液体制剂显示出更高的血浆浓度和生物利用度。此外,年龄也会影响ALA的生物利用度,而性别则显示出微不足道的差异。因此,可以增强ALA吸收的改进制剂将显着改善ALA生物利用度,最终导致改善的治疗功效。
在查看临床试验数据时,ALA已发现在特定疾病和病症中有效,包括糖尿病神经病变、肥胖、精神分裂症、MS、妊娠和器官移植异常,没有或有轻微的不良反应。 ALA似乎也是改善生活质量,神经病症状甚至减少使用糖尿病神经病变患者常用的救援药物的有希望的药物。此外,除了减轻CNS相关疾病(精神分裂症和MS)症状外,它还具有改善肥胖患者的脂质代谢和促进体重减轻的潜力。 ALA还可以减少由于使用处方抗精神病药物引起的体重增加,以及精神分裂症患者的一些代谢风险因素。在MS患者中,ALA具有一些积极的结果,尤其是在增强步行和平衡障碍方面,同时降低与MS进展相关的一些促炎因子的水平。因此,评估ALA效应的临床试验显示其能够缓解CNS疾病中常见的一些症状,并且具有非常有希望的结果。在怀孕威胁的情况下,ALA表现出对增强亚慢性血肿症状的有益作用,以及预防流产的积极结果,没有副作用。 ALA通过降低炎症因子的水平并对缺氧和氧化应激发挥保护作用在器官移植患者中也是有效的,而在细胞毒性化疗药物引起的神经毒性的情况下,ALA不代表保护功能。总而言之,ALA可以被分类为用于预防或减缓与几种疾病进展相关的一些病症的候选分子之一。然而,必须设计更加可控和强大的临床试验来研究ALA治疗效果。
作者贡献:所有作者都为这项工作做出了重要贡献。 此外,J.S.-R.,B.S.,N.M.,W.C.C 和F.S.,批判性地审阅了手稿。 所有作者阅读并认可的终稿。
资金:N. Martins感谢葡萄牙科技基金会(FCT-Portugal)的战略项目参考。 UID / BIM / 04293/2013和“NORTE2020 - 北部地区业务计划”(NORTE-01-0145-FEDER-000012)。
利益冲突:作者声明没有利益冲突。
References
1. Reed, L.J.; DeBusk, B.G.; Gunsalus, I.C.; Hornberger, C.S. Crystalline α-lipoic acid: A catalytic agent associated with pyruvate dehydrogenase. Science 1951, 114, 93–94. [CrossRef] [PubMed]
2. Bock, E.; Schneeweiss, J. Ein Beitrag zur Therapie der Neuropathia diabetica. Munch. Med. Wochenschr. 1959, 43, 1911–1912.
3. Brookes, M.H.; Golding, B.T.; Howes, D.A.; Hudson, A.T. Proof that the absolute configuration of natural α-lipoic acid is R by the synthesis of its enantiomer [(S)-(–)-α-lipoic acid] from (S)-malic acid. J. Chem. Soc. Chem. Commun. 1983, 19, 1051–1053. [CrossRef]
4. Ghibu, S.; Richard, C.; Vergely, C.; Zeller, M.; Cottin, Y.; Rochette, L. Antioxidant properties of an endogenous thiol: Alpha-lipoic acid, useful in the prevention of cardiovascular diseases. J. Cardiovasc. Pharmacol. 2009, 54, 391–398. [CrossRef] [PubMed]
5. Brufani, M. Acido α-lipoico farmaco o integratore. Una panoramica sulla farmacocinetica, le formulazioni disponibili e le evidenze cliniche nelle complicanze del diabete. Prog. Nutr. 2014, 16, 62–74.
6. Singh, U.; Jialal, I. Retracted: Alpha-lipoic acid supplementation and diabetes. Nutr. Rev. 2008, 66, 646–657. [ CrossRef] [PubMed]
7. Maglione, E.; Marrese, C.; Migliaro, E.; Marcuccio, F.; Panico, C.; Salvati, C.; Citro, G.; Quercio, M.; Roncagliolo, F.; Torello, C.; et al. Increasing bioavailability of (R)-alpha-lipoic acid to boost antioxidant activity in the treatment of neuropathic pain. Acta Bio-Medica Atenei Parm. 2015, 86, 226–233.
8. Packer, L.; Cadenas, E. Lipoic acid: Energy metabolism and redox regulation of transcription and cell signaling. J. Clin. Biochem. Nutr. 2010, 48, 26–32. [CrossRef] [PubMed]
9. Konrad, D.; Somwar, R.; Sweeney, G.; Yaworsky, K.; Hayashi, M.; Ramlal, T.; Klip, A. The antihyperglycemic drug alpha-lipoic acid stimulates glucose uptake via both GLUT4 translocation and GLUT4 activation: Potential role of p38 mitogen-activated protein kinase in GLUT4 activation. Diabetes 2001, 50, 1464–1471. [CrossRef] [PubMed]
10. Chen, W.-L.; Kang, C.-H.; Wang, S.-G.; Lee, H.-M. α-Lipoic acid regulates lipid metabolism through induction of sirtuin 1 (SIRT1) and activation of AMP-activated protein kinase. Diabetologia 2012, 55, 1824–1835. [CrossRef]
11. Gor ˛aca, A.; Huk-Kolega, H.; Piechota, A.; Kleniewska, P.; Ciejka, E.; Skibska, B. Lipoic acid–biological activity and therapeutic potential. Pharmacol. Rep. 2011, 63, 849–858. [CrossRef]
12. Han, D.; Handelman, G.; Marcocci, L.; Sen, C.K.; Roy, S.; Kobuchi, H.; Tritschler, H.J.; Floh é, L.; Packer, L. Lipoic acid increases de novo synthesis of cellular glutathione by improving cystine utilization. Biofactors 1997, 6, 321–338. [CrossRef] [PubMed]
13. Shay, K.P.; Moreau, R.F.; Smith, E.J.; Smith, A.R.; Hagen, T.M. Alpha-lipoic acid as a dietary supplement: Molecular mechanisms and therapeutic potential. Biochim. Biophys. Acta 2009, 1790, 1149–1160. [CrossRef] [PubMed]
14. Ou, P.; Tritschler, H.J.; Wol ff, S.P. Thioctic (lipoic) acid: A therapeutic metal-chelating antioxidant? Biochem. Pharmacol. 1995, 50, 123–126. [CrossRef]
15. Bilska, A.; Wlodek, L. Lipoic acid-the drug of the future. Pharmacol. Rep. 2005, 57, 570–577.
16. Castro, M.C.; Villagarc ía, H.G.; Massa, M.L.; Francini, F. Alpha-lipoic acid and its protective role in fructose induced endocrine-metabolic disturbances. Food Funct. 2019, 10, 16–25. [CrossRef] [PubMed]
17. Keith, D.J.; Butler, J.A.; Bemer, B.; Dixon, B.; Johnson, S.; Garrard, M.; Sudakin, D.L.; Christensen, J.M.; Pereira, C.; Hagen, T.M. Age and gender dependent bioavailability of R- and R,S-alpha-lipoic acid: A pilot study. Pharmacol. Res. 2012, 66, 199–206. [CrossRef]
18. Packer, L.; Witt, E.H.; Tritschler, H.J. alpha-Lipoic acid as a biological antioxidant. Free Radic. Boil. Med. 1995, 19, 227–250. [CrossRef]
19. Carreau, J.-P. [32] Biosynthesis of lipoic acid via unsaturated fatty acids. Meth. Enzymol. 1979, 62, 152–158.
20. Ziegler, D. Thioctic acid for patients with symptomatic diabetic polyneuropathy: A critical review. Treat Endocrino 2004, 3, 173–179. [CrossRef]
21. Henriksen, E.J. Exercise training and the antioxidant alpha-lipoic acid in the treatment of insulin resistance and type 2 diabetes. Free Radic. Boil. Med. 2006, 40, 3–12. [CrossRef] [PubMed]
22. Ciftci, H.; Bakal, U. The effect of lipoic acid on macro and trace metal levels in living tissues exposed to oxidative stress. Anti-Cancer Agents Med. Chem. 2009, 9, 560–568. [CrossRef]
23. Golbidi, S.; Badran, M.; Laher, I. Diabetes and alpha lipoic acid. Front. Pharmacol. 2011, 2, 69. [CrossRef] [PubMed]
24. Szel ˛ag, M.; Mikulski, D.; Molski, M. Quantum-chemical investigation of the structure and the antioxidant properties of α-lipoic acid and its metabolites. J. Mol. Modeling 2012, 18, 2907–2916. [CrossRef] [PubMed]
25. Akiba, S.; Matsugo, S.; Packer, L.; Konishi, T. Assay of protein-bound lipoic acid in tissues by a new enzymatic method. Anal. Biochem. 1998, 258, 299–304. [CrossRef] [PubMed]
26. Moura, F.A.; de Andrade, K.Q.; dos Santos, J.C.; Goulart, M.O. Lipoic acid: Its antioxidant and anti-inflammatory role and clinical applications. Curr. Topics Med. Chem. 2015, 15, 458–483.
27. Gomes, M.B.; Negrato, C.A. Alpha-lipoic acid as a pleiotropic compound with potential therapeutic use in diabetes and other chronic diseases. Diabetol. Metab. Syndr. 2014, 6, 80. [CrossRef]
28. Smith, A.R.; Shenvi, S.V.; Widlansky, M.; Suh, J.H.; Hagen, T.M. Lipoic acid as a potential therapy for chronic diseases associated with oxidative stress. Curr. Med. Chem. 2004, 11, 1135–1146. [CrossRef]
29. Liu, J.; Head, E.; Gharib, A.M.; Yuan, W.; Ingersoll, R.T.; Hagen, T.M.; Cotman, C.W.; Ames, B.N. Memory loss in old rats is associated with brain mitochondrial decay and RNA/DNA oxidation: Partial reversal by feeding acetyl-L-carnitine and /or R-α-lipoic acid. Proc. Natl. Acad. Sci. USA 2002, 99, 2356–2361. [CrossRef]
30. Han, D.; Sen, C.K.; Roy, S.; Kobayashi, M.S.; Tritschler, H.J.; Packer, L. Protection against glutamate-induced cytotoxicity in C6 glial cells by thiol antioxidants. Am. J. Physiol. Integr. Comp. Physiol. 1997, 273, 1771–1778.[CrossRef]
31. Wray, D.W.; Nishiyama, S.K.; Harris, R.A.; Zhao, J.; McDaniel, J.; Fjeldstad, A.S.; Richardson, R.S. Acute reversal of endothelial dysfunction in the elderly after antioxidant consumption. Hypertension 2012, 59, 818–824. [ CrossRef] [PubMed]
32. McNeilly, A.M.; Davison, G.W.; Murphy, M.H.; Nadeem, N.; Trinick, T.; Duly, E.; McEneny, J. Effect of α-lipoic acid and exercise training on cardiovascular disease risk in obesity with impaired glucose tolerance. Lipids Heal. Dis. 2011, 10, 217. [CrossRef] [PubMed]
33. Ying, Z.; Kherada, N.; Farrar, B.; Kampfrath, T.; Chung, Y.; Simonetti, O.; Deiuliis, J.; Desikan, R.; Khan, B.; Villamena, F.; et al. Lipoic acid effects on established atherosclerosis. Life Sci. 2010, 86, 95–102. [CrossRef] [PubMed]
34. Park, S.; Karunakaran, U.; Jeoung, N.H.; Jeon, J.-H.; Lee, I.-K. Physiological effect and therapeutic application of alpha lipoic acid. Curr. Med. Chem. 2014, 21, 3636–3645. [CrossRef] [PubMed]
35. El Barky, A.R.; Hussein, S.A.; Mohamed, T.M. The potent antioxidant alpha lipoic acid. J. Plant Chem. Ecophysiol. 2017, 2, 1016.
36. Biewenga, G.P.; Haenen, G.R.; Bast, A. The pharmacology of the antioxidant lipoic acid. Gen. Pharmacol. Vasc. Syst. 1997, 29, 315–331. [CrossRef]
37. Goralska, M.; Dackor, R.; Holley, B.; McGahan, M.C. Alpha lipoic acid changes iron uptake and storage in lens epithelial cells. Exp. Eye Res. 2003, 76, 241–248. [CrossRef]
38. Suzuki, Y.J.; Tsuchiya, M.; Packer, L. Thioctic acid and dihydrolipoic acid are novel antioxidants which interact with reactive oxygen species. Free Radic. Res. Commun. 1991, 15, 255–263. [CrossRef]
39. Scott, B.C.; Aruoma, O.I.; Evans, P.J.; O’Neill, C.; Van der Vliet, A.; Cross, C.E.; Tritschler, H.; Halliwell, B. Lipoic and dihydrolipoic acids as antioxidants. A critical evaluation. Free Radic. Res. 1994, 20, 119–133. [ CrossRef]
40. Islam, M.T. Antioxidant activities of dithiol alpha-lipoic acid. Bangladesh J. Med. Sci. 2009, 8, 34–49. [CrossRef]
41. WHO. Diabetes; World Health Organization: Geneva, Switzerland, 2018.
42. Moodley, K.; Joseph, K.; Naidoo, Y.; Islam, S.; Mackraj, I. Antioxidant, antidiabetic and hypolipidemic effects of Tulbaghia violacea Harv. (wild garlic) rhizome methanolic extract in a diabetic rat model. BMC Complement. Altern. Med. 2015, 15, 408. [CrossRef] [PubMed]
43. Beckman, J.A.; Creager, M.A.; Libby, P. Diabetes and atherosclerosis: Epidemiology, pathophysiology, and management. J. Am. Med. Assoc. 2002, 287, 2570–2581. [CrossRef] [PubMed]
44. Giacco, F.; Brownlee, M. Oxidative stress and diabetic complications. Circ. Res. 2010, 107, 1058–1070. [CrossRef] [PubMed]
45. Pitocco, D.; Tesauro, M.; Alessandro, R.; Ghirlanda, G.; Cardillo, C. Oxidative Stress in Diabetes: Implications for Vascular and Other Complications.、 Int. J. Mol. Sci. 2013, 14, 21525–21550. [CrossRef] [PubMed]
46. Asmat, U.; Abad, K.; Ismail, K. Diabetes mellitus and oxidative stress-A concise review. Saudi Pharm. J. 2016, 24, 547–553. [CrossRef] [PubMed]
47. Eason, R.C.; Archer, H.E.; Akhtar, S.; Bailey, C.J. Lipoic acid increases glucose uptake by skeletal muscles of obesediabetic ob /ob mice. Diabetes Obes. Metab. 2002, 4, 29–35. [CrossRef] [PubMed]
48. Garc ía-Osta, A.; Cuadrado-Tejedor, M.; García-Barroso, C.; Oyarzábal, J.; Franco, R. Phosphodiesterases as therapeutic targets for Alzheimer’s disease. ACS Chem. Neurosci. 2012, 3, 832–844. [CrossRef]
49. Wu, Y.; Li, Z.; Huang, Y.Y.; Wu, D.; Luo, H.B. Novel phosphodiesterase inhibitors for cognitive improvement in Alzheimer’s disease. J. Med. Chem. 2018, 61, 5467–5483. [CrossRef] [PubMed]
50. Perry, G.; Cash, A.D.; Smith, M.A. Alzheimer disease and oxidative stress. J. Biomed. Biotechnol. 2002, 2, 120–123. [CrossRef]
51. Chen, Z.; Zhong, C. Oxidative stress in Alzheimer’s disease. Neurosci. Bull. 2014, 30, 271–281. [CrossRef]
52. Huang, W.-J.; Zhang, X.; Chen, W.-W. Role of oxidative stress in Alzheimer’s disease. Biomed. Rep. 2016, 4, 519–522. [ CrossRef]
53. Cacciatore, I.; Marinelli, L.; Fornasari, E.; Cerasa, L.S.; Eusepi, P.; Türkez, H.; Pomilio, C.; Reale, M.; D’Angelo, C.; Costantini, E.; et al. Novel NSAID-derived drugs for the potential treatment of Alzheimer’s disease. Int. J. Mol. Sci. 2016, 17, 1035. [CrossRef] [PubMed]
54. Hagen, T.M.; Ingersoll, R.T.; Lykkesfeldt, J.; Liu, J.; Wehr, C.M.; Vinarsky, V.; Bartholomew, J.C.; Ames, A.B. (R)-alpha-lipoic acid-supplemented old rats have improved mitochondrial function, decreased oxidative damage, and increased metabolic rate. FASEB J. 1999, 13, 411–418. [CrossRef] [PubMed]
55. Farr, S.A.; Poon, H.F.; Dogrukol-Ak, D.; Drake, J.; Banks, W.A.; Eyerman, E.; Allan Butterfield, D.; Morley, J.E. The antioxidants alpha-lipoic acid and N-acetylcysteine reverse memory impairment and brain oxidative stress in aged SAMP8 mice. J. Neurochem. 2003, 84, 1173–1183. [CrossRef] [PubMed]
56. Ono, K.; Hirohata, M.; Yamada, M. α-Lipoic acid exhibits anti-amyloidogenicity for β-amyloid fibrils in vitro. Biochem. Biophys. Res. Commun. 2006, 341, 1046–1052. [CrossRef] [PubMed]
57. Zhang, W.-J.; Frei, B. Alpha-lipoic acid inhibits TNF-alpha-induced NF-kappaB activation and adhesion molecule expression in human aortic endothelial cells. FASEB J. 2001, 15, 2423–2432. [CrossRef] [PubMed]
58. Lovell, M.A.; Xie, C.; Xiong, S.; Markesbery, W. Protection against amyloid beta peptide and iron /hydrogen peroxide toxicity by alpha lipoic acid. J. Alzheimer’s Dis. 2003, 5, 229–239. [CrossRef]
59. Holmquist, L.; Stauchbury, G.; Berbaum, K.; Muscat, S.; Young, S.; Hager, K.; Engel, J.; Münch, G. Lipoic acid as a novel treatment for Alzheimer’s disease and related demenias. Pharmacol. Ther. 2007, 113, 154–164. [CrossRef]
60. Haugaard, N.; Levin, R.M. Regulation of the activity of choline acetyl transferase by lipoic acid.
Mol. Cell. Biochem. 2000, 213, 61–63. [CrossRef]
61. Meraz-R íos,M.A.; Toral-Rios, D.; Franco-Bocanegra, D.; Villeda-Hernández, J.; Campos-Peña, V. Inflammatory process in Alzheimer’s disease. Front. Integr. Neurosci. 2013, 7, 59. [CrossRef]
62. Ooi, L.; Patel, M.; Münch, G. The thiol antioxidant lipoic acid and Alzheimer’s disease. In Systems Biology of Free Radicals and Antioxidants; Laher, I., Ed.; Springer: Berlin/Heidelberg, Germany, 2014; pp. 2275–2288.
63. Suh, J.H.; Wang, H.; Liu, R.-M.; Liu, J.K.; Hagena, T.M. (R)-α-Lipoic acid reverses the age-related loss in GSH redox status in post-mitotic tissues: Evidence for increased cysteine requirement for zGSH synthesis. Arch. Biochem. Biophys. 2015, 423, 126–135. [CrossRef] [PubMed]
64. Hardas, S.S.; Sultana, R.; Clark, A.M.; Beckett, T.L.; Szweda, L.I.; Murphy, P.; Butterfielda, D.A. Oxidative modification of lipoic acid by HNE in Alzheimer disease brain. Redox Biol. 2013, 1, 80–85. [CrossRef] [PubMed]
65. Breitzig, M.; Bhimineni, C.; Lockey, R.; Kolliputi, N. 4-Hydroxy-2-nonenal: A critical target in oxidative stress? Am. J. Physiol. Cell Physiol. 2016, 311, 537–543. [CrossRef] [PubMed]
66. Wong, A.; Dukic-Stefanovic, S.; Gasic-Milenkovic, J.; Schinzel, R.; Wiesinger, H.; Riederer, P.; Münch, G. Anti-inflammatory antioxidants attenuate the expression of inducible nitric oxide synthase mediated by advanced glycation endproducts in murine microglia. Eur. J. Neurosci. 2001, 14, 1961–1967. [CrossRef] [PubMed]
67. Dinicola, S.; Proietti, S.; Cucina, A.; Bizzarri, M.; Fuso, A.J.A. Alpha-Lipoic Acid Downregulates IL-1 β and IL-6 by DNA Hypermethylation in SK-N-BE Neuroblastoma Cells. Antioxidant 2017, 6, 74. [CrossRef] [PubMed]
68. Schwartz, L.; Abolhassani, M.; Guais, A.; Sanders, E.; Steyaert, J.M.; Campion, F.; Israël, M. A combination of alpha lipoic acid and calcium hydroxycitrate is efficient against mouse cancer models: Preliminary results. Oncol. Rep. 2010, 23, 1407–1420. [CrossRef]
69. Na, M.H.; Seo, E.Y.; Kim, W.K. Effects of alpha-lipoic acid on cell proliferation and apoptosis in MDA-MB-231 human breast cells. Nutr. Res. Pract. 2009, 3, 265–271. [CrossRef]
70. Ganapathy-Kanniappan, S.; Geschwind, J.F. Tumor glycolysis as a target for cancer therapy: Progress and prospects. Mol. Cancer 2013, 12, 152. [CrossRef]
71. Zhang, C.; Liu, J.; Liang, Y.; Wu, R.; Zhao, Y.; Hong, X.; Lin, M.; Yu, H.; Liu, L.; Levine, A.J.; et al. Tumour-associated mutant p53 drives the Warburg effect. Nat. Commun. 2013, 4, 2935. [CrossRef]
72. Feuerecker, B.; Pirsig, S.; Seidl, C.; Aichler, M.; Feuchtinger, A.; Bruchelt, G.; Senekowitsch-Schmidtke, R. Lipoic acid inhibits cell proliferation of tumor cells in vitro and in vivo. Cancer Biol. Ther. 2012, 13, 1425–1435. [CrossRef]
73. Jeon, M.J.; Kim, W.G.; Lim, S.; Choi, H.J.; Sim, S.; Kim, T.Y.; Shong, Y.K.; Kim, W.B. Alpha lipoic acid inhibits proliferation and epithelial mesenchymal transition of thyroid cancer cells. Mol. Cell. Endocrinol. 2016, 419, 113–123. [CrossRef] [PubMed]
74. Yang, L.; Wen, Y.; Lv, G.; Lin, Y.; Tang, J.; Lu, J.; Zhang, M.; Liu, W.; Sun, X. a-Lipoic acid inhibits human lung cancer cell proliferation through Grb2-mediated EGFR down regulation. Biochem. Biophys. Res. Commun. 2017, 494, 325–331. [CrossRef] [PubMed]
75. Moungjaroen, J.; Nimmannit, U.; Callery, P.S.; Wang, L.; Azad, N.; Lipipun, V.; Chanvorachote, P.; Rojanasakul, Y. Reactive oxygen species mediate caspase activation and apoptosis induced by lipoic acid in human lung epithelial cancer cells through Bcl-2 down-regulation. J. Pharmacol. Exp. Ther. 2006, 319, 1062–1069. [ CrossRef] [PubMed]
76. Dozio, E.; Ruscica, M.; Passafaro, L.; Dogliotti, G.; Ste ffani, L.; Marthyn, P.; Pagani, A.; Demartini, G.; Esposti, D.; Fraschini, F.; et al. The natural antioxidant alpha-lipoic acid induces p27(Kip1)-dependent cell cycle arrest and apoptosis in MCF-7 human breast cancer cells. Eur. J. Pharmacol. 2010, 641, 29–34. [CrossRef] [PubMed]
77. Wenzel, U.; Nickel, A.; Daniel, H. α-Lipoic acid induces apoptosis in human colon cancer cells by increasing mitochondrial respiration with a concomitant O 2-*-generation. Apoptosis 2005, 10, 359–368. [CrossRef] [PubMed]
78. Trivedi, P.P.; Jena, G.B. Role of α-lipoic acid in dextran sulfate sodium-induced ulcerative colitis in mice: Studies on inflammation, oxidative stress, DNA damage and fibrosis. Food Chem. Toxicol. 2013, 59, 339–355. [CrossRef]
79. Tripathy, J.; Tripathy, A.; Thangaraju, M.; Suar, M.; Elangovan, S. alpha-Lipoic acid inhibits the migration and invasion of breast cancer cells through inhibition of TGFbeta signaling. Life Sci. 2018, 207, 15–22. [CrossRef]
80. Lee, W.J.; Song, K.H.; Koh, E.H.; Won, J.C.; Kim, H.S.; Park, H.S.; Kim, M.S.; Kim, S.W.; Lee, K.U.; Park, J.Y. Alpha-lipoic acid increases insulin sensitivity by activating AMPK in skeletal muscle. Biochem. Biophys. Res. Commun. 2005, 332, 885–891. [CrossRef]
81. Bitar, M.S.; Ayed, A.K.; Abdel-Halim, S.M.; Isenovic, E.R.; Al-Mulla, F. Inflammation and apoptosis in aortic tissues of aged type II diabetes: Amelioration with lipoic acid through phosphatidylinositol 3-kinase /Akt-dependent mechanism. Life Sci. 2010, 86, 844–853. [CrossRef]
82. Rochette, L.; Ghibu, S.; Muresan, A.; Vergely, C. Alpha-lipoic acid: Molecular mechanisms and therapeutic potential in diabetes1. Can. J. Physiol. Pharmacol. 2015, 93, 1021–1027. [CrossRef]
83. Smith, A.R.; Hagen, T.M. Vascularendothelialdys- function inaging: Loss of Akt- dependent endothelial nitricoxide synthase phosphorylation and partial restoration by (R)-alpha-lipoic acid. Biochem. Soc. Trans. 2003, 31, 1447–1449. [CrossRef] [PubMed]
84. Artwohl, M.; Muth, K.; Kosulin, K.; de Martin, R.; Holzenbein, T.; Rainer, G.; Freudenthaler, A.; Huttary, N.; Schmetterer, L.; Waldhausl, W.K.; et al. R-(+)-alpha-lipoic acid inhibits endothelial cell apoptosis and proliferation: Involvement of Akt and retinoblastoma protein /E2F-1. Am. J. Physiol. Endocrinol. Metab. 2007, 293, 681–689. [CrossRef] [PubMed]
85. Zhang, W.J.; Wei, H.; Hagen, T.; Frei, B. Alpha-lipoic acid attenuates LPS-induced inflammatory responses by activating the phosphoinositide 3-kinase /Akt signaling pathway. Proc. Natl. Acad. Sci. USA 2007, 104, 4077–4082. [CrossRef] [PubMed]
86. Kawabata, T.; Packer, L. Alpha-lipoate can protect against glycation of serum albumin, but not low density lipoprotein. Biochem. Biophys. Res. Commun. 1994, 203, 99–104. [CrossRef] [PubMed]
87. Thirunavukkarasu, V.; Nandhini, A.A.T.; Anuradha, C.V. Lipoic acid improves glucose utilisation and prevents protein glycation and AGE formation. Die Pharm. 2005, 60, 772–775.
88. Quinn, J.F.; Bussiere, J.R.; Hammond, R.S.; Montine, T.J.; Henson, E.; Jones, R.E.; Stackman, R.W. Chronic dietary alpha-lipoic acid reduces deficits in hippocampal memory of aged Tg2576 mice. Neurobiol. Aging 2007, 28, 213–225. [CrossRef] [PubMed]
89. Suh, J.H.; Zhu, B.Z.; de Szoeke, E.; Frei, B.; Hagen, T.M. Dihydrolipoic acid lowers the redox activity of transition metal ions but does not remove them from the active site of enzymes. Redox Rep. 2004, 9, 57–61. [CrossRef] [PubMed]
90. Micili, S.C.; Goker, A.; Kuscu, K.; Ergur, B.U.; Fuso, A.J.R.S. α-Lipoic Acid Vaginal Administration Contrasts Inflammation and Preterm Delivery in Rats. Reprod. Sci. 2019, 26, 128–138. [CrossRef] [PubMed]
91. Brufani, M.; Figliola, R. (R)-α-lipoic acid oral liquid formulation: Pharmacokinetic parameters and therapeutic efficacy. Acta Bio-Medica Atenei Parm. 2014, 85, 108–115.
92. Gleiter, C.H.; Schug, B.S.; Hermann, R.; Elze, M.; Blume, H.H.; Gundert-Remy, U. Influence of food intake on the bioavailability of thioctic acid enantiomers. Eur. J. Clin. Pharmacol. 1996, 50, 513–514. [CrossRef]
93. Hermann, R.; Niebch, G.; Borbe, H.O.; Fieger-Büschges, H.; Ruus, P.; Nowak, H.; Riethmüller-Winzen, H.; Peukert, M.; Blume, H. Enantioselective pharmacokinetics and bioavailability of different racemic α-lipoic acid formulations in healthy volunteers. Eur. J. Pharmacol. Sci. 1996, 4, 167–174. [CrossRef]
94. Teichert, J.; Tuemmers, T.; Achenbach, H.; Preiss, C.; Hermann, R.; Ruus, P.; Preiss, R. Pharmacokinetics of alpha-lipoic acid in subjects with severe kidney damage and end-stage renal disease. J. Clin. Pharmacol. 2005, 45, 313–328. [CrossRef] [PubMed]
95. Breithaupt-Grogler, K.; Niebch, G.; Schneider, E.; Erb, K.; Hermann, R.; Blume, H.H.; Schug, B.S.; Belz, G.G. Dose-proportionality of oral thioctic acid–coincidence of assessments via pooled plasma and individual data.Eur. J. Pharm. Sci. 1999, 8, 57–65. [CrossRef]
96. Uchida, R.; Iwamoto, K.; Nagayama, S.; Miyajima, A.; Okamoto, H.; Ikuta, N.; Fukumi, H.; Terao, K.; Hirota, T. Effect of gamma-Cyclodextrin Inclusion Complex on the Absorption of R-alpha-Lipoic Acid in Rats. Int. J. Mol. Sci. 2015, 16, 10105–10120. [CrossRef] [PubMed]
97. Uchida, R.; Okamoto, H.; Ikuta, N.; Terao, K.; Hirota, T. Enantioselective Pharmacokinetics of alpha-Lipoic Acid in Rats. Int. J. Mol. Sci. 2015, 16, 22781–22794. [CrossRef] [PubMed]
98. Mignini, F.; Nasuti, C.; Gioventu, G.; Napolioni, V.; Martino, P.D. Human bioavailability and pharmacokinetic profile of different formulations delivering alpha lipoic acid. Open Access Sci. Rep. 2012, 1, 418. [CrossRef]
99. Hermann, R.; Mungo, J.; Cnota, P.J.; Ziegler, D. Enantiomer-selective pharmacokinetics, oral bioavailability, and sex effects of various alpha-lipoic acid dosage forms. Clin. Pharmacol. 2014, 6, 195–204. [CrossRef] 100. Reed, L.J. The chemistry and function of lipoic acid. Adv. Enzymol. Related Areas Mol. Biol. 1957, 18, 319–347.
101. Kim, N.W.; Song, Y.M.; Kim, E.; Cho, H.S.; Cheon, K.A.; Kim, S.J.; Park, J.Y. Adjunctive α-lipoic acid reduces weight gain compared with placebo at 12 weeks in schizophrenic patients treated with atypical antipsychotics: A double-blind randomized placebo-controlled study. Int. Clin. Psychopharmacol. 2016, 31, 265–274. [CrossRef]
102. Sun, H.; Yao, W.; Tang, Y.; Zhuang, W.; Wu, D.; Huang, S.; Sheng, H. Urinary exosomes as a novel biomarker for evaluation of α-lipoic acid’s protective effect in early diabetic nephropathy. J. Clin. Lab. Anal. 2017, 31, e22129. [CrossRef]
103. De Sousa, C.N.S.; da Silva Leite, C.M.G.; da Silva Medeiros, I.; Vasconcelos, L.C.; Cabral, L.M.; Patroc ínio, C.F.V.; Patrocínio, M.L.V.; Mouaffak, F.; Kebir, O.; Macedo, D.; et al. Alpha-lipoic acid in the treatment of psychiatric and neurological disorders: A systematic review. Metab. Brain Dis. 2019, 34, 39–52. [CrossRef] [PubMed]
104. The Emerging Risk Factors Collaboration. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: A collaborative meta-analysis of 102 prospective studies. Lancet 2010, 375, 2215–2222. [CrossRef]
105. Fowler, M.J. Microvascular and macrovascular complications of diabetes. Clin. Diabetes 2008, 26, 77–82. [CrossRef]
106. Vinik, A.; Casellini, C.; Nevoret, M.L. Diabetic Neuropathies. In South Dartmouth; Feingold, K.R., Anawalt, B., Boyce, A., Chrousos, G., Dungan, K., Grossman, A., Hershman, J.M., Kaltsas, G., Koch, C., Kopp, P., et al., Eds.; MDText.com, Inc.: South Dartmouth, MA, USA, 2000.
107. Ziegler, D.; Low, P.A.; Freeman, R.; Tritschler, H.J.; Vinik, A.I. Predictors of improvement and progression of diabetic polyneuropathy following treatment with α-lipoic acid for 4 years in the NATHAN 1 trial. J. Diabetes Its Complicat. 2016, 30, 350–356. [CrossRef] [PubMed]
108. Garcia-Alcala, H.; Santos Vichido, C.I.; Islas Macedo, S.; Genestier-Tamborero, C.N.; Minutti-Palacios, M.; Hirales Tamez, O.; Garcia, C.; Ziegler, D. Treatment with alpha-Lipoic Acid over 16 Weeks in Type 2 Diabetic Patients with Symptomatic Polyneuropathy Who Responded to Initial 4-Week High-Dose Loading. J. Diabetes Res. 2015, 2015, 189857. [CrossRef]
109. Agathos, E.; Tentolouris, A.; Eleftheriadou, I.; Katsaouni, P.; Nemtzas, I.; Petrou, A.; Papanikolaou, C.; Tentolouris, N. Effect of α-lipoic acid on symptoms and quality of life in patients with painful diabetic neuropathy. J. Int. Med. Res. 2018, 46, 1779–1790. [CrossRef]
110. WHO. Obesity and Overweight; World Health Organization: Geneva, Switzerland, 2018.
111. Flegal, K.M.; Graubard, B.I.; Williamson, D.F.; Gail, M.H. Cause-specific excess deaths associated with underweight, overweight, and obesity. JAMA 2007, 298, 2028–2037. [CrossRef]
112. Van Kruijsdijk, R.C.M.; Van Der Wall, E.; Visseren, F.L.J. Obesity and cancer: The role of dysfunctional adipose tissue. Cancer Epidemiol. Biomarkers Prev. 2009, 18, 2569–2578. [CrossRef]
113. Escoté, X.; Félix-Soriano, E.; Gayoso, L.; Huerta, A.E.; Alvarado, M.A.; Ansorena, D.; Astiasarán, I.; Martínez, J.A.; Moreno-Aliaga, M.J. Effects of EPA and lipoic acid supplementation on circulating FGF21 and the fatty acid profile in overweight/obese women following a hypocaloric diet. Food Funct. 2018, 9, 3028–3036. [CrossRef]
114. Huerta, A.E.; Navas-Carretero, S.; Prieto-Hontoria, P.L.; Martínez, J.A.; Moreno-Aliaga, M.J. Effects of α-lipoic acid and eicosapentaenoic acid in overweight and obese women during weight loss. Obesity 2015, 23, 313–321. [CrossRef]
115. Li, N.; Yan, W.; Hu, X.; Huang, Y.; Wang, F.; Zhang, W.; Wang, Q.; Wang, X.; Sun, K. Effects of oral α-lipoic acid administration on body weight in overweight or obese subjects: A crossover randomized, double-blind, placebo-controlled trial. Clin. Endocrinol. 2017, 86, 680–687. [CrossRef] [PubMed]
116. Hosseinpour-Arjmand, S.; Amirkhizi, F.; Ebrahimi-Mameghani, M. The effect of alpha-lipoic acid on inflammatory markers and body composition in obese patients with non-alcoholic fatty liver disease: A randomized, double-blind, placebo-controlled trial. J. Clin. Pharm. Ther. 2019, 44, 258–267. [CrossRef] [PubMed]
117. Romo-Hualde, A.; Huerta, A.E.; González-Navarro, C.J.; Ramos-López, O.; Moreno-Aliaga, M.J.; Martínez, J.A. Untargeted metabolomic on urine samples after α-lipoic acid and/or eicosapentaenoic acid supplementation in healthy overweight/obese women. Lipids Health Dis. 2018, 17, 103. [CrossRef] [PubMed]
118. The American Psychiatric Association. Diagnostic and statistical manual of mental disorders; The American Psychiatric Association: Washington, DC, USA, 2013.
119. Gold, J.M. Cognitive deficits as treatment targets in schizophrenia. Schizophr. Res. 2004, 72, 21–28. [CrossRef] [PubMed]
120. Friedman, J.I.; Wallenstein, S.; Moshier, E.; Parrella, M.; White, L.; Bowler, S.; Gottlieb, S.; Harvey, P.D.; McGinn, T.G.; Flanagan, L. The effects of hypertension and body mass index on cognition in schizophrenia. Am. J. Psychiatry 2010, 167, 1232–1239. [CrossRef] [PubMed]
121. Goughari, A.S.; Mazhari, S.; Pourrahimi, A.M.; Sadeghi, M.M.; Nakhaee, N. Associations between components of metabolic syndrome and cognition in patients with schizophrenia. J. Psychiatr. Pract. 2015, 21, 190–197. [CrossRef] [PubMed]
122. Sanders, L.L.O.; de Souza Menezes, C.E.; Chaves Filho, A.J.M.; de Almeida Viana, G.; Fechine, F.V.; de Queiroz, M.G.R.; da Cruz Fonseca, S.G.; Vasconcelos, S.M.M.; de Moraes, M.E.A.; Gama, C.S. α-Lipoic acid as adjunctive treatment for Schizophrenia: An open-label trial. J. Clin. Psychopharmacol. 2017, 37, 697–701. [CrossRef] [PubMed]
123. Vidovi´c, B.; Milovanovi´c, S.; Stefanovi´c, A.; Kotur-Stevuljevi´c, J.; Taki´c, M.; Debeljak-Martaˇci´c, J.; Pantovi´c, M.; Đorđevi´c, B. Effects of alpha-lipoic acid supplementation on plasma adiponectin levels and some metabolic risk factors in patients with schizophrenia. J. Med. Food 2017, 20, 79–85. [CrossRef]
124. Confavreux, C.; Vukusic, S.; Moreau, T.; Adeleine, P. Relapses and progression of disability in multiple sclerosis. N. Engl. J. Med. 2000, 343, 1430–1438. [CrossRef]
125. Marracci, G.H.; Jones, R.E.; McKeon, G.P.; Bourdette, D.N. Alpha lipoic acid inhibits T cell migration into the spinal cord and suppresses and treats experimental autoimmune encephalomyelitis. J. Neuroimmunol. 2002, 131, 104–114. [CrossRef]
126. Yadav, V.; Marracci, G.; Lovera, J.; Woodward, W.; Bogardus, K.; Marquardt, W.; Shinto, L.; Morris, C.; Bourdette, D. Lipoic acid in multiple sclerosis: A pilot study. Mult. Scler. J. 2005, 11, 159–165. [CrossRef] [PubMed]
127. Dutta, R.; Trapp, B.D. Relapsing and progressive forms of multiple sclerosis–insights from pathology. Curr. Opin. Neurol. 2014, 27, 271–278. [CrossRef] [PubMed]
128. Khalili, M.; Azimi, A.; Izadi, V.; Eghtesadi, S.; Mirshafiey, A.; Sahraian, M.A.; Motevalian, A.; Norouzi, A.; Sanoobar, M.; Eskandari, G.; et al. Does lipoic acid consumption affect the cytokine profile in multiple sclerosis patients: A double-blind, placebo-controlled, randomized clinical trial. Neuroimmunomodulation 2014, 21, 291–296. [CrossRef] [PubMed]
129. Loy, B.D.; Fling, B.W.; Horak, F.B.; Bourdette, D.N.; Spain, R.I. Effects of lipoic acid on walking performance, gait, and balance in secondary progressive multiple sclerosis. Complement. Ther. Med. 2018, 41, 169–174. [CrossRef] [PubMed]
130. Fiedler, S.E.; Yadav, V.; Kerns, A.R.; Tsang, C.; Markwardt, S.; Kim, E.; Spain, R.; Bourdette, D.; Salinthone, S. Lipoic acid stimulates cAMP production in healthy control and secondary progressive MS subjects. Mol. Neurobiol. 2018, 55, 6037–6049. [CrossRef] [PubMed]
131. Yamada, T.; Atsuki, Y.; Wakasaya, A.; Kobayashi, M.; Hirano, Y.; Ohwada, M. Characteristics of patients with subchorionic hematomas in the second trimester. J. Obstet. Gynaecol. Res. 2012, 38, 180–184. [CrossRef] [PubMed]
132. ¸Sükür, Y.E.; Göç, G.; Köse, O.; Açmaz, G.; Özmen, B.; Atabeko˘glu, C.S.; Koç, A.; Söylemez, F. The effects of subchorionic hematoma on pregnancy outcome in patients with threatened abortion. J. Turkish German Gynecol. Assoc. 2014, 15, 239. [CrossRef] [PubMed]
133. Carp, H.J.A. Progestogens and pregnancy loss. Climacteric 2018, 21, 380–384. [CrossRef]
134. Porcaro, G.; Brillo, E.; Giardina, I.; Di Iorio, R. Alpha Lipoic Acid (ALA) effects on subchorionic hematoma: Preliminary clinical results. Eur. Rev. Med. Pharmacol. Sci. 2015, 19, 3426–3432.
135. Grandi, G.; Pignatti, L.; Ferrari, F.; Dante, G.; Neri, I.; Facchinetti, F. Vaginal alpha-lipoic acid shows an anti-inflammatory effect on the cervix, preventing its shortening after primary tocolysis. A pilot, randomized, placebo-controlled study. J. Matern. Fetal Neonatal Med. 2017, 30, 2243–2249. [CrossRef]
136. Costantino, M.; Guaraldi, C.; Costantino, D. Resolution of subchorionic hematoma and symptoms of threatened miscarriage using vaginal alpha lipoic acid or progesterone: Clinical evidences. Eur. Rev. Med. Pharmacol. Sci. 2016, 20, 1656–1663. [PubMed]
137. Ambrosi, N.; Arrosagaray, V.; Guerrieri, D.; Uva, P.D.; Petroni, J.; Herrera, M.B.; Iovanna, J.L.; Leon, L.; Incardona, C.; Chuluyan, H.E.; et al. alpha-Lipoic acid protects against ischemia-reperfusion injury in simultaneous kidney-pancreas transplantation. Transplantation 2016, 100, 908–915. [CrossRef] [PubMed]
138. Casciato, P.; Ambrosi, N.; Caro, F.; Vazquez, M.; Müllen, E.; Gadano, A.; de Santibañes, E.; de Santibañes, M.; Zandomeni, M.; Chahdi, M. α-Lipoic acid reduces postreperfusion syndrome in human liver transplantation-a
pilot study. Transpl. Int. 2018, 31, 1357–1368. [CrossRef] [PubMed]
139. Guo, Y.; Jones, D.; Palmer, J.L.; Forman, A.; Dakhil, S.R.; Velasco, M.R.; Weiss, M.; Gilman, P.; Mills, G.M.; Noga, S.J.; et al. Oral alpha-lipoic acid to prevent chemotherapy-induced peripheral neuropathy: A randomized, double-blind, placebo-controlled trial.Support. Care Cancer 2014, 22, 1223–1231. [CrossRef] [PubMed]
' 2019 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access
article distributed under the terms and conditions of the Creative Commons Attribution
(CC BY) license (http://creativecommons.org/licenses/by/4.0/).