(一)BGB-290
BGB290是一种高选择性PARP1/2抑制剂,在中国优先开发用于治疗携带BRCA突变的卵巢癌和乳腺癌。
1. 与全球唯一获批上市的PRAP抑制剂奥拉帕尼相比,BGB290拥有更强的血脑屏障通透性和DNA捕获性,更强的PARP选择性,更好的生物利用度,因此在安全性、耐受性和有效性方面都有较大改善。
2. BGB290已于2014年7月启动剂量爬坡研究,截至2016年1月15日,已给药40例患者。
3. 百济神州计划2016年初启动BGB290联合BGB-A317治疗BRCA突变型卵巢癌、乳腺癌、铂敏感型卵巢癌、HR-或MMR-肿瘤的临床研究。
4.百济神州未来将考察BGB290联合替莫唑胺治疗恶性胶质瘤、BGB290联合紫杉醇治疗胃癌、BGB290联合铂类/依托泊苷治疗小细胞肺癌的疗效。
(二)PARP抑制剂
PARP抑制剂是一种靶向聚ADP核糖聚合酶(Poly ADP-ribose Polymerase,PARP)的癌症疗法。聚腺苷二磷酸核糖聚合酶(PARP)是一种DNA修复酶,在DNA修复通路中起关键作用。DNA损伤断裂时会激活PARP,它作为DNA损伤的一种分子感受器,具有识别、结合到DNA断裂位置的功能,进而激活、催化受体蛋白的聚ADP核糖基化作用,参与DNA的修复过程。
最初开发PARP抑制剂是通过削弱癌细胞修复DNA损伤的能力以增强其它疗法(如放疗和化疗)的疗效。研究发现携带BRCA突变的肿瘤细胞对PARP抑制剂的敏感度高,推进了PARP抑制剂针对DNA修复缺陷型癌症的单一疗法在临床上的应用。
其作用机制主要包括两个方面:
第一,其能够抑制DNA单链损伤的修复过程,但这种DNA单链损伤可在DNA复制形成复制叉过程中转变为双链损伤(DSB),而DSB仍可通过同源重组(HR)途径修复完成。如果肿瘤细胞存在同源重组修复缺陷(包括BRCA1和BRCA2突变),使得DSB损伤无法修复,则会导致PARP抑制剂和同源重组修复缺陷对肿瘤细胞合成致死的作用。
第二,BRCA1和BRCA2只是HR修复的一部分,其他蛋白如EMSY和PTEN对于HR途径同样重要,如果HR修复途径中这些基因突变或表达沉默,PARP抑制剂即可能通过合成致死作用而产生单药抗肿瘤活性。
(三)国内外研发
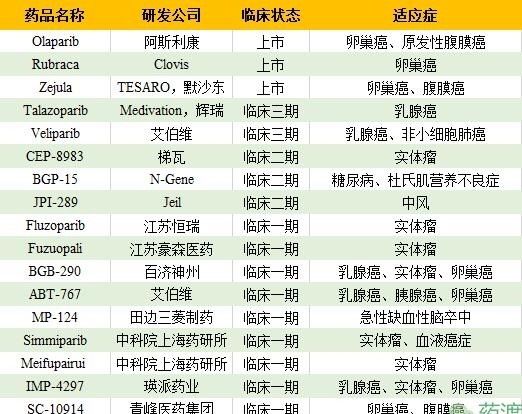
FDA已批准3个药物上市,第一个上市药物:阿斯利康公司的Olaparib;第二个上市药物:Clovis公司的Rubraca;第三个上市药物:TESARO和默沙东公司的Zejula。
1.Lynparza (Olaparib)
【英文商品名】Lynparza
【英文药品名】Olaparib
【中文药品名】奥拉帕尼
【生产厂家名】阿斯利康
2014年12月19日,美国FDA批准阿斯利康公司的Lynparza上市许可,批准剂型为胶囊剂,规格为50mg;用于铂敏感复发性BRCA突变卵巢癌成人患者的维持治疗,该药也成为用于BRCA突变铂敏感复发性卵巢癌的首个PARP抑制剂。同年6月,欧盟委员会(EC)已批准Lynparza作为一种单药疗法,用于卵巢癌成人患者的维持治疗。
Lynparza是一种首创口服聚ADP核糖聚合酶(PARP)抑制剂,其具有治疗DNA修复缺陷型多种肿瘤的潜力,尤其用于乳腺癌和卵巢癌的治疗,阿斯利康正开展多个III期研究,用于BRCA突变引起的卵巢癌、胃癌、乳腺癌治疗。临床研究已经证实,Lynparza可显著延长携带生殖系BRCA突变(gBRCA)、复发且对铂类药物的化疗无反应的卵巢癌病人的无进展生存期(PFS)。
Lynparza在上市第一年全球销售额高达0.94亿美元,2016年销售额超过2.18亿美元,年增长率高达130%,阿斯利康对Lynparza寄予了厚望,认为其年销售额将会突破20亿美元。
2.Rubraca (Rucaparib)
【英文商品名】Rubraca
【英文药品名】Rucaparib
【中文药品名】芦卡帕利
【生产厂家名】克洛维斯肿瘤公司
2016年12月19日,美国FDA批准Clovis公司的Rubraca上市许可,批准剂型为片剂,规格为200mg和300mg;用于经过两线或两线以上化疗的和BRCA基因突变相关的晚期卵巢癌,该药是继2014年阿斯利康Lynparza后第二个在美国上市的PARP抑制剂。
Rubraca的安全性和疗效是通过两项单臂临床试验涉及106例有BRCA突变的晚期卵巢癌(曾使用两种或多种化疗方案治疗)患者得出的,在该试验中,54%患者实现持续中位时间9.2个月的肿瘤完全或部分收缩。
FDA曾授予Rubraca优先审评和突破性药物治疗的资格认定,同时还获得了孤儿药物的认定。
3.Zejula(Niraparib)
【英文商品名】Zejula
【英文药品名】Niraparib
【中文药品名】尼拉帕利
【研发厂家名】TESARO,默沙东
2017年03月27日,美国FDA批准TESARO及默沙东公司共同研发的Zejula上市许可,批准剂型为胶囊剂,规格为100mg,用于复发性上皮卵巢癌、输卵管癌或原发性腹膜癌女性患者的维持治疗。
Zejula曾获得FDA加速审批、优先审批、突破性药物多重身份,是第三个上市的PARP抑制剂,同时是美国FDA批准的首个无需BRCA突变或其他生物标志物检测就可用于治疗的PARP抑制剂,其没有BRCA变异限制,适用人群更为广泛。
4.Talazoparib
【英文药品名】Talazoparib
【现临床阶段】临床三期
【研发厂家名】Medivation,辉瑞
Talazoparib是新一代PARP抑制剂,也是目前已知报道中发现的最强PARP抑制剂,其能够抑制PARP-1与PARP-2,但不抑制PARG,对PTEN突变型细胞高度敏感。临床研究显示,其能显著增强Temozolomide(TMZ,替莫唑胺)和SN-38的细胞毒性效果;并对携带BRCA种系基因突变在没有接受化疗或手术早期乳腺癌患者,显示出良好的临床优势。
5.Veliparib
【英文药品名】Veliparib
【研发厂家名】艾伯维
艾伯维曾于2014年底宣布Veliparib在治疗晚期乳腺癌临床三期研究结果,该药与卡铂和紫杉醇联合治疗乳腺癌反应率为52%,临床效果良好。汤森路透曾预测其在2019年潜在销售额在3.5亿美元。
艾伯维于2017年04月20日发布公告称,该公司在研PARP抑制剂Veliparib的两项临床三期试验均未达到主要试验终点。此次公布结果的两项临床三期研究分别用于评估Veliparib联合卡铂及紫杉醇用于鳞状非小细胞肺癌和早期三阴性乳腺癌的治疗效果。
总结与展望
PARP抑制剂是近年来肿瘤治疗领域的热门靶点,也是治疗卵巢癌最有希望的靶向药物,有多项临床试验正在进行中,国内大多数企业处于临床一期阶段。虽然PARP抑制剂通常与BRCA1或BRCA2种系基因突变联系在一起,但有望拓展到其他原因导致的HR缺陷肿瘤中。为此,寻找新的HR缺陷相关的生物标记物具有重要意义。
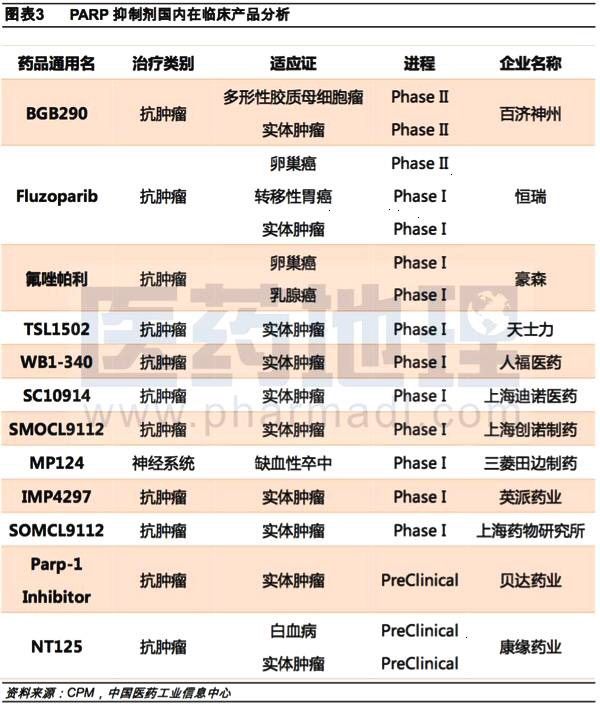
国内在PARP领域的玩家主要有再鼎医药、百济神州、豪森药业、青峰药业、人福医药、恒瑞医药、瑛派药业等。
1、再鼎医药
2016年,9月29日,再鼎医药与Tesaro公司达成战略合作协议,获得Niraparib在中国市场的独家研发和销售权,Tesaro保留可能参与Niraparib在中国共同销售的选择权。此外,Tesaro从再鼎医药获得两个新型的处于研发阶段的免疫肿瘤新药项目海外合作的选择权。
旗下候选药物ZL-2306,是一种口服、高效、高选择性的PARP抑制剂,已在全球随机3期研究中证明了具有维持BRCA突变的卵巢癌患者治疗的临床疗效。
2、百济神州
百济神州是一家全球性的生物制药公司,致力于成为具有创新性的分子靶向与免疫抗肿瘤药物研发领域领导者。旗下处于临床阶段的药物BGB-290,是一种针对PARP1和PARP2的分子靶向、口服、强效且高度选择性的抑制剂。
BGB-290在选择性、DNA捕获活性、口服生物利用度和脑组织穿透性方面可区别于其它PARP抑制剂,包括目前唯一获得美国FDA和欧洲EMA许可的PARP抑制剂olaparib。
3、豪森药业
江苏豪森成立于1995年,已发展成为集化学、生物药物研究,医药中间体、原料药合成,制剂制造和产品销售于一体的创新型医药集团。旗下候选药物氟唑帕利正在晚期实体瘤患者中开展耐受性及药代动力学I期临床研究(CTR20131369)。国内第一例患者在2015年4月27日入组。
4、青峰药业
青峰医药是一家跨地区、产学研、科工贸于一体的新型医药企业集团,在赣州、北京、上海、杭州、深圳和昆明等地拥有10家全资子公司、2家控股公司和1家参股公司。
旗下SC10914为青峰药业联合上海迪诺联合开发,迪诺为青峰药业子公司。目前,正在开展在晚期实体肿瘤患者中的安全性、耐受性,药代动力学/药效动力学及初步疗效的I期临床研究(CTR20160752)。2016年11月23日国内首例患者入组。
5、人福医药
人福医药成立于1993年,于1997年在上海证券交易所上市(股票代码:600079.SH),经过20多年的发展,人福医药已成为综合性的医药产业集团。旗下PARP抑制剂WXFL10040340胶囊,累计研发投入约2000万元人民币。
该药在水溶性、代谢、组织分布及生物利用度等方面具有明显的优势,且经过体内外药效模型及安全性研究证实,其靶点选择性高、抗肿瘤疗效显著、安全窗口宽,是单药或联合治疗同源重组障碍(包括BRCA突变或缺失)的恶性肿瘤(如乳腺癌,卵巢癌等)的良好选择,有较大潜力能成为走向市场的“BEST-IN-CLASS”新药。
一款“乌龙“药物引发的案件
关于已上市三款PARP抑制剂,笔者忍不住要提一提其中非常戏剧化的经历。一波三折,此起彼伏的收购和转卖源自医药研发界的一个“乌龙”,那就是一个自认为是PARP抑制剂的药物——Iniparib。
Iniparib最先由PiPar Sciences公司研发,在2009年的ASCO年会上,该公司公布了这款候选药物2期临床试验数据,表现出积极结果,且当时被认为在PARP抑制剂中处于绝对领先位置,吸引了制药巨头赛诺菲的注意力。
随后赛诺菲立即开展收购活动,最终以5亿美元成功收购PiPar Sciences公司,将Iniparib收入囊中,并紧急上马开展三阴性乳腺癌的3期临床试验。
不幸的是,2011年Iniparib的这期临床试验还是以失败告终。同年遭遇3期临床失败的PARP热门候选药物还有阿斯利康原研的Olaparib。自此,PARP抑制剂的研发一度走冷,当时研发进度相对滞后的其他几款候选药物也不被看好。
于是辉瑞把Rucaparib卖给了Clovis Oncology公司,默沙东将Niraparib卖给了Tesaro公司。
2012年,也不知哪位研究人员发现并证实赛诺菲的Iniparib并非真正的PARP抑制剂,“惨案”就此埋下伏笔。2014年,矢志不渝的阿斯利康重拾Olaparib,再次开启治疗卵巢癌的3期临床试验,并顺利于同年12月16日获得欧盟EMA批准,几天后(12月19日)又获得美国FDA批准上市。
继阿斯利康的Olaparib上市之后,Rucaparib和Niraparib也于近期相继上市,市场前景广阔。辉瑞和默沙东为他人做嫁衣,追悔莫及也已无济于事。