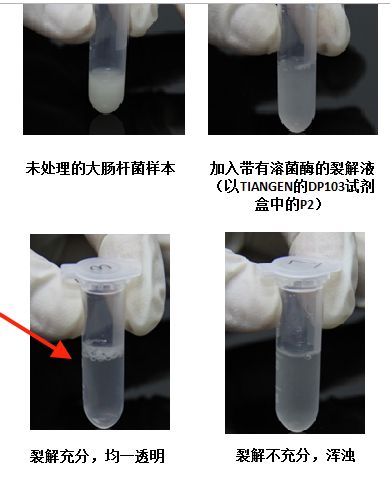
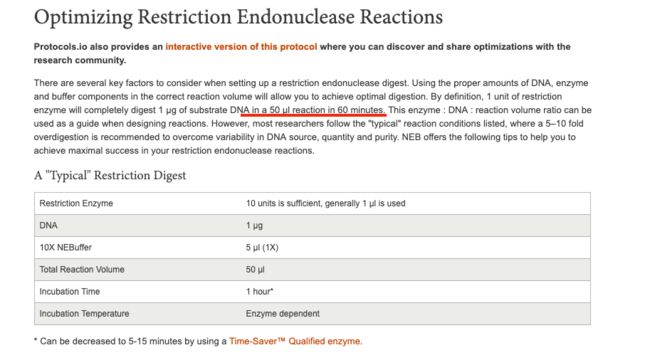
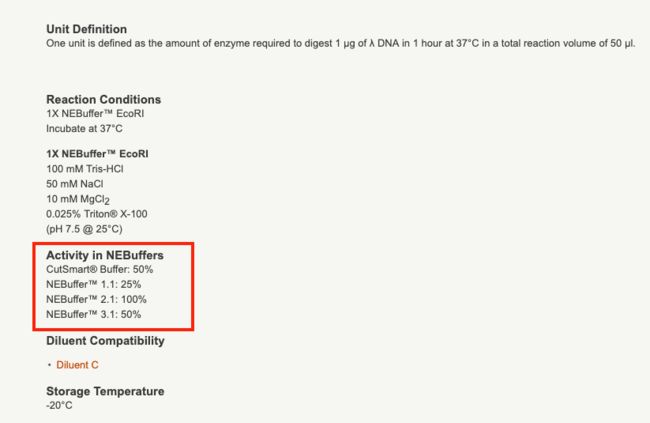
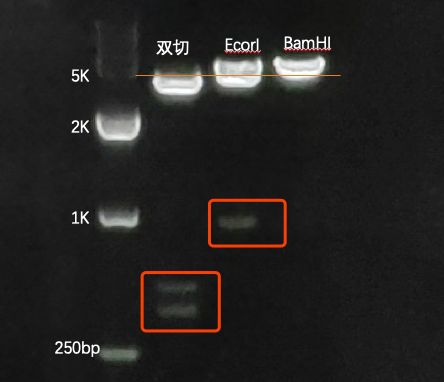
- 力扣hot100(普通数组)
桐原_
leetcode算法
最大子数组和给你一个整数数组nums,请你找出一个具有最大和的连续子数组(子数组最少包含一个元素),返回其最大和。子数组是数组中的一个连续部分。解析假设nums数组的长度是n,下标从0到n−1。我们用f(i)代表以第i个数结尾的「连续子数组的最大和」,那么很显然我们要求的答案就是:max0≤i≤n−1{f(i)}因此我们只需要求出每个位置的f(i),然后返回f数组中的最大值即可。那么我们如何求f(
- 【ArkUI】对于Flex布局与基础组件&&声明式UI-组件封装&&父子组件相互绑定的运用
一键难忘
harmonyos华为OpenHarmony对于Flex布局与基础组件声明式UI-组件封装
文章目录一.Flex布局与基础组件二.声明式UI-组件封装和父对子组件传值2.1组件封装2.2父对子组件传值三.父子组件相互绑定3.1远程模拟器3.2Link装饰器一.Flex布局与基础组件Flex是FlexibleBox的缩写,意为”弹性布局”,用来为盒状模型提供最大的灵活性。任何一个容器都可以指定为Flex布局。1.先规定弹性布局的大小,设置为百分之百。.width("100%").heigh
- 2025美赛数学建模C题:奥运奖牌榜模型——思路+代码+模型
灿灿数模
人工智能
详细思路更新见文末名片2025MCM问题C:奥运奖牌榜模型除了观看2024年巴黎夏季奥运会的各项个人比赛外,粉丝们还关注每个国家的“奖牌榜”。最终结果(表1)显示,美国获得了最多的奖牌(126枚),中国和美国在金牌榜上并列第一(40枚金牌)。东道国法国在金牌榜上排名第五(16枚金牌),但在总奖牌榜上排名第四,而英国以14枚金牌排名第七,在总奖牌数上排名第三。金牌银牌铜牌总计美国404442126中
- 2025美赛数学建模MCM/ICM选题建议与分析,思路+模型+代码
灿灿数模
数学建模
2025美赛数学建模MCM/ICM选题建议与分析,思路+模型+代码,详细更新见文末名片一、问题A:测试时间:楼梯的恒定磨损(ArchaeologicalModeling)适合专业:考古学、历史学、数学、机械工程难度:中等开放度:中等问题A让学生探索如何根据楼梯的磨损情况推断楼梯的使用情况。这个问题涉及到对磨损的定量分析,并通过历史记录推测使用模式。该题目适合对历史、考古以及机械磨损有兴趣的学生,尤
- plt.show()输出<Figure size 1200x800 with 1 Axes>没有展示出图片在notebook里
热爱生活的五柒
AI相关pythonnotebookpython
解决方法如下:在JupyterNotebook中,如果使用plt.show()没有直接显示图像,可能是由于某些设置或限制导致的。您可以尝试使用%matplotlibinline魔术命令来确保图像能够直接显示在Notebook中。请在Notebook的第一个单元格中执行以下命令:%matplotlibinline然后再次运行您的代码,应该能够在Notebook中看到图像。示例如下:
- CPU中断机制
万物琴弦光锥之外
操作系统操作系统
CPU的中断机制是操作系统和硬件之间通信的重要方式,用于处理外部事件和内部任务。中断可以分为硬中断(HardwareInterrupts)和软中断(SoftwareInterrupts)。以下是详细的讲解:1.中断的基本概念定义中断:是一种异步事件,它会打断当前正在执行的程序或指令流,使CPU转而去处理特定的中断服务程序(InterruptServiceRoutine,ISR),处理完毕后再返回原
- 2023-简单点-非极大值抑制NMS
万物琴弦光锥之外
目标跟踪人工智能计算机视觉
非极大值抑制(Non-MaximumSuppression,NMS)是一种在目标检测中常用的后处理技术。NMS能够抑制那些与真实目标重叠较大的冗余检测框,留下最好的一个。非极大值抑制(Non-MaximumSuppression,NMS)的原理是:在目标检测中,对于检测到的冗余框,保留置信度最高的那个,抑制其他与它有较大重叠的冗余框。其基本原理是先在图像中找到所有可能包含目标物体的矩形区域,并按照
- Windows系统加固
泷羽Sec-pp
windows安全
一、身份鉴别1.密码安全策略位置:开始—>管理工具—>本地安全策略—>账户策略—>密码策略。加固设置:(1)开启密码复杂度:使用数字、大小写字母、特殊符号等(2)密码长度最小值为8个字符(3)密码最短使用期限30天(4)密码最长使用期限90天(5)强制密码历史5个2.账户锁定策略位置:开始—>管理工具—>本地安全策略—>账户策略—>账号锁定策略。加固设置:(1)账户锁定时间30分钟(2)账户锁定阈
- 游戏AI 技术方案部分解析 |用 AI 技术,练就 FPS 游戏中的刚枪王!
游戏智眼
游戏AI人工智能
一、整体方案详情FPS作为重度竞技游戏品类,存在显著的新手留存问题及高端匹配困难问题,通过引入AI陪玩智能体来针对性解决FPS品类通用痛点。在这个过程中,我们用到了强化学习,让AI通过自我在游戏中学习探索,最终成为超越或比肩人类顶尖玩家水平的强大AI。1.针对新手留存问题通过引入不同水平的陪玩智能体+智能投放来为新手玩家设计好前20局甚至前50局的对战,为玩家制造一个平滑的新手过渡期,帮手玩家更顺
- python中json的用法总结
小疯子呀
python基础
一、json的概念json是一种通用的数据类型一般情况下接口返回的数据类型都是json长得像字典,形式也是k-v{}其实json是字符串字符串不能用key、value来取值,所以要先转换为字典才可以使用JSON函数,需要先导入importjson二、json的相关方法1、json.dumps:将Python对象编码成JSON字符串2、json.loads:将已编码的JSON字符串解码为Python
- C盘里的AppData文件夹是什么?如何清理?
W优化大师
windows电脑科技笔记本电脑
什么是AppData文件夹?AppData文件夹是Windows操作系统中的一个隐藏文件夹,存储着用户个人数据和应用程序的配置文件。每个用户账户都有一个独立的AppData文件夹,通常位于以下路径:C:\Users\[你的用户名]\AppDataAppData文件夹下包含三个子文件夹:Local:存储本地应用程序的数据,不会在不同设备间同步。LocalLow:存储低完整性级别应用程序的数据,适用于
- C# Json字符串生成工具的实现与应用
徐子贡
本文还有配套的精品资源,点击获取简介:JSON是一种轻量级的数据交换格式,被广泛用于Web服务中,用以替代XML,因其简洁易处理特性。本课程主要介绍如何在C#中使用Json.NET库生成JSON字符串,并提供源码分析,帮助开发者理解并根据需求定制自己的Json字符串生成工具。课程将涵盖数据类型、库的使用、源码解析、工具定制、效率提升、扩展性以及如何将工具集成到项目中,从而加深对JSON生成原理的理
- 系统架构设计中的需求分析与建模
Evaporator Core
系统架构设计师软考信息系统项目管理师基础班系统架构需求分析
引言在系统架构设计的过程中,需求分析是至关重要的一步。需求分析不仅决定了系统的功能和非功能需求,还为后续的设计和开发提供了基础。一个成功的系统架构设计必须建立在对需求的深刻理解之上。本文将深入探讨需求分析的方法与建模技术,帮助读者掌握如何通过有效的需求分析来指导系统架构设计。第一章:需求分析的重要性需求分析是系统架构设计的起点,它的目的是明确系统的功能需求、非功能需求以及约束条件。功能需求描述了系
- 2025年新出炉的MySQL面试题
长风清留扬
150道MySQL高频面试题mysql数据库面试sql
作者简介:CSDN\阿里云\腾讯云\华为云开发社区优质创作者,专注分享大数据、Python、数据库、人工智能等领域的优质内容个人主页:长风清留杨的博客形式准则:无论成就大小,都保持一颗谦逊的心,尊重他人,虚心学习。✨推荐专栏:Python入门到入魔,Mysql入门到入魔,Python入门基础大全,Flink入门到实战若缘分至此,无法再续相逢,愿你朝朝暮暮,皆有安好,晨曦微露道早安,日中炽热说午安,
- 精选了几道MySQL的大厂面试题,被提问的几率很高!
长风清留扬
150道MySQL高频面试题mysqlandroid数据库面试学习MySQL面试
作者简介:CSDN\阿里云\腾讯云\华为云开发社区优质创作者,专注分享大数据、Python、数据库、人工智能等领域的优质内容个人主页:长风清留杨的博客形式准则:无论成就大小,都保持一颗谦逊的心,尊重他人,虚心学习。✨推荐专栏:Python入门到入魔,Mysql入门到入魔,Python入门基础大全,Flink入门到实战若缘分至此,无法再续相逢,愿你朝朝暮暮,皆有安好,晨曦微露道早安,日中炽热说午安,
- 有史以来最全的异常类讲解没有之一!第二部分爆肝2万字,终于把Python的异常类写完了!最全Python异常类合集和案例演示,第二部分
长风清留扬
最新Python入门基础合集python笔记学习异常处理改行学it异常BUG
本文是第二部分,第一部分请看:有史以来最全的异常类讲解没有之一!爆肝3万字,终于把Python的异常类写完了!最全Python异常类合集和案例演示,第一部分博客主页:长风清留扬-CSDN博客系列专栏:Python基础专栏每天更新大数据相关方面的技术,分享自己的实战工作经验和学习总结,尽量帮助大家解决更多问题和学习更多新知识,欢迎评论区分享自己的看法感谢大家点赞收藏⭐评论异常类型IndexError
- 有史以来最全的异常类讲解没有之一!第三部分爆肝4万字,终于把Python的异常类写完了!最全Python异常类合集和案例演示,第三部分
长风清留扬
最新Python入门基础合集python面试异常处理BUG异常类型职场和发展改行学it
本文是第三部分,第一第二部分请看:有史以来最全的异常类讲解没有之一!爆肝3万字,终于把Python的异常类写完了!最全Python异常类合集和案例演示,第一部分有史以来最全的异常类讲解没有之一!第二部分爆肝2万字,终于把Python的异常类写完了!最全Python异常类合集和案例演示,第二部分博客主页:长风清留扬-CSDN博客系列专栏:Python基础专栏每天更新大数据相关方面的技术,分享自己的实
- Python全网最全基础课程笔记(十三)——作用域,跟着思维导图和图文来学习,爆肝2w字,无数代码案例!
长风清留扬
最新Python入门基础合集python笔记学习作用域面试跳槽改行学it
本专栏系列为Pythong基础系列,每篇内容非常全面,包含全网各个知识点,非常长,请耐心看完。每天都会更新新的内容,搜罗全网资源以及自己在学习和工作过程中的一些总结,可以说是非常详细和全面。以至于为什么要写的这么详细:自己也是学过Python的,很多新手只是简单的过一篇语法,其实对于一个知识点的底层逻辑和其他使用方法以及参数详情根本不是很了解,这就导致学完很容易忘记,而且在实战过程中也是半知半解,
- Python全网最全基础课程笔记(三)——所有运算符+运算符优先级
长风清留扬
最新Python入门基础合集开发语言python运算符Python基础numpypandaspip
本专栏系列为Pythong基础系列,每天都会更新新的内容,搜罗全网资源以及自己在学习和工作过程中的一些总结,可以说是非常详细和全面。以至于为什么要写的这么详细:自己也是学过Python的,很多新手只是简单的过一篇语法,其实对于一个知识点的底层逻辑和其他使用方法以及参数详情根本不是很了解,这就导致学完很容易忘记,而且在实战过程中也是半知半解,所以自己就尽量写的详细些,让需要的人能更了解Python的
- 【OTFS与信号处理:论文阅读1】:考虑分数多普勒的OTFS系统有效信道估计(24.01.16更新)
Cuby!
OTFS论文学习信号处理论文阅读人工智能
2023.06.05最近在研究OTFS考虑分数多普勒时信道估计与信号检测相关问题,最近精读了一篇论文,并针对论文中部分公式进行推导,故记录一下学习过程。【OTFS与信号处理:论文阅读1】EfficientChannelEstimationforOTFSSystemsinthePresenceofFractionalDoppler前言一、摘要及背景摘要分数多普勒的引入估计分数多普勒的意义研究现状二、
- 本地docker镜像改名字
Wwwilling
docker容器运维
如果你想修改本地Docker镜像的名字,可以通过创建该镜像的新标签(tag)来实现。Docker中没有直接修改镜像名字的命令,但可以通过重新打标签的方式实现类似的效果。以下是具体步骤:查看当前镜像:dockerimages找到你想要重命名的镜像的IMAGEID。给镜像打一个新的标签(即新名字):dockertag:例如,如果你想把一个镜像重命名为mynewimage:latest,你可以这样做:d
- Nacos负载均衡
平凡人笔记
平凡人笔记负载均衡java运维
常见的负载均衡策略随机、hash、轮询、权重、最小连接数、最快响应速度适用场景1、在短连接中因为连接快速建立销毁因为数据延时容易造成堆积效应,随机、hash、轮询、权重四种方式大致能够保持整体是均衡的,服务端重启也不会影响整体均衡2、最小连接、最快响应速度是有状态的算法,因为数据延时容易造成堆积效应3、长连接,连接会一直保持,断连后需要重新选择一个新的服务节点,当服务重启后,最终连接数会出现不均衡
- 金融数据有哪些,有用的股票API接口数据
nance99
金融pythongit
一、金融数据有哪些,有用的股票API接口行情数据金融大数据是为金融机构、个人投资者以及金融应用开发者提供专业的数据和行情报价API服务,满足不同用户在投资过程中丰富多样的行情数据分析和投资研究,以API接口形式为用户提供行情数据API服务,提供的数据包括市场行情、财报、宏观等,还有基于文本分析的股票关联数据。对金融机构或者投资者而言,金融数据是企业财富。实时数据对企业成功至关重要,股票行情数据种类
- Vue 3 中的 ref 完全指南
m0_74824002
vue.js前端javascript
Vue3中的ref完全指南Vue3引入了CompositionAPI,其中ref是关键的一部分。ref可以让我们更方便地在组件中定义响应式数据,在模板中使用语法糖时尤为简洁。本文将详细讲解Vue3中ref的概念、用途及常见用法,并通过示例展示如何在实际开发中利用ref提升开发效率。一、什么是refref是Vue3CompositionAPI中定义响应式数据的核心函数。ref可以使基本类型(字符串、
- SQL实现md5加密方法
m0_74824002
面试学习路线阿里巴巴sql数据库
1.MD5加密概述MD5(MessageDigestAlgorithm5)是一种广泛使用的哈希算法,它将输入的字符串(或数据)转换为固定长度的128位(16字节)哈希值。MD5的主要特点是:不可逆性:MD5是一种单向哈希算法,这意味着你无法从MD5哈希值还原出原始数据。输出固定长度:无论输入数据的长度如何,MD5输出的哈希值始终是32个字符的十六进制数(128位)。碰撞性:虽然MD5很长时间被广泛
- SpringBoot如何开启异步编程
肥肥技术宅
javaspringbootjavaspring
一、什么是异步?现在我们假设有一个接口方法,里面又调用了三个子方法,分别是A,B,C。先从A执行,执行完毕再执行B,B执行完最后执行C。这也是我们代码最常见的执行方式。ABC顺序执行,其中一个出问题了,如果抛出了异常,后续则不再执行。这中方式就是同步执行。那么异步执行是什么样子的呢?假设B方法改为异步,那么A方法执行完毕,执行B方法。此时不需要等B方法执行完毕,代码会直接执行C方法。也就是B方法不
- 2024 年 MathorCup 数学应用挑战赛——大数据竞赛 赛道 B:电商品类货量预测及品类分仓规划 思路和代码 持续更新中
2025年数学建模美赛
数学建模2024年大数据第五届MathorCupB题
2024年所有数学建模类比赛的个人思路和代码都会发布到专栏内,会结合最新的chatgpt发布思路,开赛一天后恢复原价99,不代写论文,不回复私信.没有群,只需订阅一次目录问题分析与解决思路问题1:货量预测模型问题2:一品一仓分仓规划问题3:一品多仓分仓规划总结这类大数据竞赛的重点在于构建一个全面的预测和优化模型,通过数据处理、时间序列分析以及运筹优化来完成货量预测和分仓规划。下面是一个解决问题的整
- 2024年美赛MCM/ICM E题 财产保险的可持续性 最新思路
2025年数学建模美赛
数学建模20242024美赛思路财产保险的可持续性最新思路
专栏内ABCDEF题持续更新中这个数学建模问题要求我们开发两个模型:一个用于保险公司决定是否在极端天气事件频发地区承保保单的模型,另一个为社区领导人提供如何保护具有文化、历史、经济或社区意义建筑的指导模型。我们将分步骤地探讨这两个模型的开发过程,提供详细的解决思路和方法。保险公司模型目标开发一个模型,帮助保险公司评估在特定地区承保财产保险的风险与收益,特别是在极端天气事件日益增多的背景下。方法数据
- xss靶场练习之xss.haozi.me解析及答案
钟情妺喜107
xss安全前端
目录0x000x010x020x030x040x050x060x070x080x090x0A0x0B0x0C0x0D0x0E0x0F0x100x110x120x00先看源码,没有任何限制,所以很简单,直接抛出一个常规的payload就过了alert(1)0x01看源码里注入点是在标签中的,所以用上一题的方法是不会被解析的,所以要去构造一个标签,闭合,就可以注入alert(1)当然这个题也有其他的做
- ArkUI页面导航机制
荔枝寄
harmonyos
鸿蒙操作系统(HarmonyOS)是华为公司自主研发的分布式操作系统,旨在为不同设备提供统一的操作平台。它支持多种终端设备,包括但不限于智能手机、平板电脑、智能手表等,并能够实现设备间的无缝协同工作。为了适应这一特性,鸿蒙引入了ArkUI,一个专为鸿蒙设计的用户界面开发框架。ArkUI页面导航机制在鸿蒙操作系统中,页面导航是指在应用的不同页面之间进行切换和传递数据的过程。良好的页面导航设计对于用户
- HttpClient 4.3与4.3版本以下版本比较
spjich
javahttpclient
网上利用java发送http请求的代码很多,一搜一大把,有的利用的是java.net.*下的HttpURLConnection,有的用httpclient,而且发送的代码也分门别类。今天我们主要来说的是利用httpclient发送请求。
httpclient又可分为
httpclient3.x
httpclient4.x到httpclient4.3以下
httpclient4.3
- Essential Studio Enterprise Edition 2015 v1新功能体验
Axiba
.net
概述:Essential Studio已全线升级至2015 v1版本了!新版本为JavaScript和ASP.NET MVC添加了新的文件资源管理器控件,还有其他一些控件功能升级,精彩不容错过,让我们一起来看看吧!
syncfusion公司是世界领先的Windows开发组件提供商,该公司正式对外发布Essential Studio Enterprise Edition 2015 v1版本。新版本
- [宇宙与天文]微波背景辐射值与地球温度
comsci
背景
宇宙这个庞大,无边无际的空间是否存在某种确定的,变化的温度呢?
如果宇宙微波背景辐射值是表示宇宙空间温度的参数之一,那么测量这些数值,并观测周围的恒星能量输出值,我们是否获得地球的长期气候变化的情况呢?
&nbs
- lvs-server
男人50
server
#!/bin/bash
#
# LVS script for VS/DR
#
#./etc/rc.d/init.d/functions
#
VIP=10.10.6.252
RIP1=10.10.6.101
RIP2=10.10.6.13
PORT=80
case $1 in
start)
/sbin/ifconfig eth2:0 $VIP broadca
- java的WebCollector爬虫框架
oloz
爬虫
WebCollector主页:
https://github.com/CrawlScript/WebCollector
下载:webcollector-版本号-bin.zip将解压后文件夹中的所有jar包添加到工程既可。
接下来看demo
package org.spider.myspider;
import cn.edu.hfut.dmic.webcollector.cra
- jQuery append 与 after 的区别
小猪猪08
1、after函数
定义和用法:
after() 方法在被选元素后插入指定的内容。
语法:
$(selector).after(content)
实例:
<html>
<head>
<script type="text/javascript" src="/jquery/jquery.js"></scr
- mysql知识充电
香水浓
mysql
索引
索引是在存储引擎中实现的,因此每种存储引擎的索引都不一定完全相同,并且每种存储引擎也不一定支持所有索引类型。
根据存储引擎定义每个表的最大索引数和最大索引长度。所有存储引擎支持每个表至少16个索引,总索引长度至少为256字节。
大多数存储引擎有更高的限制。MYSQL中索引的存储类型有两种:BTREE和HASH,具体和表的存储引擎相关;
MYISAM和InnoDB存储引擎
- 我的架构经验系列文章索引
agevs
架构
下面是一些个人架构上的总结,本来想只在公司内部进行共享的,因此内容写的口语化一点,也没什么图示,所有内容没有查任何资料是脑子里面的东西吐出来的因此可能会不准确不全,希望抛砖引玉,大家互相讨论。
要注意,我这些文章是一个总体的架构经验不针对具体的语言和平台,因此也不一定是适用所有的语言和平台的。
(内容是前几天写的,现附上索引)
前端架构 http://www.
- Android so lib库远程http下载和动态注册
aijuans
andorid
一、背景
在开发Android应用程序的实现,有时候需要引入第三方so lib库,但第三方so库比较大,例如开源第三方播放组件ffmpeg库, 如果直接打包的apk包里面, 整个应用程序会大很多.经过查阅资料和实验,发现通过远程下载so文件,然后再动态注册so文件时可行的。主要需要解决下载so文件存放位置以及文件读写权限问题。
二、主要
- linux中svn配置出错 conf/svnserve.conf:12: Option expected 解决方法
baalwolf
option
在客户端访问subversion版本库时出现这个错误:
svnserve.conf:12: Option expected
为什么会出现这个错误呢,就是因为subversion读取配置文件svnserve.conf时,无法识别有前置空格的配置文件,如### This file controls the configuration of the svnserve daemon, if you##
- MongoDB的连接池和连接管理
BigCat2013
mongodb
在关系型数据库中,我们总是需要关闭使用的数据库连接,不然大量的创建连接会导致资源的浪费甚至于数据库宕机。这篇文章主要想解释一下mongoDB的连接池以及连接管理机制,如果正对此有疑惑的朋友可以看一下。
通常我们习惯于new 一个connection并且通常在finally语句中调用connection的close()方法将其关闭。正巧,mongoDB中当我们new一个Mongo的时候,会发现它也
- AngularJS使用Socket.IO
bijian1013
JavaScriptAngularJSSocket.IO
目前,web应用普遍被要求是实时web应用,即服务端的数据更新之后,应用能立即更新。以前使用的技术(例如polling)存在一些局限性,而且有时我们需要在客户端打开一个socket,然后进行通信。
Socket.IO(http://socket.io/)是一个非常优秀的库,它可以帮你实
- [Maven学习笔记四]Maven依赖特性
bit1129
maven
三个模块
为了说明问题,以用户登陆小web应用为例。通常一个web应用分为三个模块,模型和数据持久化层user-core, 业务逻辑层user-service以及web展现层user-web,
user-service依赖于user-core
user-web依赖于user-core和user-service
依赖作用范围
Maven的dependency定义
- 【Akka一】Akka入门
bit1129
akka
什么是Akka
Message-Driven Runtime is the Foundation to Reactive Applications
In Akka, your business logic is driven through message-based communication patterns that are independent of physical locatio
- zabbix_api之perl语言写法
ronin47
zabbix_api之perl
zabbix_api网上比较多的写法是python或curl。上次我用java--http://bossr.iteye.com/blog/2195679,这次用perl。for example: #!/usr/bin/perl
use 5.010 ;
use strict ;
use warnings ;
use JSON :: RPC :: Client ;
use
- 比优衣库跟牛掰的视频流出了,兄弟连Linux运维工程师课堂实录,更加刺激,更加实在!
brotherlamp
linux运维工程师linux运维工程师教程linux运维工程师视频linux运维工程师资料linux运维工程师自学
比优衣库跟牛掰的视频流出了,兄弟连Linux运维工程师课堂实录,更加刺激,更加实在!
-----------------------------------------------------
兄弟连Linux运维工程师课堂实录-计算机基础-1-课程体系介绍1
链接:http://pan.baidu.com/s/1i3GQtGL 密码:bl65
兄弟连Lin
- bitmap求哈密顿距离-给定N(1<=N<=100000)个五维的点A(x1,x2,x3,x4,x5),求两个点X(x1,x2,x3,x4,x5)和Y(
bylijinnan
java
import java.util.Random;
/**
* 题目:
* 给定N(1<=N<=100000)个五维的点A(x1,x2,x3,x4,x5),求两个点X(x1,x2,x3,x4,x5)和Y(y1,y2,y3,y4,y5),
* 使得他们的哈密顿距离(d=|x1-y1| + |x2-y2| + |x3-y3| + |x4-y4| + |x5-y5|)最大
- map的三种遍历方法
chicony
map
package com.test;
import java.util.Collection;
import java.util.HashMap;
import java.util.Iterator;
import java.util.Map;
import java.util.Set;
public class TestMap {
public static v
- Linux安装mysql的一些坑
chenchao051
linux
1、mysql不建议在root用户下运行
2、出现服务启动不了,111错误,注意要用chown来赋予权限, 我在root用户下装的mysql,我就把usr/share/mysql/mysql.server复制到/etc/init.d/mysqld, (同时把my-huge.cnf复制/etc/my.cnf)
chown -R cc /etc/init.d/mysql
- Sublime Text 3 配置
daizj
配置Sublime Text
Sublime Text 3 配置解释(默认){// 设置主题文件“color_scheme”: “Packages/Color Scheme – Default/Monokai.tmTheme”,// 设置字体和大小“font_face”: “Consolas”,“font_size”: 12,// 字体选项:no_bold不显示粗体字,no_italic不显示斜体字,no_antialias和
- MySQL server has gone away 问题的解决方法
dcj3sjt126com
SQL Server
MySQL server has gone away 问题解决方法,需要的朋友可以参考下。
应用程序(比如PHP)长时间的执行批量的MYSQL语句。执行一个SQL,但SQL语句过大或者语句中含有BLOB或者longblob字段。比如,图片数据的处理。都容易引起MySQL server has gone away。 今天遇到类似的情景,MySQL只是冷冷的说:MySQL server h
- javascript/dom:固定居中效果
dcj3sjt126com
JavaScript
<!DOCTYPE html PUBLIC "-//W3C//DTD XHTML 1.0 Transitional//EN" "http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd">
<html xmlns="http://www.w3.org/1999/xhtml&
- 使用 Spring 2.5 注释驱动的 IoC 功能
e200702084
springbean配置管理IOCOffice
使用 Spring 2.5 注释驱动的 IoC 功能
developerWorks
文档选项
将打印机的版面设置成横向打印模式
打印本页
将此页作为电子邮件发送
将此页作为电子邮件发送
级别: 初级
陈 雄华 (
[email protected]), 技术总监, 宝宝淘网络科技有限公司
2008 年 2 月 28 日
&nb
- MongoDB常用操作命令
geeksun
mongodb
1. 基本操作
db.AddUser(username,password) 添加用户
db.auth(usrename,password) 设置数据库连接验证
db.cloneDataBase(fromhost)
- php写守护进程(Daemon)
hongtoushizi
PHP
转载自: http://blog.csdn.net/tengzhaorong/article/details/9764655
守护进程(Daemon)是运行在后台的一种特殊进程。它独立于控制终端并且周期性地执行某种任务或等待处理某些发生的事件。守护进程是一种很有用的进程。php也可以实现守护进程的功能。
1、基本概念
&nbs
- spring整合mybatis,关于注入Dao对象出错问题
jonsvien
DAOspringbeanmybatisprototype
今天在公司测试功能时发现一问题:
先进行代码说明:
1,controller配置了Scope="prototype"(表明每一次请求都是原子型)
@resource/@autowired service对象都可以(两种注解都可以)。
2,service 配置了Scope="prototype"(表明每一次请求都是原子型)
- 对象关系行为模式之标识映射
home198979
PHP架构企业应用对象关系标识映射
HELLO!架构
一、概念
identity Map:通过在映射中保存每个已经加载的对象,确保每个对象只加载一次,当要访问对象的时候,通过映射来查找它们。其实在数据源架构模式之数据映射器代码中有提及到标识映射,Mapper类的getFromMap方法就是实现标识映射的实现。
二、为什么要使用标识映射?
在数据源架构模式之数据映射器中
//c
- Linux下hosts文件详解
pda158
linux
1、主机名: 无论在局域网还是INTERNET上,每台主机都有一个IP地址,是为了区分此台主机和彼台主机,也就是说IP地址就是主机的门牌号。 公网:IP地址不方便记忆,所以又有了域名。域名只是在公网(INtERNET)中存在,每个域名都对应一个IP地址,但一个IP地址可有对应多个域名。 局域网:每台机器都有一个主机名,用于主机与主机之间的便于区分,就可以为每台机器设置主机
- nginx配置文件粗解
spjich
javanginx
#运行用户#user nobody;#启动进程,通常设置成和cpu的数量相等worker_processes 2;#全局错误日志及PID文件#error_log logs/error.log;#error_log logs/error.log notice;#error_log logs/error.log inf
- 数学函数
w54653520
java
public
class
S {
// 传入两个整数,进行比较,返回两个数中的最大值的方法。
public
int
get(
int
num1,
int
nu