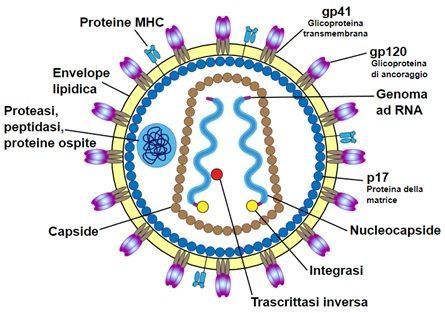
人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的11月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Nat Commun:在抗逆转录病毒治疗期间,大多数HIV病毒的持续存在是由于受感染细胞的增殖
doi:10.1038/s41467-018-06843-5
根据一项新的研究,即时在接受抑制性的抗逆转录病毒药物(ART)治疗期间,大多数受到HIV感染的细胞仍然存在于HIV感染者体内,这些受感染细胞来自细胞增殖,而不是病毒复制。相关研究结果于2018年11月16日发表在Nature Communications期刊上,论文标题为“A majority of HIV persistence during antiretroviral therapy is due to infected cell proliferation”。论文通讯作者为美国弗雷德-哈金森癌症研究中心疫苗与传染病科的Joshua T. Schiffer博士。论文第一作者为弗雷德-哈金森癌症研究中心疫苗与传染病科的Daniel B. Reeves博士。
图片来自Nature Communications, doi:10.1038/s41467-018-06843-5。
减少受到HIV感染的细胞库的大小是治愈HIV感染的最大挑战。基于这些结果,负责开展这项研究的研究人员认为减少细胞增殖可能有助于清除这种细胞库,并且潜在地导致人们开发出一种功能性治愈方法。
当HIV感染健康细胞时,它会将它自己的DNA插入到人类染色体中,从而留下独特的遗传特征。这些研究人员指出,如果这种病毒复制本身是潜伏性HIV病毒库存在的原因,那么这种遗传特征将包括独特的整合位点和受感染细胞的DNA存在的不同突变。事实上,他们发现大多数遗传特征是相同的,这表明HIV病毒库中的持久存在是正常的CD4+ T细胞有丝分裂的产物。为了维持稳定的细胞群体并对外来抗原作出反应,CD4+ T细胞通常每隔几个月就会发生增殖。每当这个正常的过程发生时,HIV DNA与人类DNA一起被复制到子细胞中。
2.Nature:没看错!HIV药物有望治疗阿尔茨海默病!
doi:10.1038/s41586-018-0718-6
在一项新的研究中,来自美国桑福德-伯纳姆-普利贝斯医学发现研究所(Sanford Burnham Prebys Medical Discovery Institute)的研究人员发现在阿尔茨海默病患者的大脑中,神经元中的基因重组产生了数千种新的基因变体。这项研究首次揭示了作为一种阿尔茨海默病相关基因,APP如何利用一种在HIV病毒中发现的相同类型的酶发生重组。相关研究结果于2018年11月21日在线发表在Nature期刊上,论文标题为“Somatic app gene recombination in Alzheimer’s disease and normal neurons”。
利用专注于单细胞和多细胞样本的新分析方法,这些研究人员发现app基因---产生阿尔茨海默病特征性的毒性β淀粉样蛋白---在神经元中产生新的基因变体,从而导致基因组镶嵌(genomic mosaic)过程发生。这个过程需要将这些基因变体进行逆转录和重新插入到原始基因组中,从而在细胞的DNA蓝图中产生永久的DNA序列变化。
与来自正常大脑的样本相比,100%的阿尔茨海默病脑样本含有过量的不同app基因变体。在这些在阿尔茨海默病中富含的基因变体中,这些研究人员发现了11种单核苷酸变化与家族性阿尔茨海默病中的已知突变相同,其中家族性阿尔茨海默病是一种非常罕见的遗传性的阿尔茨海默病。尽管在家族性阿尔茨海默病中发现存在基因组镶嵌,但是在最常见的阿尔茨海默病形式中也观察到相同的app变体,进一步将神经元中的基因重组与这种疾病相关联在一起。
这些研究人员发现这种基因重组过程需要一种称为逆转录酶的酶,这种酶与HIV用来感染细胞的酶属于同一类型。尽管没有医学证据表明HIV感染或者由这种感染引起的艾滋病(AIDS)会导致阿尔茨海默病,但是现有的得到美国食品药物管理局(FDA)批准的用于阻断HIV中的逆转录酶的抗逆转录病毒药物也可能能够阻止这种重组过程,并可作为阿尔茨海默病的一种新疗法进行探究。他们指出服用抗逆转录病毒药物的老年HIV感染者相对很少患上阿尔茨海默病支持了这种可能性。
3.PLoS Pathog:控制HIV潜伏的机制在血液和肠道中存在差异
doi:10.1371/journal.ppat.1007357
在一项新的研究中,来自美国旧金山退伍军人事务医学中心和加州大学旧金山分校的研究人员发现控制HIV转录和潜伏的机制在肠道和血液中存在着差异。这一发现可能有助于开发旨在治愈HIV感染的新疗法。相关研究结果于2018年11月15日发表在PLoS Pathogens期刊上,论文标题为“Gut and blood differ in constitutive blocks to HIV tranion, suggesting tissue-specific differences in the mechanisms that govern HIV latency”。论文通讯作者为加州大学旧金山分校的Steven Yukl。
图片来自CDC/C. Goldsmith, P. Feorino, E. L. Palmer, W. R. McManus. CC BY 0。
为了比较肠道和血液中抑制HIV转录的机制,Yukl和他的同事们定量确定了来自接受抗逆转录病毒药物有效治疗的HIV感染者血液和直肠的细胞中的HIV转录本。
这些研究人员发现在血液和肠道中,不同的机制会阻止HIV转录,并导致HIV在CD4+ T细胞中潜伏。此外,这些研究结果表明直肠可能富含潜伏感染的细胞,或者处于更深潜伏状态的细胞。这些阻断HIV转录的差异在设计旨在破坏所有组织区室中的HIV潜伏的疗法中起着重要的作用。特别地,直肠中的受感染细胞可能不太容易受到旨在逆转HIV潜伏的试剂的影响,因而可能需要不同类型的疗法。
4.JAIDS:蛋白S100A14较高表达或可阻止HIV感染
doi:10.1097/QAI.0000000000001911
在一项新的研究中,来自美国威斯达研究所(Wistar Institute)的研究人员发现在具有较高的HIV感染率的地区,尽管多年在注射毒品时使用高风险的针头共用行为但是仍然未被HIV感染的人群中,S100A14蛋白更高水平地表达。这种蛋白介导一类称为自然杀伤细胞(natural killer cell, NK细胞)的免疫细胞活化,其中在病毒感染的最早阶段,NK细胞在宿主免疫防御中起着关键性作用。相关研究结果于2018年11月5日在线发表在JAIDS期刊上,论文标题为“S100a14 is Increased in Activated Nk Cells and Plasma of HIV-Exposed Seronegative People Who Inject Drugs and Promotes Monocyte-Nk crosstalk”。
通过进行蛋白质组学分析,这些研究人员发现与对照供者相比,在注射毒品时因针头共用而具有较高的HIV感染风险的HESN人群的血液和分离的NK细胞中具有更高的干扰素相关蛋白和S100蛋白家族成员表达水平。Montaner及其同事们着重关注S100A14蛋白,并证实它强效地激活血液中的一群称为单核细胞的免疫细胞,这接着会激活NK细胞。
Montaner实验室高级研究员Costin Tomescu博士说,“我们的研究结果表明S100A14代表着宿主抵御HIV感染的一种新因子。进一步的研究将探究这种蛋白在增强NK细胞抑制HIV复制和消除受感染细胞的能力方面发挥的潜在作用,并且可能有助于开发预防HIV感染的新方法。”
5.PNAS:新研究揭示HIV具有传染性的细节
doi:10.1073/pnas.1800796115
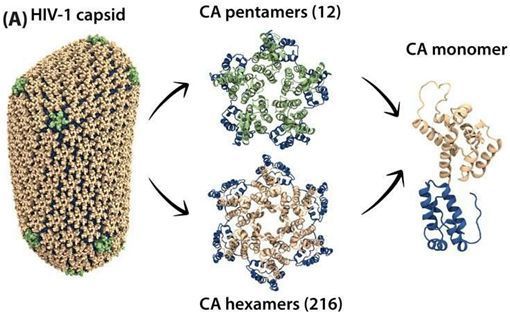
HIV衣壳是由不同形状的蛋白组成的锥形外壳。它是由衣壳蛋白(CA)形成的大约200个具有6个边的六聚体和12个具有5个边的五聚体所构成。这些衣壳蛋白六聚体和五聚体组合在一起,形成一个外壳,包围并保护HIV病毒,直到这种病毒能够感染健康细胞。如果这种衣壳结构过早地裂解,那么这种感染就不会发生。
图片来自University of Delaware。
在一项新的研究中,来自美国特拉华大学和匹兹堡大学的研究人员获得了关于HIV衣壳结构的新见解。他们利用多种高科技方法研究了HIV衣壳及其与蛋白TRIM5-α之间的相互作用,其中作为一种限制因子,TRIM5-α会破坏这种衣壳结构,因而限制这种病毒具有传染性的能力。相关研究结果发表在2018年11月6日的PNAS期刊上,论文标题为“Dynamic regulation of HIV-1 capsid interaction with the restriction factor TRIM5α identified by magic-angle spinning NMR and molecular dynamics simulations”。
他们之所以关注TRIM5-α,是因为诸如恒河猴之类的旧大陆猴具有TRIM5-α,在这些非人灵长类动物中,它阻止HIV感染。人类也有这种蛋白,但是具有不同于非人灵长类动物的一些主要的氨基酸序列差异,这就使得人TRIM5-α不会破坏HIV衣壳,因而就不会阻止HIV感染。
这些研究人员利用核磁共振波谱仪观察HIV衣壳与蛋白TRIM5-α之间的相互作用。核磁共振波谱仪可在原子水平下揭示出关于这种衣壳结构的细节和分子运动。此外,他们利用匹兹堡超级计算中心的Bridges超级计算机进行全原子分子动力学模拟。这种全原子分子动力学模拟可允许人们研究分子运动的方式以便了解它们如何在自然中执行它们的功能。
这些研究人员发现蛋白TRIM5-α结合到HIV衣壳的外面上,影响它的硬度。他们吃惊地发现即便在不与TRIM5-α直接相互作用的HIV衣壳区域中,也会对HIV衣壳结构产生影响。他们认为TRIM5-α利用多种机制让HIV衣壳的晶格状结构变得不稳定,导致它过早地裂解,然而在缺乏TRIM5-α的情形下,这种衣壳并不那么容易地裂解。
6.Nat Commun:仅需一滴血!一种基于手机的设备就可检测HIV-1
doi:10.1038/s41467-018-06727-8
在一项新的研究中,美国布莱根妇女医院的Hadi Shafiee博士及其团队利用纳米技术、微芯片(microchip)、手机和三维打印的手机附件,开发出一种便携式的可负担得起的移动诊断工具,这种工具能够在医疗资源有限的地区用于测试和监测HIV-1。这种快速的基于手机的诊断平台代表着一种诊断急性病毒感染的新方法,从而可能降低病毒传播风险,此外,它也可能用于检测早期的治疗失败。相关研究结果近期发表在Nature Communications期刊上,论文标题为“DNA engineered micromotors powered by metal nanoparticles for motion based cellphone diagnostics”。
利用这种诊断平台,这些研究人员能够检测一滴血中存在的HIV-1 RNA。这种设备通过在手机上监测经过DNA修饰的聚苯乙烯珠的运动就可检测经过LAMP(loop-mediated isothermal amplification, 环介导等温扩增,一种不同于PCR的核酸扩增反应)扩增的HIV-1 RNA核酸,从而无需使用笨重或昂贵的设备。
这些研究人员还评估了这种设备的特异性和灵敏度。他们发现在一小时内,在临床相关阈值为每毫升1000个病毒颗粒时,这种设备检测HIV-1的特异性为99.1%,灵敏度为94.6%。值得注意的是,每次测试时,这种微芯片、手机附件和所使用的试剂的总材料成本低于5美元。
7.Lancet子刊:长期研究表明HIV-2比之前认为的更为致命性
doi:10.1016/S2352-3018(18)30254-6
在一项新的研究中,来自瑞典隆德大学、厄勒布鲁大学和几内亚比绍国家公共卫生实验室等研究机构的研究人员发现HIV-2的致病性要比之前认为的更高。这一新发现表明早期治疗应当适用于所有HIV感染者,而不仅仅是那些HIV-1感染者。相关研究结果于2018年11月1日在线发表在Lancet HIV期刊上,论文标题为“Long-term follow-up of HIV-2-related AIDS and mortality in Guinea-Bissau: a prospective open cohort study”。
图片来自atropos235/Wikipedia。
论文通讯作者、隆德大学医学微生物学研究员Joakim Esbjörnsson说,“这项研究的独特之处在于我们频繁地长期跟踪研究一群研究参与者,这使得我们能够确定这些参与者何时感染上HIV和跟踪疾病进展。我们的数据表明大多数HIV-2感染者都将会患上并死于艾滋病(AIDS, 也称为获得性免疫缺乏综合征),这是之前的研究无法确定的。”
作为HIV病毒的两种类型,HIV-1和HIV-2存在着密切的亲缘关系,但是它们在世界范围内的传播方式是不相同的。HIV-1已在全球蔓延,然而HIV-2被认为是一种更为温和的HIV变体,主要在非洲西部流行。
这项研究是迄今为止首次对HIV-2感染与HIV-2/AIDS相关死亡之间的时间进行可靠的估计。这些研究人员在1990年至2013年这23多年时间里对4900名患者进行了随访,内容涉及包括血液测试在内的年度检查。他们还比较了这群患者中的HIV-1阳性个体和HIV-1阴性个体。这些数据表明HIV-2患者遭受HIV相关感染和患上艾滋病的方式与HIV-1患者几乎是相同的,不过有一点需要提及的是,HIV-2患者的疾病进展相对要缓慢一些。
8.PLoS ONE:天花疫苗能否影响女性HIV-1易感性?
doi: 10.1371/journal.pone.0207259
1980年全球停止接种天花疫苗。最近的研究表明,与不接种天花疫苗的女性相比,接种天花疫苗的女性感染艾滋病毒风险降低。在最初感染时,HIV-1最常使用CCR5作为共同受体来感染T淋巴细胞。因此,研究人员研究了天花疫苗接种是否与女性外周T淋巴细胞表面CCR5的下调有关。
该研究包括1974年以前出生的几内亚比绍地区的HIV血清阴性妇女,有或没有天花疫苗接种疤痕。研究人员将血液样品在TransFix缓冲溶液中稳定,并根据T细胞成熟曲线染色用于流式细胞术。该研究纳入了97名妇女,其中52名妇女有天花疫苗接种疤痕,45名妇女没有疤痕。在任何T淋巴细胞亚型中未发现天花疫苗接种瘢痕和CCR5表达之间的关联。因此,在HIV血清反应阴性的女性中,40多年前接种天花疫苗与外周T淋巴细胞表面CCR5受体的下调无关。
9.Lancet:度鲁特韦联合拉米夫定可作为HIV感染者的首先治疗方案
doi:10.1016/S0140-6736(18)32462-0
有效的两药方案可减少HIV-1抗逆转录病毒疗法(ART)的长期药物暴露和毒性。现研究人员对两药方案和三药方案治疗HIV-1感染的安全性和疗效进行对比研究。
研究人员在21个国家的192个中心进行了两项相同设计的、多中心的、双盲随机非劣效性的3期试验:GEMINI-1和GEMINI-2。招募年满18岁的未进行过ART治疗的HIV-1感染者(HIV-1 RNA≤500 000拷贝/ml)。将受试者按1:1随机分至两药组(度鲁特韦50mg+拉米夫定300mg,1/日)或三药组(度鲁特韦50mg+延胡索酸300mg+恩曲他滨200mg,1/日),均口服。主要结点是48周时,HIV-1 RNA少于50拷贝/ml的受试者比例。
图片来自The Wistar Institute。
2016年7月18日-2017年3月31日,两个研究共1441位受试者被随机分至两药组(719位)或三药组(722位)。GEMINI-1试验48周时,接受两药治疗的356位受试者中有320位(90%)、接受三药治疗的358位受试者中有332位(93%)的血浆HIV-1 RNA<50拷贝/ml(校正治疗差异 -2.6%,95% CI -6.7~1.5);在GEMINI-2试验中,两药组360位受试者中有335位(93%)、三药组359位中有337位(94%)的血浆HIV-1 RNA<50拷贝/ml(校正治疗差异 -0.7%,95% CI -4.3~2.9),在两个研究中显示为非劣效性(混总分析:两药组 vs 三药组=655[91%]vs 669[93%];校正治疗差 -1.7%,95% CI -4.4~1.1)。三药组药物相关副反应事件要多于两药组(169[24%] vs 126[18%]);部分受试者因副反应而终止治疗(三药组16例[2%]、两药组15例[2%])。GEMINI-2试验的两药组出现2例死亡,但均与研究用药无关。
相比指南推荐的三药方案,度鲁特韦联合拉米夫定治疗未进行过ART治疗的成人HIV感染者48周时的非劣效性和相似的耐受性,支持其作为HIV-1感染者的初始治疗方案。
10.以色列新药Gammora 4周内清除99%的艾滋病毒
Zion Medical是一家以色列生物技术公司,专注于开发治疗艾滋病和癌症的创新疗法。近日,该公司公布了实验性HIV药物Gammora的首批临床研究结果。数据显示,该药在治疗4周内清除了患者体内多达99%的HIV。
Gammora是一种源于HIV整合酶的合成肽化合物,HIV整合酶负责将病毒的遗传物质插入被感染细胞的DNA中。该药物可刺激多个HIV DNA片段整合到宿主细胞的基因组DNA中,直至达成触发被感染细胞自我毁灭(称之为凋亡)的程度。Gammora由美国加利福尼亚州圣迭戈的PolyPeptide Labs生产,通过破坏携带HIV基因组的所有细胞,具有治愈HIV感染者的潜力。目前市面上的抗逆转录病毒药物,即所谓的“鸡尾酒”疗法,只能抑制病毒的复制和传播,但并不能治愈感染。
2018年7-8月,Zion Medical公司开展了Gammora的一项I/IIa期临床研究,结果再次证实了先前的临床结果,该药在杀死HIV感染细胞方面是安全有效的。在该研究的第一部分中,乌干达罗纳德巴塔纪念医院的9例HIV感染者被随机分配接受了0.05-0.2mg/kg、0.1-0.3mg/kg或0.2-0.4mg/kg的Gammora治疗组,疗程为4-5周。在最初的4周内,大多数患者的病毒载量相对基线显著降低了90%。
在第一部分完成2周后,开展该研究的第二部分,患者接受Gammora及其他抗逆转录病毒药物联合治疗4-5周,接受每日一次洛匹那韦+利托那韦(lopinavir/ritonavir, LPV+r, 800mg/200mg)联合每周2次Gammora (0.2-0.4mg/kg),或仅接受LPV+r治疗。结果显示,联合治疗组表现出持续的病毒学抑制并达到了HIV-1 RNA<300拷贝/mL,在4周内HIV载量从基线下降幅度达99%。
整个10周治疗期间,两部分研究中的患者安全性数据均证明Gammora是一种安全且耐受性良好的药物,没有发生副作用。此外,患者CD4细胞计数从基线显著升高达97%。CD4细胞也称为T细胞或T辅助细胞,在机体免疫系统中发挥着重要作用,是整体健康的一个关键