一、软件介绍
该分析流程主要根据2016年发表在Nature Protocols上的一篇名为Transcript-level expression analysis of RNA-seq experiments with HISAT, StringTie and Ballgown的文章撰写的,主要用到以下三个软件:
HISAT (http://ccb.jhu.edu/software/hisat/index.shtml)利用大量FM索引,以覆盖整个基因组,能够将RNA-Seq的读取与基因组进行快速比对,相较于STAR、Tophat,该软件比对速度快,占用内存少。
StringTie(http://ccb.jhu.edu/software/stringtie/)能够应用流神经网络算法和可选的de novo组装进行转录本组装并预计表达水平。与Cufflinks等程序相比,StringTie实现了更完整、更准确的基因重建,并更好地预测了表达水平。
Ballgown (https://github.com/alyssafrazee/ballgown)是R语言中基因差异表达分析的工具,能利用RNA-Seq实验的数据(StringTie, RSEM, Cufflinks)的结果预测基因、转录本的差异表达。然而Ballgown并没有不能很好地检测差异外显子,而 DEXseq、rMATS和MISO可以很好解决该问题。
二、数据下载
首先进行数据下载:
Linux系统下常用的下载工具是wget,但该工具是单线程下载,当使用它下载较大数据时比较慢,所以选择axel,终端中输入安装命令:
$ sudo yum install axel
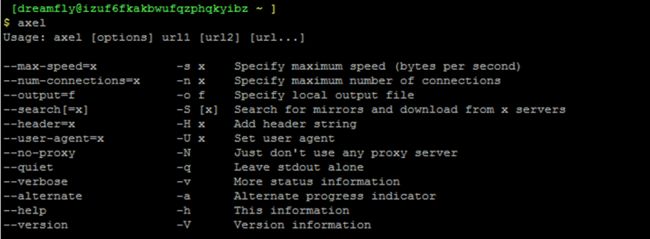
Axel工具常用参数有:
axel [选项][下载目录][下载地址]
-s :指定每秒下载最大比特数
-n:指定同时打开的线程数
-o:指定本地输出文件
-S:搜索镜像并从X servers服务器下载
-N:不使用代理服务器
-v:打印更多状态信息
-a:打印进度信息
-h:该版本命令帮助
-V:查看版本信息号
#Axel安装成功后在终端中输入命令:
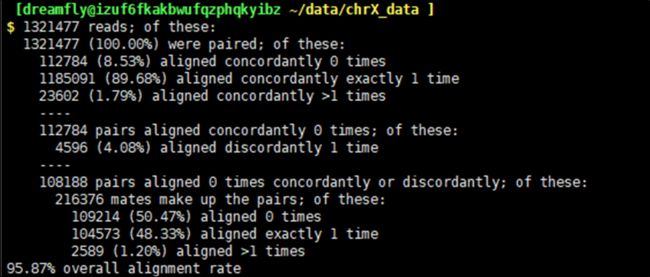
$ axel ftp://ftp.ccb.jhu.edu/pub/RNAseq_protocol/chrX_data.tar.gz
此时在终端中会显示如上图信息,如果不想该信息刷屏,添加参数q,采用静默模式即可。
#数据下载后,进行解压:
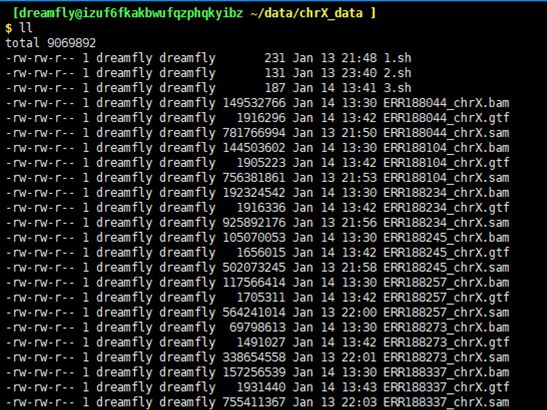
$ tar –zxvf chrX_data.tar.gz
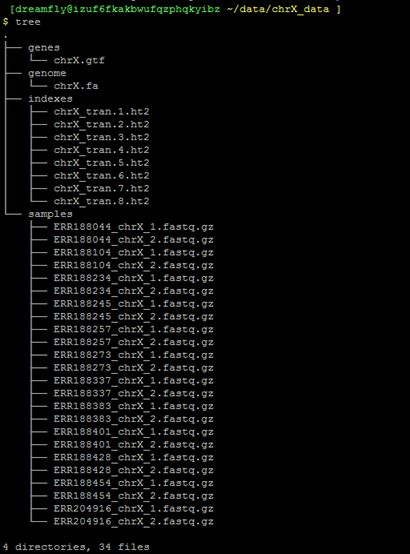
chrX_gtf是X号染色体的注释文件
chrX.fa是X号染色体的序列文件
indexes文件夹中是HISAT对于X号染色体的index文件,该文件是根据序列文件chrX.fa利用hisat2-build构建的,samples文件夹中的12个fastq文件是英格兰岛和约鲁巴住民的X号染色体的数据。
三、软件安装:
首先安装bioconda,它是一个自动化管理生物信息软件的工具,安装简单,且各个软件依赖的环境一同打包且相互隔离,非常适合在服务器中搭建生信分析环境。
#下载和安装miniconda
$ wget https://repo.continuum.io/miniconda/Miniconda3-latest-Linux-x86_64.sh
#下载完成后在终端中安装
$ bash Miniconda-latest-Linux-x86_64.sh
#按照提示安装,完成后
$ source ~/.bashrc #使以上的安装立即生效
#输入以下命令检验miniconda是否安装成功
$ conda list
然后利用conda install 软件名+版本号安装软件即可,我们需要安装hisat2、stringtie、samtools三个软件,安装的命令为:
$ conda install hisat2
$ conda install stringtie
$ conda install samtools
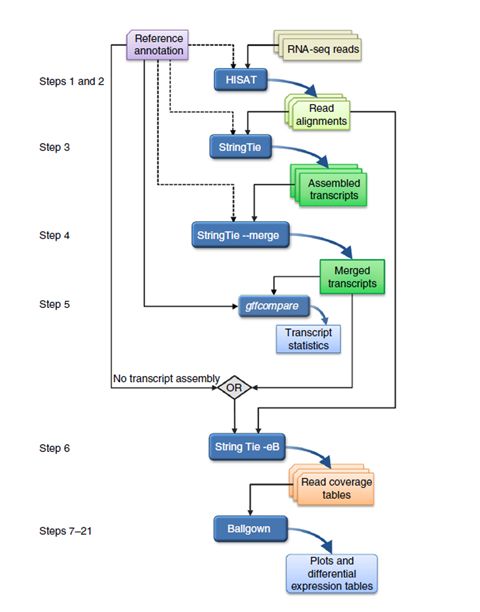
四、分析流程:
2、比对上的reads将会被呈递给StringTie进行转录本组装,StringTie单独的对每个样本进行组装,在组装的过程中顺带估算每个基因及isoform的表达水平。
3、所有的转录本都被呈递给StringTie的merge函数进行merge,这一步是必须的,因为有些样本的转录本可能仅仅被部分reads覆盖,无法被第二步的StringTie组装出来。merge步骤可以创建出所有样本里面都有的转录本,方便下一步的对比。
4、merge的数据再一次被呈递给StringTie,StringTie可以利用merge的数据重新估算转录本的丰度,还能额外的提供转录本reads数量的数据给下一步的ballgown。
5、Ballgown从上一步获得所有转录本及其丰度,根据实验条件进行分类统计。
五、实战:
首先使用hisat2进行比对,具体用法:
hisat2 [options]* -x
主要参数:
-x
-1
-2
-S
由于该样本采用双端测序,文件数稍多,利用脚本一次性执行
$ for i in {188044,188104,188234,188245,188257,188273,188337,188383,188401,188428,188454,204916};do
hisat2 -p 4 -x chrX_data/indexes/chrX_tran -1 chrX_data/samples/ERR${i}_chrX_1.fastq.gz -2 chrX_data/samples/ERR${i}_chrX_2.fastq.gz -S ERR${i}_chrX.sam
done
将该脚本保存为1.sh,在终端中运行即可,即:
sh ~/脚本/所处/位置/1.sh
$ for i in {188044,188104,188234,188245,188257,188273,188337,188383,188401,188428,188454,204916};do
samtools sort -@ 4 -o ERR${i}_chrX.bam ERR${i}_chrX.sam
done
此处sort默认输出的bam文件是按其基因组位置排序,而tophat的输出的bam文件即是按此顺序排序的
sort -n 则是按reads的ID排序 。
$ for i in {188044,188104,188234,188245,188257,188273,188337,188383,188401,188428,188454,204916};do
stringtie -p 8 -G ./genes/chrX.gtf -o ERR${i}_chrX.gtf -l ERR${i} ERR${i}_chrX.bam
done
然后利用软件stringtie将12个含有转录本信息的gtf文件合并成一个gtf,此时需要预先将12个GTF文件的文件名录入到mergelist.txt文件中,下载的数据中已经给出该文件,执行完会多出一个GTF文件,即tringtie_merged.gtf:
$ stringtie --merge -p 8 -G ./genes/chrX.gtf -o stringtie_merged.gtf ./mergelist.txt
参数--merge 为转录本合并模式。 在合并模式下,stringtie将所有样品的GTF/GFF文件列表作为输入,并将这些转录本合并/组装成非冗余的转录本集合。这种模式被用于新的差异分析流程中,用以生成一个跨多个RNA-Seq样品的全局的、统一的转录本。
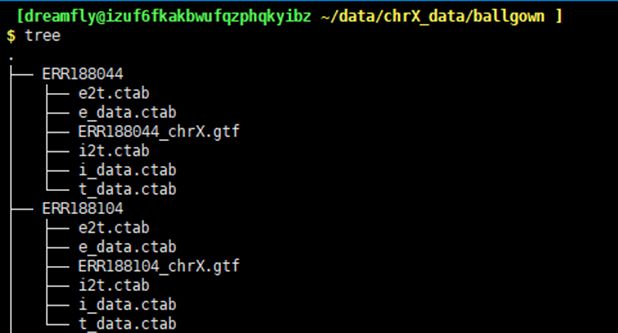
接下来,重新组装转录本并估算基因表达丰度,并为ballgown创建读入文件。利用组装好的非冗余的转录本文件即stringtie_merged.gtf 和12个bam文件,执行下面的脚本:
$ for i in {188044,188104,188234,188245,188257,188273,188337,188383,188401,188428,188454,204916};do
stringtie -e -B -p 8 -G stringtie_merged.gtf -o ballgown/ERR${i}/ERR${i}_chrX.gtf ERR${i}_chrX.bam
done
接下来要用到R语言分析,选择在Windows中的Rstudio软件中进行分析,前提是系统中已经正确安装R语言,才能使用Rstudio
#安装需要的R包
> source("https://bioconductor.org/biocLite.R")
> biocLite("ballgown")
> source("https://bioconductor.org/biocLite.R")
> biocLite("genefilter")
> source("https://bioconductor.org/biocLite.R")
> biocLite("devtools")
> source("https://bioconductor.org/biocLite.R")
> biocLite("RSkittleBrewer")
> install.packages("dplyr")
#加载要用到的语言包
> library(RSkittleBrewer)
> library(ballgown)
> library(genefilter)
> library(dplyr)
> library(devtools)
#设置R语言的工作路径
> setwd("F:/data/R")
#读取表型数据如右图所示
> read.csv("geuvadis_phenodata.csv")
> pheno_data<-read.csv("F:/data/R/geuvadis_phenodata.csv ")
#dataDir告知数据路径, samplePattern则依据样本的名字来,pheno_data则指明了样本数据的关系,这个里面第一列样本名需要和ballgown下面的文件夹的样本名一样,不然会报错
> bg_chrX = ballgown(dataDir = “F:/data/R/ballgown", samplePattern = "ERR", pData=pheno_data)
#滤掉低丰度的基因,这里选择过滤掉样本间差异少于一个转录本的数据
>bg_chrX_filt=subset(bg_chrX,"rowVars(texpr(bg_chrX))>1",genomesubset=TRUE)
#确认组间有差异的转录本,在这里我们比较male和famle之间的基因差异,指定的分析参数为“transcripts”,主变量是“sex”,修正变量是“population”,getFC可以指定输出结果显示组间表达量的foldchange。
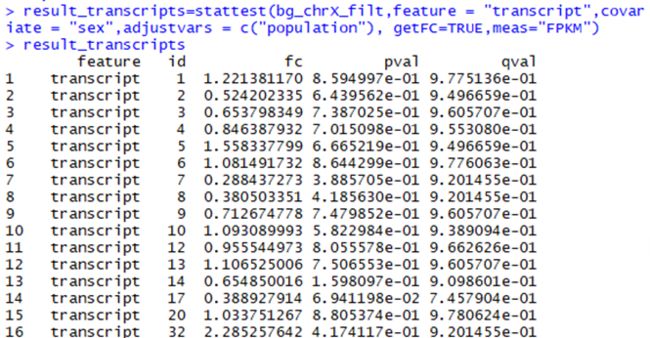
> result_transcripts=stattest(bg_chrX_filt,feature = "transcript",covariate = "sex",adjustvars = c("population"), getFC=TRUE,meas="FPKM")
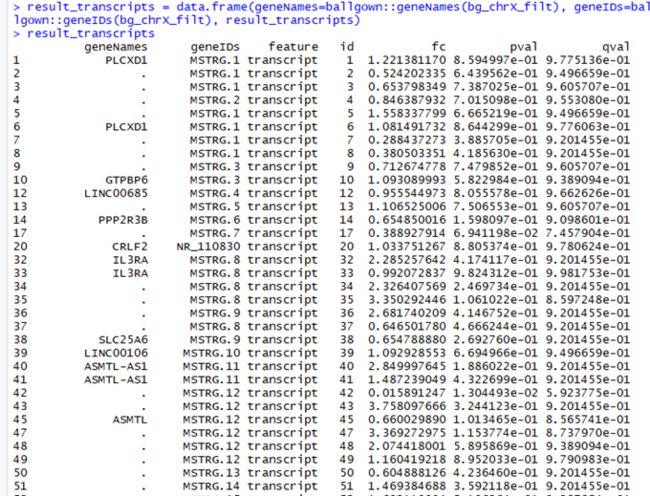
#查看有差异转录本的输出结果,如下图
> result_transcripts
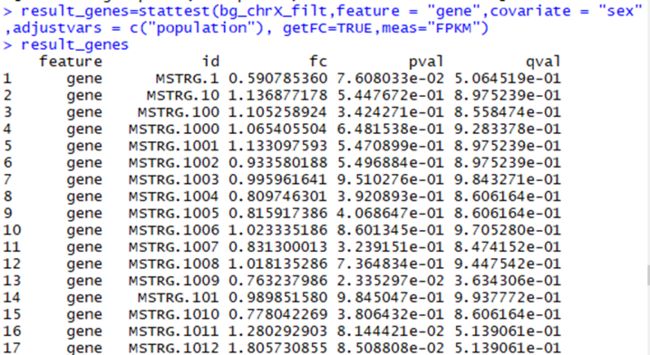
#确定各组间有差异的基因,如下图
>result_genes=stattest(bg_chrX_filt,feature = "gene",covariate = "sex",adjustvars = c("population"), getFC=TRUE,meas="FPKM")
#为组间有差异的转录本添加基因名,如下图
> result_transcripts = data.frame(geneNames=ballgown::geneNames(bg_chrX_filt), geneIDs = ballgown::geneIDs(bg_chrX_filt), result_transcripts)
#按照p-value从小到大排序
> result_transcripts=arrange(result_transcripts,pval)
> result_genes=arrange(result_genes,pval)
#把两个结果写入到csv文件中
> write.csv(result_transcripts, "chrX_transcript_results.csv",row.names=FALSE)
> write.csv(result_genes, "chrX_gene_results.csv",row.names=FALSE)
#从以上的输出中筛选出q值小于0.05的transcripts和genes,即性别间表达有差异的基因
> subset(result_transcripts,result_transcripts$qval<0.05)
> subset(result_genes,result_genes$qval<0.05)
#赋予调色板五个指定颜色
> tropical= c('darkorange', 'dodgerblue','hotpink', 'limegreen', 'yellow')
> palette(tropical)
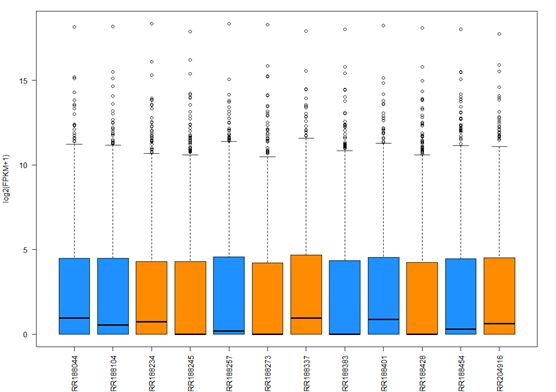
#以FPKM为参考值作图,以性别作为区分条件
> fpkm = texpr(bg_chrX,meas="FPKM")
#方便作图将其log转换,+1是为了避免出现log2(0)的情况
> fpkm = log2(fpkm+1)
>boxplot(fpkm,col=as.numeric(pheno_data$sex),las=2,ylab='log2(FPKM+1)')
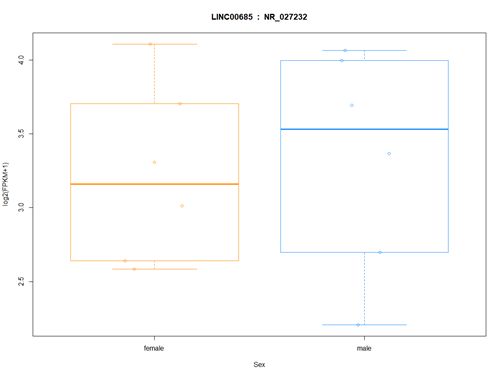
#查看单个转录本在样品中的分布,如图,并绘制箱线图
> ballgown::transcriptNames(bg_chrX)[12]
> ballgown::geneNames(bg_chrX)[12]
>plot(fpkm[12,] ~ pheno_data$sex, border=c(1,2), main=paste(ballgown::geneNames(bg_chrX)[12],' : ', ballgown::transcriptNames(bg_chrX)[12]),pch=19, xlab="Sex", ylab='log2(FPKM+1)')
>points(fpkm[12,] ~ jitter(as.numeric(pheno_data$sex)), col=as.numeric(pheno_data$sex))
# plotTranscripts函数可以根据指定基因的id画出在特定区段的转录本,可以通过sample函数指定看在某个样本中的表达情况,这里选用id=1750, sample=ERR188234
> plotTranscripts(ballgown::geneIDs(bg_chrX)[1750], bg_chrX, main=c('Gene MSTRG.575 in sample ERR188234'), sample=c('ERR188234'))
# 这里以id=575的基因为例(对应上一步作图)
> plotMeans('MSTRG.575', bg_chrX_filt,groupvar="sex",legend=FALSE)
请关注我的公众号----生信栈,不定期分享实用的生物信息干货!!!