关于更多实验技巧,可关注公众号:南京铭研生物
免疫印迹(Western Blot)作为科研中最平常的实验,操作起来很简单,但也会出现这样那样让人头大的结果:没条带、假阳性、有杂带等等……科研人员在被WB虐的体无完肤的同时,当然也积累了不少的实战经验!
今天小编就搜罗了一些关于Western Blot的实验经验,整理成文,仅供同学们参考~
Western Blot的基本原理
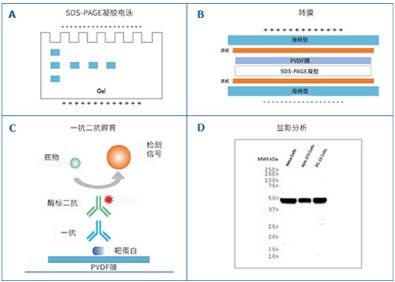
Western Blot蛋白免疫印迹是对目的蛋白进行检测、分析以及定量的一种技术。蛋白质样品经SDS-PAGE 分离后从凝胶转移到固相支持物(如PVDF膜)上,后用特异性抗体对某一特定的抗原进行着色,分析着色的位置或深度获得该蛋白质在所分析的细胞或组织中的表达情况。
主要有直接检测和间接检测两种。间接检测是加入未标记的第一抗体与抗原结合后,用酶/荧光团标记的二抗来检测一抗,染色显影后对目的蛋白进行分析;而直接检测是用酶/荧光团缀合的一抗检测印迹上的目的抗原,直接检测在实验操作中应用很少.
实验流程
① 在检测未知蛋白时,可以减少裂解液,加大上样量,抽提得到高浓度蛋白,先做出实验结果,再根据条带的亮度调整各种试剂的用量;
★ 这样做可以避免首次抽提时没有结果却不好排查原因的情况
② 在同时检测两种蛋白或两个样本的同种蛋白时,抽提后测浓度,一般可以做标准曲线,再计算待测蛋白的浓度;
★ 可推荐一种简易的方法:直接用酶标仪测这两个样品的吸光度,根据吸光度值将两个样品的蛋白浓度调整成一致后上样
③ 抽提蛋白全程需要冰上操作。加了细胞裂解液后细胞被破坏,细胞内的各种酶被释放,若不在冰上操作,蛋白易降解。
① 配胶前应将玻璃板洗净,最后再用ddH2O冲洗,晾干备用;
② 配制分离胶,倒入玻璃板时不可倒的太满,需要留一定的浓缩胶空间,在胶表面可加入一层蒸馏水促进凝集,后配制浓缩胶倒入,插好梳子,灌好浓缩胶后1h拔除梳子;
★ 梳子插入浓缩胶时,应确保没有气泡,可将梳子稍微倾斜插入以减少气泡的产生,
★ 梳子拔出来时应该小心,不要破坏加样孔,如有加样孔上的凝胶歪斜可用针头插入加样孔中纠正但要避免针头刺入胶内
★ 拔除梳子时宜边加水边拔,以免有气泡进入梳孔使梳孔变形
★ 胶最好现配现用,但如果频繁的做WB,可以一次性多配几块胶,running buffer4℃保存
③ 上样前将胶板下的气泡赶走,蛋白样品最好先离心,根据蛋白表达丰度调整蛋白上样量,上样蛋白量不应超过30ug/mm2,尽量保证每孔上样量保持一致;
★ 载荷面积:如果你的胶槽是5mm×1mm,则载荷面为:1mm×5mm=5mm2
④为确保Western Blot实验结果的准确性,一般需要设置合适的实验对照:
★ 阳性对照:最好有标准品(比如β-actin,GAPDH)或阳性血清
★ 阴性对照:测血时用相应小鼠未免疫血清(即正常血)
★ 空白对照:不加一抗,用PBS代替
⑤ 电泳时上层胶用60-80V电压,当样品至分离胶时,用100-120V电压。电泳时间在1.5小时左右;
★ 观察maker的情况,一般目的条带跑到分离胶的2/3处比较好
★ Maker尽量点在两边而不是在中间,或者在剥离胶后和PVDF膜的一角减掉一小块作为标记
⑥ 跑完电泳后,取出胶,可以一块做考马斯亮蓝R250染色约30分钟,脱色液脱色,看看蛋白条带跑的如何,上样量如何。但考马斯亮蓝染色或者银染都是不可逆结合,会干扰后面的Western Blot实验。避免这种情况发生可选择用同样的样品跑两块胶,一块染色一块转膜;也可以用丽春红S直接染色转移膜,检测转膜效果,充分脱色后不干扰Western结果。
★ 电泳时胶不可长时间放置于仪器中,胶内蛋白由于未固定,长时间放置蛋白会扩散,转完膜后条带会很难看,可以放在转膜液中固定。(含有甲醛可固定蛋白)
电泳结束前20分钟左右开始准备,转膜过程需戴上手套或是用塑料镊子接触膜,以避免手上的蛋白和油脂降低转膜效率。
膜的选择
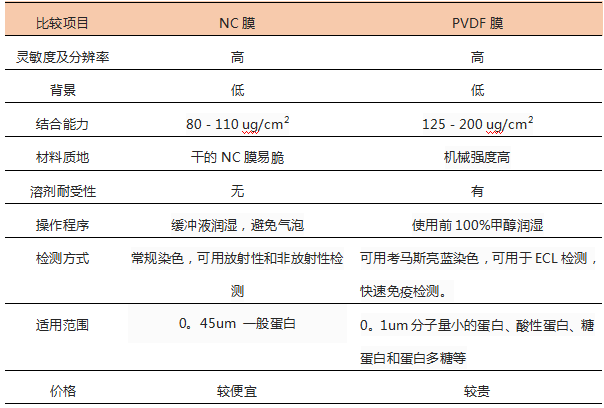
用于Western Blot的转移膜主要有两种:NC膜和PVDF膜,一般可根据目的蛋白与膜的结合能力(即单位面积的膜能结合蛋白的载量)以及膜的孔径(即拦截蛋白的大小);是否影响后续的显色反应等因素进行综合选择
若后续实验有其他要求,比如要做蛋白测序或是质谱分析,要需要根据不同的目的来挑选不同的转移膜。
转膜Tips
⑤ 转膜前胶要在转移缓冲液里平衡一下防止胶变形,也有助于进一步去掉可能有碍转膜的杂质
① 将膜铺在靠膜滤纸上,膜和滤纸间不要有气泡,滤纸的大小不能超过膜,否则会造成短路;
② 转膜时胶在正极,膜在负极,最好是膜置于胶的下面,否则会造成镜像效果;
③ 夹好膜和凝胶后,确定凝胶、膜和滤纸之间没有气泡存在,否则会导致转膜不完全;
④转膜过程中,尤其是高电流快速转膜时,通常会有非常严重的发热现象,最好把转膜槽放置在冰浴中进行转膜。
电泳转移
一般有有湿转和半干转两种方式。两者的原理完全相同。
对于湿转法,一般转膜的电流在200mA-400mA之间,转膜时间为30-60分钟。也可以在15-20mA转膜过夜。大片段的>50KD的可以选用350mA,小片段的可以用250mA。具体的转膜时间要根据目的蛋白的大小而定,目的蛋白的分子量越大,需要的转膜时间越长,目的蛋白的分子量越小,需要的转膜时间越短。
对于半干转法,用电转液淋洗石墨电极,滤纸吸干,铺上胶,再滴少许电转液,以1。5mA/cm2凝胶面积转移1-2小时。负载电压不宜超过1V/cm2胶面积。与湿转相比,这种方法要快(15-45 分钟)。
①常见的封闭液有5%脱脂奶粉、BSA和Western Blot膜封闭液(生物试剂公司提供)。但是封闭液的选取具体得看抗体说明书,有的抗体是明确要求只能用BSA,而封闭液浓度的选择也是具体得看抗体的要求,但是一般情况5%BSA会比5%牛奶的效果好;
②封闭时一般在室温下2h就够了,但是要注意如果是生物素标记的二抗就不宜用牛奶,因为牛奶中含有生物素,用BSA效果更好;
③ 一抗二抗的选择会直接影响实验的结果及背景,一方面需要考虑所选抗体是否能识别凝胶电泳后转印至膜上的变性蛋白,另一方面需要考虑所选抗体是否会引起交叉反应条带;
④ 抗体的浓度要严格的参照说明书选择最适当的稀释比例;加入抗体后要严格保证反应时间,洗膜要注意尽可能地将一抗二抗洗净,有利于降低背景。