晚间重磅!瑞德西韦临试达到主要评估指标,特朗普称好消息,美股强劲反弹,大A概念股要嗨?(名单)
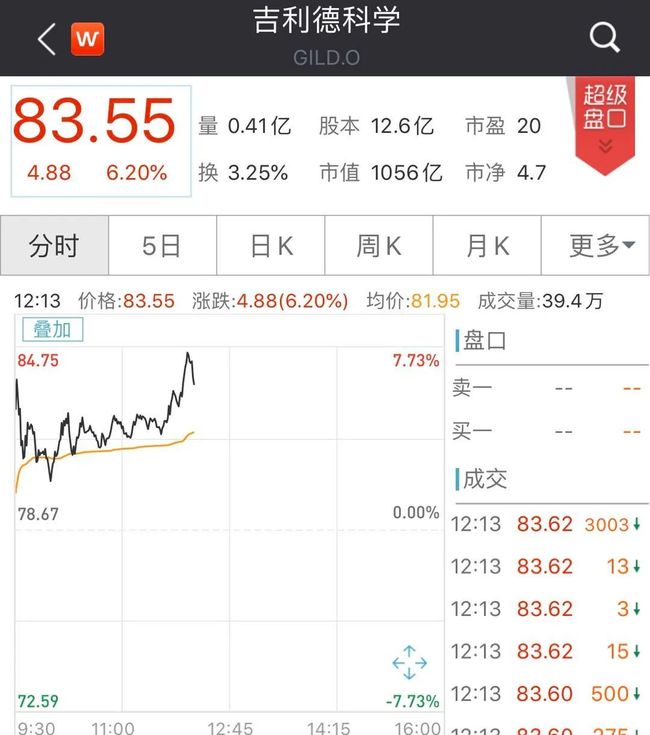
北京时间4月29日,吉利德科学盘前停牌,以待公布重要消息。
随后,吉利德官网公布了新的关于瑞德西韦临床试验结果。
吉利德称,美国过敏和传染病研究所(NIAID)对瑞德西韦治疗COVID-19的研究得到了积极数据,已达到主要评估指标。据了解,该试验已达到其主要终点,数据显示,接受该药物10天治疗与5天治疗的患者临床状态均出现相似改善,第二次简单试验的前600名患者的结果预计在5月底出炉。
据悉,NIAID将在即将举行的简报中提供详细信息,也正因如此,吉利德科学盘前停牌。
此外,吉利德同日还公布了该公司一直在进行的瑞德西韦治疗COVID-19重症住院患者的III期SIMPLE研究结果。这项研究比较了瑞德西韦的5天和10天疗程,但没有安慰剂组。结果显示,瑞德西韦10天给药方案和5天给药方案显示出相似的临床改善(第14天的Odds Ratio: 0.75 [95% CI 0.51 – 1.12])。该研究未发现新的安全信号。吉利德计划在未来几天发布详细结果,并交由同行评审。
该结果显示,5天疗程组50%患者得到临床改善的时间是10天,10天治疗组50%患者得到改善的时间为11天。两个治疗组中均有超过一半的患者在第14天出院。在第14天,5天疗程组中有64.5%的患者实现临床恢复,10天疗程组中,有53.8%的患者实现了临床恢复。不过试验数据也显示临床结果因地理位置而异。在意大利境外,两个治疗组在第14天的总体死亡率均为7%,第14天有64%的患者经历了临床改善,有61%患者出院。
美国国家过敏症和传染病研究所所长福奇称,吉利德科学的试验在多个国家进行,不只是美国,吉利德科学数据表明瑞德西韦在抗病毒上有显著的积极作用,“有一种药是能够抑制(新冠)病毒的”。
此外,美国总统特朗普称,吉利德的报告看起来是好消息、是积极的。
受此消息影响,吉利德科学高开7%。截至发稿,涨6.2%。
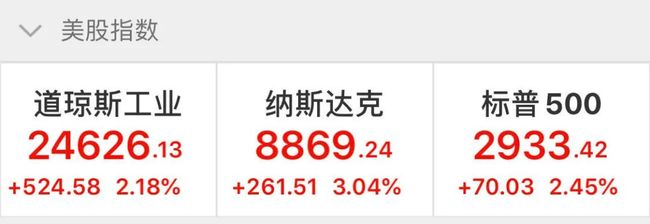
此外,美股三大股指也有不错的涨幅,截至发稿,道指及标普500指数均涨超2%,纳指则涨超3%。此前美国公布第一季度实际GDP下滑4.8%,为2009年来单季最大跌幅。
瑞德西韦概念股解析
瑞德西韦为广谱抗RNA病毒药物,此前的动物实验证明瑞德西韦可抑制多种RNA病毒,包括SARS、 MERS、埃博拉病毒。同时,体外实验证实瑞德西韦对新冠病毒抑制效果显著,在细胞实验中,相比其他药物,瑞德西韦半最大效应浓度(EC50)低,对病毒抑制活性高,因此,瑞德西韦也一度称作为是新冠肺炎特效药。
国联证券指出,此次若吉利德研发成功,将提升在国内的品牌知名度,对其所有产品销售都有助益,可以关注和吉利德有合作的企业。
博腾股份博腾股份在2月4日晚间发布公告表示,吉利德为公司核心客户,公司于2015年开始为吉利德科学在研抗病毒药物瑞德西韦提供定制研发生产服务,并于2016年多次交付临床需求的高级中间体,根据公司掌握的业务信息,公司认为,上述事项不会对公司2020年度业绩产生重大影响。
博瑞医药2月11日,博瑞医药宣布成功开发了瑞德西韦原料药合成工艺技术和制剂技术,并已经批量生产出瑞德西韦原料药。上交所3月1日的监管措施决定显示,博瑞医药公告所称“批量生产”实际为药品研发中小试、中试等批次的试验性生产。
永太科技永太科技此前在投资者问答平台表示,公司下游客户包括吉利德、拜尔等企业。近期公司得知吉利德公司在研药物瑞德西韦可用于治疗新型冠状病毒肺炎,公司正积极与吉利德公司等下游客户接洽,寻求可能的合作机会。
九洲药业九洲药业此前公告,公司与吉利德于2011年开始合作,公司已为其提供多个品种的医药中间体CDMO服务,近两年,吉利德公司的产品销售收入占公司营业收入不超过2%;同时表示双方尚未未就新型冠状病毒肺炎在研药物瑞德西韦开展实质性合作。
美迪西公司此前表示与吉利德科学公司2009年开始进行合作,吉利德科学公司是公司的客户之一,但2019年度吉利德科学公司不构成公司的大客户,公司也未直接参与吉利德科学公司的瑞德西韦抗肺炎药物的研发。
海南海药海南海药2月14日晚间公告,已经完成瑞德西韦原料药及制剂工艺研发。公司已经完成瑞德西韦制剂的第一批生产,并已具备年产350万支的规模化生产能力。
WHO曾不慎泄露瑞德西韦临床疗效
此前,国内瑞德西韦临床试验及其结果草案曾被世卫组织意外泄露,由于数据并不理想,当日导致其生产商吉利德科学一度闪崩。
北京时间4月24日凌晨,世卫组织(WHO)关于药物临床试验的网站上突然公布了一项瑞德西韦的最新临床试验结果,显示为“负面”。不过随后临床试验及其结果均被删除。
根据世卫组织网站截屏显示临床试验的序列号,这项试验就是由中日友好医院曹彬教授主导的中国瑞德西韦的临床试验。
该结果显示,在237位新冠重症患者的随机双盲对照试验中,158人接受瑞德西韦治疗,另有79人为对照组控制。结果发现瑞德西韦并未对临床症状的改善有明显效果。从28天死亡率来看,瑞德西韦组和对照组分别为13.9%和12.8%;两组的副作用比例分别为65.2%和64.1%。此外,临床试验结果还显示临床症状改善的风险率为1.23。
世界卫生组织在“秒删”这份草案文件后表示,这份草稿在无意中被发布到网站上,在意识到之后已经立马撤下。该组织强调,瑞德西韦研究草案正在接受同行的审查,我们正在等待最终版本。
随后,吉利德科学公开发布声明表示,世界卫生组织过早发布关于中国第一个临床研究的信息,是研究人员并未许可公布结果,该信息已经删除。吉利德认为,世界卫生组织所发布文章包含了对研究的不恰当描述,“由于入组率低,该研究被提前终止,因此,它的数据不足以支撑有统计意义的结论。”
尽管WHO“秒删”了该文件,吉利德科学股价在当日盘中仍然直线跳水,一度短暂停牌,最低一度跌至74.4美元,尾盘期间跌幅有所收窄,最终收跌4.34%。受到此影响,美股三大股指当日盘中也一度闪崩,回吐此前涨幅。随后开盘的A股相关概念股也遭受波及,博腾股份当日一字跌停,永太科技大跌逾9%。
抗击新冠的3大技术路线
对于抗击新冠病毒,西南证券认为,短期靠基础疗法+各类已上市或已有临床基础的药物通过开展临床实验救治更多患者,中期看中和抗体类的特效药,长期看疫苗。
尽管瑞德西韦此前被高度关注,甚至冠以“人民的希望”称号。但从资本市场角度来看,资本更看好的仍然还是疫苗类公司。
过去10个交易日,新冠疫苗公司Inovio涨超80%,MODERNA涨近40%,康希诺生物涨超20%,BIONTECH、VIR BIOTECHNOLOGY涨幅均超过10%。
从年内股价表现来看,疫苗类公司涨幅遥遥领先,INOVIO年内涨超300%;VIR、MODERNA、康希诺生物累计涨幅均达到150%左右。但吉利德科学年内涨幅不到23%,表现并不算出彩。
而国内抗击新冠药物和疫苗公司中,截至4月27日收盘,海正药业年内涨幅达51%,疫苗方向的智飞生物累计涨幅66%,复星医药累计涨28%。
01 化药主要以抗病毒+消炎+抗细菌感染为主:虽然目前德西韦仍被称为“人民的希望”,但现阶段尚未有大规模临床数据支撑其疗效,目前有临床数据支撑的两个相对有效品种为法匹拉韦和氢化氯喹。
氯喹是奎宁的一种胺类嗜酸形式,1934年由拜耳在德国合成,是治疗疟疾的首选药物。
法匹拉韦由富士胶片下属的日本富山化学工业株式会社研发。法匹拉韦国内对应的公司主要为海正药业,2016年6月,浙江海正药业与富山化学签订了专利独家授权协议,前者负责在中国研发、制造、销售含法匹拉韦的抗流感病毒药物。2020年2月15日:海正药业取得生产批号,系目前国内获批的唯一一家企业。
02 生物药主要以中和抗体+抑制炎症因子风暴为主:中和抗体具有安全、高特异性的优势(可以理解为抗新冠特效药),最早于8月进入临床,君实生物、再生元、Vir都在抗埃博拉病毒方面有相关经验。
抗炎药多为已上市品种,重点关注赛诺菲和罗氏的IL-6单抗,舒泰神的C5a抗体个例临床数据优异。
03 疫苗所需研发时间最久,核酸类疫苗领跑,但因史无前例,成功概率有待评估。新冠疫苗5条技术路径和主要竞争企业
目前全球新冠疫苗研发路径有五条,主要有灭活疫苗、基因工程重组亚单位疫苗、腺病毒载体疫苗、核酸疫苗、减毒流感病毒疫苗载体疫苗。其中进度较快的为 mRNA 和腺病毒路径,mRNA将编码抗原蛋白的基因序列与相关载体重组,直接递送至人体内,研发设计所需时间较短、制备简单,但目前尚无该技术产品获批上市,免疫性尚待验证。
目前全球有超90家单位竞相开展新冠疫苗的研发项目60余个;已进入临床阶段的包括COV001(牛津大学)、腺病毒疫苗(康希诺)、Moderna的Mrna-1273等5个品种;其中核酸疫苗进度最快;从疫苗分类看,重组蛋白疫苗占比最高达到23%、病毒载体疫苗为20%、核酸疫苗为19%;目前全球范围内疫苗研发的机构中,中国占比过半,其次为美国。
康希诺+Moderna领跑,核酸类疫苗虽快,但缺乏实际成功案例,而康希诺的腺病毒疫苗技术所开发的埃博拉疫苗已成功上市,风险相对较低;此外康希诺II期已发公告预计全球最快。
Moderna mRNA疫苗:最早进入临床只因跳过动物实验,且最早进入临床不代表最快出产品(以ZIKA病毒疫苗为例:DNA疫苗最先进入临床,但传统减活疫苗最先开展临床III期)。
Inovio DNA疫苗:新冠疫苗预计最早4月进入临床,秋季公布第一批数据;公司研发管线中同为冠状病毒的MERS疫苗已取得阶段性成功;公司股价在过去一周涨近76%。
BioNTech mRNA疫苗:新冠疫苗研发牵手辉瑞和复星,最早4月进入临床。
CureVac mRNA疫苗:未上市,其狂犬疫苗疗效数据良好,其优势为使用剂量低;自新冠爆发后,公司成为德、美政客必争之地。
国内4款疫苗获批进入临床试验
27日,国药集团中国生物技术股份有限公司表示,中国生物北京生物制品研究所研发的新冠灭活疫苗获得国家药监局临床试验批件。中国生物相关负责人表示,刚刚获得临床批件的新冠灭活疫苗于4月28日在河南正式启动临床试验。
据了解,这也是中国生物获批临床的第二个新冠灭活疫苗。4月12日,中国生物武汉生物制品研究所申报的新型冠状病毒灭活疫苗获临床试验许可,成为全球首家获得临床试验批件的新冠病毒灭活疫苗。
加上此前军事科学院军事医学研究院陈薇院士团队研发的腺病毒载体重组新冠病毒疫苗、北京科兴中维生物研发的新冠灭活疫苗,至此,我国已有四个新冠疫苗获批进入临床试验阶段。
此外,还有30 余家企业机构公布正在进行新冠疫苗研发,复星医药分与BioNTech 合作开展mRNA 疫苗的研制预计四月底进行临床Ⅰ期,智飞生物与中国科学院微生物研究所合作开发重组蛋白亚单位疫苗,目前尚在临床前阶段。
另外,根据券商报告梳理,冠昊生物与ZY TherapeuticsInc合作的mRNA疫苗、成大生物与清华药学院合作的多肽疫苗、贝达药业,北京鼎成肽源生物与杭州瑞普基因科技有限公司合作的通用DC疫苗、成大生物与清华药学院合作的多肽疫苗、杨森制药、华兰生物、沃森生物等疫苗项目处于临床前阶段。