通过免疫组化进行家蚕胚胎制备的新方法
摘要
昆虫的卵体积较小,要获得其完整的胚胎,尤其是完整的早期胚胎是非常困难的。鉴于传统用于获得家蚕胚胎的方法与先前用于获取果蝇胚胎的方法,我们建立了一种制备家蚕胚胎的新方法。新方法直接简便,易于操作。由于新方法的运用,当大量制备家蚕胚胎时,胚胎避免了严重损伤。此外,免疫组化相当适合家蚕胚胎制备的新方法。
说明
家蚕,作为鳞翅目模式系统之一,是一种在丝绸工业中具有重要经济效益的昆虫。由于它遗传的多样性和培育种系分支广,它也成为用于基础研究的生物体。随着分子生物学的发展,关于家蚕胚胎发育相关基因的研究正在提高。免疫组化为在空间上探究定位这些基因产物提供了简便有力的方法。但是,蚕卵需要移除卵壳和卵黄膜以使抗体进入胚胎。传统方法是用煮沸的KOH(15-20%)去除卵壳和卵黄膜。然而,这种方法的缺点是无法获得早期胚胎,由于胚胎容易被破坏因此获得完整胚胎比较难。Wang和Li(1984)运用热水固定的方法以获得早期胚胎,但是这种方法只适用于小量胚胎的获取。一些人员巧妙地运用手动剥离的方法移除卵壳和卵黄膜,这种方法可获得产卵16h的胚胎(Kokubo)。这种方法需要精巧的技术,同时也并不适合获取大量的胚胎。获取果蝇胚胎的方法已经趋于成熟和完善,Singh和Gopinathan(1997)对以上方法稍作修改以获取家蚕胚胎。本文描述了制备家蚕胚胎的新方法的详细实验步骤。
材料和方法
家蚕蚕卵的收集
实验使用的是一种多化性家蚕(HNMW)和四种二化性家蚕(A40,C108,HNMW,Jingsong and Haoyue)。在蚕室中,他们在短日照条件下(12h光照/12h黑暗)以新鲜桑叶喂养。HNMW品种的蚕卵在产卵后16-48h内收集。将4种二化性品种产卵后20h的卵置于46℃Hcl(比重1.075)处理5分钟以阻止滞育的发生。4种二化性品种的蚕卵在产卵后1-9天内收集。
获得家蚕胚胎的步骤
实验使用30%(w/v)KOH、2%(w/v)NaClO和一种特殊装置来去除家蚕卵壳。通过对去除卵壳的卵的固定和去除卵黄膜,即可获得大量完整的家蚕胚胎。第一步是胚胎去卵壳。蚕卵放置在下层不锈钢过滤器中(Fig.1a2),然后将上层不锈钢过滤器(Fig.1b2)嵌入到下层过滤器(Fig.1d)中.(下层和上层过滤器可以作为整体使用。)将装有卵的上下层过滤器移进玻璃培养皿(60mm),然后在平皿中加入30%(w/v)KOH.(液面应保持在上层过滤器以上,这样可使蚕卵完全浸入KOH溶液中。)蚕卵去卵壳处理约7分钟。在解剖显微镜下观察到卵壳膜变成透明时,立即将装有卵的上下层过滤器部分地放入装有2%(w/v)NaClO的另一玻璃培养皿。(液面也应超过上层过滤器)。蚕卵需要继续在NaClO溶液中去卵壳处理3分钟。然后将上下层过滤器部分浸入装有PBS(0.1M,pH7.4)的平皿。将上层过滤器移开,去卵壳的卵漂浮在液体表面呈圆形。第二步是将胚胎固定。固定剂[10ml PBS, 2 ml 甲醛(37-40%),12ml 庚烷]加入事先准备好的50ml试管,用滤网(Fig.1c)将去卵壳的卵转移进这个试管。试管盖上盖子,水平移至摇床,在28℃条件下以180rpm(半径26mm)摇50分钟。第三步是去卵黄膜。用滤网将经过固定的胚胎转移进预冷的10ml甲醇里,大力摇晃30s从而得到去卵黄膜的胚胎。
Fig.1 此装置用于胚胎制备。a1为下层不锈钢过滤器的顶视图(直径:5.2cm,高度:1.8cm,网眼大小:1mm×0.8mm),a2为下层不锈钢过滤器的侧视图,b1为上层不锈钢过滤器的顶视图(直径:5.1 cm,高度:1.2cm,网眼大小:0.7mm×0.9mm),b2为上层不锈钢过滤器的侧视图,c为滤网(网眼大小:0.5mm×0.7mm),d为上层过滤器嵌入下层过滤器的整体图。
免疫组化
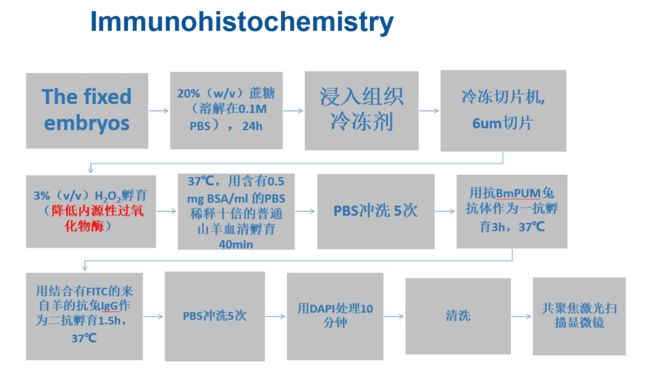
将经过固定的胚胎放入20%(w/v)蔗糖(溶解在0.1M PBS)内24h,随后浸入组织冷冻剂中。使用冷冻切片机进行冷冻切片可获得6um的切片。稍后切片用3%(v/v)H2O2孵育以降低内源性过氧化物酶,在37℃条件下用含有0.5 mg BSA/ml 的PBS稀释十倍的普通山羊血清将切片孵育40分钟。切片在用PBS冲洗 5次之后继续用抗BmPUM兔抗体作为一抗在37℃孵育3h。负调控是通过忽略一抗而呈现的。切片在37℃条件下用结合有FITC的来自羊的抗兔IgG作为二抗孵育1.5h,再用PBS冲洗5次。最后,这些切片用DAPI处理10分钟,随后清洗并使用共聚焦激光扫描显微镜进行观察和照相。
结果与讨论
-
完整胚胎获取
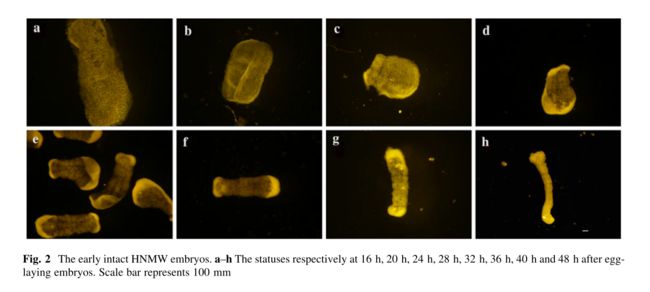
实验使用室温下的KOH与NaClO混合溶液去除家蚕卵壳。通过我们的新方法我们从HNMW品种的蚕卵中获得8个时间点(Fig.2)的早期胚胎。这些是完整的胚胎,并且易于从形态上区分。例如,产卵后16h和20h的胚胎处于胚带形成时期(Fig.2a,b)。产卵后24h,28h,32h,36h,40h和48h的胚胎处于中胚层分化时期(Fig.2c-h).如图Fig.2a所示,甚至细胞结构亦可辨别。
我们的方法较适合获取家蚕早期胚胎。传统使用KOH的方法在去除卵壳方面有效但煮沸溶液IS会被破坏。此外,尽管KOH溶液处于室温下,但由于溶液是单独使用的,要想控制去卵壳温度仍然是困难的。比KOH更温和的关于去卵壳的方法是使用NaClO直接去除果蝇的卵壳。但是,NaClO不能单独用于去除家蚕卵壳,因为家蚕卵壳在大小,厚度,组分和结构上都与果蝇卵壳有差异。例如,果蝇的卵大约0.45mm长,0.2mm宽,卵壳1.1-1.6um厚(Margaritis et al.1980),而家蚕的卵大约1.2mm长,0.95mm宽,卵壳大约 5.7-6.8mm厚(Sakaguchi et al.1973).综合考量,本实验使用KOH(7min)和NaClO(3min)的混合液去除卵壳。与蛋白酶K(15min)和NaClO(~3 min)配合使用的方法(Singh and Gopinathan 1997)相比,此方法更加快速有效。
选择家蚕的4种二化性品种(A40,C108,HNMW,Jingsong and Haoyue)来证实这种方法是否适用于其他品种的蚕卵。结果显示我们的方法同样有效。Fig.1的补充图显示我们从A40蚕卵中获取了完整胚胎。
-
胚产率和影响因子
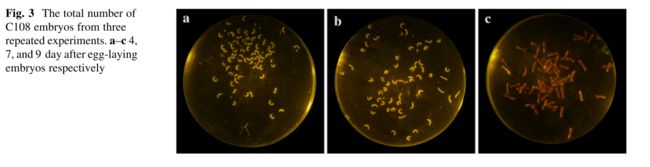
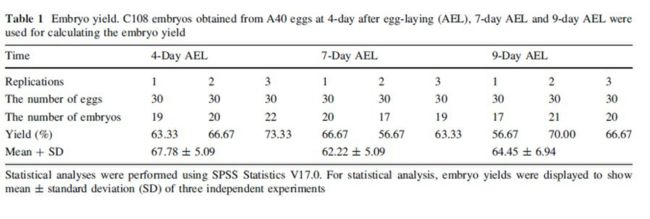
为了继续证明我们的方法,在我们的实验中首次使用了一种含有上下层过滤器的特殊装置(Fig.1)。使用这种装置获得了C108品种产卵后4天,7天和9天的胚胎。这些C108品种的胚胎用来计算胚产率(Table 1)。
结果表明每一次操作产量稳定并且一次操作可获取较多胚胎。诚然,一次操作获取的胚胎数目取决于卵的数量。我们曾经经过一次操作从860枚卵中获取413个胚胎(数据未展示)。特殊装置确保了蚕卵完全浸入KOH和NaClO溶液因而这些卵能够均匀去卵壳。(网眼的大小必须适当以防止去卵壳的圆形卵从网眼过滤器漏出。)另外,不均匀去卵壳直接导致胚产率下降,因为不能从不完全去卵壳的卵中获取胚胎(Fig.2a补充图)。与使用灭菌吸管持续冲洗蚕卵以去除外在卵壳相比,使用特殊装置的方法对于维持胚产率(Table 1)稳定更加有效。尤其对于处理大量蚕卵的工作更加行之有效。
许多因素可影响胚产率,比如家蚕蚕卵的品质,蚕卵间的个体差异,KOH和NaClO溶液的浓度,去卵壳和固定过程的时间长度,转移过程中的损失等等。更多关于影响因子的细节讨论如下。在浓度方面,30%(w/v)KOH比15-20%(w/v)KOH更适合。KOH的浓度越高,粘稠度越大,渗透越慢。因此高浓度的KOH在渗透进卵的内部结构并且造成卵的损伤之前可能会使卵壳膜变成透明的。NaClO产生效用的标志是蚕卵周围产生许多气泡。实验中2%(w/v)NaClO用来去除剩下的卵壳。以上数据提供的胚胎去除卵壳的时间仅供参考。由于不同品种(A40,C108,HNMW,Jingsong and Haoyue)和发育时间(从16h到10天)的差异,去卵壳的时间会有差异。并且,用滤网转移去卵壳卵进入50ml试管的时间应尽可能短以避免损伤发生。胚胎固定的时间应适当。假使时间太短,完整的胚胎易于碎裂因而无法获取(补充图 Fig.2b);假使时间太长,去卵壳的卵会浸入液相中。正常情况下,它会位于上层庚烷相和下层液相的临界面,并且,胚胎由于与卵黄膜和卵黄颗粒结合紧密而无法获取(补充图 Fig.2c)(Rothwell and Sullivan 2000)。摇床的温度和速度和去卵壳卵的状态也会影响胚胎固定所需时间。将已固定的胚胎从固定剂转移到甲醇中时,过滤器可尽量减少下层液相的携带。摄入的下层液相部分会影响去卵黄膜并减少胚产率(Parthasarathy et al.2005)。
-
胚胎的免疫组化
对获取的A40胚胎的BmPUM蛋白进行免疫组化分析。Fig.4的结果显示,PUM是一种序列特异的RNA结合蛋白。在黑腹果蝇中,pumilio基因在胚胎发育不同阶段进行表达(Macdonald 1992)。在青鳉中,pum1和pum2在所有组织以及胚胎发育的不同阶段(Zhao et al.2012)均表达。我们的结果显示,同以上物种类似,BmPUM蛋白在胚胎形成时期广泛表达。这暗示,在需要去除蚕卵卵壳和卵黄膜以及允许试剂进入胚胎的情况下,在分子水平上,我们的方法可适用于对家蚕的胚胎发育进行探究。
无法通过传统方法获得发育早期的家蚕胚胎。家蚕胚胎不能通过一次手动剥离的操作大量获得。但是,我们新方法的改进和优化方案基本证明可适用于获取发育早期的家蚕胚胎并且可从一次操作获得大量家蚕胚胎。此外,由于方法简便,使得在实验室条件下进行家蚕胚胎的免疫组化确实可行。
Fig.2 早期完整的HNMW胚胎。a-h分别为产卵后16h,20h,24h,28h,32h,36h,40h和48h的胚胎形态。比例尺为100mm。
Fig.3三次重复试验获得C108品种胚胎的总数。a-c分别为产卵后4天,7天和9天的胚胎。
Table 1
胚产率。用A40品种产卵后4天,7天和9天的蚕卵和获取的C108品种的胚胎来计算胚产率。
使用SPSS Statistics V17.0进行数据分析。对于数据分析,胚产率在三次独立实验中通过平均数±标准差来展示。
Fig.4 A40胚胎在4个不同发育阶段的免疫组化。BmPUM蛋白在家蚕胚胎里1天,3天,7天和9天的表达。垂直列分别为在明场,用FITC处理的绿色荧光,用DAPI处理拍得的照片。水平行分别为3天龄的胚胎用PBS代替原发性抗体所进行的负调控。a-d分别为产卵后1天 3天,7天和9天的胚胎。比例尺为100mm。