今天跟大家分享的是八月份发表在OncoImmunology杂志(IF:5.869)上的一篇文章,文章主要讲的是利用公共数据库中的多组学生物信息学对新的抗肿瘤靶点Siglec-15的表达特征、预后价值、免疫浸润模式和生物学功能进行分析,并在103例肺癌患者中进行验证。
泛癌分析识别Siglec-15表达特征、预后价值和免疫特征
一、摘要
唾液酸结合免疫球蛋白样凝集素15 (Siglec-15)被认为是一种新的抗肿瘤靶点,可与程序性细胞死亡1配体1(PD-L1)相媲美。然而,人们对Siglec-15知之甚少。本工作的研究目的是利用公共数据库中的多组学生物信息学了解其表达特征、预后价值、免疫浸润模式和生物学功能,并在肺癌患者中进行验证。对TCGA和Genotype-Tissue Expression portals的综合分析显示,Siglec-15在癌症中过表达。利用cBioportal和UALCAN进行遗传和表观改变分析,结果显示Siglec-15在遗传和表观水平上受到调控。生存分析显示,高表达的Siglec-15与肿瘤的有利或不利预后相关(取决于不同类型和亚型的癌症)。利用CIBERSORT分析免疫微环境成分,发现免疫细胞与Siglec-15之间的相关性在不同癌症类型中存在显著性差异。基因集富集分析显示,Siglec- 15参与免疫、代谢、癌症和传染病的相关通路。免疫组化显示,Siglec- 15阳性表达的肺癌患者无进展生存期短,同时CD20 + B和树突状细胞浸润减少。RT-qPCR结果显示,过表达Siglec- 15与趋化因子信号通路的激活相关。综上所述,Siglec- 15可以作为一个重要的预后生物标志物,并在肿瘤中发挥免疫调节作用。
二、数据及方法
1. 患者和样本组织
回顾性收集了2013年1月至2013年5月在中国天津医科大学肿瘤医院行根治性(R0)切除术并组织学诊断为LUAD的103例患者的资料。所有患者均行R0切除术及淋巴结清扫。根据国际肺癌研究协会第八版TNM分期系统对淋巴结和肺癌分期进行分类。
2. 基因表达数据
TCGA的截至2018年的33种癌症类型的1.1万多个肿瘤。获取了基因表达、甲基化、拷贝数变异数据集和临床数据。从UCSC Xena下载GTEx和TCGA的RNA-seq数据。使用R包limma进行差异表达分析,发现Siglec-15在全肿瘤表达中具有显著差异。
3. 拷贝数变异和突变数据
使用cBioPortal提供的基因组数据,分析了不同癌症中Siglec-15的基因拷贝数变异(CNA)和基因突变。
4. 差异甲基化分析
使用UALCAN network (http://ualcan.path.uab.edu)来分析肿瘤组织和正常组织的Siglec-15启动子甲基化水平
5. 生存分析
使用 Kaplan–Meier plotter (http://kmplot.com/analysis/)分析在不同癌型中Siglec-15的预后价值。
6. 免疫分析
使用TISIDB(http://cis.hku.hk/TISIDB/index.php)来分析Siglec-15基因在不同免疫亚型中的表达,包括C1(创面愈合),C2 (IFN-阻断显性),C3(炎性)、C4(淋巴细胞消耗)、C5(免疫安静)、C6 (TGF-多核主导)亚型,和TCGA不同分子亚型肿瘤样本中的Siglec-15基因表达。
使用CIBERSORT (https://cibersort.stanford.edu/)来评估TCGA和GEO检测的肿瘤肿块中肿瘤浸润免疫细胞的相对丰度。
7. 基因集富集分析(GSEA)
使用TCGA的RNA-seq数据,对Siglec-15及其共表达基因进行GSEA,KEGG和GO通路分析发现潜在通路。
三、结果解析
1. 在人类癌症中的Siglec-15 mRNA表达
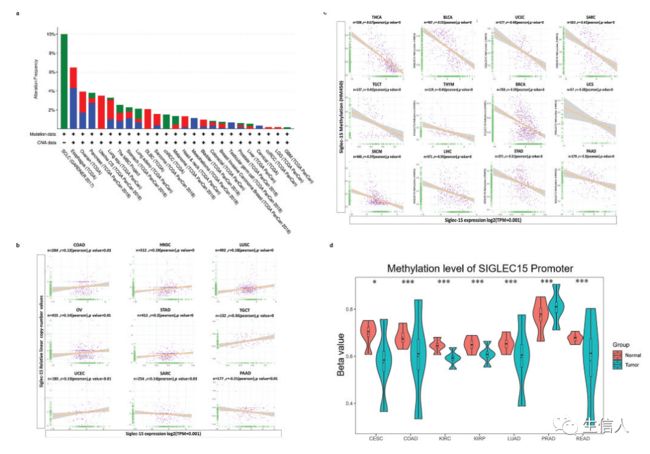
整合了TCGA的肿瘤样本和GTEx数据库的正常样本,来识别Siglec-15 mRNA的表达特征。发现在大多数癌症类型中,Siglec-15上调(图1a)。当只分析TCGA的肿瘤和邻近组织时,发现在COAD、HNSC、KICH、KIRP、LUAD、READ、SKCM、THCA和UCEC的转移组织中,Siglec-15表达上调。通过TIMER数据库分析,Siglec-15在PRAD中下调。然后使用Oncomine分析Siglec-15在不同癌型的表达情况。
然后分析了不同临床分期和分子亚型的Siglec-15的mRNA表达模式(图1b)。Siglec-15在BRCA、KIRP、PCPG、SKCM和ESCA的不同分子亚型中的表达差异显著(图1c)。在其他癌症中,没有发现Siglec-15表达与癌症分期或分子亚型之间的关联。
图1.人类癌症中Siglec-15的转录水平
2. 不同人类癌症中Siglec-15的CNA和DNA甲基化改变
遗传和表观遗传变化在调控肿瘤发育和免疫耐受中发挥着重要作用。利用cBioPortal进一步研究了Siglec-15的遗传改变。发现OV、HNSC、SARC和UCEC等中Siglec-15高表达(图2a)。在这些癌症中,Siglec-15基因改变的趋势与其mRNA水平一致。为了探讨CNA对基因表达的影响,分析了基因表达与相对线性拷贝数值的关系。结果显示,在COAD、HNSC和LUSC等癌型中,Siglec-15表达与CNA呈正相关,而在SARC和PAAD中呈负相关(图2b)。
接下来确定了表观遗传机制是否在调控Siglec-15 mRNA表达中起作用。为了将启动子DNA甲基化水平与Siglec-15表达联系起来,进行了DNA甲基化状态与Siglec-15表达的相关性分析(图2c)。在THCA、BLCA和UCEC等癌型中,DNA甲基化与Siglec-15表达呈显著负相关。然后使用UALCAN研究了癌组织和癌旁正常组织中Siglec-15启动子DNA甲基化状态的差异(图2d)。在LUAD、CESC和COAD等癌型中,癌组织中Siglec-15甲基化比邻近正常组织少。因此,在某些癌症中,Siglec-15 mRNA的异常升高可能是基因改变和DNA甲基化水平降低的结果。
图2.人类癌症中Siglec-15的CNA和DNA甲基化和
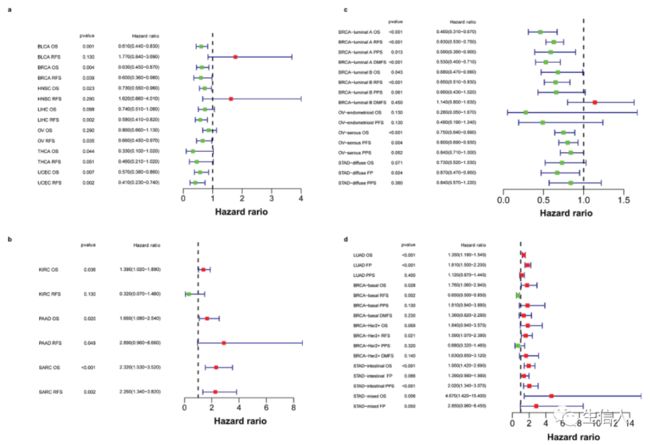
3. Siglec-15的mRNA表达相关性分析和预后价值
结果显示,在不同类型的癌症中,Siglec-15具有不同的预后价值(图3)。在TCGA数据中,发现Siglec-15表达上调与BLCA、BRCA和HNSC等癌型的更长OS相关,与BRCA、LIHC、OV和UCEC的长无复发生存期(RFS)相关(图3a)。Siglec-15表达上调与KIRC、PAAD和SARC短OS相关,与PAAD和SARC的短RFS相关(图3b)。接下来分析了GEO和其他项目的ChIP和RNAseq数据,发现高Siglec-15的mRNA表达对BRCA-luminal A、BRCA-luminal B、OV和STAD-diffuse有较好的预后(图3c)。高Siglec-15的mRNA表达预测LUAD、BRCA-basal、BRCA-Her2+和STAD较差预后(图3d)。
图3. Kaplan-Meier分析评估的Siglec-15的预后意义
4. Siglec-15 的mRNA表达与肿瘤免疫微环境的关系
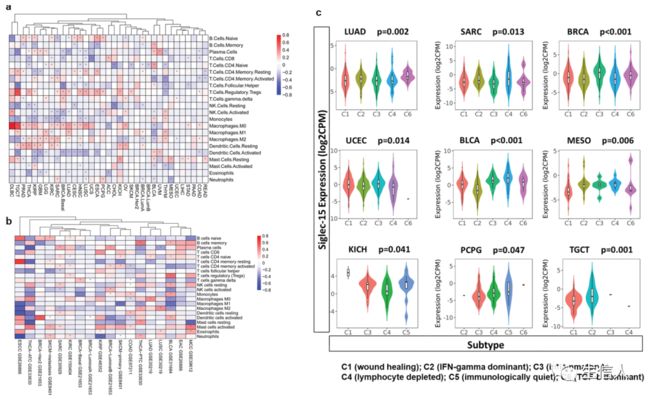
接下来分析了Siglec-15与肿瘤浸润免疫细胞之间的关系(图4a)。首先通过CIBERSORT算法评估了TCGA中33种癌症的免疫微环境成分。根据Siglec-15与免疫细胞关系的聚类热图显示,在一些癌症中,尤其与调节性T细胞呈正相关,与巨噬细胞的相关性大多为阳性。而在BLCA和ACC中与巨噬细胞、肾上腺皮质癌呈负相关。由于其抑制T细胞的功能,所以接下来重点研究了Siglec-15和CD8 + T细胞之间的关系。在ACC中,Siglec-15与CD8 + T细胞呈显著正相关,而在BRCAbasal、THCA和UCS中,Siglec-15与CD8 + T细胞呈显著负相关。
接下来使用GEO的多个数据分析了Siglec-15与免疫微环境之间的关系(图4b)。GSE31684中,Siglec-15与记忆B细胞正相关,巨噬细胞(M0, M1)呈负相关;与BRCA-Basal的γδT cells正相关;在LUAD中与巨噬细胞(M0)正相关,与TCGA一致。
利用免疫亚型的分子分型,研究了不同免疫亚型中Siglec-15 mRNA的表达。在C1(创面愈合)、C2(干扰素-γ显性)、C3(炎症)、C4(淋巴细胞耗尽)、C5(免疫沉默)和C6 (TGF-β显性)中的表达有显著差异(图4c)。在不同免疫亚型中Siglec-15的差异表达可能部分解释了为什么Siglec-15在各种癌症的预后中发挥着不同的作用。
图4. Siglec-15表达与肿瘤浸润免疫细胞相关分析
5. Siglec-15影响的显著通路
为了进一步研究Siglec-15的潜在功能,对许多癌症类型进行了KEGG和GO GSEA富集分析(图5a)。免疫相关通路在大部分癌症中高度富集。Siglec-15显著涉及“趋化因子信号通路”、“JAK-STAT信号通路”和“NF-kappa B信号通路”等通路的激活。GO分析显示,在大多数癌症中,Siglec-15对免疫相关的BP、CC和MF均有影响(图5b)。在GO MF条目,细胞因子相关的MFs在SARC、TGCT和UVM等癌型中富集(图5c)。在CC分类,“质膜的外侧面”、“质膜的细胞质侧”和“细胞表面”等是主要富集的条目(图5d)。
图5.Siglec-15影响的显著通路
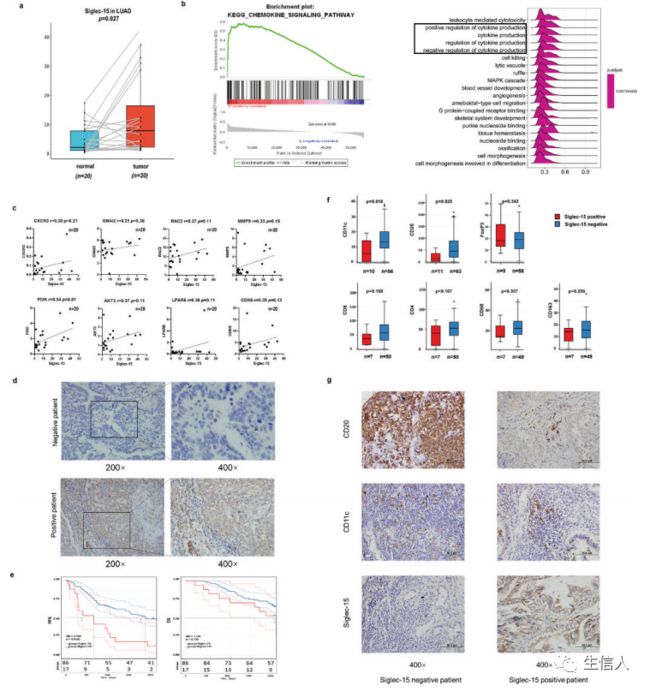
6. LUAD中Siglec-15特征的初步实验验证
为验证上述结果,重点研究了在LUAD中Siglec-15的表达、预后价值、与免疫细胞的关系及相关通路,并利用天津医科大学肿瘤医院的组织标本进行了体外实验。首先通过RT-qPCR检测20份配对的LUAD组织样本中Siglec-15的表达。结果显示,在原发肿瘤组织中,Siglec-15表达明显上调(图6a)。之前的分析显示,Siglec-15与“趋化因子信号通路”、“细胞因子受体相互作用”、“细胞因子产生”和“调节细胞因子的产生”的激活相关(图6b)。接下来主要集中在“趋化因子信号通路”,并通过对20个LUAD组织样本进行RT-qPCR来验证它(6c)。趋化因子信号通路(CXCR3、GNAI2、RAC2和MMP9)及其下游PI3 K-AKT信号通路(AKT3、LPAR6和CDK6)的基因表达与Siglec-15呈正相关趋势。PI3 K与Siglec-15 表达显著正相关。然后把癌组织分成两组(Siglec-15高、低)来评估通路中关键基因的mRNA表达水平。PI3 K在Siglec-15高组高表达(p < .05)。
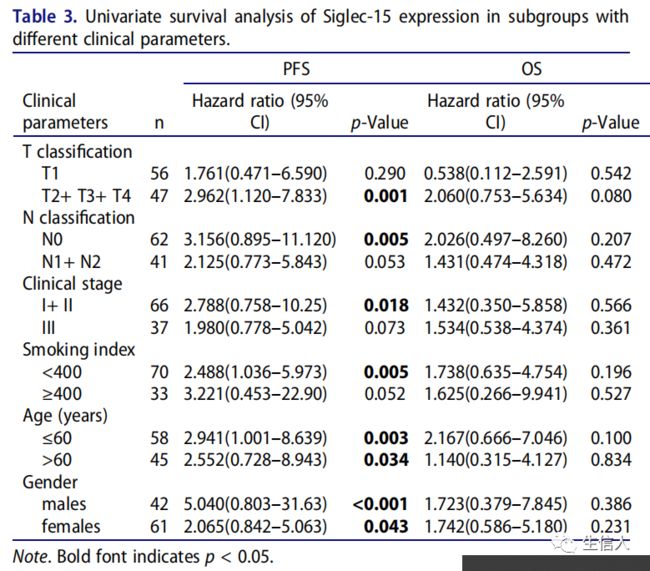
同时,对103例LUAD标本进行免疫组化以评估Siglec-15的表达和预后价值。患者的人口学特征及Siglec-15表达与临床病理因素的关系见表1。经Fisher精确检验,Siglec-15阳性表达与肿瘤大小、淋巴转移、TNM分期、吸烟指数、年龄和性别无关。共有17例(16.5%)患者的Siglec-15染色呈阳性,分为膜阳性和膜阴性(表1)。具有代表性的阴性和阳性标本在200倍和400倍放大镜下拍摄(图6d)。T分型、N分型和临床分期是确定OS和PFS的危险因素(表2)。生存曲线显示,Siglec-15阳性表达的患者PFS不佳。阳性和阴性患者的OS无显著差异(图6e)。此外,根据临床病理因素对选择的LUAD患者亚组研究了Siglec-15的预后价值(表3)。
接下来用免疫组化来评估88例LUAD标本中Siglec-15阴性和阳性患者的相对免疫细胞浸润水平(图6f, 6g)。结果表明,阴性患者的B细胞和DCs的浸润更强。还发现Siglec-15表达与B细胞和DCs呈负相关,这与TCGA的结果一致。然后,进一步用RTqPCR检测这些基因的表达情况。在20个LUAD组织中,Siglec-15与CD68、CD163和 FoxP3呈正相关。
图6.LUAD中Siglec-15特征的初步实验验证
表1.患者临床参数及其与Siglec-15表达的关系
表2.LUAD患者的单因素生存分析
表3.不同亚型中Siglec-15表达的单因素生存分析
总结:
本工作利用有分析意向(http://gaptechsxr.mikecrm.com/1vdMmqy)生信人WX公众号公共数据库中的基因表达、拷贝数、甲基化数据等对新的抗肿瘤靶点Siglec-15的表达特征、预后价值、免疫浸润模式和生物学功能进行分析,并在肺癌患者中进行验证。基因表达分析显示,Siglec-15在癌症中过表达。遗传和表观改变分析显示Siglec-15在遗传和表观水平上受到调控。生存分析显示,高表达的Siglec-15与肿瘤的有利或不利预后相关。同时免疫细胞与Siglec-15之间的相关性在不同癌症类型中存在显著性差异。Siglec- 15参与免疫、代谢、癌症和传染病的相关通路。免疫组化结果说明,Siglec- 15阳性表达的肺癌患者无进展生存期短。