今天和大家分享的是2021年1月份发表在Theranostics杂志上的一篇文章(IF= 8.579)“Siglec15 shapes a non-inflamed tumor microenvironment and predicts the molecular subtype in bladder cancer”。文章中作者基于癌症基因组图谱获得的RNA测序数据,通过Siglec15的表达模式和免疫作用进行泛癌分析发现,Siglec15在各种癌症的TME中过表达。Siglec15免疫疗法可能适合膀胱癌(BLCA)治疗,Siglec15还可以预测分子亚型以及对几种治疗方案的反应。
Siglec15 shapes a non-inflamed tumor microenvironment and predicts the molecular subtype in bladder cancer
Siglec15塑造非炎症性肿瘤微环境并预测膀胱癌的分子亚型
一、研究背景
膀胱癌(BLCA)是常见的泌尿道癌。尽管有新辅助化疗和辅助化疗,转移性BLCA的预后较差。癌症免疫疗法,包括免疫检查点封锁(ICB),为晚期BLCA带来生存获益。但由于具有耐药性,只有少数患者对ICB有反应。Siglec15,唾液酸结合性免疫球蛋白样凝集素家族的一个成员,通过抑制CD8 + T细胞的增殖来促进肿瘤生长。晚期非小细胞肺癌(NSCLC)的I期临床试验结果表明,Siglec15抑制剂可实现为有希望的临床应用。Siglec15在肺腺癌中具有免疫调节作用,并且可能是重要的预后生物标志物。然而,全癌抗Siglec15治疗尚未得到验证,Siglec15在膀胱癌(BLCA)中的潜在作用。
二、研究思路
三、结果解读
1 Siglec15的全癌表达模式、预后和免疫学相关性
作者对TCGA,GTEx和Oncomine数据库的表达数据进行全面分析,流程和结果见图1。与大多数正常组织相比,Siglec15在诸如BLCA和乳腺癌(BRCA)的大多数癌症中高表达。对来自BioGPS和CCLE数据库的表达数据的筛选发现,Siglec15还可以在包括膀胱癌细胞系在内的各种癌细胞系中表达。另一方面,除了巨噬细胞,Siglec15在正常组织中的表达量非常低。由膀胱癌和正常组织组成的30个配对样本中,发现Siglec15在癌组织中的表达明显高于正常组织。
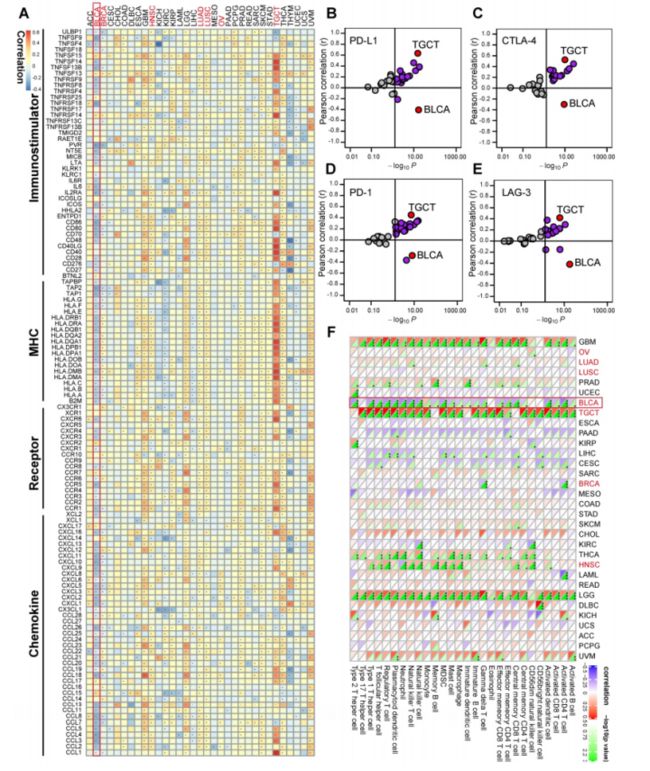
发现Siglec15在全癌过度表达模式后。作者使用Cox回归模型,Kaplan-Meier分析和对数秩检验对总体生存期,无进展生存期和癌症特异性生存期进行了全癌生存分析。发现Siglec15在各种癌症中均已成为预后的生物标志物,尽管其预后价值在不同的癌症中也有所不同,需要进一步评估,尤其是使用多变量分析时。因此,描述Siglec15免疫功能的全癌分析对于确定可从抗Siglec15免疫疗法中受益的癌症类型至关重要。作者发现,Siglec15与BLCA中的大多数免疫调节剂呈负相关。使用ssGSEA算法估算了TME中TIIC的浸润水平,发现Siglec15与BLCA中的大多数TIIC呈负相关。
此外文章中还证明了Siglec15的表达与BLCA中的几个免疫检查点(包括PD-L1,PD-1,CTLA-4和LAG-3)互斥。除BLCA外,未观察到Siglec15与其他恶性肿瘤(如NSCLC,卵巢癌,黑色素瘤,BRCA和结直肠癌)的负免疫相关性。Siglec15在某些癌症中与TMB和MSI呈负相关,这表明Siglec15可能反映了这些癌症中的癌症免疫原性。
Siglec15的过表达模式是TME特异的,证明了Siglec15作为癌症免疫治疗靶标的潜力。Siglec15在TME中的免疫抑制作用在BLCA中最为明显,表明BLCA可能是抗Siglec15免疫治疗的合适候选癌症类型。
2 BLCA中Siglec15的突变分析
Siglec15基因中没有发现突变:Siglec15的拷贝数缺失和甲基化降低了Siglec15 mRNA的表达。这些结果表明Siglec15基因的表观遗传修饰可能是抗Siglec15抑制剂的另一种干预性治疗方法。
3 Siglec15在BLCA中塑造了非炎症性TME
Siglec15与大量免疫调节剂呈负相关,高Siglec15组中大多数MHC分子被下调,这表明高Siglec15组中抗原呈递和加工的能力被下调。高Siglec15组下调了三种关键趋化因子(CXCL9,CXCL10和CCR3),这些趋化因子诱导CD8 + T细胞募集进入BLCA的TME中。其他趋化因子(CCL2,CCL3,CCL4,CCL5,CCL19,CCL20,CCL21,CXCL11,CXCL13)和成对的受体(包括CCR1,CCR2,CCR5,CCR6和CXCR3)与Siglec15负相关。这些趋化因子和受体促进效应TIIC的募集,例如CD8 + T细胞,TH17细胞和抗原呈递细胞。
在高Siglec15组中,发现大多数步骤的活性均被下调,包括癌细胞抗原的释放(步骤1),引发和激活(步骤3)以及免疫细胞向肿瘤的转运(步骤4)(CD8 T细胞募集,巨噬细胞募集,Th1细胞募集,NK细胞募集,DC募集和TH17募集)。随后,这些步骤活动的减少可能会减少效应TIIC在TME中的浸润水平。有趣的是,在低Siglec15组中, T细胞识别癌细胞的活性(步骤6)被下调。这可能是由于低Siglec15组中PD-L1的高表达所致。在高Siglec15组中,杀死癌细胞活性(步骤7)被下调。
接下来使用七个独立算法计算TIIC的浸润水平。在不同的算法中,Siglec15与CD8 + T细胞,NK细胞,Th1细胞,巨噬细胞和树突状细胞的浸润水平呈负相关。同样,Siglec15与这些TIIC的效应子基因呈负相关。此外,Siglec15与巨噬细胞的标记基因负相关。据报道,在非炎性的TME中,Siglec15与大部分免疫检查点抑制剂(包括PD-L1,PD-1,CTLA-4,LAG-3,TIM-3,IDO1,和TIGIT)负相关,且通过免疫荧光检测在膀胱癌微阵列(TMA)队列中得到了验证。
根据CD8 + T细胞的空间分布,将TMA队列中的样本分为三种表型,分别是废弃,排斥和发炎。发炎表型中的PD-L1 IHC得分最高,具有最高的CD8阳性率。这些结果表明这三种免疫表型的分类是合适的。作者分析了Siglec15,CD8和PD-L1的相关性发现,发炎表型的Siglec15表达最低。Siglec15表达与CD8表达负相关,PD-L1的表达与CD8的表达呈正相关,Siglec15表达与PD-L1表达负相关。此外,作者在三个样本量更大的外部队列中验证了这些结果,如下图:在IMvigor210队列中,Siglec15在废弃表型,TC0(PD-L1值最低的肿瘤细胞)和IC0(PD-L1值最低的免疫细胞)组中表达更高。Siglec15与GSE32894,GSE31684和IMvigor210队列中的大多数免疫调节因子,TIIC的效应子基因和免疫检查点负相关。
总的来说,Siglec15与非炎性的TME的发展密切相关。
4 Siglec15预测BLCA中ICB的临床反应和过度进展
从理论上讲,具有较高Siglec15表达的患者对ICB的反应较低,因为Siglec15定义为非炎性的TME。正如预期的那样,与显示对治疗有部分或完全反应的患者相比,患有进行性和稳定疾病的患者中Siglec15的表达明显更高。Siglec15与大多数免疫疗法阳性基因特征的富集得分负相关,这在三个外部队列中得到了验证。作者还分析了具有不同ICB反应的亚组中Siglec15与各种免疫特征之间的相关性。将这些组定义为完全缓解,部分缓解,疾病稳定和疾病进展组。亚组分析结果表明,高Siglec15与这些免疫特征呈负相关,并预测所有亚组对免疫治疗的反应都较低。此外,Siglec15与泛癌T细胞炎症评分呈负相关。在高Siglec15组中与ICB相关的过度进展的发生率可能更高。与过度发展呈正相关的基因(包括CCND1,FGF3,FGF4,FGF19,MDM2,MDM4和DNMT3A)的拷贝数扩增率和mRNA表达在高Siglec15组中显著增加。相反,在高Siglec15组中,与过度发展负相关的基因(包括CDKN2A和CDKN2B)的mRNA表达明显较低。
总之,不应在具有高Siglec15表达的BLCA患者中实施ICB,因为他们对ICB无反应,而表现出过度进展的可能性更高。
5 Siglec15预测分子亚型和治疗机会
从PURE-01研究中发现,具有较低Siglec15表达的BLCA更可能是七个分子亚型系统中的Basal分子亚型(如下图C)。这再次验证了Siglec15与ICB响应呈负相关的结论。此外,高Siglec15组的管腔分化,Ta通路和尿路上皮分化的富集得分更高。另一方面,高Siglec15组的基础分化,EMT分化,免疫浸润和干扰素应答的富集得分较低。使用三个外部队列验证了这些结果。
6.使用七种不同算法和膀胱癌特征在Siglec15和分子亚型之间的相关性
此外,除Baylor分子亚型系统外,其他系统中Siglec15的ROC曲线下面积(AUC)≥0.90。使用四个队列进行验证,观察到了相似的发现。分子亚型也可以预测到新辅助化疗,放疗,和几个靶向疗法。Basal分子亚型肿瘤更可能对新辅助化疗产生反应。在低Siglec15组(基础亚型)中,RB1,ERBB2和FANCC的突变率显着较高。另外,在低Siglec15组中,放疗预测的途径和EGFR配体的富集得分更高。
此外,Drugbank数据库的结果表明,低Siglec15组对化学疗法,免疫疗法和ERBB治疗的反应明显更高。这表明ICB,新辅助或辅助化疗以及ERBB治疗可单独或联合用于治疗低Siglec15表达的BLCA。
而具有较高Siglec15表达的BLCA更有可能是腔亚型。ICB,化学疗法和放射疗法都不适合具有高Siglec15表达的BLCA。在高Siglec15组中,几种免疫抑制致癌途径的富集得分显着更高。这些致癌途径与BLCA中非炎性TME有关。抑制这些途径促进发炎的TME的形成,从而重新激活癌免疫。靶向PPARG和FGFR途径的药物在BLCA中取得了可喜的结果。同样,erdafitinib(一种FGFR抑制剂)与先前的ICB治疗在转移性BLCA中也取得了出色的反应。从理论上讲,Siglec15与这些致癌途径具有相似的免疫抑制功能。因此,可以将阻断这些途径的靶向疗法与抗Siglec15疗法联合使用,以治疗具有高Siglec15表达的BLCA。这些结果在三个外部队列中得到了验证。我们发现抗血管生成疗法可能适用于具有高Siglec15表达的BLCA。
7 Siglec15预测湘雅队列的免疫表型和分子亚型
Siglec15与大多数免疫调节剂(例如CXCL9,CXCL10,CCL2,CCL3,CCL4,CCL19等)负相关。在多种算法中,还发现Siglec15与CD8 + T细胞,NK细胞,树突状细胞和巨噬细胞呈负相关。Siglec15还与巨噬细胞的四个关键标记基因负相关。正如预期的那样,Siglec15与癌症-免疫周期的关键步骤呈负相关,包括癌细胞抗原的释放(步骤1)和免疫细胞向肿瘤的运输(步骤4)(CD8 T细胞募集,巨噬细胞募集,Th1细胞募集,NK细胞募集,DC募集和TH17募集)。我们还分析了Siglec15与预测的ICB响应特征之间的相关性。Siglec15与所有与免疫治疗相关的阳性特征的富集得分呈负相关。此外,Siglec15还与大多数免疫检查点(例如PD-L1,LAG-3和CTLA-4)和T细胞炎症评分呈负相关。
总而言之,Siglec15可以在7种不同的分子亚型算法中准确的区分Basal和luminal亚型。具有较高Siglec15表达的BLCA更可能是luminal亚型。在七个算法中,Siglec15预测分子亚型的准确性在0.81至0.91之间。此外,Siglec15在预测对新辅助或辅助化疗,放疗和靶向治疗的治疗反应性中的作用已得到成功验证。
8 识别免疫相关的DER
这项研究确定了1500个常见DER。在高Siglec15组和高免疫/基质评分组中,上调的DER之间没有共性,在高Siglec15组和高免疫/间质评分组中,DER的下调之间没有交集。这表明Siglec15与TME中的免疫和基质评分呈负相关。低Siglec15组的一些基础亚型特异性基因(KRT6A,KRT6B,KRT6C,KRT5和KRT14)均被上调一种。在高Siglec15组中,一些管腔亚型特异性基因(包括UPK1A,UPK2,UPK3A和KRT20)也被上调。这意味着Siglec15表达水平可以预测BLCA的分子亚型。根据GO和KEGG分析结果表明,这些DER丰富了免疫相关的功能过程。PPI分析的结果确定了24个聚类,在这24个簇中,前三个簇和相应的中枢基因也与免疫相关过程相关。
9 IRS的开发和验证
对总体进行单变量Cox分析发现524个DER影响预后,然后使用LASSO算法确定了具有最小λ(0.001765)的21个最佳候选DER。使用多变量Cox回归分析,根据IRS RNA表达特征开发了IRS。在TCGA训练集中,使用IRS的中位数作为风险临界值,将275名患者分为高IRS组(n = 137)和低IRS组(n = 138)。IRS低的患者的总生存时间明显高于IRS高的患者。IRS在12、36和60个月时的AUC分别为0.78、0.78和0.83。在TCGA内部验证集中,IRS的预测准确性得到了很好的验证。
作者进一步验证了IRS RNA表达谱在多个外部BLCA队列中的预后价值。发现IRS RNA表达谱在所有BLCA队列中都是有价值的预后指标。
IRS还可以预测对ICB的临床反应。IRS与Siglec15负相关,但与泛癌T细胞炎症评分正相关。高IRS组中几个免疫检查点(例如PD-L1,CTLA-4和LAG-3)的表达明显更高。同时,IRS与几种免疫调节剂,效应TIIC和癌症免疫周期活动呈正相关。最后,在高IRS组中,大多数免疫治疗正相关特征的富集得分显着更高。
最后作者比较了IRS和TIDE算法之间预测ICB响应的准确性,并评估了这两种算法的预后价值。两种算法之间在预测ICB响应方面的预测准确性没有差异。但是TIDE与预后无关,IRS在预测预后方面比TIDE更好。IMvigor210研究组的TIDE或IRS对ICB反应或预后的预测准确性较低。通常,TIDE和IRS在预测ICB反应方面具有可比性。至于预后价值,IRS可能比TIDE表现更好。
四、小结
作者从癌症基因组图谱获得的RNA测序数据,使用泛癌分析全面评估了Siglec15的表达模式和免疫学作用,分析Siglec15在预测BLCA中分子亚型和对几种治疗方案的反应中的作用。制定了免疫风险评分(IRS)可根据IRS RNA表达预测ICB的预后和应答,发现Siglec15在各种癌症的TME中过表达。发现Siglec15与BLCA中非炎性TME相关,Siglec15免疫疗法可能是膀胱癌的合适候选药物,同时Siglec15塑造BLCA中非炎性TME,也可以预测对ICB和BLCA分子亚型的临床反应。