一、实验设计
按照客户的预期,期望通过杆状病毒-昆虫细胞蛋白表达系统以胞外分泌的形式获得目的蛋白,因此我们分析客户提供的Target-Gene序列,整个蛋白序列呈亲水性,自身不带信号肽序列,并且序列本身含有昆虫细胞的稀有密码子,因此我们设计思路为:
1.1、以客户的基因序列翻译的蛋白序列为源模板,通过密码子优化一套最适宜SF9细胞系的基因序列。
1.2、在蛋白序列N端添加GP67信号序列帮助蛋白穿膜分泌表达至胞外,在C端添加6XHis-Tag便于重组蛋白的检测和亲和纯化。
依据上述设计思路,以基因合成的方式构建pFast-bac1-target-gene表达质粒,转化后通过蓝白筛选方法获得重组的Bacmid,经PCR鉴定之后转染sf9细胞,以获得P1代病毒和P2代病毒。侵染200ml小试表达,通过western blot检测蛋白表达情况,确认蛋白表达情况,再通过Ni-resin亲和纯化获得80%以上目的蛋白。
二、试剂和耗材
转染试剂(购自invitrogen公司);培养基(购自HYclone公司);抽提试剂盒(购自Axygen公司);PCR试剂盒(IO-RAD公司);血清(购自invitrogen公司);六孔板(购自corning公司);细胞培养瓶(购自corning公司);离心管(购自corning公司);PCR反应管(购自Fisher公司);Agarose(购自上海基因公司);DNA胶纯化试剂盒、质粒小提试剂盒(购自AXYGEN公司);低熔点琼脂糖(购自sigma公司);中性红(购自碧云天生物公司);其它试剂均为国产分析纯。
三、主要实验仪器
Allegra 21R 台式高速冷冻离心机 (美国BECKMAN公司),台式高速离心机(德国SORVAL公司),Biologic LP层析系统、Mini Protean II垂直平板电泳系统、Gel Doc2000成像系统、水平电泳系统(美国BIO-RAD公司),PTC-200基因扩增仪(美国MJ Research公司)
320-S pH计(美国Mettler Toledo公司),AR5120电子天平(美国AHOM S公司),MultiTemp III 恒温水浴锅、Hofer ΜV-25紫外透射仪(美国Amersham Pharmacia公司),雪花状制冰机(日本SANYO公司),JY92-2D超声波细胞粉碎机(中国新芝科器研究所),蛋白核酸检测仪(南京大学普阳科学仪器厂),超净工作台(中国苏净集团),NANODROP2000(美国Thermo公司)
四、蛋白性质分析
4.1 客户提供原始基因序列
GTGGGGTGCT******NNNNNNNNNNNNNN---------涉及客户研究内容,不予显示----NNNNNNNNNNNNNNN*******CTTCTCCCTT
4.2 编码的蛋白序列如下(理论分子量41.18KD,理论等电点PI6.73)
GCSVDFSK******NNNNNNNNNNNNNN---------涉及客户研究内容,不予显示----NNNNNNNNNNNNNNN*******TAGSTDHMDHFSL
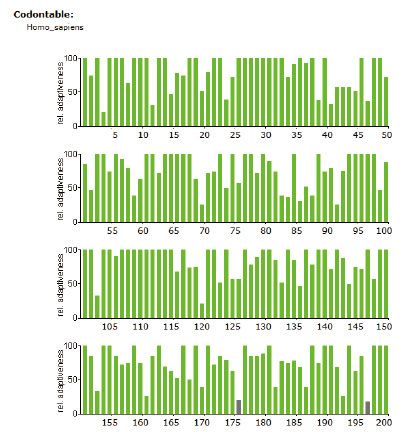
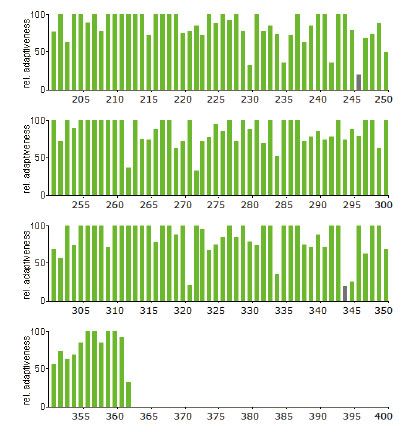
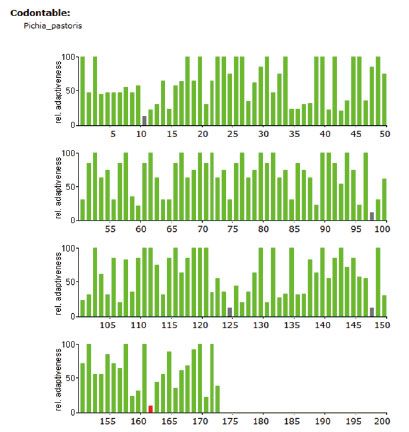
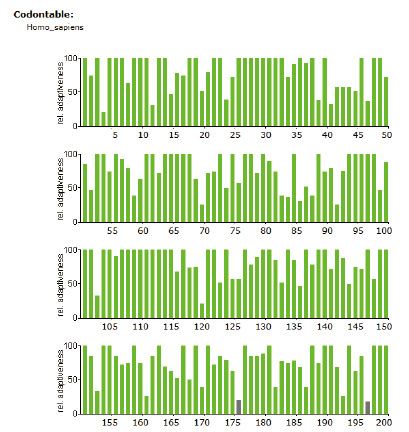
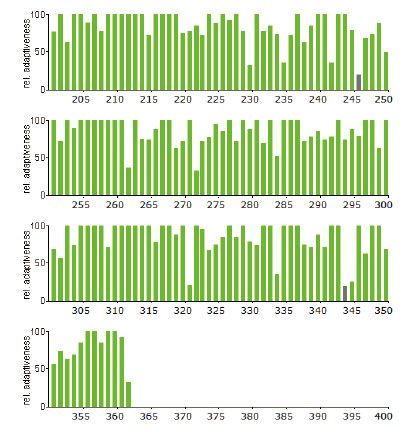
4.3 稀有密码子序列分析如下图所示(红色:使用频率低于10% 灰色:使用频率低于20%,绿色为正常频率密码子)
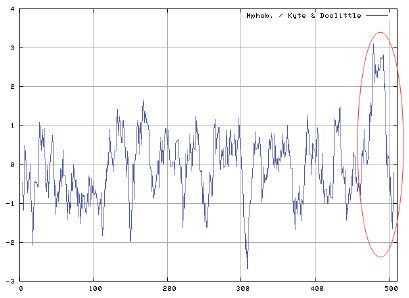
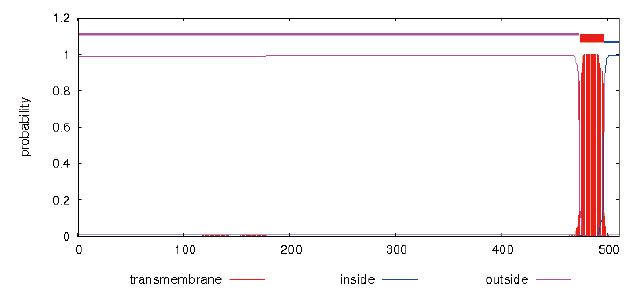
4.4 蛋白序列跨膜及亲疏水性分析
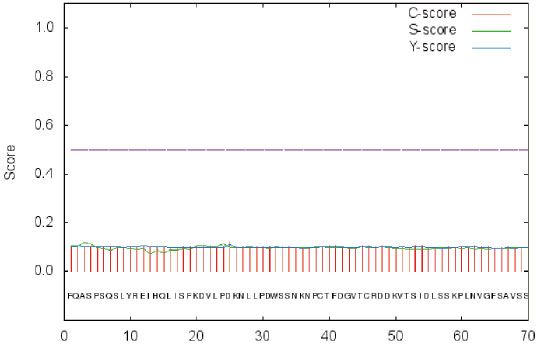
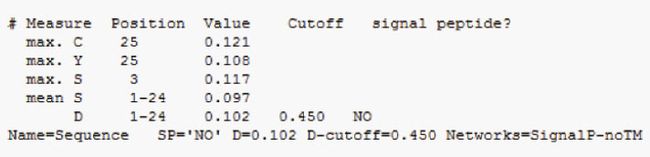
4.5 信号肽预测
综上所述:
1、蛋白理论分子量为 41KD,属于正常分子量范围,较适宜表达。
2、通过对基因密码子使用频率的分析,如果以293细胞为表达宿主,基因序列上使用频率低于20%的密码子X个,使用频率低于10%的密码子X个,优化后通过基因合成方式获得目的基因。
3、通过对蛋白的跨膜结构和亲疏水性分析,蛋白整体呈亲水性,但从473AA之后,蛋白存在典型的跨膜结构,建议去除后表达以提高成功率。
4、目的蛋白自身无信号肽,添加GP67信号肽便于蛋白分泌表达。为了纯化方便,考虑在C端添加His标签。
五、实验方法及实验结果
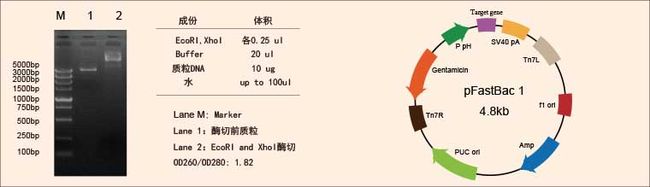
5.1 pFast-bac1-target-gene表达质粒构建
采用基于PAS(PCR-based Accurate Synthesis)的方法合成target-gene基因,双酶切连接至pFast-bac1载体的BamH I和Hind III之间;将获得的重组质粒转入TOP10克隆菌株,挑取阳性克隆子测序,测序结果拼接如下所示,单划线区为目的基因基因区域。紫色区域为酶切位点,黄色区域为GP67信号肽,绿色区域为6XHis标签;
g c c a c c A T G T T A C T C G T C A A C C A G A G C C A C C A A G G G T T T A A C A A G G A A C A C A C A T C C A A A A T G G T T T C A G C T A T C G T G CT T T A T G T T C T T C T T G C C G C G G C A G C T C A T T C T G C A T T C G C G A G A T T G G C T T G T A A G G A A G A T T A C A G A T A T G C C * * * * * * N N N N N N N ---略--- N N N N N N N * * * * * A T C A T C A C C A T C A C C A T C A C T A A a a g c t t
5.2 使用Chromas软件查看测序峰图文件,截取部分序列示例如下:
5.3 pFast-bac1-XXX质粒酶切图与载体构建示意图如下所示:
5.4 重组杆状病毒表达载体(Bacmid,杆粒)的构建
5.4.1 杆粒菌株转化
DH10Bac E.coli 感受态细胞冰上解冻;(2)将200ng的pFastBac1-gene转移载体缓慢加入感受态细胞中,轻轻混匀;(3)冰上放置30min,然后42℃热击90s;(4)迅速冰上静止5min; (5)向EP管里加入900 μl S.O.C.培养基;(6)37℃,225 rpm震荡摇菌4h;(7)取100μl菌液涂于含有50 mg/ml 卡那霉素,7 mg/ml 庆大霉素,10 mg/ml 四环素,100 mg/ml x-gal,and 40 mg/ml IPTG的LB平板;(8)37℃,倒置培养48h。
5.4.2 重组Bacmid质粒的鉴定
挑取3个白色单克隆菌落接种分别接种于5ml含有50 mg/ml卡那霉素,7 mg/ml 庆大霉素,10 mg/ml 四环素,摇菌,菌液PCR初步筛选阳性克隆菌。小量抽取质粒,PCR验证杆粒正确性,因杆粒大小>135Kb,酶切方式很难进行验证,故采用PCR进行验证,理论上,若目的基因成功转座至Bacmid中,那扩增产物的大小应为(2300bp+目的基因长度)
5.5转染及收获病毒
5.5.1 sf9细胞的培养
sf9细胞培养使用SF 900Ⅱ培养基培养,一般每3天分瓶传代一次。处于对数生长期细胞且细胞活力大于95%的sf9 细胞用于转染实验。
5.5.2 Sf9细胞冻存方法:
细胞培养至对数生长期,活力超过90%; 计数,使得储存浓度为1×107 /ml至2×107 /ml; 准备所需量的储存培养液,加DMSO至10%和FBS至30%,预冷培养液保存于4℃; 离心悬浮细胞或单层细胞 100×g,5min,用预冷的冻存液悬浮至所需密度; 混匀,分装至冻存管; 将冻存管放入填有脱脂棉的泡沫盒,-80℃放置1天;移入液氮罐中保存。
5.5.3 Bacmid转染sf9细胞
(1)在六孔板中接种9×105个细胞/2ml/孔。其中培养基Grace’s medium中含有青霉素50U/ml,链霉素50ug/ml,10%FBS;
(2) 27℃培养1h,使细胞贴壁;
(3) 在这期间制备Bacmid与Cellfectin Reagent复合物:
A. 用100ul不完全Grace’s medium(不含双抗、FBS)稀释1ug Bacmid(约5ul);
B. 在使用前将Cellfectin Reagent倒置5~10次,使其充分混匀,取6ul Cellfectin Reagent用100ul不完全Grace’s medium(不含双抗、FBS)稀释;
C. 将上述两种稀释液合并(总体积约210ul),轻轻混匀,室温孵育15~45min;
(4) 在制备Bacmid与Cellfectin Reagent复合物期间,将六孔板中的培养基吸掉,用2ml不完全Grace’s medium(不含双抗、FBS)洗涤一次,去掉培养基;
(5) 在含有210ul的复合物的管内加入800ul的不完全Graces medium(不含双抗、FBS),轻轻混匀,加到每个孔中;
(6) 将六孔板内的细胞孵育5h,27℃;
(7) 去掉复合物混合液,然后在每个孔中加2ml完全培养基(SF900含双抗、10%FBS);
(8) 在27℃湿度培养箱中孵育72h或着直到细胞出现病毒感染迹象。上清和沉淀需要分别制备样品,待后期western blot表达鉴定使用。
5.5.4 P1病毒液的收集
当细胞出现感染迹象时,将细胞上清转移至15ml离心管中,1000rpm离心5min以去除细胞及大的碎片,可用蛋白结合率低的0.2um的滤膜过滤,滴度损失小于10%;将含病毒的上清液转移到另一个无菌带盖的EP管中(一般,P1的滴度在10^6pfu/ml左右), 将得到的病毒液体避光置于4℃冰箱(短期)。若长期保存,进行1ml分装,避光储存于-80℃。
5.5.5 P2病毒扩增及收获
原代病毒滴度(P1)较低,介于1×106~1×107,扩增后滴度为1×107~1×108。 50ml摇瓶中加入适量的P1病毒。扩增病毒时可用下列公式进行计算:
MOI(Multiplicity of infection)在0.01~0.1之间,
接种量 (ml):desired MOI (phf/ml) ×(total number of cells) tlter of viral inoculum (puf/ml)
感染细胞48 h收集的病毒扩增的将近100倍,超过48h 收集的病毒质量较低。每种病毒的收集时间都有一定的差别,如在72h收集,但是随着细胞的裂解,病毒的增殖活力会受损。
5.5.6 病毒滴度检测
六孔板中细胞120万/孔,静置培养1h,病毒梯度稀释101 102 103 104 105 106 107 108 ,去掉六孔板中的上清,取106、107、108三个滴度病毒加入到六孔板中,平行对照2组,孵育1h,配置空斑培养基,每孔加入2mL空斑培养基;第四天加入中性红染色液;7-10天计数空斑数,算病毒滴度。
5.6 重组蛋白表达纯化
f9细胞以2×106/ml瓶接种于500ml细胞培养瓶中;待细胞生长至对数期,接P2代病毒感染sf9细胞;48~72h内收集细胞及上清,用于重组蛋白表达的检测。
1、依此条件方法放大培养。4℃ 10000g离心20 min,取上清;
2. 利用低压层析系统,上清液以0.5 ml/min流速上样至Ni-IDA Binding-Buffer预平衡的Ni-IDA -Sepharose CL-6B亲和层析柱;
3. 用Ni-IDA Binding-Buffer以0.5 ml/min流速冲洗,至流出液OD280值到达基线;
4. 用Ni-IDA Washing-Buffer(20 mM Tris-HCl,20 mM咪唑,0.15 M NaCl,pH8.0)以1 ml/min流速冲洗,至流出液OD280值到达基线;
5. 用Ni-IDA Elution-Buffer(20 mM Tris-HCl,250 mM咪唑,0.15 M NaCl,pH8.0)以1 ml/min流速洗脱目的蛋白,收集流出液;
6.将上述收集的蛋白溶液加入透析袋中,使用PBS(PH7.4)进行透析过夜;
7. 进行10% SDS-PAGE分析。
5.7 Western Blot检测
1. 样品上样0.01ug。
2. 上样完毕后,聚丙烯酰胺凝胶先90V跑完积层胶,再将电压升至200V直到电泳结束。
3. 电泳结束后,取下凝胶进行转膜,恒压100V转膜,约为1.5小时。
4. 电转结束后,取下膜后先用PBS洗涤4次,每次5分钟。然后置于5%脱脂奶粉封闭液中封闭37℃ 1小时。
5. 用封闭液稀释一抗,膜在一抗稀释液中37℃反应1小时。
6. 洗膜4次,每次5 分钟;用含5%牛奶的封闭液稀释二抗。膜在二抗中37℃反应1小时。
7. 洗膜ECL显影。
六. 实验结果及分析
6.1 质粒鉴定结果
6.1.1 质粒浓度
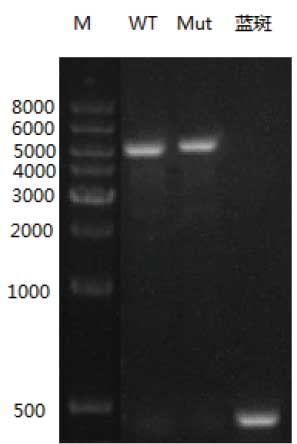
6.1.2 PCR鉴定结果
说明:
目的基因2600bp,使用pUC/M13引物扩增产物理论大小为4900bp,实验结果与预期一致。
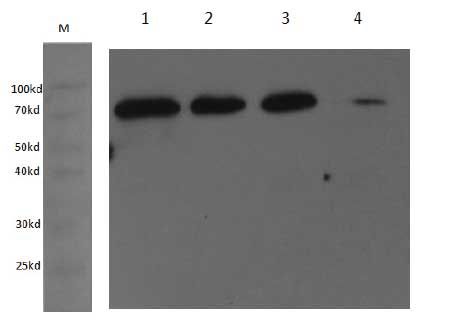
6.2 P2代病毒蛋白表达鉴定
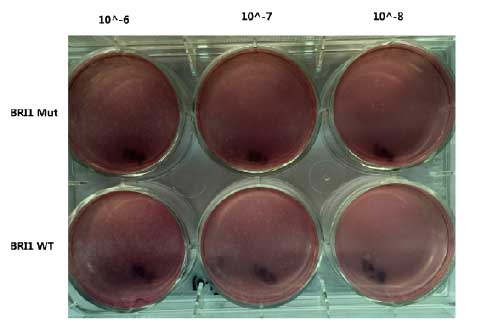
6.3 病毒滴度检测,采用病毒空斑实验方法检测病毒滴度
说明:
P2代病毒感染sf9细胞,通过检测细胞上清和细胞裂解液发现:目的蛋白大部分存在上清中,正常分泌至胞外。
说明:
通过6孔板病毒空斑实验法检测病毒低毒,可以确认我们提供的病毒低毒达到107pfu/ml。
6.4 通过Ni-IDA-Resin亲和纯化目的蛋白,获得纯度约85%的目的蛋白
说明:
通过Ni-IDA-resin收集目的蛋白,经过浓缩处理后使用SDS-PAGE检测,得到了85%以上的目的蛋白。
说明:
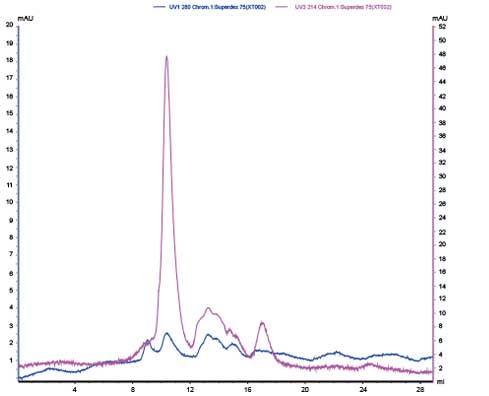
通过SEC-HPLC进一步纯化,获得单一峰的目的重组蛋白,HPLC检测纯度在95%以上。
七. 发货清单
序号类型名称规格常数
1克隆质粒PMD18-target gene2-4ug2
2克隆菌株PMD18-target gene in DH5 α1ml1
3表达菌株PFast-Bac1-target2-4ug2
4杆粒bacmidBacmid-target in TOP101ml1
5P2代病毒MT 107pfu/ml1ml5
6重组蛋白MT protein 纯度>85%,浓度 0.5mg/ml1ml3
钟鼎生物官网