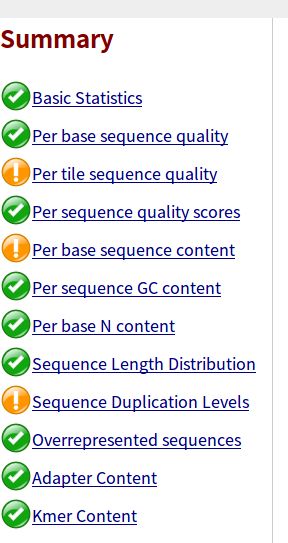
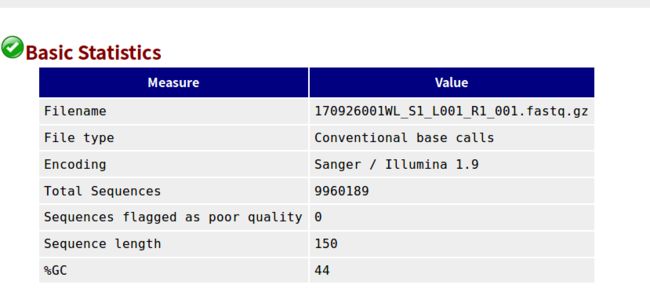
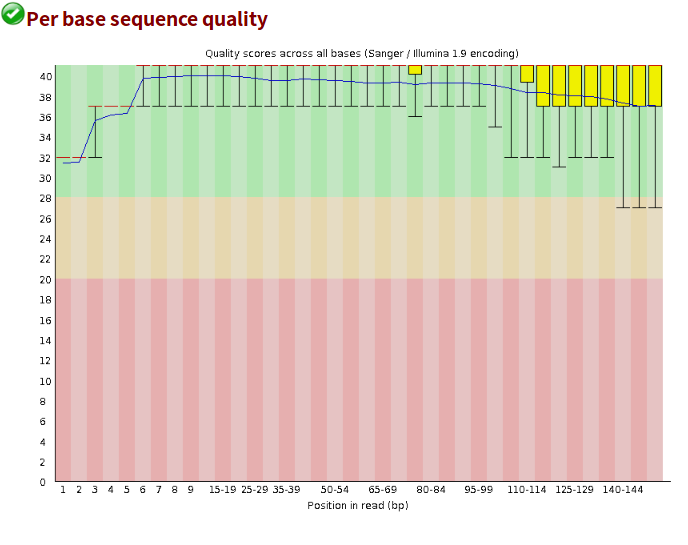
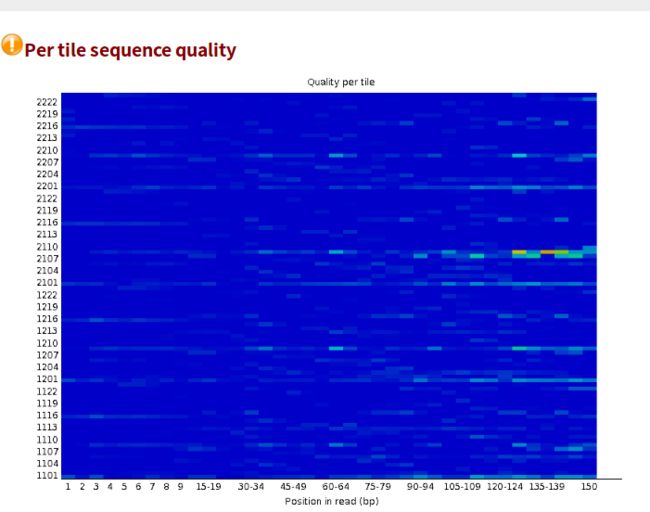
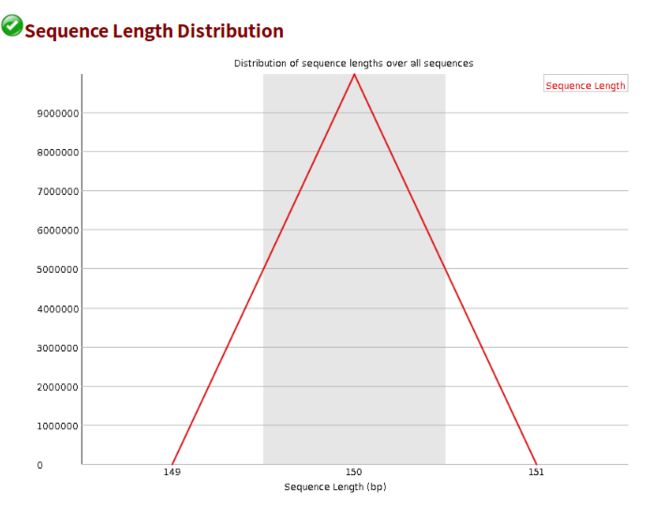
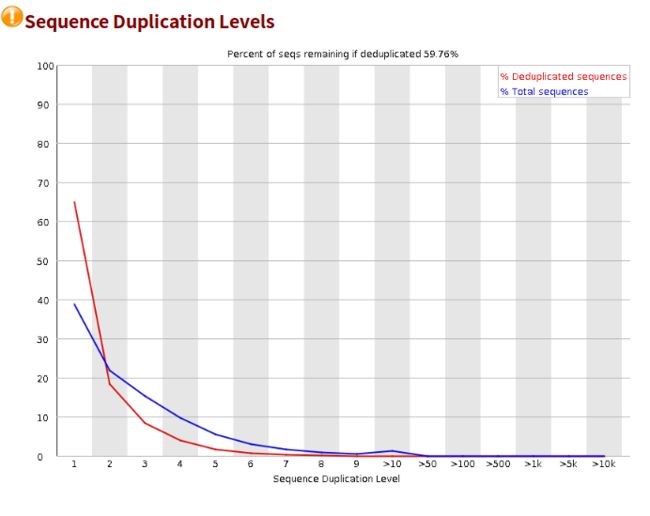
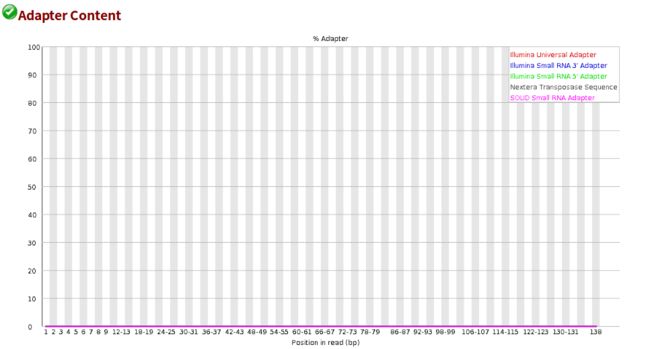
- 设计模式之旅5--构建者模式
小楠总
1.定义建造者模式也叫做生成器模式。将一个复杂对象的构建与它的表示分离,使得同样的构建过程可以创建不同的表示。构建者模式2.使用场景相同的方法,不同的执行顺序,产生不同的事件结果时,可以采用建造者模式。多个部件或零件,都可以装配到一个对象中,但是产生的运行结果又不相同时,则可以使用该模式。产品类非常复杂,或者产品类中的调用顺序不同产生了不同的效能,这个时候使用建造者模式非常合适。在对象创建过程中会
- 守住初心,等待美丽——致我亲爱的CP盲目精彩
玛鲁玛鲁
亲爱的精彩,不知不觉,草长莺飞的四月已经走到了最后。说好这个月我先给你写信的,结果我却耽误到了今天,都怪我。这个月,我没能每天追更你在的更文,其他的事情占据了太多的时间。心里觉得很抱歉,你为了鼓励我开的那个文,我却没能日日固定去看。知道我最近眼睛不好,常去医院检查、治疗、复查,你常常给我发来语音,让我躺着滴眼药的时候听,细心叮嘱我如果回复也用语音,叫我不要老看手机,注意休息。有时看到信息,回复你已
- 晨语问安2022年3月5日
求索大伟
『晨语问安3.5』干活,人类赖以生存的底子,也是成就伟业的根本,开创美好明天的基石。俗话说:锯响就有沫,只要去干就能够取得效果,但是干,也有积极和消极之分,也有主动与被动之别,最终取得的效果也有大小之差,很多时候看似差之毫厘,可能结果天壤之别。干与不干、真干与假干的结果迥然不同,同样是真干,积极主动真干和消极被动真干的效果也不一样,且是时间越久差距越大。同样的工作相同的事情,如果积极主动真干取得的
- python 类 实例_Python类的实例详解
weixin_39997173
python类实例
类(class)是一个用户自定义类型,开发者可以将其实例化以获得实例(instance),实例表示这种类型的对象。在Python中,类就是对象,开发者可以像对其他对象那样处理函数,可以在调用函数时传递一个类作为参数,也可以返回一个类作为函数调用的结果。任何对象,即使是一个类对象,都有一个类型。在Python中,类型和类也都是第一类对象。类对象的类型也被称为该类的元类(metaclass)。对象的行
- java的db是什么_java db
北斗星再亮
java的db是什么
关于javadb的搜索结果问题关于DB+RECORD操作oracle数据库的问题?报错@JFinal你好,想跟你请教个问题:我操作oracle数据库,插入一条记录Recorduser=newRecord().set("userid",...爱吃鱼的程序员2020-06-2220:22:060浏览量回答数1回答为什么不用分页查询是为了导出Excel使用的,前台页面的分页查询没有问题将jvm内存调大点
- 4D习书第三章
刘彦坤
了解用4D管理社会背景的坐标,并明确了坐标的诞生。我关注的内容:有关于4D的验证结论;传统方法的局限。从本章当中的学习对4D使用充满信心。因为它被充分而且反复的应用在领导力和团队发展之中。我的想法与内心独白:用个人的方法精准明确的使用4D系统有效管理团队;让自己变得更好的行动:应用这些定律,并通过实践证明这些定律。期待的结果:有效提高团队和领导至关重要的特点罗列。
- 题梨花初放
岠山剑客
题梨树初花文/岠山剑客梨花院子外面的小路边,那是哪一年生出一棵树,有认识的路人说梨树,但是得拆,不拆不结果,但是我们谁也不会。四五年的等待,长到拳头粗细,在这个春天到来的时候,绽放几穗翩然的花絮,洁白温润,灵动秀丽,引起我和我的邻居们在花下讨论,关于美丽,关于动人心扉,关于岁月的经历。用手机软件识别,一次,两次,防止不准,三次,四次,每次的结果指向:梨花。总还是感觉和果园里的梨树有点差异,可能,或
- 大一暑假适合学51单片机吗?
淘晶驰AK
51单片机嵌入式硬件单片机
大一暑假学51单片机,简直是老天爷赏饭吃的黄金窗口。我当时就是靠着这两个月,把从课本上看来的C语言指针、循环语句,变成了能让LED按节奏跳舞的真本事。学期里总被高数作业和英语背单词挤得没整块时间,焊个电路板还得算着实验室关门时间。暑假就不一样了,早上自然醒后泡杯咖啡,搬个小桌子到阳台,开发板一铺就是一整天。记得第一次烧写程序时,手抖着插杜邦线,结果把VCC接到了GND,开发板瞬间冒出股焦味——后来
- 复盘从一点一滴做起
娟子爱写作
昨天做了第一个比较正式的复盘,按照笔盖导师的话开始了正规复盘。今天落实行动。复盘不是目的,是要理清思路,开始第二天的行动。如果只是写复盘,不去认真地做,只能练练文采而已。改好了形象照片,构思出了创意听里的课程,新梦想写作训练营有四位朋友入群。线下老大哥可能会成为95元第一个付费成员。这些是我不断复盘带来的结果。在泽宇教育里就是要以结果为导向,没有结果,再华丽的词藻都是浪费。
- uniapp下拉选择组件
王旭晨
uni-app
目录背景实现思路代码实现配置项使用尾巴背景最近遇到一个这样的需求,在输入框中输入关键字,通过接口查询到结果之后,以下拉框列表形式展现供用户选择。查询了下uni-app官网和项目中使用的uv-ui库,没找到符合条件的组件。唯一一个有点类似的就是uni官方下拉框组件,但是不支持input组件,所以我们自己来实现一个。实现思路那么实现这样一个组件要有哪些注意点了?我大概罗列了一下:1、下拉框默认是不显示
- 随笔
戍戊
给我挣扎却不给我重生,给我问题却不给我答案,给我希望却不给我结果,给我一光明却没有路途,给我目标却不给我终途,给我选项却不给我选择,给我生命却不给生活,给我牵绊却不给我理解,给我你给的却不给我我要的,最后还是觉得我不懂事,不听话,可是这样了还有人羡慕,有人嫉妒,我不知道我该怎么说,人生终途不过向死而生,我却做不得我。
- 表态发言
可爱婷好
何烊:.严格要求自己,强化教研,提高课堂效果黄磊:对领导,各科老师的肯定,英语老师课间抽几个学生进行指导,共同努力的结果。王康:讲故事,向敬佩的班主任学习脚踏实地,做好自己的事情,对学生真心负出,与学生关系好,创造一个舒适的学习环境,饭要一口一口的吃,事要一件一件的做,路要一步一步的走,踏实平稳地坚持下去,成功的把握好每"一步"的大小是成功的关键。李亦非:慈善之心太强赵件兵:对学生估计过高,重落实
- 畅远正面管教【爱的52种习惯】之21天践行打卡Day13~ 零花钱
雪_8316
最早开始给孩子零花钱,主要目的是延迟满足,控制他每天路过好邻居都想买一个奇趣蛋的冲动。于是我们商定,每周有15元零花钱。他可以自己安排如何花,如果都用来买奇趣蛋,就只能买两次,如果用来买其他的小物件,也许有机会买更多东西。当然一开始很快把钱花光,会讨价还价,不行,我就要!这个时候是对父母的考验,尤其是有社会压力的情况下。让他从错误设想结果中学习的唯一方式,就是认可他们的感受,等待他平静下来,利用启
- PHP MySQL 读取数据
froginwe11
开发语言
PHPMySQL读取数据引言在Web开发中,PHP和MySQL是两个常用的技术栈。PHP作为服务器端脚本语言,而MySQL作为关系型数据库管理系统,两者结合能够构建强大的动态网站。本文将详细介绍如何使用PHP从MySQL数据库中读取数据,包括连接数据库、执行查询、处理结果等关键步骤。连接MySQL数据库在PHP中,首先需要连接到MySQL数据库。以下是一个示例代码,展示了如何使用mysqli扩展连
- 你家有爱挑食的孩子吗
李梅清
偏食厌食世界上很多父母头疼的问题,每次吃饭都像是一个艰巨的任务,陪着哄着,说笑让孩子高兴,孩子一笑趁机喂一口,给孩子讲道理,讲不偏食多吃饭的重要意义数。总之数出浑身结束,想让孩子多吃一点吃丰富一点结果孩子就是不买账,招数用尽,气急败坏。开始吓唬孩子,甚至殴打孩子。曾经我就是以这样的方式来教育我的孩子,因为我在怀孕前自己身体就不好,也没有及时补充营养,准备怀孕过程中和产后,孩子都没有得到很好的营养,
- 《道德经》第七十三章的疑问与猜想
旭日老师
我们先看《道德经》第73章的原文:勇于敢则杀,勇于不敢则活。此两者,或利或害。天之所恶,孰知其故?是以圣人犹难之。天之道,不争而善胜,不言而善应,不召而自来,繟然而善谋。天网恢恢,疏而不失。对于这一章的翻译,比较通行的是这样翻译的:勇于坚强就会死,勇于柔弱就可以活,这两种勇的结果,有的得利,有的受害。天所厌恶的,谁知道是什么缘故?有道的圣人也难以解说明白。自然的规律是,不斗争而善于取胜;不言语而善
- 家庭关系对孩子的性格形成造成影响
慧玲家庭教育
欢迎来到博星教育408将讲师朱老师课堂,这里是朱老师第1033天早安问候。孩子心理健康与家庭结构、父母关系和生活环境密不可分。社会学研究指出,家庭是一个互动的系统。在此过程中,父母的信念、情绪、行为等都会影响孩子的心理健康水平,进而影响孩子一生的发展。家庭关系,会对孩子的性格形成造成影响。蒙台梭利说过:每一种性格缺陷,都是由童年的不幸造成的。一个孩子的成长是生物遗传和环境交互作用的结果,不良的家庭
- 脏读、不可重复读、幻读?一文扫盲数据库三大“读“问题
想象一下:你在银行查看账户余额时,数字在你眼前变来变去;或者明明没有记录的操作,却突然冒出新数据。这不是系统故障,而是数据库事务隔离的三大经典问题!今天我们就来揭开这些神秘现象的面纱。一、事务隔离的"三座大山"️在数据库世界中,多个事务同时操作数据时会产生三种典型问题:问题类型出现场景危害程度类比场景脏读读取未提交的数据⚠️⚠️⚠️高危看到别人未提交的草稿不可重复读同一事务内读取结果不一致⚠️⚠️
- 美好的事物总是值得留念~
韩沫
大家好!我是李晶晶,李是木子李的李,晶是bulingbuling的晶晶,我的爱好非常广泛,我喜欢羽毛球,篮球,看动漫,听音乐,摄影。认识我晶晶,事事都顺心,认识我晶晶,家和万事兴!放一张我傻傻滴图一天,我在向同学抱怨在大学学习真的好无力,身边的人似乎都在刷剧,刷抖音,似乎没有那种对学习独有的激情,我总是在意别人的眼光,我怕自己的独行被人当作另类,结果也融入了这样的圈子。但是到头来却总是忧虑,可又做
- 今天是个特殊的日子
璀璨夜空之星星
2021.12.02阴历十月二十八,星期四。天气阴,飘小雪花。20211202,这个数字是不是不一般,从前往后看,还是从后往前看是不是都是一样的。说实话,如果不是网络上有人发,我还真没注意这个事儿。有时候,不得不佩服这些有心人,我记得二零二零年也有过一次是二月二日(20200202),真是人才辈出。更逗的是,我今天打开朋友圈,结果又有一个同学和我那遥远的书法老师发了同样的朋友圈。微笑!朋友圈图片网
- 最离谱的梦
凌伊澈
做梦人人都会,每当遇到大概率做不到的事情时候,也会经常被别人说:你是白日做梦。想到自己做梦时都感觉好精彩,好激烈呀,结果一醒来就忘记了,真的是觉得好惋惜。有时候我不知道是我在做梦还是想象。眼睛闭着,一直跟着剧情走,但其实自己已经醒了。从小到大做过各种各样的梦,我觉得次数最多,最离谱的就是我每次想考一个好大学,我要从小学开始读,小升初,初升高,高升大学。每次醒来我就觉得怎么这么麻烦呢?直接高三复读或
- 84、【情商】轻松快乐生活的秘密(三)
简单15513012298
生命是由思想组成的。要想改变结果得先改变行动,要改变行为先改变思想。轻松快乐生活的秘诀我们昨天说了一个人感到累或者疲劳,最主要的原因是情绪或者精神上的那种倦怠感。你说人的情绪能对身体产生那么大的影响吗?我们举一个例子:比如有个小伙子工作一整天非常的忙碌,回家的路上就昏昏欲睡,自己感觉精疲力尽,疲惫不堪……也真的觉得头也疼,背也疼,不想吃饭,只想上床睡觉,而且疲劳的觉得自己得拽着猫尾巴才能上去床。这
- 流量
深度链诺惜
自然流量:关键字搜索可比价款,趋势热销款,普通商品公司搜索,图片搜索,就是客户通过主页的推荐和搜索进入的就叫自然搜索流量,搜索流量:千人千面每个人搜索结果显示的商品不一样,结果是根据他本人定制的展示页面搜索流量:流量加权分为4个等级等级1新搜索上线之日起,商品在过去30天没有交易等级2新搜索上线之日起,商品在过去30天交易大于0,通过搜索指数,商品3级类目下排名在60%以外等级3,新搜索在线上之日
- 7.17day10-90 #为减重10斤,每天做一件力所能及的事情 #复盘
慧媛麻麻
固定时间嗯嗯。轻断食用华为健康记录卡路里。多喝水,上1000ml,用手机响铃提醒自己昨天本来没有运动的,但是由于要践行打卡,运动的进度条没法骗人哈,所以还是运动哈,是啊,就如结果没法骗人一样,已经10天的,可是的我重量还那么坚挺着,再坚持轻断食试试,如果还不行,再试其他办法,一定可以在3个月内减重的。似乎有些焦虑了。
- Linux 定时器应用示例
1.运行结果2.程序#include#include#includeintcount=0;structitimervalt;voidtimer_handler(intsig){printf("timer_handler:signal=%d,count=%d\n",sig,++count);if(count>=8){printf("canceltimer\n");t.it_value.tv_sec=
- AI应用服务
SUPER5266
人工智能
AI大模型--AI应用,该如何和前端交互,呈现llm模型答复内容呢?向LLM大模型提问后,系统得先识别问题,再从数据网络找信息,接着推理出正确结果,还得防止模型“胡编乱造”(控制模型幻想)。有时多个智能体(agent)要一起处理,结果还得融合。这些步骤都是异步进行的,没法像传统应用接口那样实时出结果。为减少大模型结果延迟、提升用户体验,我们提供以下方案。方案1、轮询后端pedding结果到db或其
- AI Agent从零到精通:深度解析Workflow、Prompt、Multi-Agent Systems和RL Training
爱看烟花的码农
AIGCNLP人工智能prompt
1.AI智能体简介:从概念到应用1.1什么是AI智能体?AI智能体是一种自主智能体,能够根据用户输入的目标,自主规划、执行和优化任务,最终生成结果。它不同于传统聊天模型(如ChatGPT)的单次回答能力,而是能处理多步骤、工具依赖、动态调整的复杂任务。例如:任务:用户要求“撰写一篇关于AI伦理的文章”。智能体行为:搜索资料、整理信息、撰写草稿、校对优化,全程无需用户干预。制造业场景(ManuS):
- 是爱笑的女孩运气好,还是运气好的女孩才会笑?
周小周鹅仔
送孩子去游泳吧,看那些游泳运动员身材练的多好。送孩子去打篮球吧,打篮球能长高。送孩子...停!您怕是“误会”了游泳身材好和打篮球长的高这两件事,你以为游泳和打球可以练出身材、长高高。而真正的事实是,那些人因为身材好,在水里的阻力小,才会被选去游泳队。篮球运动员也是因为长得高,在比赛中会占据优势才会被选去篮球队。明白了吗?您倒果为因了,这带来的结果就是,您的预期只是妄念。这样说来,有这样一句话——“
- 心理表征
Miss冯点点
“每天写作200字+演讲1分钟”打卡第13天:《刻意练习》中提到:心理表征不只是学习某项技能的结果,还可以帮助我们高效学习如我观察学生之间学习的差距,很大程度上是取决于学生是否能够在一遍一遍的练习中,敏锐的察觉自己所犯的错误及时调整,有助于学生建立高效学习的心理表征,并为之做出反馈,成为学习中的优秀学生甚至是黑马。反之不太优秀的学生,可能需要依靠导师的帮助反馈,才能调整错误方向,建立心理表征。心理
- 《情商3.0》折页一RIA
顽伴高振裕
R:I:每个人每天都需要感受一下自己的情绪,分析一下情绪的来源,这样才能更好的链接自己。如果不去感受自己情绪,身体也可能会出现问题,比如焦虑不安、头痛等。所以要后天的培养自我意识,寻找更深层次的自己。A1:之前的工作强度很大,也不懂放权,很多事情觉得别人做得不好,就自己解决自己上。结果很少有自己的时间,晚上又特别多应酬。很长一段时间都是很暴躁的状态。有时候想想,为什么会这样?这不是我希望的我,一直
- Nginx负载均衡
510888780
nginx应用服务器
Nginx负载均衡一些基础知识:
nginx 的 upstream目前支持 4 种方式的分配
1)、轮询(默认)
每个请求按时间顺序逐一分配到不同的后端服务器,如果后端服务器down掉,能自动剔除。
2)、weight
指定轮询几率,weight和访问比率成正比
- RedHat 6.4 安装 rabbitmq
bylijinnan
erlangrabbitmqredhat
在 linux 下安装软件就是折腾,首先是测试机不能上外网要找运维开通,开通后发现测试机的 yum 不能使用于是又要配置 yum 源,最后安装 rabbitmq 时也尝试了两种方法最后才安装成功
机器版本:
[root@redhat1 rabbitmq]# lsb_release
LSB Version: :base-4.0-amd64:base-4.0-noarch:core
- FilenameUtils工具类
eksliang
FilenameUtilscommon-io
转载请出自出处:http://eksliang.iteye.com/blog/2217081 一、概述
这是一个Java操作文件的常用库,是Apache对java的IO包的封装,这里面有两个非常核心的类FilenameUtils跟FileUtils,其中FilenameUtils是对文件名操作的封装;FileUtils是文件封装,开发中对文件的操作,几乎都可以在这个框架里面找到。 非常的好用。
- xml文件解析SAX
不懂事的小屁孩
xml
xml文件解析:xml文件解析有四种方式,
1.DOM生成和解析XML文档(SAX是基于事件流的解析)
2.SAX生成和解析XML文档(基于XML文档树结构的解析)
3.DOM4J生成和解析XML文档
4.JDOM生成和解析XML
本文章用第一种方法进行解析,使用android常用的DefaultHandler
import org.xml.sax.Attributes;
- 通过定时任务执行mysql的定期删除和新建分区,此处是按日分区
酷的飞上天空
mysql
使用python脚本作为命令脚本,linux的定时任务来每天定时执行
#!/usr/bin/python
# -*- coding: utf8 -*-
import pymysql
import datetime
import calendar
#要分区的表
table_name = 'my_table'
#连接数据库的信息
host,user,passwd,db =
- 如何搭建数据湖架构?听听专家的意见
蓝儿唯美
架构
Edo Interactive在几年前遇到一个大问题:公司使用交易数据来帮助零售商和餐馆进行个性化促销,但其数据仓库没有足够时间去处理所有的信用卡和借记卡交易数据
“我们要花费27小时来处理每日的数据量,”Edo主管基础设施和信息系统的高级副总裁Tim Garnto说道:“所以在2013年,我们放弃了现有的基于PostgreSQL的关系型数据库系统,使用了Hadoop集群作为公司的数
- spring学习——控制反转与依赖注入
a-john
spring
控制反转(Inversion of Control,英文缩写为IoC)是一个重要的面向对象编程的法则来削减计算机程序的耦合问题,也是轻量级的Spring框架的核心。 控制反转一般分为两种类型,依赖注入(Dependency Injection,简称DI)和依赖查找(Dependency Lookup)。依赖注入应用比较广泛。
- 用spool+unixshell生成文本文件的方法
aijuans
xshell
例如我们把scott.dept表生成文本文件的语句写成dept.sql,内容如下:
set pages 50000;
set lines 200;
set trims on;
set heading off;
spool /oracle_backup/log/test/dept.lst;
select deptno||','||dname||','||loc
- 1、基础--名词解析(OOA/OOD/OOP)
asia007
学习基础知识
OOA:Object-Oriented Analysis(面向对象分析方法)
是在一个系统的开发过程中进行了系统业务调查以后,按照面向对象的思想来分析问题。OOA与结构化分析有较大的区别。OOA所强调的是在系统调查资料的基础上,针对OO方法所需要的素材进行的归类分析和整理,而不是对管理业务现状和方法的分析。
OOA(面向对象的分析)模型由5个层次(主题层、对象类层、结构层、属性层和服务层)
- 浅谈java转成json编码格式技术
百合不是茶
json编码java转成json编码
json编码;是一个轻量级的数据存储和传输的语言
在java中需要引入json相关的包,引包方式在工程的lib下就可以了
JSON与JAVA数据的转换(JSON 即 JavaScript Object Natation,它是一种轻量级的数据交换格式,非
常适合于服务器与 JavaScript 之间的数据的交
- web.xml之Spring配置(基于Spring+Struts+Ibatis)
bijian1013
javaweb.xmlSSIspring配置
指定Spring配置文件位置
<context-param>
<param-name>contextConfigLocation</param-name>
<param-value>
/WEB-INF/spring-dao-bean.xml,/WEB-INF/spring-resources.xml,
/WEB-INF/
- Installing SonarQube(Fail to download libraries from server)
sunjing
InstallSonar
1. Download and unzip the SonarQube distribution
2. Starting the Web Server
The default port is "9000" and the context path is "/". These values can be changed in &l
- 【MongoDB学习笔记十一】Mongo副本集基本的增删查
bit1129
mongodb
一、创建复本集
假设mongod,mongo已经配置在系统路径变量上,启动三个命令行窗口,分别执行如下命令:
mongod --port 27017 --dbpath data1 --replSet rs0
mongod --port 27018 --dbpath data2 --replSet rs0
mongod --port 27019 -
- Anychart图表系列二之执行Flash和HTML5渲染
白糖_
Flash
今天介绍Anychart的Flash和HTML5渲染功能
HTML5
Anychart从6.0第一个版本起,已经逐渐开始支持各种图的HTML5渲染效果了,也就是说即使你没有安装Flash插件,只要浏览器支持HTML5,也能看到Anychart的图形(不过这些是需要做一些配置的)。
这里要提醒下大家,Anychart6.0版本对HTML5的支持还不算很成熟,目前还处于
- Laravel版本更新异常4.2.8-> 4.2.9 Declaration of ... CompilerEngine ... should be compa
bozch
laravel
昨天在为了把laravel升级到最新的版本,突然之间就出现了如下错误:
ErrorException thrown with message "Declaration of Illuminate\View\Engines\CompilerEngine::handleViewException() should be compatible with Illuminate\View\Eng
- 编程之美-NIM游戏分析-石头总数为奇数时如何保证先动手者必胜
bylijinnan
编程之美
import java.util.Arrays;
import java.util.Random;
public class Nim {
/**编程之美 NIM游戏分析
问题:
有N块石头和两个玩家A和B,玩家A先将石头随机分成若干堆,然后按照BABA...的顺序不断轮流取石头,
能将剩下的石头一次取光的玩家获胜,每次取石头时,每个玩家只能从若干堆石头中任选一堆,
- lunce创建索引及简单查询
chengxuyuancsdn
查询创建索引lunce
import java.io.File;
import java.io.IOException;
import org.apache.lucene.analysis.Analyzer;
import org.apache.lucene.analysis.standard.StandardAnalyzer;
import org.apache.lucene.document.Docume
- [IT与投资]坚持独立自主的研究核心技术
comsci
it
和别人合作开发某项产品....如果互相之间的技术水平不同,那么这种合作很难进行,一般都会成为强者控制弱者的方法和手段.....
所以弱者,在遇到技术难题的时候,最好不要一开始就去寻求强者的帮助,因为在我们这颗星球上,生物都有一种控制其
- flashback transaction闪回事务查询
daizj
oraclesql闪回事务
闪回事务查询有别于闪回查询的特点有以下3个:
(1)其正常工作不但需要利用撤销数据,还需要事先启用最小补充日志。
(2)返回的结果不是以前的“旧”数据,而是能够将当前数据修改为以前的样子的撤销SQL(Undo SQL)语句。
(3)集中地在名为flashback_transaction_query表上查询,而不是在各个表上通过“as of”或“vers
- Java I/O之FilenameFilter类列举出指定路径下某个扩展名的文件
游其是你
FilenameFilter
这是一个FilenameFilter类用法的例子,实现的列举出“c:\\folder“路径下所有以“.jpg”扩展名的文件。 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28
- C语言学习五函数,函数的前置声明以及如何在软件开发中合理的设计函数来解决实际问题
dcj3sjt126com
c
# include <stdio.h>
int f(void) //括号中的void表示该函数不能接受数据,int表示返回的类型为int类型
{
return 10; //向主调函数返回10
}
void g(void) //函数名前面的void表示该函数没有返回值
{
//return 10; //error 与第8行行首的void相矛盾
}
in
- 今天在测试环境使用yum安装,遇到一个问题: Error: Cannot retrieve metalink for repository: epel. Pl
dcj3sjt126com
centos
今天在测试环境使用yum安装,遇到一个问题:
Error: Cannot retrieve metalink for repository: epel. Please verify its path and try again
处理很简单,修改文件“/etc/yum.repos.d/epel.repo”, 将baseurl的注释取消, mirrorlist注释掉。即可。
&n
- 单例模式
shuizhaosi888
单例模式
单例模式 懒汉式
public class RunMain {
/**
* 私有构造
*/
private RunMain() {
}
/**
* 内部类,用于占位,只有
*/
private static class SingletonRunMain {
priv
- Spring Security(09)——Filter
234390216
Spring Security
Filter
目录
1.1 Filter顺序
1.2 添加Filter到FilterChain
1.3 DelegatingFilterProxy
1.4 FilterChainProxy
1.5
- 公司项目NODEJS实践0.1
逐行分析JS源代码
mongodbnginxubuntunodejs
一、前言
前端如何独立用nodeJs实现一个简单的注册、登录功能,是不是只用nodejs+sql就可以了?其实是可以实现,但离实际应用还有距离,那要怎么做才是实际可用的。
网上有很多nod
- java.lang.Math
liuhaibo_ljf
javaMathlang
System.out.println(Math.PI);
System.out.println(Math.abs(1.2));
System.out.println(Math.abs(1.2));
System.out.println(Math.abs(1));
System.out.println(Math.abs(111111111));
System.out.println(Mat
- linux下时间同步
nonobaba
ntp
今天在linux下做hbase集群的时候,发现hmaster启动成功了,但是用hbase命令进入shell的时候报了一个错误 PleaseHoldException: Master is initializing,查看了日志,大致意思是说master和slave时间不同步,没办法,只好找一种手动同步一下,后来发现一共部署了10来台机器,手动同步偏差又比较大,所以还是从网上找现成的解决方
- ZooKeeper3.4.6的集群部署
roadrunners
zookeeper集群部署
ZooKeeper是Apache的一个开源项目,在分布式服务中应用比较广泛。它主要用来解决分布式应用中经常遇到的一些数据管理问题,如:统一命名服务、状态同步、集群管理、配置文件管理、同步锁、队列等。这里主要讲集群中ZooKeeper的部署。
1、准备工作
我们准备3台机器做ZooKeeper集群,分别在3台机器上创建ZooKeeper需要的目录。
数据存储目录
- Java高效读取大文件
tomcat_oracle
java
读取文件行的标准方式是在内存中读取,Guava 和Apache Commons IO都提供了如下所示快速读取文件行的方法: Files.readLines(new File(path), Charsets.UTF_8); FileUtils.readLines(new File(path)); 这种方法带来的问题是文件的所有行都被存放在内存中,当文件足够大时很快就会导致
- 微信支付api返回的xml转换为Map的方法
xu3508620
xmlmap微信api
举例如下:
<xml>
<return_code><![CDATA[SUCCESS]]></return_code>
<return_msg><![CDATA[OK]]></return_msg>
<appid><