Molecular profiling of long-term responders to immune checkpoint inhibitors in advanced non-small cell lung cancer
晚期非小细胞肺癌免疫检查点抑制剂长期应答者的分子特征分析
发表期刊:mol oncol
发表日期:2021 Apr
影响因子:6.574
DOI: 10.1002/1878-0261.12891
一、研究背景
肺癌因其发病率高、存活率低而成为全球癌症相关死亡的首要原因。幸运的是,免疫检查点抑制剂(ICI),已显示出巨大的疗效。然而,大多数患者对这种类型的免疫疗法没有反应,许多患者最终产生了耐药性。通过免疫组化评估PD-L1的表达是NSCLC中ICIs一线治疗决策的唯一有效测试。
肿瘤突变负担(TMB)也与一些肿瘤类型如黑色素瘤和肺癌的ICIs反应相关。与ICI有关的较少被探索的特征是肿瘤的体细胞拷贝数改变(SCNA)负担。研究通常只关注一种或两种生物标志物。因此,有必要进行综合研究来分析同一组个体中的多种分子生物标志物,这些个体表现出较长的反应时间,以了解ICI相关的长期获益。
二、材料与方法
1 数据来源
1)发现集:47名诊断为晚期NSCLC并接受ICI单药治疗的患者
2)验证集:队列1:cBioPortal下载的非小细胞肺癌MSKCC队列(NSCLC-MSK);队列2:PRJEB24995
3)不同文章中收集肿瘤中T细胞活性相关的一般转录特征、不同免疫细胞群的基因表达特征
2 分析流程
1)全外显子组测序
2)测量突变、SCNAs
3)TMB和SCNAs负载计算:肿瘤突变负荷计算为每个样本所有外显子非同义突变、插入和缺失的总和;每名患者的SCNAs负荷计算为受SCNAs影响的所有基因组区域的大小之和
4)基因表达评估:通过Nanostring进行基因表达,按照Nanostring基因表达数据分析指南对Nanostring结果进行标准化(PUMBED ID:28487385)
5)特征值计算:每个样本的每个特征的值被计算为特征中所有基因表达值的几何平均值,通过减去队列中签名的平均值并除以标准差,对每个签名的所有样本的值进行标准化
6)统计分析:Mann-Whitney-Wilcoxon(MWW)test、生存分析、单变量cox、多变量模型、相关性分析
三、结果展示
01 - 肿瘤固有特征及对ICI的反应
对所有47名患者的肿瘤样本及其配对正常样本进行了全外显子组测序。经过适当的质量控制,发现44个样本适合进一步分析。作者确定了这44个样本的TMB,并将其与不同的临床特征包括组织学、性别、吸烟状态和药物的靶点相关联(图S1)。有吸烟史的患者所呈现的TMB显著高于从未吸烟者。
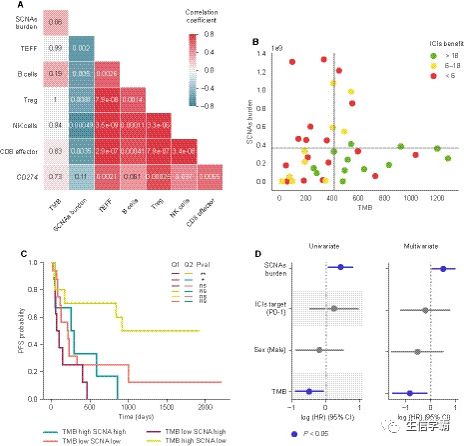
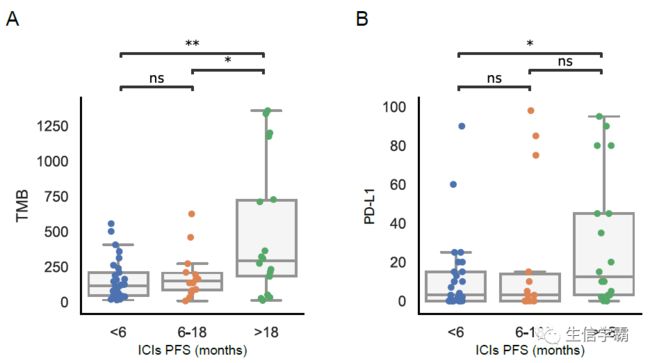
接下来探究TMB与ICI反应之间的关联。呈现持久临床获益(PFS>6个月)的患者的TMB略高于无临床获益的患者(图1A)。然后根据患者的PFS将其分为三组:无获益(<6个月)、中度获益(6-18个月)和长期获益(>18个月)。在比较各组TMB分布时,长期获益的患者TMB大大高于中度或无获益的患者,而这两组之间无统计学意义上的差异(图1B)。此外,将患者分层为TMB分层的Kaplan-Meier分析表明,上层分层的患者比下层分层的患者的PFS更长(图1C)。
体细胞拷贝数改变负担也被报道影响ICIs的反应。为了确定其在发现队列中的重要性,首先推断那些具有足够肿瘤纯度的样本(40个样本)的SCNAs,并计算基因组所有改变区域的大小之和。然后,将这个分数与患者的PFS相关联。当将患者分层为上述定义的三类获益时,尽管可以观察到那些临床获益的患者往往具有较低的SCNAs负担,却没有观察到统计学上的显著差异(图1D,E)。Kaplan-Meier分析根据患者肿瘤的SCNAs负担将其分为分层,结果显示,上层分层的患者的PFS比中层和下层分层的患者有显著的缩短(图1F)。这些数据表明,高水平的SCNAs与PFS下降相关,而中等和低SCNAs水平的患者对ICI的反应没有呈现差异。
最后,评估了单个基因的突变或拷贝数改变是否与反应相关,结果没有发现与反应显著相关。还探讨了已知肺癌相关基因和与ICIs反应相关基因的体质改变分布(图1G)。然而,没有发现任何一个基因在任何一组中显著富集。
02 - 肿瘤免疫相关的转录信号和对ICI的反应
肿瘤内浸润的免疫细胞的数量和类型被认为会影响对ICI的反应。通过使用富含免疫相关基因转录物的Nanostring面板从22名患者的活检中获得RNA表达数据,评估了与激活的T细胞相关的转录标志是否与ICIs反应相关。事实上,与缺乏获益的患者相比,具有临床获益的患者表现出更高水平的这些信号;一些具有统计学意义,而另一些则接近于显著性(图2A,图S2A,S2B)。当将患者分层为三类获益时,没有观察到中度和长期获益之间的差异(图2B,图S2A,S2B),这表明图2A中的结果不可能仅由长期反应者驱动。
由于Nanostring面板涵盖了广泛的基因转录物,接下来分析了免疫细胞类型特异性信号,发现B细胞、CD8有效细胞、自然杀伤力和T-reg在受益患者中显著富集,而M2巨噬细胞或其他与免疫抑制微环境相关的评分在两组之间是平衡的,甚至表现出在非应答者中更高的趋势(图2C,D,图S2B,S2C)。
最后,从Nanostring数据中检查了这22名患者的CD274(PD-L1)表达,发现高水平的CD274表达与临床获益相关(图2E)。将获益分层为中度和长期,发现与无获益的患者相比,高CD274表达水平在长期反应者中最为明显(图2F)。对于少数有Nanostring数据的患者,还可以通过免疫组化检测PD-L1的表达。在这些患者中,CD274和PD-L1之间的相关性很高(图S2D)。
03 - 肿瘤内在特征与肿瘤外在特征的相互作用
为了更好地了解对ICI反应的决定因素,作者还研究了肿瘤内在和肿瘤微环境的免疫特征之间的相互作用。发现SCNAs负担与评估的大多数免疫相关的转录标志呈负相关,但与CD274(PD-L1)表达无关,而TMB似乎与所有分析的特征无关(图3A,图S3A,S3B)。
由于TMB和SCNAs负担很可能是独立的,接下来评估了它们的组合如何与ICIs获益相关。将患者的TMB、SCNAs负担和PFS表示出来,然后以SCNAs负担和TMB平均值作为阈值将队列分为四组。该分析显示,几乎所有长期应答者都具有高于平均水平的TMB和低于平均水平的SCNAs负担,而肿瘤呈现相反特征的患者为非应答者(图3B)。另外,中等获益的患者往往具有高TMB或低SCNAs负担,但不是两者都有(图3B)。还观察到3名呈现高TMB和低SCNAs负担的患者没有从ICIs治疗中获益。
此外,基于这四类患者的Kaplan-Meier分析表明,高TMB和低SCNAs负担的患者比低TMB和高SCNAs负担的患者表现出更长的PFS,高TMB和高SCNAs负担的患者比低TMB和低SCNAs负担的患者表现出有统计学意义的更长的PFS(图3C)。无论TMB水平如何,高SCNAs负担似乎都会缩减获益的持续时间,因为没有一个反应突出的患者表现出高SCNAs(图3C)。
最后,将TMB和SCNAs负担作为连续变量,与患者的性别和ICIs的目标一起,整合到一个由组织学和吸烟状态分层的多变量Cox比例危险模型中。该分析表明,即使通过潜在的混杂因素进行校正,TMB和SCNAs的组合也与ICIs的反应显著相关(图3D)。
重要的是,当使用患者的总生存期(OS)--而不是PFS--作为获益的衡量标准进行上述分析时,也得到了类似的结果(图S4A,S4B)。
04 - 通过分析可公开获得的数据进行验证
NSCLC对ICI的长期反应者的分子表征仍然很差,事实上,使用基因组和转录组数据的综合研究几乎不存在。作者试图通过重新分析一个公开的队列(NSCLC-MSK)来验证本研究中的一些发现。值得注意的是,TMB和SCNAs负担(在原稿中称为基因组改变分数(FGA))都是通过基因组面板估计的,由于面板中包括的基因组分数的大小和包括的基因类型(主要是癌症相关基因)可能不如WES或全基因组测序准确(特别是在估计SCNAs负担时)。
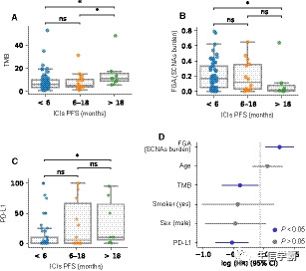
根据患者的PFS将患者分层为三类(无获益、中度获益和长期获益),就像在图1B,E中所做的那样。正如发现队列所观察到的那样,长期受益的患者的TMB大大高于中度或无受益的患者,而这两组之间没有统计学上的显著差异(图4A)。此外,长期应答者的PD-L1表达量和SCNAs负担大大高于无获益的患者(图4B,C)。
对发现队列进行的综合分析(图3A)表明,结合TMB、SCNAs负担和PD-L1表达的潜在价值。在发现队列中,由于具有CD274(PD-L1)基因表达数据的患者数量减少,所以没有建立这样的模型,但可以使用NSCLC-MSK队列创建它。因此,将TMB、SCNAs负担和PD-L1表达以及其他临床相关特征纳入多变量Cox比例危险模型,该模型按肿瘤组织学分层。分析表明,这三个特征都与患者的PFS有统计学意义(图4D)。
最后,使用队列2,用PD-1加CTLA-4阻断治疗,进一步验证了长期应答者中TMB和PD-L1水平的增加(图S5A,S5B)。
四、结论
本研究数据表明,高TMB与ICI的持久临床获益有适度关联,而它与长期反应密切相关。相反,高SCNAs负担则表明缺乏反应。此外,从ICIs治疗中获益的患者呈现出更高水平的免疫浸润标志,CD274表达在长期应答者中特别高。TMB与SCNAs负担或肿瘤免疫浸润无关,两者呈负相关。将TMB和SCNAs负担结合起来,可以比单独的每个特征更好地分辨ICI相关的长期获益患者。还观察到TMB在ICI长期应答者中强烈富集,并在两个独立的队列中得到了验证,提示TMB可能是长期获益的生物标志物,而不是持久的临床获益(6个月的PFS)。最后,利用NSCLC-MSK队列,描述了TMB、SCNAs负担和PD-L1与ICIs治疗后的临床获益显著相关。