分享来自nature plants关于柑橘自交不亲和进化的一篇文章:Evolution of self-compatibility by a mutant Sm-RNase in citrus
自交不亲和(SI)是防止开花植物自花受精和近亲繁殖的重要机制。最普遍的SI系统利用S核糖核酸酶(S-RNases)和S位点F-Box (SLFs)作为S决定因子。在柑橘中,SI是原始的,而柚是自交不亲和的,而宽皮柑橘及其杂种是自交亲和的(SC)。在此,我们在柚中鉴定了9个高度多态的雌蕊特异性,且发育时期表达的S-RNases,它们以配子体方式与S单倍型共分离,并与真正的S-RNases聚在一起。提供证据表明,这些S-RNases在柑橘中起着雌性决定因子的作用。此外,我们还发现每个S-RNase与大约9个SLFs相连锁。通过对117个柑橘SLFs和类SLF(SLFL)基因的分析,我们发现它们共分为12个类型,并且S-RNases与单倍体内的SLF和SLFL基因共同进化。我们的数据支持这样的观点:柑橘有一个S位点,该位点包含一个S-RNase和几个符合非自我识别模型的SLFs。我们在自交亲和柑橘中,发现一个单核苷酸突变Sm-RNase,并且它使得S-RNase的自然功能得以丧失。我们发现,由Sm-RNase引起的SI向SC转变最初出现在宽皮柑橘中,并向其杂交后代扩散并固定下来。利用基于以S-RNase的SI系统,鉴定了一个进化上遥远的新类型,该类型与最近的S-RNase家族相隔了1亿年以上,这是进化比较研究的一个里程碑。
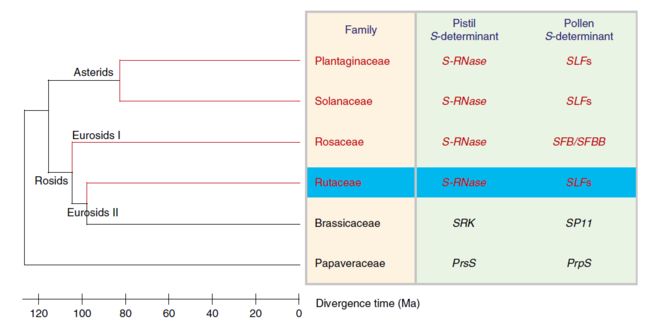
自交不亲和(SI)是开花植物用来防止近亲繁殖和促进异交的一种主要遗传机制。SI通常由一个单倍型的S位点控制,该位点携带两个紧密相连的S基因:花粉和雌蕊S决定因子。茄科、蔷薇科和车前科植物均为配子体型自交不亲和 (GSI),其S基因型由单倍体花粉决定。在这些家族中,雌性S决定因子是由雌蕊中表达的III类S-核糖核酸酶(S-RNase)所编码。因此,这个系统也被称为基于S-RNase的SI。基于S-RNase的SI花粉S决定因子通常包括多个S位点F-box (SLF)基因。基于S-RNase的SI系统的家族具有相同的起源,是75%被子植物家族的祖先;因此,基于S-RNase的SI被认为是绝大多数被子植物的原始状态。
芸香科柑橘属果树,是全球重要的经济作物。由于大多数柑橘属多年生木本果树,童期较长(从种子到开花需要5-10年),因此涉及杂交的研究非常耗时。尽管如此,授粉实验已经证实许多柑橘属植物是自交不亲和的。这与它们是长期多年生植物是一致的;也就是说,繁殖的保证不是问题,而生殖保障被近亲繁殖累积的有害影响所抵消,所以它们通常是相互矛盾的。此外,柑橘利用孢子体无融合生殖,这是一个无性繁殖的过程,导致由体细胞的珠心细胞形成种子。杂交实验数据表明,柑橘的SI是由一个具有多个S等位基因的单一共显性S位点控制的。由于在柑桔属植物中发现了许多S-RNase同系物,因此推测柑橘也可能是基于S-RNase的SI系统。然而,目前没有证据表明这些基因在柑橘中起决定作用。
在一个大的SI群体中,S等位基因的多样性是通过负频率依赖选择来维持的,因为具有罕见S单倍型的花粉比具有普通S单倍型的花粉具有更多潜在的亲和雌蕊。然而,当亲和花粉或传粉者数量有限时,自然选择倾向于将SI转变为自交亲和(SC),因为自交亲和为繁殖提供了保证。自交不亲和系统的打破在基于S-RNase的SI系统中很常见,并且可能涉及S-RNase和SLF基因或非S决定因子的基因复制或突变。
在这里,我们证明了柑橘类自交不亲和是基于S-RNase的配子体型自交不亲和,并且在每个S位点上都有一个与多个SLFs连锁的S-RNase。值得注意的是,我们发现了一个突变的S-RNase, Sm-RNase,它决定了柑橘中SC的转变。这种SI-SC转变首先发生在宽皮柑橘中,然后在它的杂交品种中传播。由于柑橘属植物与其他基于S-RNase的SI系统的科属植物距离较远,因此我们的发现为这一普遍存在的SI系统的进化提供了新的见解。
Results
以往的研究表明,日本产的一些柚子(Citrus maxima)主要为异交,它们的自花受精障碍是由SI决定的。为了检验这一结论是否适用于中国柚子,对在中国广泛种植的9个柚子品种进行了人工授粉,包括自花授粉和异花授粉(补充表1和2)。在没有授粉的情况下,四个柚子种质(HB、WB、SJ和GX)产生了无籽果实,从而确定它们为单性结实(补充表2)。所有的异花授粉都坐果并结实,每个果实的平均种子数量是121±7,而自花授粉则没有结实(补充表2)。由于这些中国柚子的花粉和雌蕊均具有完整的功能,而在异花授粉时能结实,这为它们是自交不亲和提供了很好的证据。
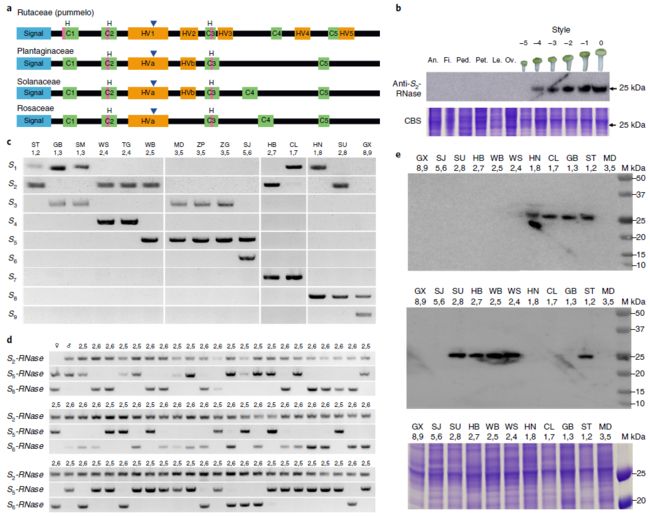
柚子中雌蕊特异性表达S-RNase基因的鉴定. 我们构建了64个中国柚子花柱和花药的RNA测序(RNA-seq)文库(补充表3)。由于之前的研究表明柚子有候选的S-RNase基因,我们对此进行了进一步的研究。并鉴定了9个候选的S-RNase基因,它们均具有完整的开放阅读框,并且与以前报道的S-RNase具有同源性。我们将这些基因命名为Sn-RNase, n表示S单倍型(即S1-RNase到S9-RNase)。它们的全长互补DNA序列包含660 bp到699 bp的编码区(补充图1),并编码高度多态性的蛋白质(氨基酸同源性为38.1-76.7%;补充图2)。其预估的分子质量(介于22.96kDa24.47kDa之间)和碱性等电点(7.679.39;补充表4)与已知S-RNases类似。高度多态的柑橘类序列包含已知功能S-RNases的关键特征(图1a;补充图2)。然而,将这些序列与已知S-RNases进行比较后发现,尽管C2和C3结构域相对保守(包括参与催化作用的组氨酸残基),其他结构域在物种间的保守性较差(补充图2)。在所有9个柑橘S-RNases中都保留了一个额外的组氨酸残基,但并没有出现在其他S-RNases中。柚子S-RNases完全保留了5个变异度高的区域,其中2个对应于其他物种中的HVa和HVb高变结构域,但另外3个是柚子中所独有的(补充图2和图3)。系统发育分析显示,柚子S-RNases与真正的S-RNases聚集在一起,但在一个单独的分支上(补充图4)。这提供了良好的证据表明这些高度多态的柚子序列可能S-RNases。
我们调查了这9个S-RNase基因在自然柚子种群中的分布,该种群由来自中国不同省份的391份资源组成(补充图5a)。这些种群的S单倍型很丰富,这9个S单倍型覆盖了种群中76.2%的种质,其单倍型频率在2.3%到30.2%之间(补充图5b)。这种模式与S-决定基因所利用的负频率依赖性选择是一致的。
通过反转录定量PCR (qRT-PCR)和蛋白质印记(补充图6a-c)对各种组织的分析表明,9种柚子S-RNases在花柱中特异性表达。尽管花柱中转录水平在开花前5天最高,开花后下降,但蛋白质印记显示在这一阶段无法检测到该蛋白。但在开花期前4天检测到该蛋白,且蛋白水平逐渐升高,直至雌蕊成熟(图1b;补充图6c)。因此,这些柑橘S-RNases表现出一种S决定因子所期望的组织和发育特异性。
柚S-RNases以GSI方式与S单倍型共分离.** 根据授粉和苯胺蓝染色确定了15个柚子的S基因型(补充图7;补充表5)。由于很多检测的柚子品种都包含9种已鉴定的S-RNase,因此使用S-RNase等位基因特异性PCR引物鉴别特定的S等位基因(补充表6)。这表明,S1到S9-RNases对于其指定的S等位基因具有独特的扩增作用,在15个柚子序列中,每个序列都有一对对应于该特定基因型的S-RNase带(图1c)。
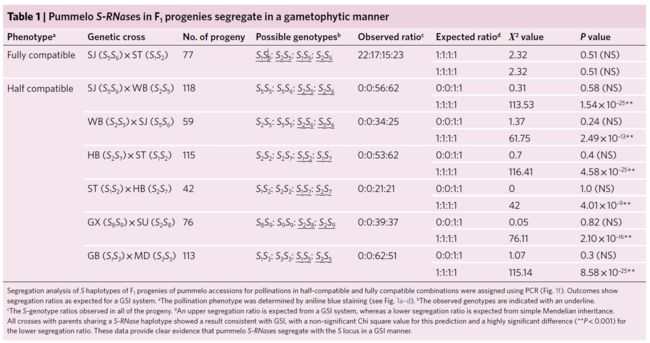
为了证实我们鉴定的这些S-RNases如预期的那样在遗传上分离,我们使用PCR来确定这些植物后代的S基因型(T1代;图1d;表1)。对于半亲和性(例如,SJ×WB杂交,S5S6×S2S5),指定给亲本的S-RNases等位基因和118个后代S-RNase基因型(经PCR鉴定)被分为两个预期类别,而且没有观察到其他基因型(即不存在S5S5和S5S6基因型)。所有的118个T1植株均具有预期1:1的比例,即S2S5(56株)或S2S6(62株)基因型(χ2 = 0.31,P = 0.58;表1)。他们缺乏S5S5或S5S6基因型,这表明只有S2花粉与S5S6雌蕊相亲和,这与GSI系统的预期一致。双向杂交(WB×SJ)得到的59个T1后代具有S2S6或S5S6基因型,其比例为1:1(χ2 = 1.37,P = 0.24)。在其他测试中也观察到这种半亲和性,其亲本具有共同的S等位基因(表1)。对于一个完全亲和的杂交组合(SJ×WB杂交,S5S6×S1S2),鉴定了4个S基因型,并按预期1:1:1:1比例进行分离(χ2 = 2.32,P = 0.51;表1)。这些数据提供了基于遗传学的证据,证明这些授粉的结果如预期的GSI系统一样分离。此外,还表明,指定的S基因型的柚S-RNases在S位点上如预期的S等位基因那样分离。针对重组的S1-RNase和S2-RNase产生的抗体也证实了克隆的S-RNase的产物与通过授粉指定的S等位基因相关(图1e)。
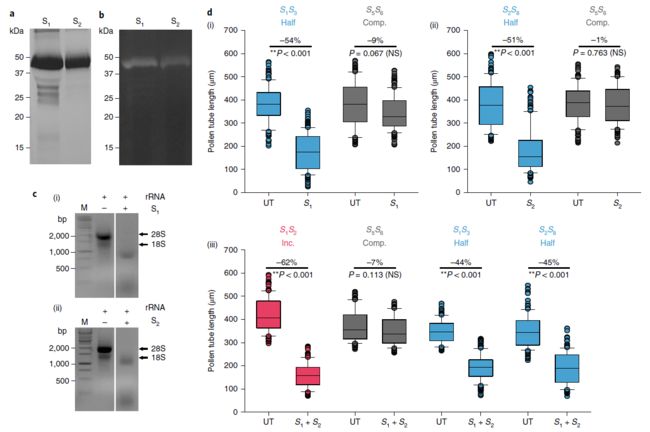
柚子中S-RNases对S特异性花粉起抑制作用.** 我们将重组的柑橘S1-RNase和S2-RNase表达为谷胱甘肽S-转移酶(GST)融合蛋白(图2a),并证实它们具有RNase活性(图2b, c)。为了确定这些S-RNases是否在柑橘中作为S决定因子起作用,我们在体外检测了这些融合蛋白是否能特异性地抑制不亲和花粉管的生长(图2d;补充图8和9)。我们使用了一种类似于Papaver SI的生物测定方法。虽然本实验不能完全模拟体内花粉与雌蕊的相互作用,但它确实提供了一种由雌蕊决定因子所表现出的对S特异性花粉抑制活性的测量方法。由于杂合植物的花粉由两个S单倍体组成,所以单个重组S-RNase会引起半不亲和反应(即50%的花粉管生长受到抑制)。与未处理的对照(花粉基因型S5S6,仅9%受到抑制,灰色条,P = 0.067,不显着(NS);图2d(i))相比,重组S1-RNase-GST蛋白对S1S3基因型植物花粉管的抑制作用约为54%(半亲和性;P < 0.001,蓝色条,图2d)。与未处理组相比,S2-RNase-GST对S2S8基因型花粉管的抑制作用约为51% (P < 0.001),而与之匹配的花粉基因型为S5S6(图2d,灰色条)同未处理组相比,仅抑制了1% (P = 0.763 (NS);图2d (ii))。与未处理的花粉管相比,重组S1-RNase和S2-RNase融合蛋白可使S1S2基因型(不亲和的组合)的植物花粉受到约62%的抑制作用 (P < 0.001)。相同的蛋白质降低了对S5S6基因型植物花粉的抑制活性,与未处理的对照相比,其花粉管长度减少了7% (P = 0.113 (NS))。S1-RNases和S2-RNases联合对S1S3和S2S8基因型植物的半亲和性花粉具有中间效应,与各自未处理的对照相比,它们的花粉管长度分别平均减少了44%和45% (P < 0.001)。总之,这些数据为S-RNases具有S特异性的花粉抑制活性提供了证据。这些数据还表明,尽管柚子花粉管生长程度与体内不同(可能是因为体外缺乏关键的雌蕊成分),尽管重组蛋白具有某些非特异性抑制活性,但不同单倍型花粉受到重组S1-RNase和S2-RNase融合蛋白的特异性和差异性影响。尽管它们可能无法准确反映出体内的情况,还需要进一步的研究来验证它们如何代表体内的反应,但这些数据表明,在此鉴定的柚子S-RNase基因可以诱导不亲和花粉的S特异性抑制,并为其作为雌性S决定因子的遗传证据提供了验证数据。
与S-RNase基因连锁的SLF基因的鉴定.** 在其他S-RNase SI系统中,S位点具有雄性的S决定因子F-box蛋白,与雌性的S决定因子S-RNase连锁。为了鉴定花粉的决定因子,我们从一个带有S1S2基因型的柚子种构建了一个覆盖S1和S2位点的细菌人工染色体 (BAC)文库(补充表7)。组装了大约240 kb的S1基因座和大约198 kb的S2基因座。对S1-和S2-等位基因序列的Harr图分析表明,S位点的两端基本上是同位的,而其余的区域则高度特异(补充图10)。每个S位点有12个与其相关的F-box基因,以及包括转座子在内的其他基因(补充表8和9),其中S1位点上的F-box基因具有33.6-74.2%的氨基酸同源性,与S2位点上的F-box基因具有33.5-73.9%的氨基酸同源性。9个F-box基因在两个S位点间序列差异较大(推测的氨基酸同源性为78.1-93.7%),3个F-box基因高度保守(推测的氨基酸同源性为99.5-99.7%),其可能为SFL-like (SLFL)基因。
RNA-seq分析显示,所有的SLFs均在花药中特异性表达(补充图11),qRT-PCR证实了这一点,并鉴定了SLFs在花药、花粉和花粉管中的表达(补充图12)。连锁分析证实,来自具有S1-RNase的分离植株表达了S1-SLF1至S1-SLF9,而具有S2-RNase的分离植株则表达了S2-SLF1至S2-SLF9(补充图13a,b)。这表明SLFs是柚子中的花粉S决定因子。
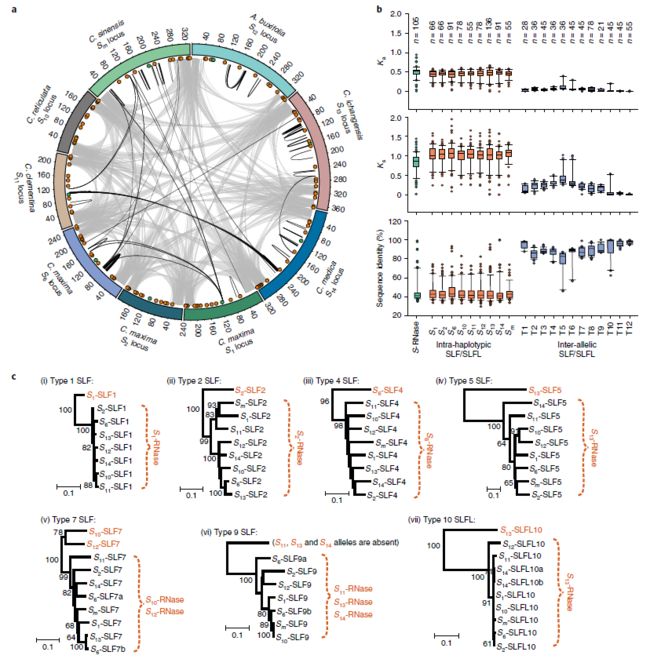
柑橘中S位点的鉴定. 基于S位点两端的两个保守序列,我们从报道的7个柑橘基因组中确定了另外的7个S位点。S位点的大小从198kb到370kb不等,每一个S位点都包含一个S-RNase和11-17个SLF或SLFL基因(图3a;补充图14)。对117个SLF和SLFL基因的分析表明,它们共分为12个类型。我们将每个位点的F-box命名为Sn-SLFx或Sn-SLFLx(其中n表示S单倍型,x表示类型;补充图15)。花粉和雌蕊的S决定因素应表现出共同进化的证据。检测同义(Ks)和非同义(Ka)替代率显示,那些S-RNases (k = 0.814, Ka = 0.503)和每个SLF/SLFL类型(k = 0.977 - 1.047, Ka = 0.422 - 0.461)相似,且远高于每种SLF/SLFL类型的等位基因间Ka和Ks值(k = 0.015 - 0.476, Ka = 0.009 - 0.156;图3 b)。这些数据表明,S-RNase和单倍型内的SLF基因是共同进化的,可能也同样古老。
与矮牵牛相似,柑橘SLF和SLFL蛋白在不同类型间存在广泛的多态性(44.24-46.52%的同源性),而各类型等位基因变异之间的序列同源性更为保守(74.78-97.49%的同源性;图3b)。SLF序列的聚类,以及等位基因间的单倍型内差异和等位基因间差异与S-RNase/SLF进化的非自我识别模型一致,该模型提出,在每个单倍型中,有一个缺失、突变或发散的SLF基因可以预测特定的S-RNase。在每个SLF的“类型”中,氨基酸序列多态性各不相同,我们观察到一些等位基因具有较高的序列保守性,另一些等位基因具有中度保守性(图3c;补充表10)。非自我识别模型预测S-RNase是非自我SLFs的靶标;因此,在柑橘S1型SLF组中,S1-SLF1是分化最严重的,因此预测较为保守的SLF1蛋白(S2-,S6-,S13-,S12-,S14-,S10-,S11-SLF1)以S1-RNase为靶标;图3c;补充表10)。在矮牵牛中,SLF拷贝数从0到2不等。我们还发现了SLF蛋白的缺失。在S9型SLFs中,S11-、S13-和S14-SLF9等位基因缺失;此外,在同一类型中经常发现SLF具有两个拷贝(图3c;补充图15)。
我们的数据表明,S-RNase基因和单倍型内的SLF和SLFL基因可能是共同进化的,而来自每个类型的等位基因间的SLF和SLFL基因的分化是最近才出现的。总之,我们的发现与S-RNase/SLF进化的非自我识别模型一致。这一机制已被证实在具有S-RNase和SLFs的物种中发挥了作用,并被证实在SI中起S特异性抑制作用;因此,我们的研究结果有助于证明柚子中的SI可能是由作为S决定因子的S-RNase和SLF基因控制的。
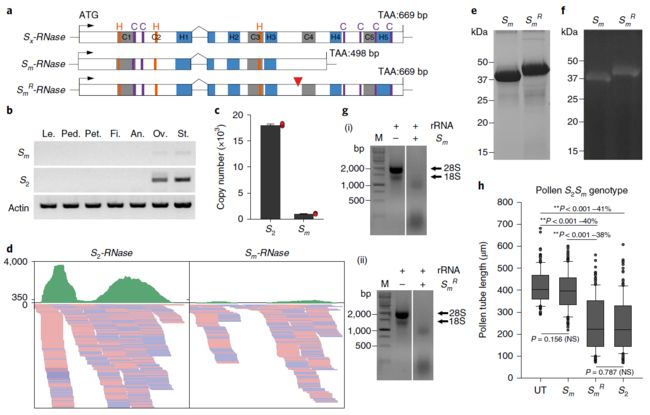
柑橘中决定亲和性的突变型Sm-RNase的鉴定.在15个已鉴定的S-RNases中,我们意外的发现了一个来自甜橙的且比其他编码序列短的S-RNase(补充图16)。该基因的克隆揭示了(命名为Sm-RNase)443位单核苷酸的缺失,并导致移码突变,并在498位出现提前终止密码子(图4a;补充图16)。截短预测的Sm-RNase蛋白含有催化作用的组氨酸残基,但缺少C4和C5保守结构域、HV4和HV5高变结构域以及4个保守半胱氨酸残基(图4a)。
由于该Sm-RNase的非突变前体在我们的研究中未被发现,因此我们通过在缺失的位置插入一个单一的腺嘌呤,设计了一个“恢复”版本(称为SmR-RNase)。S1-RNase与Sm-RNase的序列在这个位置上最为接近,均具有腺嘌呤;预计这将导致正常的转录长度(图4a;补充图17)。
我们假设截短的Sm-RNase是造成SC品种中SI功能缺失的原因。我们首先检测了Sm-RNase的mRNA表达水平,因为SC在其他物种中表达水平较低。对一系列组织的分析表明,与S2-RNase相比,Sm-RNase的表达最低(图4b)。绝对定量qRT-PCR证实,Sm-RNase转录本的表达显著降低(图4c;补充图18),RNA-seq证实了这一点(图4d)。这些数据表明SC表型可能是由于Sm-RNase转录水平的降低所导致。接下来,我们表达了重组的Sm-RNase-GST和SmR-RNase-GST融合蛋白(图4e)。两种融合蛋白都表现出RNase活性(图4f,g),因此SC不能归因于这种活性的缺失。
为了进一步测试Sm-RNase突变如何赋予柑橘的自交亲和性,我们测试了Sm-RNase-GST重组融合蛋白的活性及其功能恢复型SmR-RNase-GST融合蛋白在S2Sm基因型花粉上 (half-compatible组合,不存在纯合子的植物)进行了体外生物测定(图4h;补充图19)。重组Sm-RNase-GST融合蛋白与未处理组相比,对花粉管生长无明显抑制作用(P = 0.156 (NS),方差分析(ANOVA))。Sm-RNase花粉抑制活性的缺乏表明,这种突变可能是SC表型的原因。由于Sm-RNase不包含HV4和HV5高变区,因此其特异性可能存在于此。
为了支持这一观点,一个预测的结构分析表明这些区域位于蛋白质的表面(补充图20)。相比之下,用功能恢复型SmR-RNase-GST蛋白处理S2Sm基因型植物的花粉,导致花粉管生长受到抑制,与Sm-RNase相比其花粉管长度显著降低(** P < 0.001,ANOVA),并且与S2-RNase-GST融合蛋显示的花粉抑制活性没有显著差异(P = 0.787 (NS),ANOVA)。此外,由于功能恢复型SmR-RNase表现出一定的花粉抑制活性,这与该基因的截短可能是导致其活性丧失及产生SC表型的原因是一致的。因此,尽管Sm-RNase是一种功能性的RNase,但它并不表现出S特异性的花粉抑制活性。然而,由于SC材料中Sm-RNase的表达几乎为零,我们不能得出缺乏花粉抑制活性是SC表型的原因。
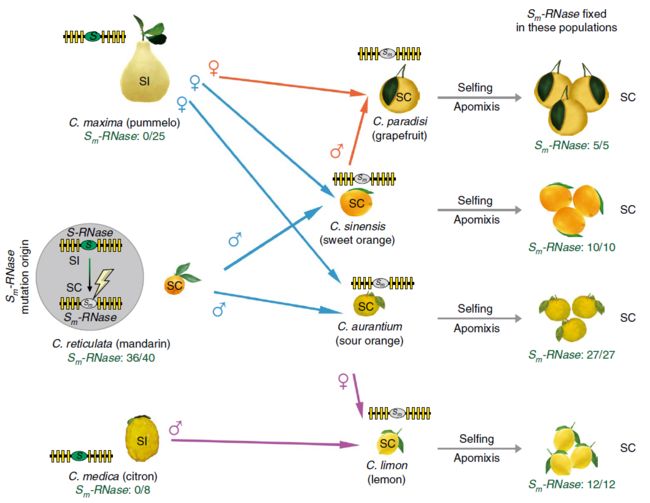
SI和SC在柑橘中的演变. 我们通过将配对序列映射到已鉴定的15个S-RNases上来检测153个柑橘种属的S单倍型的频率(补充表11)。这15个S-RNase存在于这些柑橘种属的132个基因序列中。每个S-RNase都发生在一个较低的频率上,这与通过负频率依赖选择来维持它是一致的(补充图21)。通过分析这15个S-RNase之间的关系来研究探讨它们是如何在柑橘类物种中传播的,结果发现S-RNase的系统发育与之前描述的柑橘类的系统发育不一致(补充图22),这表明这些S-RNases的分化发生在柑橘分化之前。
90份材料中均含有Sm-RNase(补充图21)。所有具有Sm-RNase的种质均表现为SC,而所有的SI材料中都没有Sm-RNase(补充图23)。宜昌橙(Ichang papeda),一种古老的近柑橘类植物,其表现为自交不亲和(附图24),其分化早于亲和的宽皮柑橘及其杂交种。这表明SI具有(预期的)祖先特征。因为在野生和栽培的宽皮柑橘及其杂交种中均发现了Sm-RNase(补充图23),这表明SI向SC的转化最初出现在宽皮柑橘中,然后通过交配或渐渗扩散到其杂交种中(图5)。数据显示,Sm-RNase在杂交种柑橘种群中是固定的;然而,这种SI向SC的转变是如何固定的还不清楚,但是自交和无融合可能起到了一定的作用,自交和无融合生殖使育种者能够固定有价值的性状和杂合性。
Discussion
迄今为止,对S-RNase为基础的SI系统的研究仅限于蔷薇科(Rosids)、茄科(Solanaceae)和车前科(Asterids)(图6)。在这里,我们鉴定了几种来自柚雌蕊表达的多态性S-RNase,并证实了它们与S单倍型共分离。我们提供了有力的证据,证明柑橘利用基于S-RNases的SI系统,并且S-RNases作为雌蕊S决定因子,以S-特异性的方式抑制花粉。在系统发育上,S-RNases存在于几个不同的家族中;然而,这个SI系统是否进化了几次仍然存在争议,尽管在过去的25年里,假定的S-RNases已经在茜草科中被发现,但几乎没有S-RNases家族在SI中发挥作用。我们在柑橘中鉴定了一个功能性S-RNase SI系统,该系统是在约1.1亿年前从茄科植物种分化而来(图6),在这些家族分化之前,这支持了S-RNase是单一起源的观点,且作为一个共同的祖先比三个独立的S-RNase更有可能。
与其他具有雌性和雄性S决定因子且显示共同进化关系的SI系统相比,茄科和苹果亚科的S-RNases和SLFs没有显示这一点。相反,它们利用一个协同的“非自我识别”系统。在这种情况下,花粉的特异性需要多个SLFs。这是因为功能性S单倍型无法编码识别自身S-RNase的SLF;因此,可以利用该SLF类型的分离或删除等位基因。因此,在S单倍型中,每种类型SLF的产物与一组非自体S-RNase相互作用,这些非自体S-RNases被共同识别及解除毒性作用。我们对与每个S-RNase紧密连锁的多个花粉表达的F-box (SLFs)的鉴定表明,柑橘中的S位点符合这一模型。对其高度多态性序列的分析表明,SLF显示了与S-RNases共同进化的证据。此外,柑橘类SLF的聚类与非自体识别模型一致,每个单倍体都有一个缺失的或分化的SLF。这证实了这些基因可能与SI相关。
对于许多物种来说,SI向SC转变(或转换)的进化史是不清楚的。在此,我们开始解读柑橘类植物SI-SC转变的演化历史。值得注意的是,柑橘的SC性状与无融合现象密切相关。生殖系统的变化是作物驯化的一个显著特征,而无融合生殖是育种者修复有价值性状和杂合性的重要手段。尽管还需要进一步的研究,但无融合生殖现象与SC突变体的选择在柑橘驯化中可能发挥了重要作用。柑橘的SI性状是原始的;当柚保留SI时,宽皮柑橘和它的杂交后代变成了SC。值得注意的是,我们在雌性S决定因子Sm-RNase中发现了一个移码突变,它产生了一个截短的S-RNase,已有的证据也证实它是SI丢失的原因。该突变在柑橘群体中的传播表明,SC具有单一的起源:Sm-RNase在宽皮柑橘中出现,随后在其杂交品种中传播并固定下来。虽然这种突变的S-RNase在植物中的表达极低,这也足以解释SC表型,但Sm-RNase具有RNase活性。这与其他许多S-RNase家族种实现SC的方式形成了对比,即SI的缺失常常伴随着S-RNase从S位点的完全缺失,尽管有例外的报道。在柑橘中,虽然低表达可以解释SC表型,但功能活跃的Sm-RNase不能特异性抑制花粉。因此,由于Sm-RNase缺失了两个高变结构域,这两个高变结构域被预测位于蛋白表面,这暗示了S特异性可能位于该区域。
综上所述,我们证明了柑橘中的SI是基于S-RNase的SI系统。我们利用这个SI系统鉴定出一个新的类别,这是进化比较研究的一个里程碑。由于柑橘是从最近的S-RNase家族中分离出来的(约1亿年前),我们的研究将有助于阐明基于S-RNase的SI系统的分布及其演化。我们提供的证据表明,SI是原始的,并表明截短的Sm-RNase是SI丢失的原因。这使我们能够破译超过150个柑橘种系中SI-SC转变的进化史。自交结合无性生殖及育种家对SC的选择,使其成为植物繁殖策略演变过程中的一个有趣的例子。
附评述文章:Expanding the RNase world
RNase世界的扩展
植物已经发展出多种分子方式来展现自交不亲和性(SI),即通过阻止自体受精来促进异交。一项新的研究表明,柑橘类植物通过S-RNase作为关键因子来展现自交不亲和性(SI),进一步证明了S-RNase系统在被子植物一个早期分支中的广泛存在和进化。
花粉粒被风、水流或昆虫、鸟类等传粉者带到花柱上,花粉粒中的异源群体最终聚集在柱头表面。许多植物已经进化出了避免近亲繁殖带来的负面后果的机制,近亲繁殖是由来自于同一或基因型相似的物种花粉受精所造成的。自交不亲和(SI)就是这样一个系统,它使柱头能够区分自我和非自我花粉,并且它发生在50%以上的开花植物物种中。由于可用于制种的雌性资源有限,因此存在相当大的进化压力来发展和维持一个优先分配能量进行杂交的系统,从而使后代具有更好的适应性。事实上,失去这种机制的物种通常是短暂的。
由于SI为研究细胞间和生物分子间的相互作用提供了一个良好的模型,近年来备受关注。这是因为大多数SI系统是由同一基因座上的一组多态的雄性和雌性决定因子控制的。在植物中发现的不同SI系统中,S -核糖核酸酶(S-RNase)系统是最常见的。S-RNase是在雌蕊中发现的一种丰富的细胞毒性分子,花粉萌发后容易被萌发的花粉管吸收。来自同一物种的一个亲和(非自体)基因型的花粉管可以解除S-RNase对花粉管的毒性作用,并向子房方向生长以完成受精。自我花粉管不能解除S-RNase对花粉管得毒性作用,使花粉管停止生长。花粉与雌蕊之间的识别是通过SI系统上的花粉组分,即S位点上的F-box蛋白(SLFs)来实现的。每个S位点上携带一个S- RNase基因和多个SLF基因,单倍型花粉产生的多种SLF蛋白能够识别并解除任何非自我S-RNase的毒性作用,而自我S-RNase不能被识别和解毒,然而这其中的机制尚不清楚。而这种分子关系也被称为协作性非自我识别模型。
开花植物中存在许多不同的交配系统,我们还不清楚它们是如何进化和分化的。一个核心问题是:基于S - RNase的SI系统应用有多广泛?这个问题的答案对于确定这个系统的进化有多早以及它是否是其他交配系统的祖先至关重要。在这一期的《自然植物》中,Liang等人报道了一种活跃的基于S - RNase的SI系统在柑桔(pomelo)中的应用。他们首先证实了中国柚子品种确实具有自交不亲和性,然后用转录组分析鉴定了9种不同的S-RNase,它们是由不同的S-RNase等位基因编码的。与其它S-RNase等位基因一样,柚子等位基因在雌蕊中特异表达,其遗传与相应的SI表型完全相关。在S-RNase 的SI系统中,一个S1S2雌株和一个S3S4雄株的杂交(二倍体植株各携带两个S等位基因)产生具有四种不同基因型(S1S3、S1S4、S2S3和S2S4)的后代,根据孟德尔遗传,这四种基因型的出现频率相同。相反,S1S2雌性和S2S3雄性杂交产生的后代只有两种频率相同的基因型(S1S3和S2S3),因为只有(单倍体)S3花粉管能够识别并解除S1-RNase和S2-RNase的毒性作用。S2花粉管不能识别和解除S2- RNase的毒性,使花粉在萌发后停止生长。
利用已建立的体外实验证明,柚子S-RNase蛋白足以抑制不亲和花粉管的生长。原核表达的纯化S1-RNase和S2-RNase的混合蛋白抑制了从S1S2植株上收获的花粉粒的花粉管伸长,其抑制效果达62%。这种混合蛋白对S5S6植物的花粉生长却几乎没有影响。为了进一步阐明花粉决定因子,他们对S1-RNase和S2-RNase等位基因的基因组区域进行了测序。发现了9个SLF基因是自我或非自我识别的主要因子,还挖掘了7个报道的柑橘类S-RNase和SLF同源的基因组序列,发现每个SLF类型的功能都得到了保持,因此它针对的是S-RNases的一个特定子集。例如,SLF1通过解除S1-RNase的毒性作用,可能与S1-RNase共同进化。进一步研究发现,S-RNase的一个功能缺失突变等位基因Sm-RNase,其可能来源于柑橘,该Sm-RNase通过传粉和渐渗,在其他重要商业柑橘类物种中得以固定和传播,如:甜橙、酸橙、柚和柠檬。
本研究是植物交配系统进化起源研究的一个重要里程碑。柑橘属属于芸香科,一亿多年前从蔷薇科中分离出来。这些科以及更远的茄科和车前科都具有以S - RNases为基础的SI,这一事实表明,这一系统起源于一个共同的核心双子叶植物的祖先。最近,另一篇论文建议在菠萝中采用基于S-RNase和SLF的SI系统。如果这个SI系统确实起源于一个共同的祖先,那么它一定在侏罗纪时期就已经进化了,但是需要进一步的研究来验证这种可能性。
以S-RNases为基础的系统是一种灵活的机制,通过SLFs的得失来实现自交不亲和表型和自交亲和表型之间的可逆切换,而SLFs可以解除来自S-RNases的毒性作用。这种可逆性有可能使这个系统在植物物种的进化中得以维持,甚至在有利于自交亲和性的生态环境中得以维持。未来的研究可能会揭示,在这些可能增加了复杂性的进化转变之后,这个古老的系统是如何适应现代物种的。例如,在Prunus中,S-单倍型特异性F-box蛋白可能会在自身S-RNases存在的情况下抑制SLFs的功能。发现S-RNase最初是如何从祖先的III类T2/ S型RNase进化而来也将是很有趣的。它最初的作用是抵御病原体,还是清除RNA ?更好地理解基于S-RNase的SI将使我们能够将这个复杂的系统应用于生物技术和农作物生产。
Liang Mei, Cao Zonghong, Zhu Andan, Liu Yuanlong, Tao Mengqin, Yang Huayan, Xu Jr Qiang, Wang Shaohua, Liu Junjie, Li Yongping, Chen Chuanwu, Xie Zongzhou, Deng Chongling, Ye Junli, Guo Wenwu, Xu Qiang, Xia Rui, Larkin RM, Deng Xiuxin, Bosch Maurice, Franklin-Tong Vernonica E, Chai Lijun (2020). Evolution of self-compatibility by a mutant Sm-RNase in citrus. Nature Plants 6:131-142.