本文选自gastroenterology, https://doi.org/10.1053/j.gastro.2020.04.057,喜欢的朋友可以自行下载。
不废话,上图。
看这篇文章不为别的,就是想看。别问为什么,不懂别问。
本文作者以一个独特的视角来研究淋巴结转移的问题,以前有miR signature来预测肿瘤的,现在又有miR来预测淋巴结转移的,等我出师的时候,来个miR或者lnc来预测肝转移。来自日本的文章,还是值得看一看的。(并非我精日,只是从学术的角度上要正确对待,日本的医学其实要比我国更加先进,尤其是胃肠道肿瘤诊治方面,一直以来都是独占鳌头,不信的话可以去看看,胃肠道肿瘤他们都有自己的指南,我国通常在他们发布新指南的时候没多久就更新指南,我也不知道是为什么)
这种研究的话,首先你要看看那些差异表达的miR(转移和没转移的进行比较),他们再疾病中的贡献有多少,然后,是不是需要一些临床数据进行training(TCGA,GEO数据),已确定那些miR是符合signature的,说白了也就是染ROC曲线下面积更大一点,找到了这些signature是不是还要证明这些miR在其他cohort中也适用的问题,那么需要验证cohort(两个中心的数据,以及一个活检样本数据),验证cohort中的ROC曲线下面积也合适,一篇文章就成型了。自我感觉这种文章其实更重要的是样本的搜集,而不是分析的过程。对比细胞、动物实验而言,这需要做的工作及其简单。还有这个ROC曲线下面积到底要多少才合适呢,最大值是1,最小值是0,越靠近1说明这个模型越准确,在0.9以上时非常准确,0.5-0.7准确性较差,0.7-0.9准确性良好。明白了吧,别自己做个0.69999的就觉得了不起了。(为什么细胞实验有人相关系数都是0.4还硬要说有相关性,真是专业脸墙大师。)
看看人家的结果吧。该模型判别有淋巴结转移和无淋巴结转移的患者,曲线下面积(AUC)为0.84(95%CI)。0.77-0.89)。在验证队列中,该模型以0.73(95%可信区间)的AUC来识别有淋巴结转移的患者和无淋巴结转移的患者。0.64-0.81)。在EUS-FNA活检中,该模型以0.78(95%可信区间)的AUC识别有淋巴结转移的患者与无淋巴结转移的患者。0.63-0.89)。在验证队列中,miRNA表达模式是PDAC淋巴结转移的独立预测因子(优势比,17.05;95%CI)。2.43-119.57),而在欧洲超声-细针穿刺队列中(95%可信区间)。0.65-0.87)。
这篇文章更大的意义还在于对术前淋巴结转移与否分层进行术前新辅助化疗的选择上,毕竟,胰腺癌的新辅助还任重道远,(我又有一个想法,可以用细针穿刺的标本进行training,看看那些signature对化疗是否敏感啊,这对新辅助治疗不就更精准了吗?这不又是好文章吗?一个亿的项目拿去吧!发文章的时候,别忘了在二作上带上我)
miRNAs具有抵抗RNA酶介导的降解的能力,并且在各种体液、福尔马林固定石蜡包埋(FFPE)以及活检组织中完整表达,因此成为重要的候选生物标记物。
这是我第一次写method的内容,足以表明他的重要性。
MATERIALS AND METHODS (标题镇楼)
MiRNA biomarker discovery
为了进行全面的生物标志物发现,作者分析了来自三个可公开获得的大型数据集(TCGA、GSE24279和GSE32688)的原发肿瘤组织的miRNA表达谱结果,以确定并建立用于识别PDAC患者LNM的miRNA签名,排除远处转移、病理性LNM信息不足和接受NAT治疗的病例(因为NAT治疗可以改变病理性LNM)。总共269名PDAC患者的miRNA表达谱数据,包括来自TCGA队列(167名患者,121名LNM阳性[LNP]和46名LNM阴性[LNN])的miRNA测序数据,以及GSE24279(77名患者,69名LNP和8名LNN)和GSE32688(25名患者,17名LNP和8名LNN)队列的miRNA测序数据,分别被分析以确定发现阶段和内部验证阶段的miRNA特征,为了评估发现的miRNA特征的诊断潜力,首先使用选定的生物标志物建立了多变量Logistic回归模型,然后确定了每个接收器操作员特征(ROC)曲线图的曲线下面积(AUC)值。
miR调控网络。
通过使用miRWalk版本3.0 进行数据分析,使用验证的miRNAs构建miRNA:mRNA调控网络,以阐明受干扰的通路。构建了miRNA:mRNA网络,其中靶基因至少在三个来源中的两个来源-TargetScan、miRDB和miRTarBase中持续表达。利用KEGG通路和GO对选定的靶基因进行路径富集分析。
Result
首先比较了TCGA和GSE24279队列中LNP和LNN患者的miRNA表达谱,其中包括接受过不使用NAT的根治性手术的患者,并确定了13个差异表达(P<0.05)的候选靶点,数据可用性至少超过50%,排除了高度相关的miRNA,并且在两个队列中都具有一致的表达谱。基于随机森林的递归特征消除,在此数据集上进行了10次交叉验证,将其签名减少到10miRNAs。其中,7个miRNAs在所有三个数据集中表现出一致的表达谱:miR-155-5p、miR-196b-5p、miR-365a-5p、miR-629-5p、miR-675-3p、miR-92b-3p和let-7d-5p,在所选的数据集中AUC都大于0.7,显示出miR预测淋巴结转移的准确性。
为了确认发现的miRNA签名的诊断稳健性,接下来在两个大型的独立临床队列中对这些生物标记物进行了训练和验证。
在训练队列中,排除了一个miRNA(let-7d-5p),因为它在内部验证队列中表现出不一致的表达,形成6个miRNA(miR-155-5p、miR-196b-5p、miR-365a-5p、miR-629-5p、miR-675-3p和miR-92b-3p)的最终signature。在训练队列中使用Logistic回归分析训练了6-miRNA风险预测模型,该模型有力地识别了患有LNM的PDAC患者。根据单个miRNA的系数和由此分析得出的常数,建立了风险评分模型:2.50737+(0.50693*miR-155-5p)+(0.082317*miR-196b-5p)+(0.014458*miR-365a-5p)+(1.74439*miR629-5p)+(2.71643*miR-675-3p)+(-5.15058*miR-92b-3p)。
随后,通过将相同的统计模型应用于一个大型的独立验证队列(63个LNP和44个LNN案例),评估了这个6-miRNA签名的稳健性和准确性。再一次,我们的miRNA生物标志物在此验证队列中对PDAC患者的LNM的识别也显示了显著的诊断准确性。
由于CA19-9是PDAC中广泛确立和重要的生物标志物,接下来检查miRNA签名和该糖蛋白水平的组合模型是否可以进一步提高PDAC患者LNM的诊断准确性。与其他经典的术前临床病理特征(包括肿瘤的位置和大小)相比,这种新的联合征象也显示出显著提高的诊断准确性。
使用Youden‘s指数从这个6-miRNA签名模型中得出的截止阈值将所有患者分为高风险组和低风险组,随后对单变量和多变量分析进行Logistic回归分析,多变量分析显示,在两个临床队列中,risk score成为PDAC患者LNM的独立预测因子。
由于得到一个令人惊喜的结果,作者进一步验证了淋巴结转移与预后相关,得到一致结论。
作者又进一步想看看这个signature与预后的关系,在使用Cox比例风险模型和其他临床病理因素进行的多变量分析中,由miRNA签名定义的高危患者与两个独立队列中的OS显著较低相关
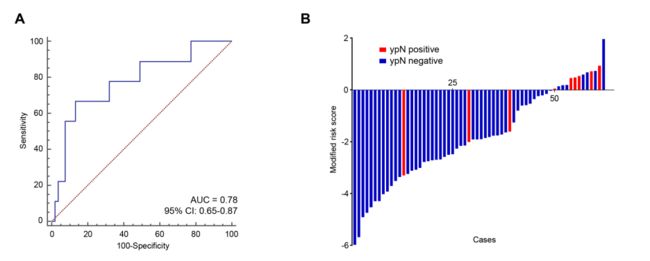
然后,作者想进一步在活检标本中验证一下这个signature是否也有效,那么,意义将不同寻常。然后,发现发现LNM的准确性也很高。
接着就是上面的套路了,联合一CA19-9,然后,logistic回归模型多因素分析发现miR signature是预测的独立危险因素。
紧接着,作者想看看新辅助治疗后,是不是这个signature也能预测残留淋巴结转移情况。放疗后。有研究表明淋巴结转移情况是NAT术后预后的影响因素,然后,作者又找了NAT后的62例患者,然后把术前的标本拿来测了一波miR,结果和预期一致。
当评估危险分数的分布和病理淋巴结转移(ypN)状态时,作者发现ypN阳性的患者的危险分数显著高于ypN阴性的患者(P<0.01,Mann
Whitney检验,)。此外,在Logistic回归模型的多因素分析中,miRNA特征成为治疗前预测PYN的一个独立特征。
作者正文到此结束,在讨论内容里又补充了关于miR靶点及调控网络的内容,过于简单,就不给大家看了,这篇文章看起来并不难,不仅不难而且十分简单,说理方式也十分的简单,如果我没记错,这是gastroenteroloy今年第二篇miR预测胰腺癌的文章了,你懂了吗?欢迎大家批评、指正。