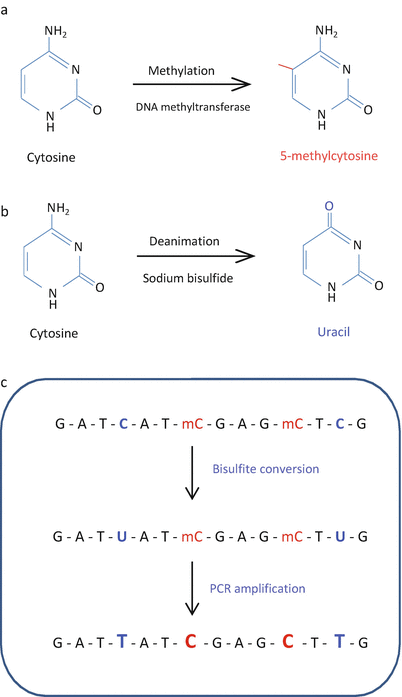
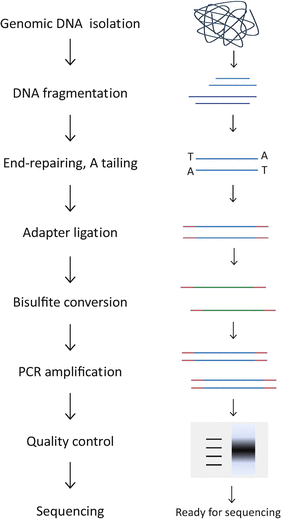
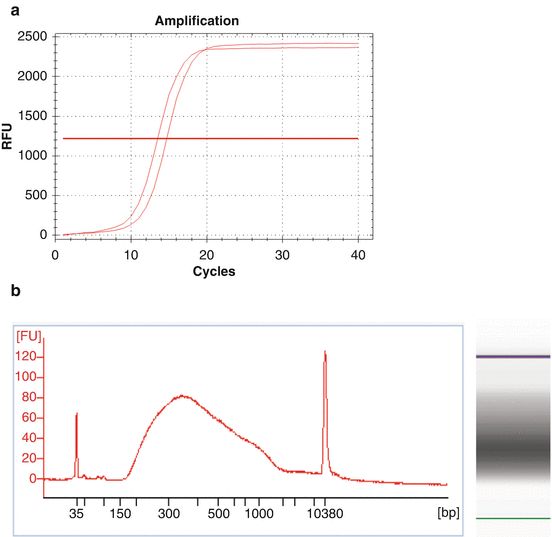
- 守护内心的平和
珍视内心的柔软
抬头看温度计,显示室内30度,可我一点也没觉得热,体会了一次“心静自然凉”。此刻的内心是平和的,这是我在多年前一直追寻却不知的答案,在此刻我体会到了。空,是放下,是轻松,是释然。当你的欲望放下了,心态是会发生变化的,你会变得轻松、自在、释然。内心是平和的,神态是宁静的,心情是愉悦的。热,是烦躁,是负累,是焦虑。当你的欲望增多了,你的心会很焦急烦躁,什么都想要,什么都不愿失去,你心里的负累越重,你的
- 2023-03-19
我_4b6f
保定影像之街道(一一三九)2019年1月26日,星期六。农历戊戌年乙丑月癸亥日(狗年)十二月(腊月)二十一。河北省保定市:五四路。保定市,古称清苑、上谷、保州、保府。因城池似靴,又称靴城。保定与北京相伴而生,保定之名取自“保卫大都、安定天下”之意。五四路,东西街道。五四路始建时,因其东端与青年路相接,关联命名为五四路(五四青年节)。2003年5月21日,国务院办公厅批准修订后的《保定市城市总体规划
- 5.7感恩日记Day4
文案小杀手瑶晗
万分感恩:昕昕班班的信任,说感觉你的文字很温暖,参与sop的修改,昕昕班班谢谢你,我爱你万分感恩:静默师父对我的开导,总是很恐惧得到一切,师父每次都告诉我说,要相信我值得一切美好,师父,谢谢你,我爱你万分感恩:组长的提醒,提醒我及早点评日记,不要拖到一起,害怕完不成任务,你真的太贴心了,谢谢你,我爱你万分感恩:同事的泡面和陪伴,中午因为下雨,没有回家,和你一起吃饭,很开心吖,谢谢你,我爱你万分感恩
- 1.5分钟了解炫石互娱文化传媒app是骗局软件,操作错误为由不给提现怎么办
最新曝光36
1.炫石互娱文化传媒APP在平台不能提现怎么办?2.炫石互娱文化传媒APP这个软件靠谱可信吗?3.炫石互娱文化传媒APP在软件做任务被骗?4.炫石互娱文化传媒APP软件app无法登录?5.炫石互娱文化传媒APP平台是真的吗?6.炫石互娱文化传媒APP被骗无法提现,操作失误!7.炫石互娱文化传媒APP平台是騙局吗?8.炫石互娱文化传媒APP被骗无法出金如何维护自己的合法权益!希望看到这篇文章的人可以
- TensorFlow GPU 2.10.1 for Python 3.9快速安装指南
疑样
本文还有配套的精品资源,点击获取简介:TensorFlowGPU2.10.1是专为Windowsx64和Python3.9设计的TensorFlow版本,它集成了GPU支持以加快深度学习模型的训练。本指南提供了该版本的概述、安装步骤及注意事项,旨在帮助开发者利用其性能优势提升机器学习项目的效率。1.TensorFlowGPU介绍1.1TensorFlow的起源与功能TensorFlow是由Goog
- 按照计划走,总会有收获
峰中言语
人总是在做事情之前担心这担心那,总害怕出点差错,都渴望一帆风顺。可是我们又怎能左右世事发展呢?只能是尽管用心向前走,遇到什么问题就解决什么问题。最近发生的一件事,让我对此深有感触。临近7月1号,即将迎来建党节,便计划着要举办一台庆祝文艺演出。应该说这项工作在六月初就已经做了安排,也开过会布置下去了,但是由于自己一直忙着其他的事情,就把这安排给办公室里的一个内勤负责。不论个人能力和工作方法,只说责任
- 什么是辩证法:是对话,是不计结论的对谈、是诚实与善意的沟通
单华伟
这是单华伟的第一百五十七篇原创文章|辩证法就是对话当赫拉克利特说出『人不能两次踏入同一条河流』的时候,辩证法在哲学上便真正开始了,但这还是一种比较朴素的自然辩证法,用大家都很熟悉的一句话来说,那就是:强调万事万物相互统一,对立转化的一面。而真正将辩证法发展成一种系统的方法论,并且实践得最好的,非苏格拉底莫属,而辩证法在他那里,用两个字就可以概括,那便是『对话』。实际上,辩证法(dialectics
- 抖音上的吃播真的能吃那么多吗?抖音吃播是真吃假吃
日常购物技巧呀
在抖音上以前是很流行大胃王的吃播的,不过由于这种大胃王有不良引导的嫌疑,所以后面就开始慢慢整治了,不过现在还是有很多人吃播了,但是吃的量还是在正常范围内,那么吃播真的可以吃那么多吗?在分享之前给大家推荐一个互联网最新导购平台(高省)买东西先上高省领取隐藏优惠券,还有高额返利,让你更优惠!大家好,我是高省APP最大团队,【高省】是一个可省钱佣金高,能赚钱有收益的平台,百度有几百万篇报道,也期待你的加
- 科尔:费德勒让我联想到库里 他们二人都一样酷
Sandy体育风云
昨日,勇士主教练科尔现身观战美国网球公开赛,他是前去给著名网球选手费德勒加油助威的。在观战期间,现场大屏幕也是给到了科尔的镜头,而记者也是就地对他进行了简短采访,让他谈谈对费德勒的看法。科尔表示:“其实费德勒真正让我联想到的人是库里,他非常酷,就像库里一样。”37岁的费德勒是当今男子网坛最杰出的运动员,可能没有之一,他身上拥有太多的荣誉,赢得20项大赛的冠军,包括5次美国网球公开赛的冠军。虽然隔行
- XSS的介绍
lq_ioi_pl
xss前端
目录XSS的原理反射型XSSDOM型XSS存储型XSS常见的XSSPayloadXSS的原理XSS全称跨站脚本(CrossSiteScripting),为避免与层叠样式表(CascadingStyleSheets,CSS)的缩写混淆,故缩写为XSS。这是一种将任意Javascript代码插入到其他Web用户页面中执行以达到攻击目的的漏洞。攻击者利用浏览器的动态展示数据功能,在HTML页面里嵌入恶意
- 《破产后,上门老公成了我的金主》唐安然贺知州&全集目录-在线阅读
寒风书楼
《破产后,上门老公成了我的金主》唐安然贺知州&全集目录-在线阅读主角:唐安然贺知州简介:想了你很久了......”夜色里,男人肆无忌惮的吻着我。他是我的上门老公。一次醉酒,我被他睡了,事情闹得很大。于是我这个金贵的千金小姐不得不让他这个落魄小子入赘我们家,成为我的老公。因为心里的不甘,我屡屡羞辱他,作践他,对他非打即骂。可他从不生气,俨然一副温顺贤良的模样。而就在我慢慢喜欢上他时,他却向我提出了离
- CentOS 服务器docker pull 拉取失败
可以通过以下步骤将Windows上下载的Docker镜像导出,然后传输到CentOS服务器并导入使用:步骤1:在Windows上导出镜像#1.拉取镜像(如果你还没有拉取)dockerpullelectronuserland/builder:wine#2.导出镜像为tar文件(注意路径使用双引号)dockersave-o"C:\path\to\electron-builder-wine.tar"el
- linux下修改文件及保存的命令
ananRunner
进入vi的命令vifilename打开或新建文件,并将光标置于第一行首vinfilename打开文件,并将光标置于第n行首vi/patternfilename打开文件,并将光标置于第一个与pattern匹配的串处vi-rfilename在上次正用vi编辑时发生系统崩溃,恢复filenamevifilename.....filename打开多个文件,依次进行编辑插入文本类命令i在光标前l在当前行首a
- 你多久没有认真读一本书了
我是巴卡
我九岁博览群书,二十岁达到顶峰。我现在都是看社会人文类的书,例如《知音》《故事会》……往前推三百年,往后推三百年,总共六百年没有人超过我。——凤姐引用凤姐的话,没有嘲讽的意思。现在的人,包括我自己,除了刷手机,恐怕连杂志都很少读了,更别说认真读一本书了。1、大数据下,人越读越窄,越读越傻前段时间,埃航波音737MAX8出事,就在网上跟着读了几篇报道。随后的一段时间,基本打开APP都是关于波音和73
- 进阶向:基于Python的智能客服系统设计与实现
智能客服系统开发指南系统概述智能客服系统是人工智能领域的重要应用,它通过自然语言处理(NLP)和机器学习技术自动化处理用户查询,显著提升客户服务效率和响应速度。基于Python的实现方案因其丰富的生态系统(如NLTK、spaCy、Transformers等库)、跨平台兼容性以及易于集成的特点,成为开发智能客服系统的首选。系统架构系统核心包括两个主要功能模块:1.API集成模块负责连接各类外部服务,
- Python 数据插值:NumPy 实现多种插值方法
Python数据插值:用NumPy解锁缺失数据的秘密拼图关键词数据插值、NumPy、线性插值、多项式插值、缺失值处理、数据平滑、数值分析摘要在数据分析和科学计算中,我们经常遇到离散或缺失的观测数据——比如气象站每小时记录的温度值有缺失,或者实验中只采集了稀疏的采样点。这时候,数据插值(Interpolation)就像“数据修复师”,能根据已知点推断出未知点的数值,让离散数据变成连续的“故事”。本文
- 实际上高仿积家手表一般多少钱一块(精仿积家售价一览表)
星耀腕表
积家手表作为世界著名的高端手表品牌,深受消费者喜爱。然而,高昂的价格让许多消费者望而却步。于是,市场上出现了各种高仿积家手表。那么,这些高仿积家手表的价格是多少呢?本文将为您揭秘。高仿积家手表的价格因其品质、材质和工艺的不同而有所差异。一般来说,价格从几百元到几千元不等。其中,价位在1000元以下的高仿积家手表多为质量较低的仿品手表,选用的是低廉的材质和简陋的工艺,不仅在美观上与正品相差甚远,而且
- 突然间的难受
拈花一笑了之
在看书的时候,老妈打电话来简单的说了几句,我说"好好,挂了"。再看书的时候,突然间想起老妈昨晚说的,"今天和你爸说了,等天气冷点,就去看看你和孩子们。"昨晚上的时候,我还在嗯嗯的答应着,此刻,我却无比的难受,我不知道自己哪里被触动了,眼泪掉下来,不停的擦眼泪,却又不停的流。我已经是妈妈了,我不可能再像小时候一样得到父母的疼爱。可能不是怨恨他们,是可怜自己罢了。家里的事不可说,身上的痛不可说,对明日
- 一、命运——打赢你的内在比赛——问答(二)
老板阿修罗
身心合一是瞬间,准备是王道。相信身体非常重要,但是还是要做好日常的准备工作。留了一个小小的作业,鼓励竞争,又要发挥自己的自恋。周一是周二是一致的,看到并放下你的自恋,看到自恋放下自恋才能进步和发展。周三又鼓励竞争,竞争是一个人的人性进行展开,通过自己的竞争,才能发现你自己。破掉自恋很难,但是也只有放下自恋才可以成功,常常伴随人的终生。自己没有太大的成就,就是因为难以破除的自恋。在关键性的决赛时间,
- bj某dongfang医院js 反混淆 分析结果
yyds970108
javascript开发语言ecmascript算法
没啥特别的手段,就是反混淆,动态调试+替换constCryptoJS=require('crypto-js');constforge=require('node-forge');constaxios=require('axios');const{v4:uuidv4}=require('uuid');constqs=require('querystring');functioncreateRando
- 琉璃叶昭全文免费阅读(和闺蜜一起穿进仙界救赎文小说)全文免费琉璃叶昭读无弹窗大结局_(琉璃叶昭和闺蜜一起穿进仙界救赎文小说免费琉璃叶昭读全文大结局)最新章节列表_笔趣阁(琉璃叶昭)
花朵文库
琉璃叶昭全文免费阅读(和闺蜜一起穿进仙界救赎文小说)全文免费琉璃叶昭读无弹窗大结局_(琉璃叶昭和闺蜜一起穿进仙界救赎文小说免费琉璃叶昭读全文大结局)最新章节列表_笔趣阁(琉璃叶昭)主角配角:琉璃叶昭小说别名:和闺蜜穿越到仙侠文的第一千年。系统终于大发慈悲的告诉了我们,回归现实世界的方法。我的夫君天族太子,也在宴会上豪气的散发了百万功德。让参加宴会的众人乐开了花。为这位刚刚归位的仙子撑足了场面。听到
- 你的生活也可以拥有“重版出来”
小胖男
《重版出来》这部剧说实话一开始我是抱着功利心去看的,为了提高自己对于运营的理解,一位导师推荐我去看一下这部剧。好在功利心并没有影响我欣赏这部剧。又是一部高评剧,豆瓣评分9.1,很值得推荐的励志剧,看这部剧的时候有一点说不上是好还是坏的体验,因为是日剧,并没有国语版,对于我这种平时可能边看剧边做其他事的人来说是一个挑战,但事也因此让我更认真的去看这部剧的每一个细节。这部剧一共10集,却是每集都异常精
- 人生小语
小琴读书
求而不得,是人生的常态。有的时候,你会发现,明明很努力了,为什么还是得不到想要的结果?别灰心,别难过,经历得多了你就会明白,不是所有的事情,都会有即时的反馈。命运从不偏袒任何人,却一定垂怜认真生活的人,你做三四月的事,在八九月自有答案。努力一点,漂亮一点,阳光一点。早晚有一天,你会惊艳了时光,既无人能替,又光芒万丈。如何过好自己的人生,其实蛮简单的。归结起来,无非就这九个字:该吃吃,该睡睡,爱谁谁
- 从AlertDialog源码看链式调用
孙大硕
相信我们大家都用过AlertDialog,但是我们没办法去直接实例化一个AlertDialog,因为内部的构造方法都是private,我们只能通过AlertDialog的内部类Builder去生成一个AlertDialog对象,可是为什么要这样设计呢?看过设计模式的人一眼就会发现,这怎么像传说中的“建造者模式”呢?建造者解决的问题:是将一个复杂的对象的构建与它的表示分离,使得同样的构建过程可以创建
- 【Python LeetCode 专题】热题 100,重在思路
一杯水果茶!
人生苦短我用Pythonpythonleetcode
哈希1.两数之和49.字母异位词分组128.最长连续序列双指针283.移动零11.盛最多水的容器15.三数之和42.接雨水滑动窗口3.无重复字符的最长子串438.找到字符串中所有字母异位词子串560.和为K的子数组239.滑动窗口最大值普通数组53.最大子数组和56.合并区间189.轮转数组238.除自身以外数组的乘积矩阵73.矩阵置零链表160.相交链表206.反转链表234.回文链表141.环
- 【原创文集】记得早先“少年”时
19旅管2班
旅游学院19旅管2班侬树霞嘿,姑娘早安啊!在这个美好的清晨里。我又来叨扰你了,哎!你别不理我呀。.....亲爱的可爱的姑娘啊!今天你还在听那首歌吗?耳机里面还是那一首吧。怎么唱来着?哦!.对了就是这个调调。铁道旁赤脚追晚霞,玻璃珠铁盒英雄卡。玩皮筋迷藏石桥下,:姥姥又纳鞋坐院坝。铁门前篮框银杏花,茅草屋可有住人家。多么美好的一首歌,怪不得你喜欢了这么久。值得!嘿,我的姑娘啊。你还记得少年时做过的傻
- 姜子牙不凡的一生
溯源清流
姜子牙本姓姜,名尚,字子牙,他的祖先曾受封于“吕”地,故又名“吕尚”。他是西周的开国元勋、齐文化的创始人,亦是一位韬略家、军事家与政治家。儒、道、法、兵、纵横诸家皆将他视为本家人物,故被尊为“百家宗师”。穷困潦倒姜子牙未辅佐周文王前,生活十分潦倒、坎坷多磨。三十二岁时,因为商朝战争不断,他为了躲避战祸,跑到山上修道,经过四十年的苦修,直到七十二岁才出山。出山后,因为年纪大又没有一技之长,只好暂时投
- 一文讲解C语言数据类型
小夕Coding
零基础学习C语言c语言
C语言中有四种数据类型——整型、浮点型、指针和聚合类型。所有其他的类型都是从这四种类型的某种组合派生而来。整型整型包括字符、短整型、整型和长整型,使用有符号signed和无符号unsigned两个关键字标记整型,其中signed为C90标准添加的关键字。规定整型值相互之间大小的规则为长整型至少应该和整型一样大,而整型至少应该和短整型一样长。C语言针对不同情况,提供了不同的整数类型。特别是,C语言中
- 三好一改 2019年11月13日 1575期
8f9514241cc4
1好:客户信任今次陌生拜访客户,到达客户店面,进行了初步的沟通,向客户介绍了产品,客户对产品有兴趣,也了解到公司的基本情况。谈到付款情况时,出现了差异,客户要求货到付款,公司的财务制度是先款后货。财务又是不可协调的,与客户只能先保持联系,在合适的时机与客户合作。客户的反馈是非常正常的,一个陌生人到了店里,跟客户说有哪些产品,信任根本没有建立起来,又怎么会直接打款发货呢?万一被骗了呢?从自身来说,没
- 住气还是孤注一掷
巴克利GG
住气还是孤注一掷1.为什么我们沉不住气?想到两点:一个是喜欢走捷径。人性如此,自己压制不住。想走捷径本来没有错,还算是创新的源动力,但是,不顾基础概率,过度自信,高估走捷径的胜率,低估走捷径的败率,就是自己的问题了。衡量过度自信的标准,就是能不能改变结果,目前看,绝大多数人不能。另一个是代表性偏差和突出事件放大,把别人成功的极小概率突出事件权重放大,以及自己也可以复制。两个因素叠加,就沉不住气,就
- [黑洞与暗粒子]没有光的世界
comsci
无论是相对论还是其它现代物理学,都显然有个缺陷,那就是必须有光才能够计算
但是,我相信,在我们的世界和宇宙平面中,肯定存在没有光的世界....
那么,在没有光的世界,光子和其它粒子的规律无法被应用和考察,那么以光速为核心的
&nbs
- jQuery Lazy Load 图片延迟加载
aijuans
jquery
基于 jQuery 的图片延迟加载插件,在用户滚动页面到图片之后才进行加载。
对于有较多的图片的网页,使用图片延迟加载,能有效的提高页面加载速度。
版本:
jQuery v1.4.4+
jQuery Lazy Load v1.7.2
注意事项:
需要真正实现图片延迟加载,必须将真实图片地址写在 data-original 属性中。若 src
- 使用Jodd的优点
Kai_Ge
jodd
1. 简化和统一 controller ,抛弃 extends SimpleFormController ,统一使用 implements Controller 的方式。
2. 简化 JSP 页面的 bind, 不需要一个字段一个字段的绑定。
3. 对 bean 没有任何要求,可以使用任意的 bean 做为 formBean。
使用方法简介
- jpa Query转hibernate Query
120153216
Hibernate
public List<Map> getMapList(String hql,
Map map) {
org.hibernate.Query jpaQuery = entityManager.createQuery(hql);
if (null != map) {
for (String parameter : map.keySet()) {
jp
- Django_Python3添加MySQL/MariaDB支持
2002wmj
mariaDB
现状
首先,
[email protected] 中默认的引擎为 django.db.backends.mysql 。但是在Python3中如果这样写的话,会发现 django.db.backends.mysql 依赖 MySQLdb[5] ,而 MySQLdb 又不兼容 Python3 于是要找一种新的方式来继续使用MySQL。 MySQL官方的方案
首先据MySQL文档[3]说,自从MySQL
- 在SQLSERVER中查找消耗IO最多的SQL
357029540
SQL Server
返回做IO数目最多的50条语句以及它们的执行计划。
select top 50
(total_logical_reads/execution_count) as avg_logical_reads,
(total_logical_writes/execution_count) as avg_logical_writes,
(tot
- spring UnChecked 异常 官方定义!
7454103
spring
如果你接触过spring的 事物管理!那么你必须明白 spring的 非捕获异常! 即 unchecked 异常! 因为 spring 默认这类异常事物自动回滚!!
public static boolean isCheckedException(Throwable ex)
{
return !(ex instanceof RuntimeExcep
- mongoDB 入门指南、示例
adminjun
javamongodb操作
一、准备工作
1、 下载mongoDB
下载地址:http://www.mongodb.org/downloads
选择合适你的版本
相关文档:http://www.mongodb.org/display/DOCS/Tutorial
2、 安装mongoDB
A、 不解压模式:
将下载下来的mongoDB-xxx.zip打开,找到bin目录,运行mongod.exe就可以启动服务,默
- CUDA 5 Release Candidate Now Available
aijuans
CUDA
The CUDA 5 Release Candidate is now available at http://developer.nvidia.com/<wbr></wbr>cuda/cuda-pre-production. Now applicable to a broader set of algorithms, CUDA 5 has advanced fe
- Essential Studio for WinRT网格控件测评
Axiba
JavaScripthtml5
Essential Studio for WinRT界面控件包含了商业平板应用程序开发中所需的所有控件,如市场上运行速度最快的grid 和chart、地图、RDL报表查看器、丰富的文本查看器及图表等等。同时,该控件还包含了一组独特的库,用于从WinRT应用程序中生成Excel、Word以及PDF格式的文件。此文将对其另外一个强大的控件——网格控件进行专门的测评详述。
网格控件功能
1、
- java 获取windows系统安装的证书或证书链
bewithme
windows
有时需要获取windows系统安装的证书或证书链,比如说你要通过证书来创建java的密钥库 。
有关证书链的解释可以查看此处 。
public static void main(String[] args) {
SunMSCAPI providerMSCAPI = new SunMSCAPI();
S
- NoSQL数据库之Redis数据库管理(set类型和zset类型)
bijian1013
redis数据库NoSQL
4.sets类型
Set是集合,它是string类型的无序集合。set是通过hash table实现的,添加、删除和查找的复杂度都是O(1)。对集合我们可以取并集、交集、差集。通过这些操作我们可以实现sns中的好友推荐和blog的tag功能。
sadd:向名称为key的set中添加元
- 异常捕获何时用Exception,何时用Throwable
bingyingao
用Exception的情况
try {
//可能发生空指针、数组溢出等异常
} catch (Exception e) {
- 【Kafka四】Kakfa伪分布式安装
bit1129
kafka
在http://bit1129.iteye.com/blog/2174791一文中,实现了单Kafka服务器的安装,在Kafka中,每个Kafka服务器称为一个broker。本文简单介绍下,在单机环境下Kafka的伪分布式安装和测试验证 1. 安装步骤
Kafka伪分布式安装的思路跟Zookeeper的伪分布式安装思路完全一样,不过比Zookeeper稍微简单些(不
- Project Euler
bookjovi
haskell
Project Euler是个数学问题求解网站,网站设计的很有意思,有很多problem,在未提交正确答案前不能查看problem的overview,也不能查看关于problem的discussion thread,只能看到现在problem已经被多少人解决了,人数越多往往代表问题越容易。
看看problem 1吧:
Add all the natural num
- Java-Collections Framework学习与总结-ArrayDeque
BrokenDreams
Collections
表、栈和队列是三种基本的数据结构,前面总结的ArrayList和LinkedList可以作为任意一种数据结构来使用,当然由于实现方式的不同,操作的效率也会不同。
这篇要看一下java.util.ArrayDeque。从命名上看
- 读《研磨设计模式》-代码笔记-装饰模式-Decorator
bylijinnan
java设计模式
声明: 本文只为方便我个人查阅和理解,详细的分析以及源代码请移步 原作者的博客http://chjavach.iteye.com/
import java.io.BufferedOutputStream;
import java.io.DataOutputStream;
import java.io.FileOutputStream;
import java.io.Fi
- Maven学习(一)
chenyu19891124
Maven私服
学习一门技术和工具总得花费一段时间,5月底6月初自己学习了一些工具,maven+Hudson+nexus的搭建,对于maven以前只是听说,顺便再自己的电脑上搭建了一个maven环境,但是完全不了解maven这一强大的构建工具,还有ant也是一个构建工具,但ant就没有maven那么的简单方便,其实简单点说maven是一个运用命令行就能完成构建,测试,打包,发布一系列功
- [原创]JWFD工作流引擎设计----节点匹配搜索算法(用于初步解决条件异步汇聚问题) 补充
comsci
算法工作PHP搜索引擎嵌入式
本文主要介绍在JWFD工作流引擎设计中遇到的一个实际问题的解决方案,请参考我的博文"带条件选择的并行汇聚路由问题"中图例A2描述的情况(http://comsci.iteye.com/blog/339756),我现在把我对图例A2的一个解决方案公布出来,请大家多指点
节点匹配搜索算法(用于解决标准对称流程图条件汇聚点运行控制参数的算法)
需要解决的问题:已知分支
- Linux中用shell获取昨天、明天或多天前的日期
daizj
linuxshell上几年昨天获取上几个月
在Linux中可以通过date命令获取昨天、明天、上个月、下个月、上一年和下一年
# 获取昨天
date -d 'yesterday' # 或 date -d 'last day'
# 获取明天
date -d 'tomorrow' # 或 date -d 'next day'
# 获取上个月
date -d 'last month'
#
- 我所理解的云计算
dongwei_6688
云计算
在刚开始接触到一个概念时,人们往往都会去探寻这个概念的含义,以达到对其有一个感性的认知,在Wikipedia上关于“云计算”是这么定义的,它说:
Cloud computing is a phrase used to describe a variety of computing co
- YII CMenu配置
dcj3sjt126com
yii
Adding id and class names to CMenu
We use the id and htmlOptions to accomplish this. Watch.
//in your view
$this->widget('zii.widgets.CMenu', array(
'id'=>'myMenu',
'items'=>$this-&g
- 设计模式之静态代理与动态代理
come_for_dream
设计模式
静态代理与动态代理
代理模式是java开发中用到的相对比较多的设计模式,其中的思想就是主业务和相关业务分离。所谓的代理设计就是指由一个代理主题来操作真实主题,真实主题执行具体的业务操作,而代理主题负责其他相关业务的处理。比如我们在进行删除操作的时候需要检验一下用户是否登陆,我们可以删除看成主业务,而把检验用户是否登陆看成其相关业务
- 【转】理解Javascript 系列
gcc2ge
JavaScript
理解Javascript_13_执行模型详解
摘要: 在《理解Javascript_12_执行模型浅析》一文中,我们初步的了解了执行上下文与作用域的概念,那么这一篇将深入分析执行上下文的构建过程,了解执行上下文、函数对象、作用域三者之间的关系。函数执行环境简单的代码:当调用say方法时,第一步是创建其执行环境,在创建执行环境的过程中,会按照定义的先后顺序完成一系列操作:1.首先会创建一个
- Subsets II
hcx2013
set
Given a collection of integers that might contain duplicates, nums, return all possible subsets.
Note:
Elements in a subset must be in non-descending order.
The solution set must not conta
- Spring4.1新特性——Spring缓存框架增强
jinnianshilongnian
spring4
目录
Spring4.1新特性——综述
Spring4.1新特性——Spring核心部分及其他
Spring4.1新特性——Spring缓存框架增强
Spring4.1新特性——异步调用和事件机制的异常处理
Spring4.1新特性——数据库集成测试脚本初始化
Spring4.1新特性——Spring MVC增强
Spring4.1新特性——页面自动化测试框架Spring MVC T
- shell嵌套expect执行命令
liyonghui160com
一直都想把expect的操作写到bash脚本里,这样就不用我再写两个脚本来执行了,搞了一下午终于有点小成就,给大家看看吧.
系统:centos 5.x
1.先安装expect
yum -y install expect
2.脚本内容:
cat auto_svn.sh
#!/bin/bash
- Linux实用命令整理
pda158
linux
0. 基本命令 linux 基本命令整理
1. 压缩 解压 tar -zcvf a.tar.gz a #把a压缩成a.tar.gz tar -zxvf a.tar.gz #把a.tar.gz解压成a
2. vim小结 2.1 vim替换 :m,ns/word_1/word_2/gc
- 独立开发人员通向成功的29个小贴士
shoothao
独立开发
概述:本文收集了关于独立开发人员通向成功需要注意的一些东西,对于具体的每个贴士的注解有兴趣的朋友可以查看下面标注的原文地址。
明白你从事独立开发的原因和目的。
保持坚持制定计划的好习惯。
万事开头难,第一份订单是关键。
培养多元化业务技能。
提供卓越的服务和品质。
谨小慎微。
营销是必备技能。
学会组织,有条理的工作才是最有效率的。
“独立
- JAVA中堆栈和内存分配原理
uule
java
1、栈、堆
1.寄存器:最快的存储区, 由编译器根据需求进行分配,我们在程序中无法控制.2. 栈:存放基本类型的变量数据和对象的引用,但对象本身不存放在栈中,而是存放在堆(new 出来的对象)或者常量池中(字符串常量对象存放在常量池中。)3. 堆:存放所有new出来的对象。4. 静态域:存放静态成员(static定义的)5. 常量池:存放字符串常量和基本类型常量(public static f