来源:https://mp.weixin.qq.com/s/iBX913ad3nVOT4oyZpsZzA
基因talks [e药安全](javascript:void(0);) 9月28日
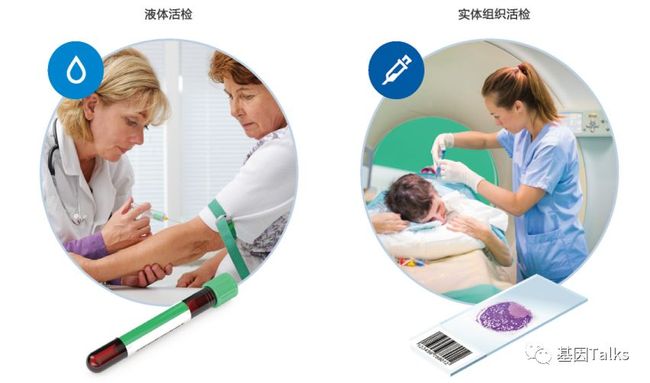
ctDNA(circulating tumor DNA) 是肿瘤细胞释放到血液循环系统中的 DNA,是循环游离 DNA(circulating free DNA,cfDNA)或细胞游离DNA(cell free DNA,cfDNA)的一部分。ctDNA检测(液体活检)相对于常规传统侵入式实体组织活检具有非侵入性,患者依从性好,异质性低,可反复取材等优势。
▲ 液体活检 vs 组织活检
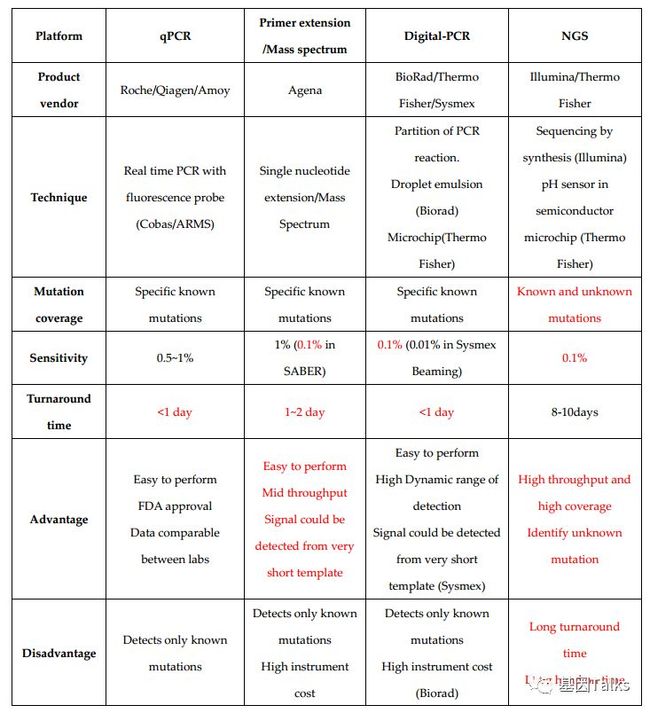
临床上,由于ctDNA的半衰期短、浓度及含量低等原因,所以ctDNA检测需要高灵敏度的技术。目前,实验室常见的ctDNA检测技术有:
✦ 扩增阻滞突变系统PCR(ARMS-PCR);
✦ 核酸质谱(MassARRAY);
✦ 液滴数字PCR(ddPCR);
✦ 二代测序(NGS)等。1
*(文末有彩蛋)
2019年6月10日发表于癌症杂志上的一篇研究,对比了分析了肺腺癌患者血浆ctDNA的两种EGFR检测方法:ARMS-PCR vs SABER/MassARRAY (Cancers (Basel), 2019, 11(6): 803. IF=6.162)。结果显示:
✦ ARMS-PCR vs SABER/MassARRAY检测血浆ctDNA中EGFR突变的总体灵敏度和特异性分别为:49.1% vs 56%,90% vs 95%。两种方法之间的一致性水平非常高,kappa值为 0.88(95%CI 0.77-0.99)。
✦ 一线EGFR-TKI治疗后血浆ctDNA中EGFR突变的存在与预后不良有关(PFS:9.0个月 vs 15.0个月;OS:30.6个月 vs 55.6个月),可见ctDNA适合作为肿瘤实时疗效监测及肿瘤进展及不良预后早期预警指标。2
▲ 肺腺癌患者血浆ctDNA两种EGFR检测方法对比(IF=6.162)
1关键词基础介绍
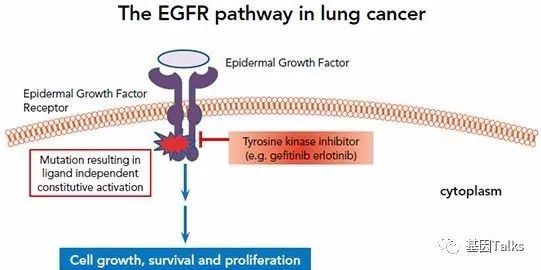
✦ EGFR与肺癌诊疗的关系:表皮生长因子受体(EGFR)通路在各种实体瘤(包括NSCLC)的生长,增殖和存活中起重要作用,因此,EGFR是肺癌治疗的重要潜在靶标。
▲ (详情点击图片查看)
✦ ARMS-PCR:扩增阻滞突变系统PCR (Amplification Refractory Mutation System PCR,ARMS-PCR),又称为等位基因特异性PCR(Allele-Specific PCR,AS-PCR)。
▲ (详情点击图片查看)
✦ SABER/MassARRAY:****单等位****基因碱基延伸反应结合质谱分析(single allele base extension reaction combined with mass spectroscopy,SABER/MassARRAY)。
▲ (详情点击图片查看)
2研究流程及结果
✦ 研究流程:在本前瞻性研究中,研究者们使用肺腺癌患者的组织样本确定EGFR突变状态,并比较了ARMS和SABER/MassARRAY方法检测从这些患者血浆中分离的ctDNA中EGFR突变的效率。同时,还评估了接受一线EGFR-TKI治疗的肺腺癌患者的EGFR状态与临床结果之间的关系。
▲ 研究流程图
✦ 研究样本数:2013年2月~2017年3月,77名肺腺癌患者(57名患者和20名没有EGFR突变者)。
✦ EGFR检测内容:包括19del、L858R及T790M等。
✦ ARMS检测试剂:therascreen EGFR RGQ PCR kit (Qiagen, Hilden, Germany) ,可以检测组织和血浆ctDNA。该试剂盒已在美国以及欧洲和亚洲国家获得批准,用于高灵敏度和特异性的检测肺癌组织/血浆ctDNA中的EGFR突变。3
✦ MassARRAY检测试剂:OncoFOCUS™ Panel v1.0(Agena Bioscience,San Diego,SABER / MassARRAY)。MassARRAY系统是基于基质辅助激光解吸电离飞行时间(MALDI-TOF)的中通量多重超灵敏突变检测系统,可检测实体瘤患者血浆ctDNA突变。4
✦ 组织DNA抽提:使用QIAamp DNA FFPE Tissue Kit(Qiagen)试剂盒从5um厚的FFPET中提取DNA。
✦ 血浆ctDNA抽提****:使用QIAamp Circulating Nucleic Acid Kit(Qiagen)试剂盒从EDTA管采集的1ml血浆中提取ctDNA。
✦ 研究结果:
首先使用ARMS方法确定77名肺腺癌患者组织样本EGFR突变状态:57名患者EGFR突变,20名患者EGFR野生型。然后,使用ARMS和SABER/MassARRAY方法分别检测从77和70名患者血浆中分离的ctDNA中EGFR突变状态,并评估接受一线EGFR-TKI治疗的肺腺癌患者的EGFR状态与临床结果之间的关系。
① EGFR的检测:以肺腺癌患者组织样本的EGFR突变状态为标准,ARMS和SABER/MassARRAY检测血浆ctDNA中EGFR突变的总体灵敏度、特异性及阳性预测值(PPV)分别为:49.1% vs 56%,90%vs 95%,93.3% vs 96.6%。
▲ 两种方法检测EGFR对比
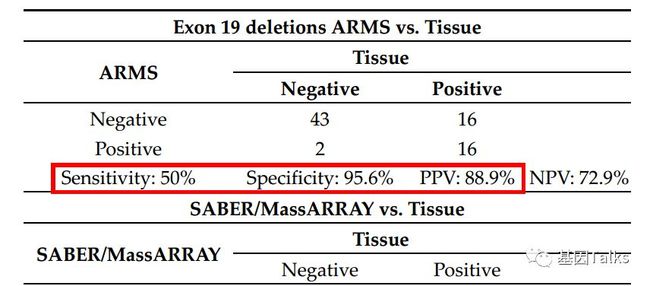
②** 19del的检测:ARMS和SABER/MassARRAY检测血浆ctDNA中EGFR 19del突变的总体灵敏度、特异性及阳性预测值(PPV)分别为:50% vs 53.8%,95.6% vs 97.7%,88.9% vs 93.3%。**
▲ 两种方法检测EGFR 19del对比
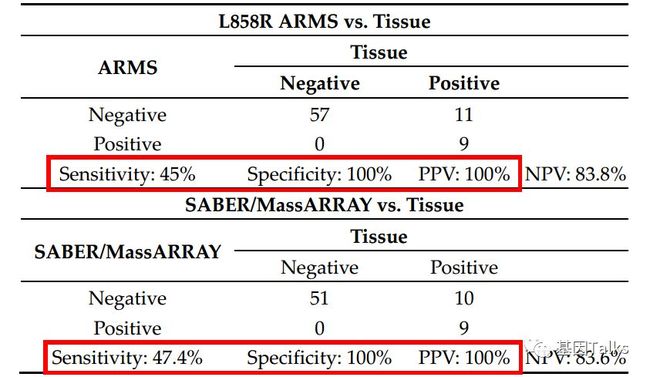
③** L858R的检测:ARMS和SABER/MassARRAY检测血浆ctDNA中EGFR L858R突变的总体灵敏度、特异性及阳性预测值(PPV)分别为:45% vs 47.4%,100% vs 100%,100% vs 100%。**
▲ 两种方法检测EGFR L858R对比
④ T790M的检测:在一名患者的血浆ctDNA中检测到与EGFR-TKI耐药相关的T790M突变,而在EGFR-TKI治疗失败的5名患者的再活检样本中也检测到T790M突变。ARMS和SABER/MassARRAY检测血浆ctDNA中EGFR T790M突变的总体灵敏度、特异性及阳性预测值(PPV)分别为:33.3% vs 50%,100% vs 100%,100% vs 100%。
▲ 两种方法检测EGFR T790M对比
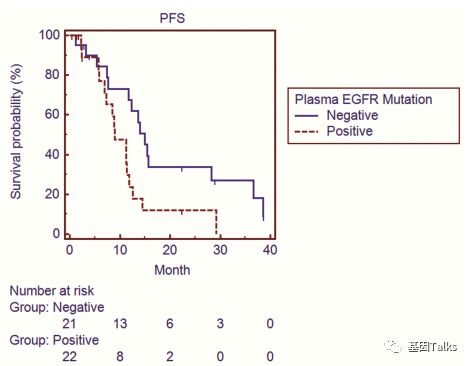
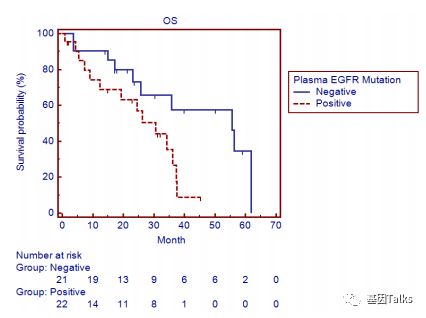
⑤ EGFR突变与预后关系:参加研究的77名患者中,43例组织检测到常见EGFR激活突变(L858R和19del)并接受一线EGFR-TKI治疗,在这43例患者中,血浆ctDNA 中EGFR突变的存在与预后不良有关(PFS:9.0个月 vs 15.0个月;OS:30.6个月 vs 55.6个月****),可见ctDNA适合作为实时疗效监测及肿瘤进展及不良预后早期预警指标。
▲ EGFR-TKI治疗后,血浆EGFR突变存在与预后PFS及OS有关
43例患者中,在预后评估方面,34例ARMS患者和30例SABER/MassARRAY患者在检测血浆ctDNA EGFR突变时,使用胸部 CT 检测肿瘤的大小,发现EGFR-TKI治疗后血浆EGFR突变存在的患者肿瘤较EGFR野生型的患者肿瘤更大。
▲ EGFR-TKI治疗后血浆EGFR突变存在的患者肿瘤更大
3研究讨论及结论
讨论:
① 本次研究的 ARMS 灵敏度(49.1%)较先前报道的略低(43.1~85.7%)5,6,7,可能原因是研究设计的问题:血液样本是在EGFR-TKI治疗后采集的。事实上,之前的一项研究报道,化疗或EGFR-TKI治疗后,肺癌患者血浆ctDNA 中EGFR突变的检出率较低。8
② SABRE/MassARRAY是检测EGFR 19del 和 L858R 突变可靠且灵敏的方法。SABER/MassARRAY的灵敏度略高于ARMS(56% vs 49.1%),其中19del的灵敏度(53.8% vs 50%),L858R的灵敏度(47.4% vs 45%),T790M的灵敏度(50% vs 33.3%)均略高于ARMS,可能与其ctDNA突变检测下限有关(SABRE/MassARRAY为0.1%,ARMS为1%)。9 (需要注意的是:Agena官方显示本研究中使用的 MassARRAY OncoFOCUS™ Panel v1.0 是较早的panel,是用 iPLEX Pro 试剂做的,官方灵敏度为 5%;组织 iPLEX HS 是 1%灵敏度,血液 UltraSEEK 是 0.1%灵敏度。所以实际对比的应该是 5%灵敏度的MassARRAY vs 1%灵敏度的ARMS)
结论:
此项研究表明,使用ARMS或SABER/MassARRAY方法检测血浆ctDNA中EGFR突变是有前景,微创和可靠的,是肿瘤组织活检替代方法。此外,研究数据表明,作为治疗随访的一部分,监测血浆ctDNA中EGFR突变状态可用作携带常见EGFR激活突变和接受一线EGFR-TKI治疗的肺腺癌患者的预后标志物。
前面我们说了,目前,实验室常见的ctDNA检测技术有:
✦ 扩增阻滞突变系统PCR(ARMS-PCR);
✦ 核酸质谱(MassARRAY);
✦ 液滴数字PCR(ddPCR);
✦ 二代测序(NGS)等。
那么,这四种ctDNA检测技术平台,有什么区别呢?下面我们从产品供应商,技术,突变报道情况,灵敏度,检测周期,优势和缺点角度看看。
MassARRAY UltraSEEKTM
听说,MassARRAY推出了新的液体活检技术:****UltraSEEKTM,灵敏度≥0.1%,一起来了解下:
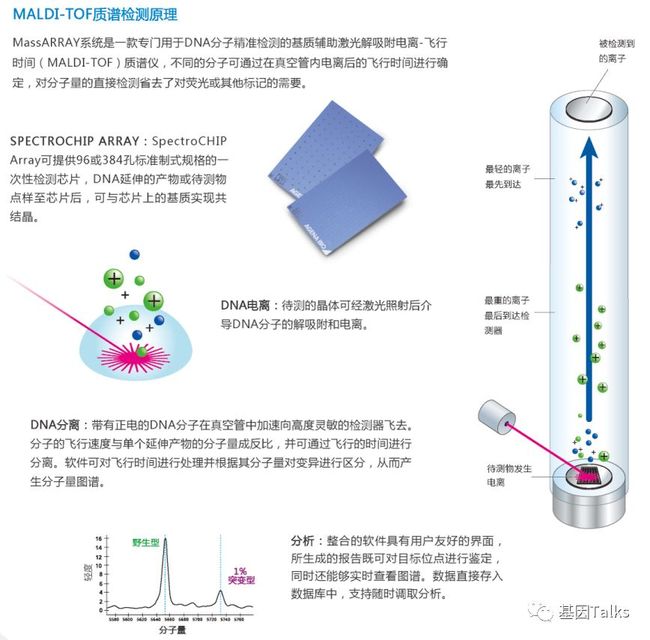
① MassARRAY系统是基于基质辅助激光解吸电离飞行时间(MALDI-TOF)的中通量多重超灵敏突变检测系统。MALDI-TOF质谱检测原理:
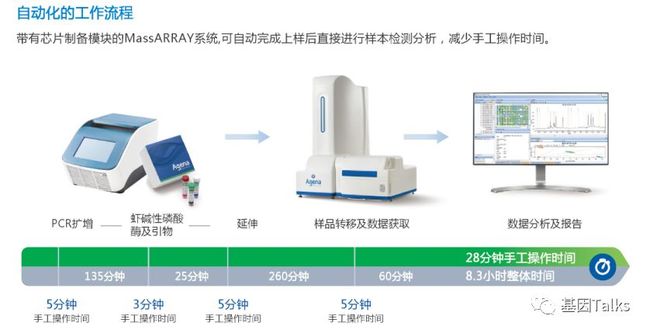
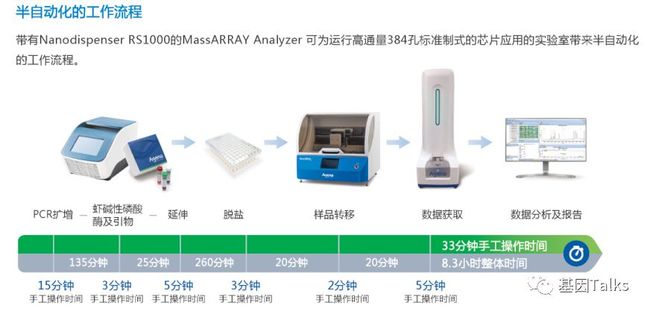
② MassARRAY系统有自动化和半自动化工作流程:
③ MassARRAY UltraSEEKTM 检测原理:Agena核酸质谱技术,不需要在检测覆盖度与灵敏度之间进行平衡,在UltraSEEK试剂的帮助下可实现低至0.1%的最小等位基因频率(MAF)的检测。为了获得高灵敏度,UltraSEEK利用的是多重PCR,并结合后续的突变特异性单碱基延伸和带有链霉亲和素标记的磁珠进行捕获,内置的对照可用于验证反应中是否存在DNA模板。
参考资料:
1.《液体活检在临床肿瘤诊疗应用和医学检验实践中的专家共识 》
2.Hung M S, Lung Jr H, Lin Y C, et al. Comparative Analysis of Two Methods for the Detection of EGFR Mutations in Plasma Circulating Tumor DNA from Lung Adenocarcinoma Patients[J]. Cancers, 2019, 11(6): 803.
3.Vallee, A.; Le Loupp, A.G.; Denis, M.G. Efficiency of the Therascreen(R) RGQ PCR kit for the detection of EGFR mutations in non-small cell lung carcinomas. Clin. Chim. Acta. 2014, 429, 8–11.
4.Mehrotra, M.; Singh, R.R.; Loghavi, S.; Duose, D.Y.; Barkoh, B.A.; Behrens, C.; Patel, K.P.; Routbort, M.J.; Kopetz, S.; Broaddus, R.R.; et al. Detection of somatic mutations in cell-free DNA in plasma and correlation with overall survival in patients with solid tumors. Oncotarget 2018, 9, 10259–10271.
5.Kimura, H.; Suminoe, M.; Kasahara, K.; Sone, T.; Araya, T.; Tamori, S.; Koizumi, F.; Nishio, K.; Miyamoto,K.; Fujimura, M.; et al. Evaluation of epidermal growth factor receptor mutation status in serum DNA as a predictor of response to gefitinib (IRESSA). Br. J. Cancer. 2007, 97, 778–784.
6.Wang, S.; Han, X.; Hu, X.; Wang, X.; Zhao, L.; Tang, L.; Feng, Y.; Wu, D.; Sun, Y.; Shi, Y. Clinical significance of pretreatment plasma biomarkers in advanced non-small cell lung cancer patients. Clin. Chim. Acta. 2014, 430, 63–70.
7.Liu, X.; Lu, Y.; Zhu, G.; Lei, Y.; Zheng, L.; Qin, H.; Tang, C.; Ellison, G.; McCormack, R.; Ji, Q. The diagnostic accuracy of pleural effusion and plasma samples versus tumour tissue for detection of EGFR mutation in patients with advanced non-small cell lung cancer: Comparison of methodologies. J. Clin. Pathol. 2013, 66, 1065–1069.
8.Zhang, C.; Wei, B.; Li, P.; Yang, K.; Wang, Z.; Ma, J.; Guo, Y. Prognostic value of plasma EGFR ctDNA in NSCLC patients treated with EGFR-TKIs. PloS ONE 2017, 12, e0173524.
9.Ellison, G.; Donald, E.; McWalter, G.; Knight, L.; Fletcher, L.; Sherwood, J.; Cantarini, M.; Orr, M.; Speake,G. A comparison of ARMS and DNA sequencing for mutation analysis in clinical biopsy samples. J. Exp.Clin. Cancer Res. 2010, 29, 132.
推荐阅读
肺癌,精准医疗系列文章肺癌,临床试验招募汇总
NCCN丨非小细胞肺癌临床实践指南2020.6版①
NCCN丨非小细胞肺癌临床实践指南2020.6版②
NCCN丨小细胞肺癌临床实践指南2020.3版
NCCN丨免疫治疗相关毒性的管理指南2020.1版①
NCCN丨免疫治疗相关毒性的管理指南2020.1版②
NCCN丨癌症相关感染的预防和治疗指南2020.2版①
NCCN丨癌症相关感染的预防和治疗指南2020.2版②
NCCN丨止吐临床实践指南2020.2版
NCCN丨造血生长因子临床实践指南2020.2版
NCCN丨成人癌痛临床实践指南2020.1版①
NCCN丨成人癌痛临床实践指南2020.1版②
加微信号:251170937,方便免费咨询和寻找最合适的免费治疗项目