2021年6月1日大学化学无机原理(12)——第六章四个量子数、多电子的核外排布。
一:波函数和原子轨道
薛定谔将经典的光波动方程 修改为薛定谔方程,用于描述电子的运动状态
(不是用数学方法推导出来的,其正确性来自大量的实验)

从数学的角度看,该方程为二阶偏微分方程,为近代量子学奠定了理论基础。
求解该方程是为了得到波函数Ψ(表征核外电子的运动状态,即原子轨道) 和相应的能量,解出来的波函数不是具体的数,而是函数式,每个解代表微观粒子的一种可能运动状态
比如:

求解可能会得到多个解其中有相当一部分解不具有合理性,所以要对薛定谔方程进行条件限制,所以引入(N,L,M)这三个量子数。
二:四个量子数
1:主量子数n:

由于n只能取得正整数,所以电子的轨道是量子化的。对氢电子其电子能量只决定于主量子数n。
E=-2.179×10-18J/n2
2:角量子数:l(副量子数,轨道角动量量子数)
由光谱实验及理论推导,同一n层内的电子能量还稍有不同,其相同的原子轨道和电子云的形状也不同,即同一n层内还分为若干亚层。用角量子数l来描述电子亚层。
物理意义:表示原子轨道或电子云的形状

处于s,p,d,f亚层的电子分别称为s电子,p电子,d电子,f电子。
注意点:
3:磁量子数m,不决定能量,只决定轨道的空间取向。
反映原子轨道和电子云在空间的延展方向。因此m的取值受到副量子数l的限制。
可从(2l+1)个从-1到+1包括0在内的整数。
m可取0,±1,±2…±l
物理意义:决定了原子轨道或者电子云在空间的伸展方向。
如图所示:
l=0时,m=0只能是为0
l=1时,m可以取到三个值,也就是有三种延展方式
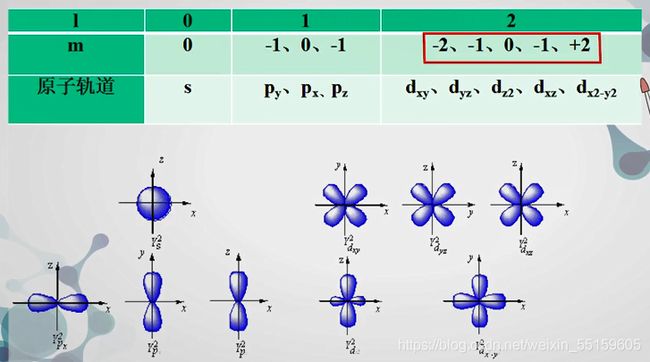
我们把能量相同的轨道称为简并轨道。
4:以上三个量子数:
1:表明了轨道的大小,轨道能量的高低。
2:轨道的形状
3:轨道在空间分布的取向。
利用三个量子数就可以讲一个原子轨道描述出来。
5:自旋量子数,ms
电子自旋的两种可能的自旋状态:+1/2,-1/2
综上所述:
第一题:n>l>=m
第二题:n,l决定能量高低(可以通过n+0.7l进行比较)
第三题:n=2:是四个轨道,有三个轨道是三重兼并。
三;多电子的核外电子排布
1:多电子原子的能级
电子不仅受到核的吸引,电子与电子之间存在相互的排斥作用。多电子原子中的能量不仅受到主量子数n的影响还收到角量子数l的影响。
能级顺序是指价电子层填入电子时各能级能量的相对高低。
多电子原子轨道近似图:
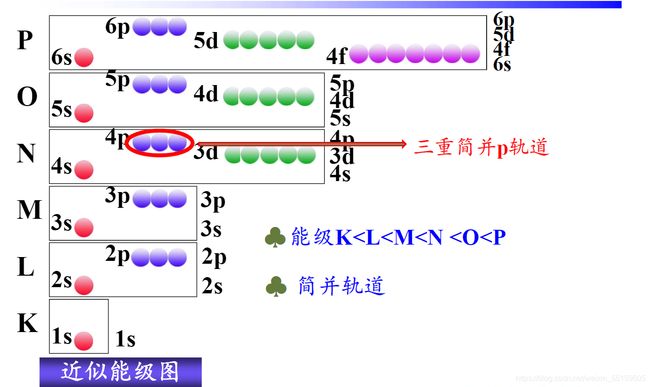
多电子原子轨道的三条规律:
(1):当角量子数相同时,主量子数越大,能量越大
(2):当主量子数n相同时,角量子数不同时,轨道产生能级分裂。
(3):同一原子,当n,l都不同时可能会产生能级交错(比较用n+0.7l)



2;核外电子排布的原则。
第一:能量最低原理:
系统的能量越小,稳定性越大,所以基态核外电子的排布优先占据能量最低的轨道。
第二:泡利不相容原理:
在同一原子中不存在四个量子数全部相同的电子,每个电子轨道可以容纳两个电子。
因此可得:

第三:洪特规则
电子在能量相同的轨道上(兼并轨道)将尽可能以自旋量子数分站不同的轨道。
根据鸿特规则,电子成单分步在等价轨道中,有利于体系能量降低。亚层轨道全空全满或者半满时能量更低,因此更稳定。
3:原子的核外电子排布式与原子构型
(1)
用主量子数n的数值和角量子数的符号并在亚层右上角标出亚层电子数的电子排布式称为电子构型,也叫电子组态、电子结构式、电子排布式。
比如氧原子。再根据之前所说的洪特规则做出图示。

(2):
基态原子中的电子排布,按照能量由低到高进行排序,先排能量低的,再排能量高的
3d层的能量比4s层的高,所以先排4s层的,排满之后在排3d层(根据洪特规则也有例外)


外层电子构型就是电子构型后面没排满的亚层。
比如上图的Na,外层电子构型就是3s1
几个注意点:
1:根据洪特规则,轨道空,轨道全满或者轨道半满时能量最低,有些元素原子的外层电子排布也有例外。

2:通常没有必要写出完整的电子构型,只写出外层电子分布式

3:原子失去电子是从最外层轨道开始的。电子填充是从能量最低开始的,而这不是逆过程。