项目文章 | 非因RPPA技术助力急性髓系白血病耐药靶标的开发
01研究背景
急性髓系白血病(AML)是一种血液系统恶性肿瘤,其特征在于造血系统中白血病细胞的增殖和积累失调。AML 的诱导治疗依赖于强化化疗,化疗耐药白血病复发是急性髓系白血病(AML)患者最常见的死亡原因之一,骨髓中的归巢/移植(BM)是AML细胞通过与基质细胞成分相互作用获得化学抵抗力的关键步骤。然而,许多患者在传统化疗后预后较差。据报道,许多因素参与了AML化疗药物耐药的发展:ABC转运蛋白,凋亡失调,基因突变和骨髓(BM)生态位,但所涉及的确切机制仍有待确定。METTL3介导的m6 A 修饰在体内外均可诱导耐药性,但与AML耐药之间的关系尚未见报道。为了缩小与AML耐药性相关的靶基因列表,来自山东省大学齐鲁医院的纪春岩课题组李明颖博士在期刊《Leukemia》(IF: 12.883)中发表“METTL3 mediates chemoresistance by enhancing AML homing and engraftment via ITGA4” 文章。在文章中研究者使用反相蛋白阵列(RPPA)技术在蛋白质表达水平上获得用于临床应用的潜在靶标,其中 RPPA 技术为非因生物在国内独有的用于蛋白验证的高通量技术。
02实验目的
利用AML的同种移植和异种移植小鼠模型,探索METTL3在AML细胞中的表达与治疗结果相关性以及METTL3介导AML耐药性的机制;证明METTL3抑制剂-STM2457是否可以逆转化疗耐药细胞的归巢和耐药性。
RPPA(Reverse Phase Protein Array)反相蛋白微阵列技术是一种结合平面高精度大规模样品蛋白抗原微阵列打印和抗体检测的高通量蛋白组学技术,该平台作为The Cancer Genome Atlas (TCGA)的核心蛋白组学技术平台,承担了33种癌种、超过10000例临床样本的数据的采集与分析工作,其相关研究成果发表在Nature、Cell、Cancer Cell、New England Journal of Medicine、Nature Biotechnology等学术杂志的高水平论文多达500篇以上。
RPPA技术平台设计严谨精密,流程高度自动化,质量控制极其严格,每次进行样品蛋白抗原微阵列打印,都会将多种阳性标准细胞系样品与待分析样品一起进行点阵,确保实验结果的高度可追溯、高度可信度与可重复性。RPPA可在15毫克组织中(米粒大小)一次性分析多达500种以上不同丰度蛋白,且抗体反应过程及靶点信号采集彼此独立,避免了不同靶标抗体反应之间的串扰及不同靶标丰度差异较大带来的信号采集无法兼容的问题,具有其它高通量蛋白组学所无可比拟的超高特异性和灵敏度,可以对大量细胞表面受体蛋白、细胞信号关键蛋白及蛋白修饰(磷酸化、乙酰化、甲基化等)、蛋白酶类、转录因子等各类代表性靶标进行分门别类的系统深度检测,也可根据需求定制所需研究的靶点蛋白进行分析,包括直接和间接的上下游蛋白网络分析。RPPA可应用于蛋白功能与调控机理分析、细胞信号转导全景扫描、肿瘤标志物及蛋白分子分型、药物靶标发现与药物机理分析等不同领域。
03研究结果与讨论
1.METTL3在AML化疗药物耐药中的可能性作用
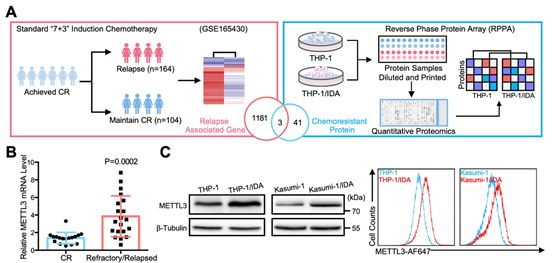
为了确定与具有临床应用潜力的化疗药物耐药性相关靶点,研究者首先对GSE165430数据集中268名遗传学正常AML(CN-AML),且经标准“7 + 3”化疗诱导治疗后实现了完全缓解(CR)的预处理样本RNA-seq数据进行分析筛选与化疗药物耐药相关候选基因。并通过反相蛋白微阵列(RPPA)技术进一步缩小候选基因集。mRNA和蛋白表达水平联合分析结果确定PDGFRB,METTL3和IGFBP2为与AML耐药性相关靶基因(图1A)。并通过qRT-PCR、蛋白印迹分析、流式细胞术分析对验证集样本中METTL3表达进行分析和相互验证(图1B-C),最终确定METTL3高表达与化疗药物耐药性相关。
图1化疗药物耐药性AML细胞中METTL3表达上调
2.METTL3以m6 A催化活性依赖的方式诱导AML的化疗药物耐药性
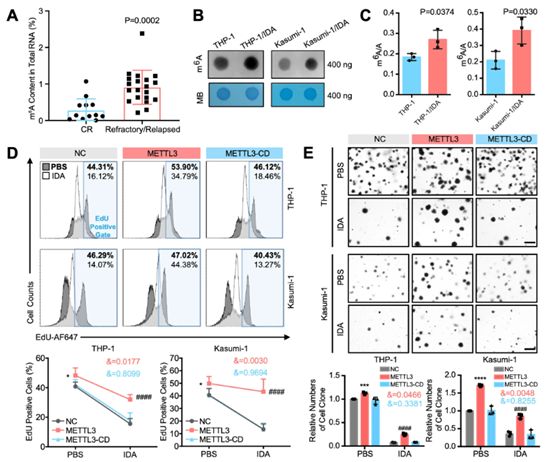
为了确定METTL3对AML耐药的刺激作用是由m6 A修饰引起,研究者分析了临床AML样本中的m6 A修饰水平,如图1b所示。难治性/复发组患者的m6 A水平显著高于经过两个周期的诱导治疗后达到CR的患者(图2A)。此外,m6 A斑点印迹分析(图2b)和液相色谱-串联质谱(LC-MS/MS)(图2C)证实了THP-1/IDA和Kasumi-1/IDA细胞mRNA中m6 A水平的增加。结果表明,METTL3可能通过改善mRNA的m6 A修饰来调节AML耐药。
图2 METTL3介导的m6 A增强AML细胞的化疗药物耐药性
随后,构建METTL3-CD,D394A和W397A三种METTL3突变体,并将METTL3和METTL3-CD转染到THP-1和Kasumi-1细胞中,验证METTL3或METTL3-CD的过表达及其促进m6 A的修饰能力。结果表明,在存在或不存在IDA的情况下,METTL3-CD在促进METTL3引起的人白血病细胞的细胞生长(图2D)和克隆生成能力(图2E)方面失去了优势。此外,IDA处理后,METTL3显著降低了AML细胞的凋亡,而METTL3-CD没有。综上所述,这些结果表明,METTL3对AML耐药性的增强作用取决于其m6 A的催化活性。
3.METTL3介导的m6 A修饰增强了AML细胞对体内化疗药物的耐药性
为了确定METTL3是否增强了体内AML耐药,研究者建立了两种AML小鼠模型。在异种移植小鼠模型中,将过表达METTL3或METTL3-CD的THP-1细胞静脉注射到NOD-Prkdcscid-Il2rgem1IDMO(NSG)小鼠中。42天后,腹腔注射IDA治疗7天。在同源移植模型中,研究者从已确诊的MLL-AF9白血病小鼠中分离出小鼠BM MLL-AF9 + AML细胞。用携带METTL3或METTL3-CD的慢病毒转染后,将MLL-AF9白血病细胞静脉注射到C57BL/6小鼠体内,建立二次BM移植(BMT)。从第8天开始注射阿霉素(DOX)和阿拉伯糖基胞嘧啶(Ara-C),持续5天。
体内实验结果表明,PBS处理后,METTL3组BM和脾脏中AML细胞的比例显著高于NC或METTL3-CD组。IDA处理后,METTL3也增加了AML细胞的比例,与PBS处理和METTL3过表达组相比,IDA处理组该比例下降的速度明显慢于NC或METTL3-CD组(图3A,B)。动物生存分析结果显示,在METTL3过表达组中,未接受化疗的小鼠存活率下降,表明METTL3的过表达显著促进了受体AML的进展。值得注意的是,未治疗亚组和IDA处理的亚组之间无生存差异(图3C),说明METTL3的过表达阻断了IDA的治疗效果,同时突出了METTL3在长期增强AML耐药中发挥了重要作用。
图3 METTL3介导的m6 A可增强AML细胞的化疗药物耐药性
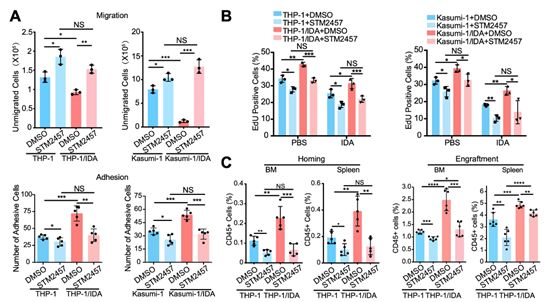
4. METTL3增强体外AML细胞迁移/粘附和体内归巢/移植
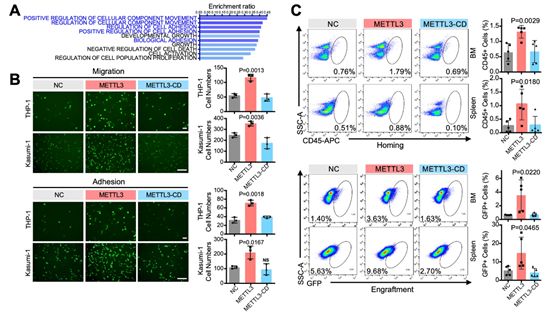
为了全面了解METTL3在AML耐药中的调控作用,研究者进行了THP-1细胞的RNA-seq和m6 A-seq测序。两个数据的联合分析结果确定了564个转录组范围内的候选基因。基因集富集分析(GSEA)结果确定了10条表达上调和下调的通路,并发现METTL3过表达显著激活了迁移和粘附相关的信号通路(图4A)。为了验证METTL3过表达组中AML细胞的聚集生长是由METTL3增强了AML细胞的迁移和粘附所致,研究者进行了HUVECs共培养进行跨孔迁移测定和细胞粘附测试。结果证实,METTL3促进了AML细胞的迁移和粘附,而METTL3-CD则没有(图4B),这与推测一致,并表明METTL3通过m6 A修饰增强了AML细胞的迁移和粘附。
图4 METTL3增强AML细胞体外粘附/迁移和体内归巢/移植
在体内,AML细胞在占据造血生态位后,以一种依赖于迁移和粘附的方式与BM基质细胞相互作用,维持休眠,增加其自我更新活性,并产生耐药性。因此研究者探讨了METTL3过表达AML细胞在异种移植和同源移植模型中的归巢和移植。流式细胞结果显示,METTL3增强了BM和脾脏中AML细胞的归巢(图4C),骨切片的免疫组织化学测定表明,靠近内膜的METTL3过表达AML细胞的比例显著增加。而METTL3-CD对AML归巢没有影响(图4C)。此外,移植结果(异种移植42天,同种移植7天)显示,METTL3的表达增加了BM和脾脏中的AML细胞比例,而METTL3-CD没有(图4C)。综上结果证实了METTL3通过m6 A修饰增加了AML细胞在BM中的归巢和移植物。
5. METTL3 抑制剂逆转 AML 化学耐药性和归巢/移植能力
为了探究STM2457治疗AML耐药的应用前景,研究者用10μM STM2457处理AML耐药细胞48 h,并证明了其逆转m6 A增加的能力。STM2457抑制了AML耐药细胞的迁移和粘附(图5A)。此外,STM2457显著抑制了AML耐药细胞的增殖并促进其凋亡(图5B),且也可逆转AML耐药细胞的增强归巢和移植以重新获得对IDA的敏感性(图5C)。综上结果说明,METTL3抑制剂可能是AML耐药患者的潜在治疗药物。
图5 METTL3抑制剂逆转AML化学耐药性和归巢/移植能力
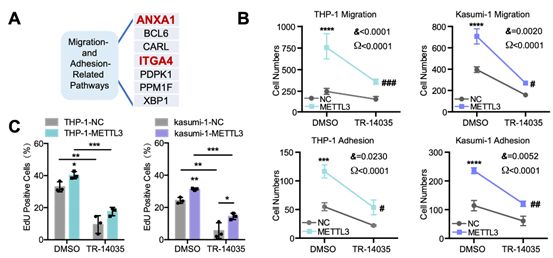
6. ITGA4是AML耐药进程中METTL3的直接靶点
为了阐明METTL3介导的AML耐药机制中的关键基因,研究者对所有迁移和粘附相关通路中的候选基因进行了深入分析和总结,确定两个关键基因:ANXA1和ITGA4(图6A)。随后,结合TCGA数据库分析的结果显示,METTL3和ITGA4 mRNA表达成正相关,表明METTL3参与促进ITGA4的表达。然后,研究者证明了ITGA4抑制剂(TR-14035)可以降低METTL3对促进AML细胞迁移和粘附(图6B)和化学耐药(图6C)的影响。值得注意的是,TR-14035也降低了NC组的化学耐药性,表明ITGA4抑制剂进一步使细胞对化疗敏感。此外,研究者发现ITGA4过表达导致AML化学耐药性,这在METTL3-CD组中也观察到类似。以上所有结果都表明 METTL3-m6 A-ITGA4-归巢/移植有助于保护AML细胞的骨髓生态位。
图6 METTL3通过调节ITGA4介导AML化学耐药性
7. METTL3 提高了 ITGA4 mRNA 稳定性
随后研究了METTL3调控ITGA4表达的机制。m6 A-seq结果显示,绝大多数m6 A peak分布在AML细胞中mRNA转录本的蛋白质编码区(CDS)和3'非翻译区(3'UTR)。值得注意的是当METTL3过表达时,ITGA4 mRNA的3’UTR中的m6 A修饰显著增加(图7A)。然后,通过m6 A-seq的ITGA4 mRNA的序列特征以及3对引物ITGA4 mRNA的3' UTR进行MeRIP-qPCR的结果表明,当METTL3过表达时,被m6 A富集的ITGA4 mRNA的3‘ UTR显著增加(图7B),表明METTL3增加了ITGA4 mRNA的3' UTR的甲基化水平。最后,研究者发现当ITGA4 mRNA的3' UTR中的基序发生突变时,METTL3对ITGA4 mRNA表达的增强显著减弱(图7C)。此外,METTL3-CD没有类似的调节效果。结果证实,METTL3通过甲基化特定的3' UTR位点来调节ITGA4 mRNA的表达。最后,研究者证明了METTL3过表达显著减缓了ITGA4 mRNA降解的速度,而METTL3敲低或STM2457预处理显著加速了ITGA4 mRNA降解的速率。所有结果都证实,METTL3通过m6 A修饰增加了ITGA4 mRNA的半衰期,从而促进了ITGA4在细胞表面的表达,帮助细胞进入BM生态位。
图7 METTL3调节ITGA4 mRNA的稳定性
04研究结论
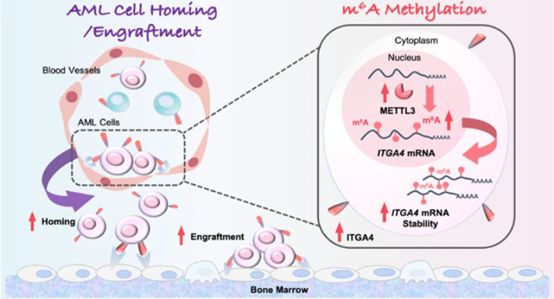
通过RPPA、m6A-seq、bulk RNA-seq等技术确定METTL3是调节AML耐药性的关键,并通过介导的m6 A修饰是诱导耐药性,METTL3表达上调会增强AML归巢/移植,其抑制剂可逆转耐药细胞的归巢/移植和耐药相关表型。
机制上,METTL3介导的m6 A甲基化延长ITGA4 mRNA的半衰期,然后增加ITGA4蛋白的表达以增强AML细胞的归巢/移植。总结来说,本研究确定了一种新的AML化疗耐药蛋白METTL3,它可以通过ITGA4 mRNA的m6 A修饰来介导AML细胞的归巢和移植。这些发现将有助于进一步阐明AML耐药的精确调控机制,并为METTL3作为AML新的治疗靶点提供新的视角。