Nat. Commun. 速递:虚拟颅内脑电与神经动力学模型
来源:集智俱乐部
作者:曹淼
编辑:邓一雪
导语
时间-空间尺度动态演变的动力学系统建模,为研究大脑状态和状态转移的神经机制提供了理论基础。最近墨尔本大学曹淼等人的联合团队在Nature Communications发表论文,提出了虚拟颅内脑电的方法,该方法能够有效识别癫痫发作相关的大脑区域。该方法是非侵入性的,未来有望在相关疾病治疗的研究和治疗中发挥作用。
同时,集智俱乐部联合天桥脑科学研究院等发起【神经动力学模型读书会】,从多学科角度探讨相关模型方法,促进合作交流。曹淼老师是读书会发起人之一。欢迎感兴趣的朋友报名参与,详情见文末。
研究领域:神经网络,神经动力学
论文题目:
Virtual intracranial EEG signals reconstructed from MEG with potential for epilepsy surgery
论文地址:https://www.nature.com/articles/s41467-022-28640-x
大脑作为一个复杂系统,对其进行建模颇具挑战性[1],尤其是在研究跨越多个时空尺度的正常和异常神经动力学系统时[2-4]。然而,大脑的激活和脑区间的协同工作模式架起了大脑状态和行为之间的桥梁,这也成为理解大脑工作机制的基础[5]。因此,研究大脑功能和神经动力学的数学与计算模型一直是过去几十年神经科学研究的关键任务[2]。
动力学网络模型是探索复杂神经系统潜在机制的有力工具[1,6-18]。然而,当前的研究主要依赖记录皮层活动的侵入性颅内电生理技术, 包括植入动物或癫痫病人的颅内脑电图(Intracranial Electroencephalography, iEEG)。由于颅内脑电图最大仅能覆盖10%的大脑区域[19]且风险极高(包括颅内感染与出血)[20-21],已有的研究只能考虑部分脑区的生理、病理活动,在空间上有极大局限性[19]。此外,获取侵入性数据的成本高(单根电极成本接近1万人民币),并且只能从患病的人脑获取。
1. 研究背景
非侵入性神经影像技术,如脑磁图(MEG)和高密度脑电图(HDEGG),具有高时间分辨率与全覆盖的特点[22-26],并且在头部表面记录的电磁场代表集体神经活动的线性总和[24,26-27],这能进一步提高将表面电磁场投影回到大脑源活动的能力[27-29]。因此,将神经动力学模型迁移至可以覆盖全脑的非侵入式神经影像或可为神经科学研究与临床应用提供突破口[30-31]。
全球约1%的人口患有癫痫,其中至少三分之一患者的癫痫发作对药物无效。神经外科手术可以有效治疗药物难治性癫痫,但是在可以手术治疗的癫痫病人中,选择手术作为治疗方法的患者的比例十分低。造成手术使用率低的主要原因是,当MRI无法定位致痫灶时,术前评估将十分复杂与困难[30-34]。Cao et al.提出了一种能够在无创状态下,更好的描述癫痫发作动力学机制的方法,目标是应用动力学网络模型在无创的发作期脑磁图数据上,从而更安全、精确地定位癫痫致痫灶,为癫痫外科制定手术治疗方案提供帮助。为此,该研究引入虚拟颅内脑电图(ViEEG)的概念。
2. 研究方法
Cook & Plummer团队(曹淼博士为第一作者)研发了虚拟颅内脑电图技术(Virtual intracranial Electroencephalography, ViEEG),在癫痫病人术前核磁共振脑结构影像上定义一系列虚拟电极(virtual electrodes)。然后使用基于beamformers的源信号重建技术与癫痫发作期脑磁图信号(Ictal MEG signals 图1),在虚拟电极位置重建癫痫发作源信号(Ictal ViEEG signals 图1)。通过该技术重建的脑磁图源信号与同一个病人记录的颅内电生理发作信号在空间和信号波形上有高相似度(如图2所示)。研究方法与流程如图1所示。
图1. 虚拟颅内脑电图技术与神经动力学模型示意图
图2展示了虚拟颅内脑电图技术重建发作信号(ViEEG seizure),颅内脑电图发作信号(iEEG seizure)的空间位置与波形比较示意图。可以看出神经动力学模型定位的热点区域(hotspot)与iEEG确定的发作起始区,切除区域和脑磁图溯源位置都重合。并且,在临床应用中病人术后无发作。
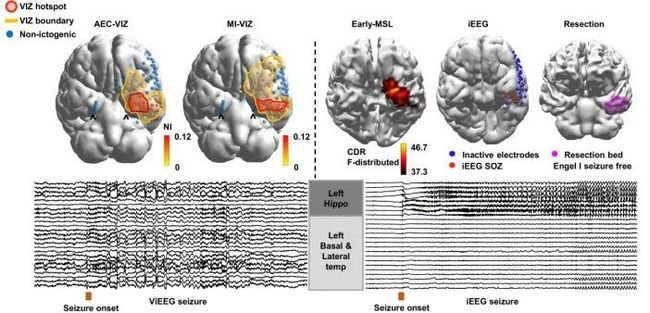 图2. ViEEG seizure与iEEG seizure的空间位置与波形比较示意图
图2. ViEEG seizure与iEEG seizure的空间位置与波形比较示意图
获得源重建的发作源信号后,研究团队以虚拟电极为节点构建功能网络(functional networks)并将动力学系统放入每个网络节点构建一个动力学网络模型(dynamical network models)。该模型可以有效模拟大脑从“正常态”到“发作态”的状态转移。详细地来说,将可以模拟癫痫同步放电的Theta模型[47]放入网络中的每个节点,节点间的相互影响由功能网络的边的权重描述。伴随整个系统随时间演变,系统可由部分节点较早进入发作状态并驱动其它节点并逐步影响整个系统进入发作状态。
随后,使用虚拟切除技术逐个将每个节点从网络中移除,每次移除会重复之前的仿真过程并计算移除一个节点对整个系统的发作时间的影响,用NI(Node Ictogenecity, NI)系数来量化节点的这种影响:NI系数越高,节点与癫痫发作的相关性越强;反之,NI 系数越低,节点与癫痫发作的相关性越弱。
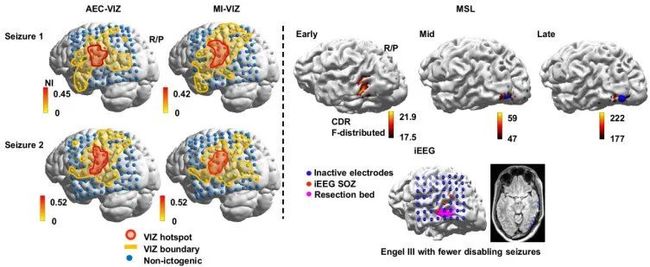 图3. 神经动力学模型显示的与癫痫发作相关的脑区与iEEG确定的发作起始区示意图
图3. 神经动力学模型显示的与癫痫发作相关的脑区与iEEG确定的发作起始区示意图
从图3中可以看出,神经动力学模型揭示了额外的脑区与癫痫发作相关,并与iEEG确定的发作起始区重合。但因与重要功能区相连,所以没有完全手术切除。因此,病人术后发作频率明显降低但仍有发作。
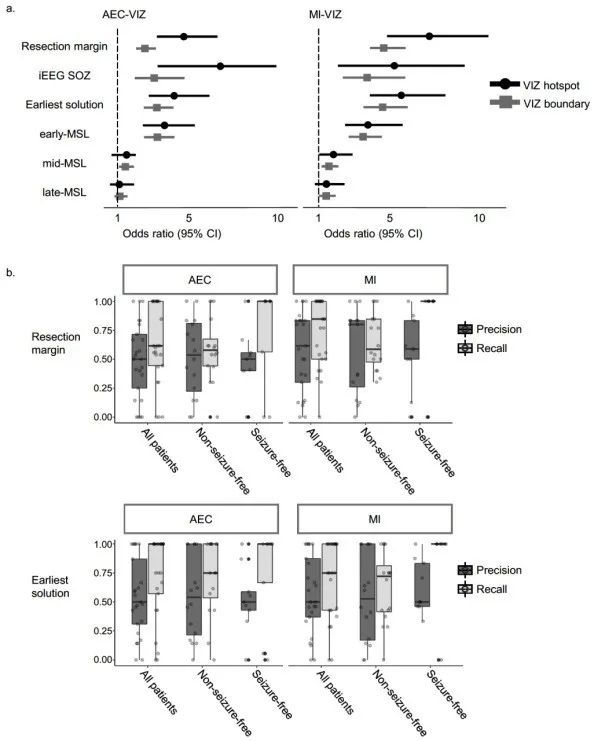
最后,研究团队将每个节点的NI值与癫痫病人临床定位区域,包括颅内脑电图(iEEG)定位的发作起始区(Seizure Onset Zone, SOZ)与手术切除区域(resection margin)进行对比。统计结果表明高NI值的节点,定义为热点区域(hotspot, 如图2、3中所示),可以很好地预测iEEG SOZ与手术切除区域。如图4所示,统计结果进一步表明,使用动力学模型的致痫灶定位精度可优于单独使用脑磁图溯源技术,并能很好的预测多模态联合溯源的结果,即动力学模型的定位结果或可为病人是否适合手术治疗提供参考信息。
图4. 神经动力学模型定位与传统脑磁图和临床定位的比较示意图
3. 结论与讨论
癫痫作为第二常见的神经系统疾病(仅次于中风),对其神经动力学过程进行建模是极具挑战性的,但对于提高癫痫手术的成功率意义重大。为了突破现有癫痫手术依赖侵入性的数据采样方法的局限性,本文提出了基于虚拟颅内脑电图(ViEEG)的癫痫发作的非侵入式的神经动力学建模方法。研究结果表明,仅由脑磁图重建的虚拟颅内脑电图(ViEEG)信号在使用动力学模型识别诱导癫痫发作的大脑区域方面具有显著优势。 未来的工作可以在临床进一步测试虚拟颅内脑电图(ViEEG)方法与神经动力学模型在癫痫外科治疗中的应用潜力。
神经动力学模型不仅为研究癫痫发作的动力学机制提供理论基础,并为癫痫外科术前规划、精确定位与提高手术疗效等临床应用提供帮助。不仅如此,神经动力学模型还能够与脑磁图等非侵入式神经影像相结合为进一步研究人类正常与病理性神经活动的底层机制与动力学性质提供可能。
参考文献
1. Breakspear, M., Terry, J. R. & Friston, K. J. Modulation of excitatory synaptic coupling facilitates synchronization and complex dynamics in a biophysical model of neuronal dynamics. Network 14, 703–732 (2003).
2. Breakspear, M. & Stam, C. J. Dynamics of a neural system with a multiscale architecture. Philos. Trans. R. Soc. Lond. B Biol. Sci. 360, 1051–1074 (2005).
3. Stam, C. J. Modern network science of neurological disorders. Nat. Rev. Neurosci. 15, 683–695 (2014).
4. Fornito, A., Zalesky, A. & Breakspear, M. The connectomics of brain disorders. Nat. Rev. Neurosci. 16, 159–172 (2015).
5. Tong, F. & Pratte, M. S. Decoding patterns of human brain activity. Annu. Rev. Psychol. 63, 483–509 (2012).
6. Jansen, B. H. & Rit, V. G. Electroencephalogram and visual evoked potential generation in a mathematical model of coupled cortical columns. Biol. Cybern. 73, 357–366 (1995).
7. Lopes da Silva, F. H., Hoeks, A., Smits, H. & Zetterberg, L. H. Model of brain rhythmic activity. The alpha-rhythm of the thalamus. Kybernetik 15,27–37 (1974).
8. Wendling, F., Bellanger, J. J., Bartolomei, F. & Chauvel, P. Relevance of nonlinear lumped-parameter models in the analysis of depth-EEG epileptic signals. Biol. Cybern. 83, 367–378 (2000).
9. David, O. & Friston, K. J. A neural mass model for MEG/EEG: coupling and neuronal dynamics. Neuroimage 20, 1743–1755 (2003).
10. Robinson, P. A., Rennie, C. J. & Rowe, D. L. Dynamics of large-scale brain activity in normal arousal states and epileptic seizures. Phys. Rev. E 65, 041924 (2002).
11. Freyer, F. et al. Biophysical mechanisms of multistability in resting-state cortical rhythms. J. Neurosci. 31, 6353–6361 (2011).
12. Wendling, F., Bartolomei, F., Bellanger, J. J. & Chauvel, P. Epileptic fast activity can be explained by a model of impaired GABAergic dendritic inhibition. Eur. J. Neurosci. 15, 1499–1508 (2002).
13. Breakspear, M. et al. A unifying explanation of primary generalized seizures through nonlinear brain modeling and bifurcation analysis. Cereb. Cortex 16, 1296–1313 (2006).
14. Terry, J. R., Benjamin, O. & Richardson, M. P. Seizure generation: the role of nodes and networks. Epilepsia 53, e166–e169 (2012).
15. Jirsa, V. K. et al. The Virtual Epileptic Patient: individualized whole-brain models of epilepsy spread. Neuroimage 145, 377–388 (2017).
16. Proix, T., Bartolomei, F., Guye, M. & Jirsa, V. K. Individual brain structure and modelling predict seizure propagation. Brain 140, 641–654 (2017).
17. Goodfellow, M. et al. Estimation of brain network ictogenicity predicts outcome from epilepsy surgery. Sci. Rep. 6, 29215 (2016).
18. Sinha, N. et al. Predicting neurosurgical outcomes in focal epilepsy patients using computational modelling. Brain 140, 319–332 (2017).
19. Parvizi, J. & Kastner, S. Promises and limitations of human intracranial electroencephalography. Nat. Neurosci. 21, 474–483 (2018).
20. Nagahama, Y. et al. Intracranial EEG for seizure focus localization: evolving techniques, outcomes, complications, and utility of combining surface and depth electrodes. J. Neurosurg. 130, 1180–1192 (2019).
21. Platt, M. & Sperling, M. R. A comparison of surgical and medical costs for refractory epilepsy. Epilepsia 43(Suppl. 4), 25–31 (2002).
22. Lopes da Silva, F. EEG and MEG: relevance to neuroscience. Neuron 80, 1112–1128 (2013).
23. Schoffelen, J. M. & Gross, J. Source connectivity analysis with MEG and EEG. Hum. Brain Mapp. 30, 1857–1865 (2009).
24. Hari, R. et al. IFCN-endorsed practical guidelines for clinical magnetoencephalography (MEG). Clin. Neurophysiol. 129, 1720–1747 (2018).
25. Hamalainen, M. S. Magnetoencephalography: a tool for functional brain imaging. Brain Topogr. 5,95–102 (1992).
26. Plummer, C., Harvey, A. S. & Cook, M. EEG source localization in focal epilepsy: where are we now? Epilepsia 49, 201–218 (2008).
27. He, K. et al. A high-performance compact magnetic shield for optically pumped magnetometer-based magnetoencephalography. Rev. Sci. Instrum. 90, 064102 (2019).
28. Little, S. et al. Quantifying the performance of MEG source reconstruction using resting state data. Neuroimage 181, 453–460 (2018).
29. Baillet, S. et al. Evaluation of inverse methods and head models for EEG source localization using a human skull phantom. Phys. Med. Biol. 46,77–96 (2001) .
30. Breakspear, M. Dynamic models of large-scale brain activity. Nat. Neurosci. 20, 340–352 (2017).
31. Stam, C. J. Modern network science of neurological disorders. Nat. Rev. Neurosci. 15, 683–95 (2014).
32. Kwan, P. & Brodie, M. J. Early identification of refractory epilepsy. N. Engl. J. Med. 342, 314–319 (2000).
33. Thurman, D. J. et al. Standards for epidemiologic studies and surveillance of epilepsy. Epilepsia 52(Suppl. 7), 2–26 (2011).
34. Vakharia, V. N. et al. Getting the best outcomes from epilepsy surgery. Ann. Neurol. 83, 676–690 (2018).
35. Nowell, M., Miserocchi, A., McEvoy, A. W. & Duncan, J. S. Advances in epilepsy surgery. J. Neurol. Neurosurg. Psychiatry 85, 1273–1279 (2014).
36. Duncan, J. S., Winston, G. P., Koepp, M. J. & Ourselin, S. Brain imaging in the assessment for epilepsy surgery. Lancet Neurol. 15, 420–433 (2016)
37. Lopes, M. A. et al. An optimal strategy for epilepsy surgery: disruption of the rich-club? PLoS Comput. Biol. 13, e1005637 (2017).
(参考文献可上下滑动查看)
未来智能实验室的主要工作包括:建立AI智能系统智商评测体系,开展世界人工智能智商评测;开展互联网(城市)大脑研究计划,构建互联网(城市)大脑技术和企业图谱,为提升企业,行业与城市的智能水平服务。每日推荐范围未来科技发展趋势的学习型文章。目前线上平台已收藏上千篇精华前沿科技文章和报告。
如果您对实验室的研究感兴趣,欢迎加入未来智能实验室线上平台。扫描以下二维码或点击本文左下角“阅读原文”