《Protein Actions Principles and Modeling》-《蛋白质作用原理和建模》中文分享(4)
《Protein Actions Principles and Modeling》-《蛋白质作用原理和建模》
本人能力有限,如果错误欢迎批评指正。
第二章:Proteins perform cellular functions
(蛋白质的细胞功能)
-蛋白质在细胞中的多种活动
想象一下,一个设备以一种重复的、自我维持的方式进行一些化学或物理功能个。那么这个设备需要什么东西呢?它需要吸收原材料,消除其废物,转化它所需的能源,并运输或创造一种产品。该设备的先进版本可能会寻求自己的供应和能量,因此它将需要移动感官,调节系统。一个更高级的版本将在其组件的使用寿命之外进行自我维持。它需要检测和修复自己的破损部件,甚至可以复制自己。
生物的细胞就是这样的装置。而这个装置大部分的功能都是由蛋白质实现的。一些蛋白质燃烧燃料(代谢酶),一些蛋白质将光转化为能量(视紫质和光合反应中心),一些蛋白质作为电池运行化学过程(ATP酶),一些蛋白质可以携带氧气(球蛋白)到燃烧燃料的位置,一些蛋白质储存和运输能量(细胞色素),一些蛋白质使离子通道或分子跨膜运输(离子通道和转运体),一些蛋白质形成结构基础设施(胶原蛋白和角蛋白),一些蛋白质将能量转换到运动(肌动蛋白、肌凝蛋白、动力蛋白和动力蛋白),一些蛋白质复制DNA和RNA蓝图(聚合酶),一些蛋白质修复DNA和RNA的蓝图(连接酶和外切酶),一些蛋白质消除旧的或断裂的成分(核酸酶和蛋白酶),一些蛋白质蛋白质控制、调节和信号以保持系统正常运行(转录因子、激素、受体和激酶),还有一些蛋白质(免疫球蛋白和细胞因子)提供对入侵者[1]的防御。
在基因本体论(GO)数据库(http://www.geneontology.org [2])中可以找到蛋白质的功能信息。在GO中,三种不同的描述符用来描述生物细胞中的一种蛋白质:其分子功能、其生物过程、其细胞室或内部定位。例如,细胞色素c的分子功能是氧化还原;它所涉及的生物过程是凋亡(程序性细胞死亡)和氧化磷酸化,其细胞定位在线粒体基质和内膜,尽管它也可以释放到细胞质中,这被视为启动凋亡的不返回点。图2.1列出了人类基因组中蛋白质的生物学过程和分子功能,来自人类基因组DNA的核苷酸序列。显示了不同生物体中不同功能的相对数量。有些蛋白质具有多种功能。例如,有时一种酶也充当一种信号分子。
图2.1 人类蛋白质的功能分布:(A)生物过程;(B)催化功能;(C)配体类型。
-蛋白质的功能蕴藏在其结构和动力学中
在宏观世界中,你通常可以通过观察物体的结构来理解它是如何工作的——马达、勺子或叉子、灯泡或房子。在微观层面上,情况通常也是如此。观察蛋白质的结构可以让你了解蛋白质是如何运作的。你可以从蛋白质数据库(PDB)中的超过10万个蛋白质的三维(3D)原子结构开始。通常,你可以从了解蛋白质是如何移动、摆动或改变成其他结构中得到进一步的见解。本章介绍了蛋白质机制是如何在结构和动力学中编码的;后面的章节给出了更多的细节和描述计算建模。
不同的蛋白质具有不同的功能。然而,每种蛋白质都是由相同的材料制成的。一个蛋白质的一维氨基酸序列编码其三维结构及其功能。这种序列结构的可编程性不是任何聚合物都可以实现的。例举个例子,特定的正电荷和负电荷序列可以在聚电解质中编码一维信息,但电荷之间的排斥将阻止大多数聚电解质折叠成紧凑的功能分子。相但是,蛋白质却可以折叠成独特的紧凑结构。
作为构建细胞功能的基础,蛋白质有三个关键特性:它们可以执行不同的功能;它们可以选择性地和其他分子相互结合(例如,DNA/RNA、代谢物、药物或脂质);因此蛋白质功能可以被调节和控制。不同的蛋白质功能可以像乐高积木一样,以模块化的方式连接在一起,以构建复杂的机器。虽然每个模块都可以自己折叠和工作,但这些模块可以以耦合和协调的方式一起工作,就像机器的不同部分一起工作的方式一样。复杂蛋白的不同模块之间,或多结构域或多聚蛋白的不同结构域或亚基之间的高协同性,对实现生物学功能至关重要。高协同性需要空间距离遥远的结构元素之间的有效耦合,称为变构,通常由配体结合触发。许多蛋白质都是由这种结合事件调节的变构机器。成千上万种不同的作用都可以由一种单一类型的分子来完成,即蛋白质,这是一个主要的原则。
-蛋白质是天生的
DNA携带构建生物体的信息,但在构建蛋白质之前,必须将信息转录成信使RNA(mRNA)的一部分。然后,蛋白质在由rRNA和蛋白质组成的大型复合物-核糖体上进行合成,该过程又称为蛋白质的翻译过程。在该过程中,核糖体从mRNA读取遗传密码片段,并将其作为模板。mRNA中每三个核苷酸碱基(称为三联或密码子)对应一个氨基酸的编码。核糖体直径约20纳米,一般由一三分之一为蛋白质,三分之二为rRNA。不同生物的核糖体包含了50-100种不同的但标志在两个主要的亚基上:一个称为大亚基(在细菌中称为50S,其中S指“Svedberg单位”,基于离心实验中测量的分子大小单位),一个称为小亚基(在细菌中称为30S)。图2.2展示了一个蛋白质如何在核糖体上合成的过程。肽链的增长是通过不断添加氨基酸形成的,而该过程则需要两个亚基的相互旋转。在第一步中,连接着相应的转移RNA(tRNA)的氨基酸到达核糖体中多肽生长部位。tRNA与mRNA上密码子结合,从而生成对应的氨基酸。其次,在新的氨基酸和多肽链的生长末端之间形成肽键-肽链增长。第三,刚刚释放其氨基酸的空tRNA从mRNA中分离。该过程重复直到它到达停止的密码子,这个密码子会发出合成终止的信号。而在这个过程中,蛋白质就根据mRNA上的遗传信息被成功翻译出来。
图2.2 核糖体是合成蛋白质的工厂。(A)在细菌核糖体的大亚单元(绿色)上显示的是三个tRNA(红色,橙色和黄色),其中tRNA分子依次与mRNA结合从而向不断延长的肽链提供氨基酸。
当生成了肽链之后,蛋白质需要进行折叠。在折叠的过程中,则需要别的分子的帮助。而这些帮助其他蛋白质(又可称为客户蛋白质)正确折叠的分子则称为蛋白质伴侣。这些伴侣具有笼状的构造,可以提供比较私密的一个空间用于蛋白质的折叠且有效地避免了蛋白质的聚集。蛋白质伴侣又可称为热休克蛋白。当细胞处于加热等状态的时候,蛋白质就会变性。而蛋白质伴侣可以捕捉这些变性的或者是未折叠的蛋白并帮助他们重新折叠。期间,也可以帮助它们避免聚集。其中一个比较有名的伴侣就是来做大肠杆菌GroEL以及其合作伴侣GroES。
图2.3 Groel-Groes伴侣是一种ATP调节和ATP供电的蛋白质机器,可帮助客户蛋白质展开和折叠并避免聚集。(a)GroEL/GroES结构的表面视图。(B)循环过程,其中(1)客户蛋白是变性或错误折叠的状态(此处显示为错误折叠),其进入伴侣的ATP结合环;(2)尺寸帽绑定;(3)当ATP水解为ADP时,错误折叠的客户蛋白可以向内展开;(4)ATP与下一周期活跃的另一个环结合;(5)将展开的蛋白质从笼放出。有时客户蛋白折叠在空腔内,有时客户蛋白从伴侣中退出,在伴侣之外重新折叠。
如图2.3所示,GroEL是一个含有14个子单元两个七元环的复合体。当一个蛋白质以变性或者是非折叠的状态进入GroEL笼内时,这个伴侣通过先展开来帮助构造蛋白质的机构。也就是说,在它的空间中,客户蛋白可以通过其内部疏水氢键壁来拉开结构然后出去重新折叠。这个活性过程是需要ATP水解来提供能量的耗能过程。有些蛋白质在完全成功折叠之前可以多次进入和退出伴侣空间。这种拉扯分离机制是通用的:在许多不同的错误折叠状态下的许多不同类型的蛋白质分子都可以由单一类型伴侣的这种单一机制来进行重新折叠。
-为生命体工作的蛋白质
很多可以用于催化加速生物化学反应的蛋白质可被称为酶。这些具有酶作用的蛋白质可以作为一把剪刀把目标蛋白质的共价骨干肽键剪断,从而使目标蛋白质变为脆片。蛋白质的酶作用可以用于各种细胞功能的应用。首先,细胞通过破坏食物中的蛋白质为新蛋白质的生成提供能量。因为食物中的蛋白质可能并不是身体所需要的,或者是这些蛋白质并不是正确的蛋白质,因此常常通过将食物中的蛋白质破坏为新的蛋白质提供能量。此外,蛋白质还可以降解细胞内一些不正确折叠,氧化,损害或者无用的蛋白质。再者,蛋白酶可以在一些生化反应的关键步骤中发挥作用。例如,一种名为凝血酶的蛋白酶切割一种名为纤维蛋白原的蛋白质以激活纤维蛋白的生成,该纤维蛋白可以治愈伤口和凝血。蛋白酶在疾病中起着重要作用。例如,有些蛋白酶的激活可以导致细胞凋亡,也称为程序性细胞死亡。细胞自杀以避免其对整个生物体造成伤害。在特地蛋白酶有缺陷的情况下,例如在癌症中,细胞无法杀死自己。
如果蛋白酶能够切割细胞中的所有蛋白质,那对于细胞来说是灾难性的。为了避免这种现象,蛋白酶具有两个保障措施,即蛋白酶活性的调节和特异性。调节是指某些蛋白酶通常是无活性的,并且必须在它们能够降解其他蛋白质之前被激活。这是激活工作的一种方式。蛋白酶首先与一个额外的肽-称为propiece-共价连接在其开始时合成。pro-piece的作用就像刀子上的刀鞘,防止蛋白酶切割其他蛋白质。只有当一个蛋白酶分子,称为A,出现并切下另一种蛋白酶B的propiece时,蛋白酶B才会被激活。从本质上讲,一种蛋白酶从另一种蛋白酶中去除刀鞘以激活它。
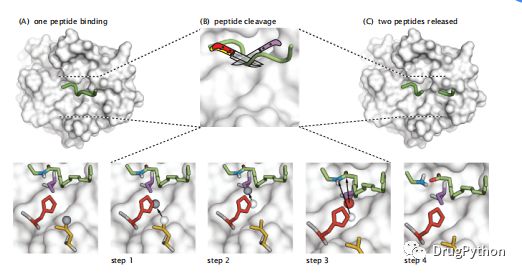
蛋白质具有特异性,它指切除蛋白质的序列的特定位置。举个例子,例如,糜蛋白酶仅在疏水性氨基酸之后立即切割肽键。胰蛋白酶仅在碱性氨基酸之后切割肽键。最好了解的蛋白质是丝氨酸蛋白酶。丝氨酸蛋白酶使用三个残基的特定空间排列来切割肽键。这个催化三合物由丝氨酸,天冬氨酸和组氨酸组成,是一起协同作用稍微(图2.4)。
图2.4 在丝氨酸蛋白酶中,氨基酸的催化三合物会切断肽键。(a)待切割的肽以绿色显示,丝氨酸蛋白酶为白色表面;(B)肽切割,显示为四个连续步骤(底部)。最左边的图显示了活性位点中三个催化残基的位置,其提供了通过将质子从活性位点氨基酸传递到肽键的氮来切割多肽(绿色,棒状表示;其切割位点处的氮以蓝色显示)。(显示为灰色球体的质子的位置已从显示为白色球体的位置转移。)这种氮只能有三个键,因此它破坏肽键,用与传入质子的键代替该键。在胰蛋白酶中,生化裂解由S195(紫色)和H57(红色)催化,而D102(黄色)支持H57并稳定一些中间体。步骤1-3显示催化三合物如何协同作用以转移质子来连接到肽键的氮从而切割肽键(绿色)。步骤4和图C显示切割后的肽。底物的蛋白链是绿色的,除了肽键氮是蓝色的,氧是红色的。红色球体是一个氧原子,白色和灰色球体是氢。第一步是将灰色质子从天冬氨酸转移到组氨酸再到丝氨酸,然后组氨酸质子附着在NH上产生NH2,丝氨酸氧(红色)附着在羰基上产生羧基和氨基。水最后用于组成组氨酸和丝氨酸。蛋白酶为这个高精度“手术”提供了平台。
纤维素是葡萄糖单体的聚合物。由重复糖(如葡萄糖)组成的聚合物称为多糖。纤维素是地球上最丰富的聚合物之一,占植物和树木生物量的很大一部分。它为植物的细胞壁以及木材和棉花提供了结构。如何获得能够分解将纤维素链中的一种葡萄糖单体连接到另一种葡萄糖单体的糖苷连接的能力对于从丰富的生物质中获得生物燃料具有巨大的商业价值。因此,人们做出了很多努力来探索可以打破这种连接的非生物催化剂。然而,开发这种催化剂一直很困难。但是大自然存在一种催化剂叫做纤维素酶,这是一种蛋白质,可以切割糖苷键。纤维素酶主要存在于微生物中,如细菌和真菌以及白蚁中。图2.5显示了纤维素酶分解纤维素的机制。纤维素链被包装成平行阵列,就像一捆捆的干意大利面,所有这些都被拉伸并在同一方向上对齐。纤维素酶将能量转化为沿着纤维素链束拉动自身的作用,同时酶的小刚性舀入区域在每个纤维素分子下舀入,将其从束中剥离出来。结合机械挖掘过程,纤维素活性位点水解该纤维素链的糖苷连接,将纤维素分解成其组分-糖。
图2.5 分解纤维素同时需要化学和机械作用。纤维素酶通过催化糖苷键的水解来破坏纤维素。该糖苷键将一对葡萄糖单体连接到聚合纤维素中。(a)酶结构,其中纤维素链显示为红色球体,并且从底部脱落。(B)纤维素酶的完整结构示意图,具有前缘碳水化合物结合模块(绿色斑点)和多糖(黄色)和肽接头,有助于引导纤维素酶。这种酶的作用是通过将葡萄糖聚合物舀入活性位点来完成的。
-------------------------------------------
欢迎点赞收藏转发!
下次见!