【中科院】分子生物学-朱玉贤第四版-笔记-第7-8讲 翻译
第7-8讲 翻译
文章目录
- 5. 翻译 (translation)
-
- 5.1 遗传密码
-
- 5.1.1 三联子密码及其破译
- 5.1.2 遗传密码的性质
- 5.2 tRNA ( 氨酰 tRNA)
- 5.3 核糖体 (ribosome)
- 5.4 翻译过程
-
- 5.4.1 起始前事件:氨基酸活化和核糖体解离
- 5.4.2 翻译的起始
- 5.4.3 肽链的延伸
- 5.4.4 肽链的终止
- 5.4.5 新合成多肽链的折叠和加工
5. 翻译 (translation)
● 翻译:mRNA 碱基序列信息转换成多肽的氨基酸序列
● 翻译的基本元件:
- 模板:mRNA;
- 转移 RNA(tRNA): 是模板与氨基酸之间的接合体。
- 场所:核糖体;
- 多种蛋白质、酶和其他生物大分子的参与。
- 能量:翻译过程是一个需能反应。
5.1 遗传密码
贮存在 DNA 上的遗传信息通过 mRNA 传递到蛋白质上,mRNA 与蛋白质之间的联系是通过遗传密码的破译来实现的。
5.1.1 三联子密码及其破译
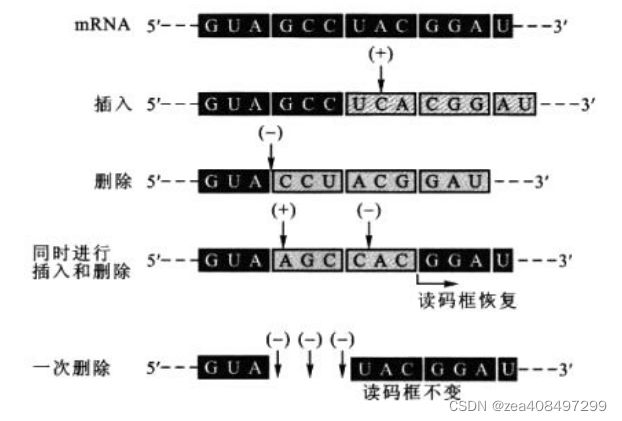
- mRNA 上每 3 个核苷酸翻译成多肽链上的一个核苷酸,这 3 个核苷酸就称为一个密码子(三联子密码,triplet code)。
- 若以 3 个核苷酸代表一个氨基酸,有 43=64 种密码子,满足了编码 20 种氨基酸的需要。
- 用核苷酸的插入或删除实验证明 mRNA 模板上每三个核苷酸组成一个密码子。
Key terms
密码子(Codon):是代表氨基酸或终止信号的核苷酸三联体。遗传密码(Genetic code):是 DNA(或 RNA)中的三联体与蛋白质中氨基酸之间的对应关系。起始密码子 (Initiation codon):是用于开始合成蛋白质的特殊密码子(通常是 AUG,也可以是 GUG)。阅读框(Reading frame):是将核苷酸序列作为一系列三联体读取的三种可能方式之一。开放阅读框(ORF):可能编码蛋白质的三联体读取方式。终止密码子(Termination codon):是导致蛋白质合成终止的三种 (UAG,UAA,UGA)中的一种。
多肽链由 ORF(开放阅读框)确定
- 开放阅读框 (ORF):连续的、非重叠的密码子串组成。是每个 mRNA 的蛋白质编码区域。
- 每个 ORF 以起始密码子开始,并以终止密码子结束。

- 一个 RNA 分子可以以三种可能的阅读框进行翻译,只有一种阅读框编码实际信息。
三联子密码的破译
- in vitro 翻译
- 核糖体结合技术–诱捕三核苷酸
· 以人工合成的三核苷酸如 UUU、UCU、UGU 等为模板,在含核糖体、同位素标记的 AA-tRNA 的适当离子强度的反应液中保温后通过硝酸纤维素滤膜。
· 游离的 AA-tRNA 因相对分子质量小能自由过膜,与模板对应的 14C 标记 AA-tRNA 能与核糖体结合,体积超过膜上的微孔而被滞留。
· 哪一种 AA-tRNA 被留在滤膜上,进一步分析这一组的模板是哪个三核苷酸,从模板三核苷酸与氨基酸的关系可测知该氨基酸的密码子。例如,模板是 UUU 时,Phe-tRNA 结合于核糖体上,可知 UUU 是 Phe 的密码子。
5.1.2 遗传密码的性质
- 密码的连续性 (commaless):三个核苷酸编码一个氨基酸。三联子密码是非重叠 (non-overlapping) 和连续的 (commaless)。
- 密码的简并性 (
degeneracy):4 种核苷酸可组成 64 个密码子:61 个是编码氨基酸的密码子;3 个即 UAA、UGA 和 UAG 是终止密码子。由一种以上密码子编码同一个氨基酸的现象称为简并 (degeneracy)。 - 密码的普遍性 (universality):生物界基本共用同一套遗传密码。
- 密码的特殊性 (specificity):标准密码子适用于大多数生物,但并非适用于所有生物。在支原体中,终止密码子 UGA 被用来编码色氨酸;在嗜热四膜虫中,另一个终止密码子 UAA 被用来编码谷氨酰胺。对人、牛及酵母线粒体 DNA 序列和结构的研究还发现,在线粒体中也有一些例外情况,如 UGA 编码色氨酸,而非终止密码子;甲硫氨酸可由 AUA 编码等,体现了遗传密码的特殊性。
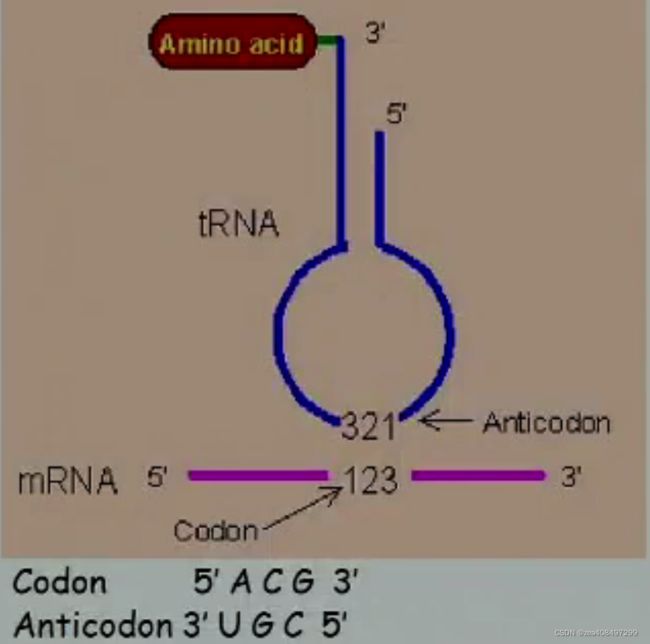
- 密码子与反密码子的相互作用。tRNA 的反密码子在核糖体内是通过碱基的 反向配对 与 mRNA 上的密码子相互作用的。
· 通常写为密码子 ACG /反密码子 CGU
★ 通用遗传密码及相应的氨基酸
- 除
色氨酸(UGG)和甲硫氨酸(AUG)只有一个密码子外,其他氨基酸都有一个以上的密码子: - 9 种氨基酸有 2 个密码子,1 种氨基酸有 3 个密码子,5 种氨基酸有 4 个密码子,3 种氨基酸有 6 个密码子。
- 同义密码子 (
synonymous codon): 对应于同一氨基酸的密码子。 - 一般说来,编码某一氨基酸的密码子越多,该氨基酸在蛋白质中出现的频率也越高,只有精氨酸 Arg 例外,因为在真核生物中 CG 双联子出现的频率较低 ,所以尽管有 6 个同义密码子,蛋白质中精氨酸的出现频率仍不高。

★ 遗传密码子不同位置突变对氨基酸产物的影响
- Transition(转换):purine ↔ purine or pymidine ↔ pymidine
● 第 3 位:没有影响,除了
Met (AUG) ↔ Ile (AUA,AUC,AUU);
Trp (UGG) ↔ stop (UGA)
● 第 2 位:产生相似化学类型的氨基酸。 - Transversions (颠换):purine ↔ pymidine
● 第 3 位: 大多没有影响,导致产生相似类型的氨基酸。如 Asp(GAU,GAC) ↔ Glu(GAA,GAG)
● 第 2 位: 改变氨基酸的类型
● 第 1 位:转换和颠换突变都产生了相似类型的氨基酸,在少数情况下氨基酸保持不变 (Leu: CUA or UUA)。
★ 起始密码子和终止密码子
- AUG→甲硫氨酸及起始密码子
- GUG→缬氨酸及起始密码子
- UAA→终止密码子 (Ochre,赭石)
- UAG→终止密码子 (Amber,琥珀)
- UGA→终止密码子 (Opal,蛋白石)
★ 摆动假说(Wobble hypothesis)
最早由 Crick 于 1966 年提出,密码子与反密码子配对时,前两对严格遵守配对原则,第三对碱基有一定的自由度,可以“摆动”,反密码子中 I(次黄嘌呤)可识别多个密码子,某些 tRNA 识别多个密码子。一个 tRNA 究竟能识别多少个密码子是由 反密码子的第一位碱基的性质决定的。

5.2 tRNA ( 氨酰 tRNA)
★ tRNA: 第二遗传密码
- 模板 mRNA 只能识别特异的 tRNA,而不是氨基酸
- 只有 tRNA 上的反密码子能与 mRNA 上的密码子相互识别并配对
- 氨基酸本身不能识别密码子,只有结合到 tRNA 上生成 AA-tRNA, 才能被带到 mRNA-核糖体复合物上,插入到正在合成的多肽链的适当位置上。
- 多个密码子同时编码一个氨基酸,凡是第一、二位碱基不同的密码子都对应于各自独立的 tRNA。
- 原核生物中大约有 30-45 种 tRNA,真核细胞中可能存在 50 种 tRNA。
★ tRNA 的功能
- 为每个三联密码子翻译成氨基酸提供了接合体。
- 为准确无误地将所需氨基酸运送到核糖体上提供了运送载体。
★ tRNA 转录
- tRNA gene 启动子
· 原核生物:一种聚合酶适用于所有 RNA 类型;类似的启动子和终止子序列
· 真核生物:内部启动子(ICR),由聚合酶Ⅲ转录;RNAP Ⅲ的一些启动子位于基因的上游。 - pre-tRNA 转录后加工
① 去除额外序列:5-前导序列,3-尾序列,内含子
② 向 3’末端添加 5’-CCA-3’
③ 所选碱基的化学修饰:修改的类型和程度各不相同;不同修饰产生不同三维结构和功能(氨基酸特异性)
tRNA 一级结构
- 长度:60-95 nt (commonly 76)
- 残基:15 个 invariant(恒定)和 8 个 emi-invariant(半恒定)。invariant 和 semi-variant 核苷的位置在二级结构和三级结构中起着重要的作用。
- 含有修饰碱基 (Modified bases):
tRNA 中所有 4 种碱基都能被修饰
有时一个 tRNA 分子的 20% 的碱基是经过修饰的。
已发现有超过 50 种不同类型的修饰碱基。
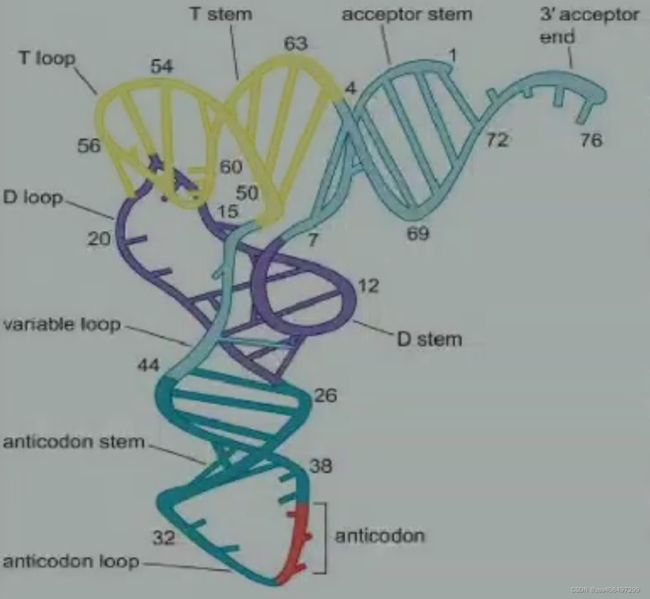
tRNA 二级结构

不同 tRNA 在结构上比较保守,由小片段碱基互补配对形成三叶草形分子结构:4 条手臂 (arm or stem),3 个环 (loop)。
受体臂(acceptor arm)由链两端序列配对形成的杆状结构和 3’端未配对的 3~4 个碱基所组成。其 3’端的最后 3 个碱基序列永远是 CCA, 最后一个碱基的 3’或 2’自由羟基 (-OH) 可以被氨酰化。- D-arm and D-loop:D 臂 是根据它含有二氢尿密啶 (dihydrouracil) 命名的。D 臂中存在多至 3 个可变核苷酸位点。
- Anticodon loop:反密码子臂是根据位于套索中央的三联反密码子命名的。由 5bp 的臂和 7 个核苷的环组成。在环中有与密码子互补的由 3 个核苷组成的反密码子。
- Variable arm and T-arm:
可变臂(多余臂) 是由 3 到 21 个核苷组成,可能会形成多达 7bp 的臂。
TψC 臂是根据 3 个核苷酸命名的,其中 [ψ] 表示拟尿密啶(一种特殊的修饰);由 5bp 臂和含有 GTψC 的环组成。
· tRNA 的稀有碱基含量非常丰富,约有 70 余种。
· 每个 tRNA 分子至少含有 2 个稀有碱基,最多有 19 个,多数分布在非配对区,特别是在反密码子 3’端邻近部位出现的频率最高,且多为嘌呤核苷酸。
· 对于维持反密码子的稳定性及密码子、反密码子间的配对很重要。
tRNA 三级结构(L-形)
- 在 L 形三级结构中:受体臂顶端的碱基位于“L”的一个端点,反密码子臂的套索状结构生成了“L”的另一个端点。这个结构形式满足了蛋白质合成过程中对 tRNA 的各种要求而成为 tRNA 的通式。
- 三级结构的形成:
tRNA 三级结构主要由在二级结构中未配对碱基间形成的 9 个氢键(三级氢键)而引发的。大部分恒定或半恒定核苷酸都参与三级氢键的形成。
tRNA 的种类
- 起始 tRNA 和延伸 tRNA
起始 tRNA: 能特异性识别 mRNA 模板上起始密码子的 tRNA。
延伸 tRNA:其他 tRNA 统称为延伸 tRNA。
- 真核生物起始 tRNA 携带甲硫氨酸 (Met)
- 原核生物起始 tRNA 携带 甲酰甲硫氨酸 (fMet)
- 原核生物中 Met-tRNAfMet 必须首先甲酰化生成 fMet-tRNAfMet 才能参与蛋白质的生物合成。
同工 tRNA: 代表相同氨基酸的不同 tRNA
- 在一个同工 tRNA 组内,所有 tRNA 均专一于相同的氨酰- tRNA 合成酶。
- 同工 tRNA 既要有不同的反密码子以识别该氨基酸的各种同义密码,又要有某种结构上的共同性,能被 AA-tRNA 合成酶识别。
校正 tRNA: 通过改变反密码子区校正无义突变和错义突变。
★ 氨酰-tRNA 合成酶 (Aminonacyl-tRNA synthetase,
ARS)
- AA-tRNA 合成酶是一类催化氨基酸与 tRNA 结合的特异性酶:AA+tRNA+ATP→AAtRNA+AMPIPPi
- tRNA 合成酶和带电荷的 tRNA 的命名
· 氨基酸:serine
· 相关联的 tRNA: tRNAser
· 相关联的氨酰-tRNA 合成酶:seryl-tRNA synthetase
· 氨酰-tRNA: seryl-tRNAser - 氨酰-tRNA 合成酶决定蛋白质合成的真实性(特异性)
· 蛋白质合成的真实性主要决定于 AA-tRNA 合成酶是否能使氨基酸与对应的 tRNA 相结合。
· AA-tRNA 合成酶既要能识别 tRNA,又要能识别氨基酸,它对两者都具有高度的专一性。
· 氨酰-tRNA 合成酶利用校读功能来提高精确性。
5.3 核糖体 (ribosome)
核糖体是蛋白质合成的机器。一个细菌细胞内约有 20,000 个核糖体,真核细胞内可达 106 个。
细胞中核糖体的存在形式
- 真核生物中,大多数正在进行蛋白质合成的核糖体都不是在细胞质内自由漂浮,而是直接或间接与细胞骨架结构有关联或者与内质网膜结构相连的。
- 细菌核糖体大都通过与 mRNA 相互作用,被固定在核基因组上。
真核生物细胞中发现的多聚核糖体 (polyribosomes or polysomes) 现象,大大加速蛋白质合成的速度,提高了 mRNA 的利用率。
核糖体循环 Ribosome cycles
- 在细胞翻译的过程中,核糖体大、小亚基与 mRNA 彼此联系在一起,每轮翻译后解离。
- 核糖体大、小亚基的解离和再结合的过程称为核糖体循环。
核糖体的组成
- 核糖体是由几十种蛋白质和多种核糖体 RNA (ribosomalRNA,
rRNA) 所组成的亚细胞颗粒。 - 原核生物核糖体由约 2/3 的 RNA 及 1/3 的蛋白质组成。
- 真核生物核糖体中 rRNA 占 3/5,蛋白质占 2/5。
核糖体的结构
- 可解离为两个亚基,每个亚基都含有一个相对分子质量较大的 rRNA 和许多不同的蛋白质分子。
- 大多数核糖体蛋白位于核糖体的周边,核糖体 RNA 既是核糖体的结构成分,也是关键的功能调控区,例如肽基转移中心完全是出 RNA 组成的。
- 核糖体 RNA 决定核糖体的整体形状。
- 核糖体分子中可容纳两个 tRNA 和约 40bp 长的 mRNA。
Svedberg Units (sedimentation coefficients, 沉降系数 )
- S-value (Svedberg units): 估计大分子/细胞器的相对大小。(通过蔗糖梯度离心,S 取决于质量,密度和形状)
- The sedimentation rate(沉降速率):测量一定尺寸和形状的颗粒的沉降速度有多快。它通常用来反映分子在离心机的离心力作用下到达试管底部的速度。
- svedberg 实际测量的是时间,而不是质量;它被定义为正好 10-13 秒 (100 fs)
- 沉降系数为 26S (26×10-13s) 的物质在百万重力加速度 ( 107 m/s2 ) 的影响下将以 26 微米/秒 ( 26×10-6m/s ) 的速度行进。离心加速度为 rω2。
- 更大的粒子倾向于更快沉淀,因此具有更高的 svedberg 值。
★ rRNA
- 5S rRNA (原核,大亚基)
● 细菌 5S rRNA 含有 120 个核苷酸(革兰氏阴性菌)或 116 个核苷酸(革兰氏阳性菌)
● 5S rRNA 有两个高度保守的区域:
① 一个区域含有保守序列 CGAAC, 这是与 tRNA 分子 TψC 环上的 GTψCG 序列相互作用的部位,是 5S rRNA 与 tRNA 相互识别的序列。
② 另一个区域含有保守序列 GCGCCGAAUGGUAGU, 与 23S rRNA 的中一段序列互补,表明组成 50S 大亚基的这两种 RNA 之间可能存在相互作用。 - 16S rRNA (原核,小亚基)
● 长约 1475~1544 个核苷酸之间
● 含有少量修饰碱基
● 位于原核生物 30S 小亚基内
● 结构十分保守:
(1) 3’端一段 ACCUCCUUA 的保守序列,与 mRNA 5’端翻译起始区中的 SD 序列互补。
(2) 靠近 3’端处还有一段与 23S rRNA 互补的序列,在 30S 与 50S 亚基的结合中起作用。 - 23S rRNA (原核,大亚基)
23 S rRNA 基因包括 2904 个核苷酸:
● 第 1984~ 2001 核苷酸之间存在能与 tRNAMet序列互补的片段,表明核糖体大亚基 23S rRNA 可能与 tRNAMet的结合有关。
● 第 143 ~ 157 位核苷酸之间有一段 12 个核苷酸的序列与 5S rRNA 上第 72 ~ 83 位核苷酸互补,表明组成 50S 大亚基的这两种 RNA 之间可能存在相互作用。 - 5.8S rRNA (真核,大亚基)
● 真核生物核糖体大亚基特有的 rRNA
● 长度为 160 个核苷酸
● 含有修饰碱基
● 含有与原核生物 5S rRNA 中的保守序列 CGAAC 相同的序列,可能与 tRNA 作用的识别有关。
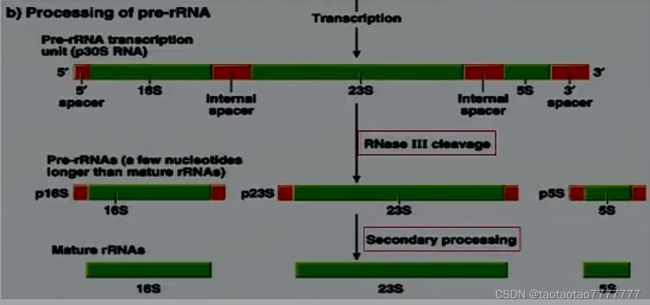
★ 原核生物 rRNA 的转录和加工
● 细菌核糖体 RNA 的转录和加工
- rDNA: 含有 rRNA 基因
- 三种不同的 rRNA 基因转录成一种 pre-rRNA 转录本:确保三种 rRNA 的量相同
- 转录单位的拷贝数低 (7)
● E.coli rRNA 转录单元结构
- 每个 rRNA 基因之间有间隔区 (spacer)
- tRNA 基因存在于某些间隔区中
- 转录起始与结构基因类似
● pre-rRNA 转录后加工
- pre-rRNA 与核糖体蛋白结合并进行加工
- RNase Ⅲ在转录发生时切割(共转录)
- RNase Ⅲ突变体积累 p30S
- RNA 酶 Ⅲ不产生成熟的 rRNA
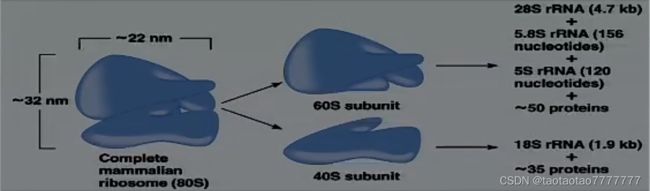
★ 真核生物 rRNA 的转录和加工
- 核糖体大小:80S; 60S+40S
- 大亚基:3 rRNAs→ 28S, 5.8S, 5S ~ 50 proteins
- 小亚基:rRNA→18S ~35 proteins
- 5.8S rRNA 与大肠杆菌 23S rRNA 的 5’末端同源
真核生物 rRNA 基因的结构特点
- 拷贝数大:适度重复的 DNA
- 18S, 5.8S, 28S rRNA 基因的单位串联的重复——簇
- 细胞核中存在一个或多个 rDNA 重复单位簇
- 在每个簇周围形成核仁 (nucleolus)
- 一些 rRNA 基因有内含子
- 5S rRNA 基因:不与其他 rRNA 基因聚集成簇,其基因拷贝数与其他 rRNA 基因无关
rRNA 合成场所
- 在核仁中 rRNA 被合成、加工并与核糖体蛋白组装以形成核糖体亚基
- 亚基然后被运输到细胞质中
rDNA 重复序列的转录
● 启动子
- A-45 to +7 core promoter element
- A-107 to -186 upstream control element (UCE)
- 启动子位于每个重复单元的上游 NTS 序列(非转录间隔区)中
● 转录因子和酶
- 转录因子在聚合酶之前与启动子结合
- 转录是通过 RNA 聚合酶Ⅰ进行的
- PolⅠ启动子的序列在不同物种间差别很大
- 不同类型的细胞具有用于 rDNA 转录的特异性激活剂不同
人类中 RNAP Ⅰ 介导的转录
- 两个因子:人上游结合因子 (hUBF) 和 SL1 复合物
- 启动子识别和 RNAPⅠ启动转录需要 SL1
- SL1 由 TBP (TATA 结合蛋白 ) 和三个 TAF (TBP 相关因子 ) 组成
pre-rRNA 的加工
- pre-rRNA 加工事件发生在 pre-rRNA, 5S rRNA 核糖体蛋白的复合物中。
- 核糖核酸酶切割去除
ITS(Internal transcribed spacer,内部转录间隔区) andETS(External transcribed spacer,外部转录间隔区) sequences - pre-rRNA 加工伴随着 60S 和 40S 亚基的形成。
snoRNA(核仁小 RNA) 作为 gRNAs, 将 RNA 修饰酶导向 pre-rRNA 的特定部分。缺失某些 snoRNA 会影响成熟 rRNA 的产生。- 加工过程含有很多修饰:主要是尿苷与假尿苷的甲基化和异构化。
- 在成熟核糖体中,5.8S rRNA 与 28S rRNA 以氢键键合。
pre-rRNA gene 中的内含子
- 只有少数生物的 rRNA 基因具有内含子
- 剪接不需要蛋白质,被归类为 Group Ⅰ内含子
- 内含子存在于:
酵母/真菌的线粒体和叶绿体的 mRNA、tRNA 和 rRNA 中
所有昆虫的 rRNA 基因中
噬菌体的 rRNA 基因、一些 mRNA 和 tRNA 基因中
5S rRNA 基因的转录
- 重复的基因单位不在核仁中;可能会聚集或不聚集。
- 由 RNA pol Ⅲ转录
- 它的启动子在基因内部:内部控制区 (ICR)
- Termination signal: poly(T)4+ 和侧翼 GC 丰富的序列形成茎环结构 (stem-loop-structure)
5.4 翻译过程
● 翻译是在核糖体中进行
- 核糖体小亚基负责对模板 mRNA 进行序列特异性识别
- 大亚基负责携带氨基酸及 tRNA 的功能,肽键的形成、AA-tRNA、肽基-tRNA 的结合等主要在大亚基上。
核糖体上重要位点
A 位点(aminoacyl site), 新到来的 氨酰-tRNA 的结合位点;P 位点(peptidyl site), 肽酰-tRNA 结合位点;E 位点(Exit site), 释放去氨酰-tRNA 的位点。- 只有 (f)Met-tRNAfMet 能与第一个 P 位点相结合, 其它所有 tRNA 都必须通过 A 位点到达 P 位点,再由 E 位点离开核糖体。
- mRNA 进入和离开的通道位于小亚基
- 每一个 tRNA 结合位点都横跨核糖体的两个亚基,位于大、小亚基的交界面。
- 多肽链离开的通道位于大亚基中,通道的大小仅允许新合成的多肽非常有限的折叠 (α螺旋)。
翻译过程
5.4.1 起始前事件:氨基酸活化和核糖体解离
起始前事件(一):氨基酸的活化 / tRNA 负载 (
tRNA charging)
- 氨基酸必须在氨酰-tRNA 合成酶的作用下生成活化氨基酸-AA-tRNA:
AA + tRNA + ATP → AAtRNA + AMP + PPi - 所需组分:
20 种氨基酸
20 种氨酰-tRNA 合成酶
20 种或更多的 tRNA
ATP
Mg2+ - 真核生物起始 tRNA 是 Met-tRNAMet;
原核生物起始 tRNA 是 fMet-tRNAfMet (甲酰化修饰)

起始前事件(二):核糖体解离
- 在每一轮翻译结束后,核糖体都要解离成亚基。
- 在大肠杆菌中核糖释放因子 (RRF) 和延伸因子 (EF-G) 促进核糖体解离。
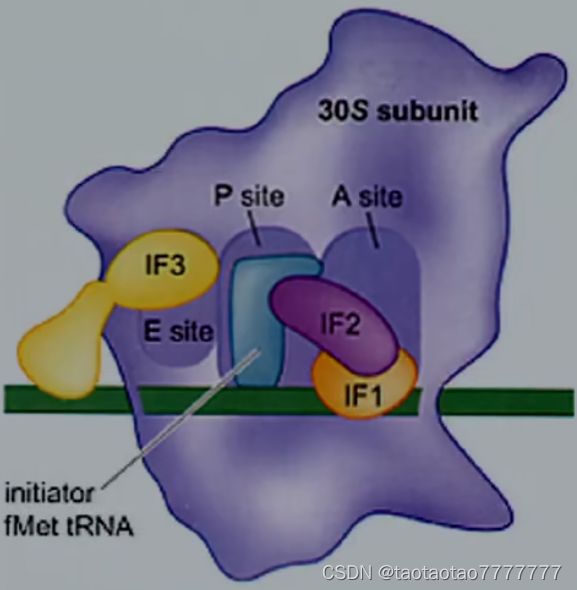
- IF3 结合到游离的 30S 亚基上,阻止其与 50S 亚基形成完整的核糖体。
5.4.2 翻译的起始
● 翻译的起始是指:在模板 mRNA 编码区 5’端形成核糖体-mRNA-起始 tRNA 复合物,并将 (甲酰)甲硫氨酸放入核糖体 P 位点。
● 成功的翻译起始需要:
- 核糖体结合到 mRNA 并精确定位到起始密码子上;
- 负载的 tRNA 定位到核糖体。
翻译的起始
- 原核生物:30S 小亚基首 先与 mRNA 模板相结合,再与 fMet-tRNAfMet 结合,最后与 50S 大亚基结合生成 70S·mRNA·fMet-tRNAMet 起始复合物。
- 真核生物:40S 小亚基首 先与 Met-tRNAMet 相结合,再与模板 mRNA 结合,最后与 60S 大亚基结合生成 80S·mRNA·Met-tRNAMet 起始复合物。
(原核生物)大肠杆菌翻译起始
● 所需组分:
-
30 S 小亚基、50 S 大亚基
-
模板 mRNA
-
fMet-tRNAfMet
-
3 个翻译起始因子,IF-1, IF-2, IF-3
-
GTP
-
Mg2+
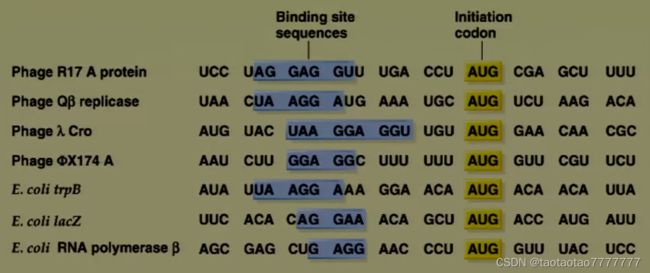
★ 核糖体对 mRNA 起始密码子的识别
-
30S 亚基上 16S rRNA 3’末端的富嘧啶区 5’-GAUCACCUCCUUA-3’, 能专一性识别 mRNA 上的 SD 序列。
-
16S rRNA 与 mRNA 上 SD 序列的相互作用将 AUG 定位于 P 位点。
- 起始因子结合 30S 核糖体小亚基
- IF1 防止 tRNA 结合到小亚基未来 A 位点的位置上。
- IF2 是 GTP 酶,它与起始过程的 3 个主要成分相互作用,催化 fMet-tRNAfMet 和小亚基的结合,并阻止其他负载 tRNA 与小亚基结合。
- IF3 结合于小亚基并阻止其与大亚基结合,对新的循环至关重要。
★ 翻译起始复合物的形成:
- 30S 小亚基与翻译起始因子 IF-1,IF-3 结合,通过 SD 序列与 mRNA 模板相结合。
- fMet-tRNAfMet 在 IF-2 的协同下进入小亚基的 P 位,tRNA 上的反密码子与 mRNA 上的起始密码子配对。charged tRNA 结合到核糖体上是需要能量(GTP 酶 IF-2 提供)的。
- 带有 tRNA、mRNA、三个翻译起始因子的小亚基复合物与 50S 大亚基结合,释放翻译起始因子。
真核生物翻译的起始
- 核糖体较大,有较多的起始因子,与原核生物有不同的起始机理
- 没有 SD 序列
- 有多重形式,主要是 “帽子”依赖的翻译起始,其中 mRNA 分子 5’端的 “帽子” 和 3’端的 多聚 A 都参与形成翻译起始复合物
- The internal AUG use a different tRNAMet.
- Initiation Met is not 甲酰化(formylated). 起始 Met 不是甲酰化的
- 40S 亚基对 mRNA 起始密码子的识别经过扫描 (Scanning)。
翻译起始途径
(一) 帽依赖的翻译起始(Cap-dependent initiation):真核生物中的主要翻译起始途径。
★ 起始过程包括:
(1)在模板 mRNA 编码区 5’端形成小亚基起始复合物;
(2)小亚基起始复合物 “扫描”和定位第一个 AUG;
(3)形成完整的核糖体-mRNA-起始 tRNA 复合物;
(4)将 Met 放入核糖体 P 位点,形成完整的起始复合物。
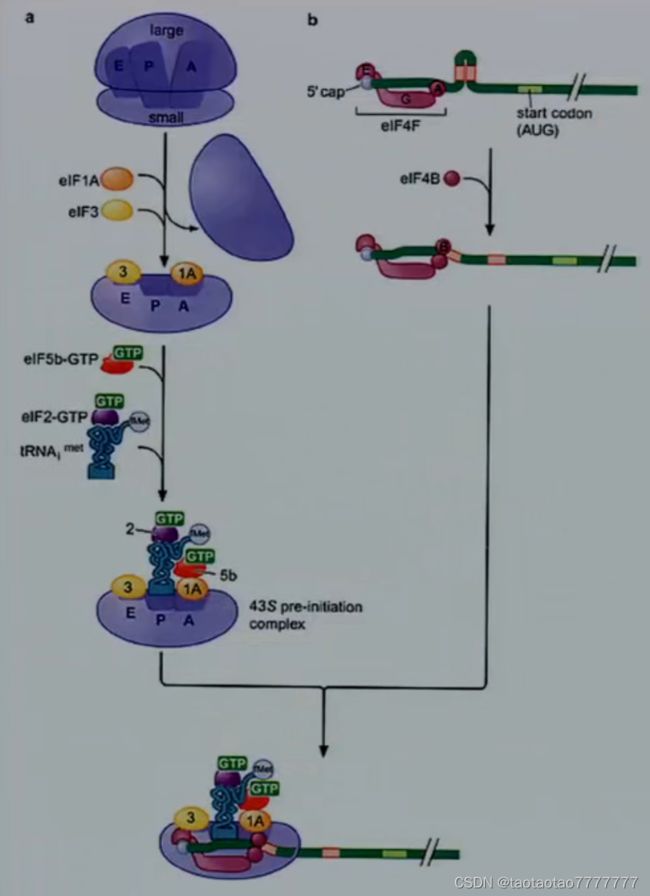
★ (1)形成多种起始复合物
① 形成 cap-binding protein complex(含 eIF4F 复合物), 解开 mRNA 末端的二级结构。
② 形成 43S 小亚基前起始复合物:含 eIF3;需要 eIF2-GTP 和 eIF5b-GTP。
③ 形成小亚基起始复合物:43S 起始前复合体识别 5’帽结构,并通过 eIF3 与 eIF4F 间的相互作用 募集 43S 起始前复合体到 mRNA 上。
★
cap-binding protein complex帽结合蛋白复合物
● 对于核内 RNA 的剪接,RNA 3’端形成很重要,防止 5’核酸外切酶的切割。
● 促进大多数 mRNA 的翻译起始;作为翻译起始因子复合体的装配地点。
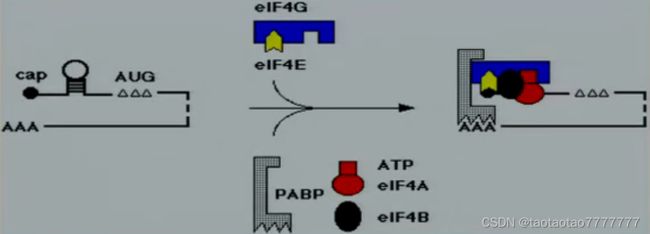
● Protein complex eIF4F containing eIF4A, eIF4E (cap-binding protein) and eIF4G.
● eIF4E-eIF4G 复合物与 mRNA 的相互作用触发选择翻译起始位点。过程如下:
① eIF4G-eIF4E 复合物直接与帽结构结合,这种相互作用需要功能性 eIF4A,并被帽类似物 如 m7GDP 阻断。
② 结合的 eIF4E-eIF4G-eIF4A 复合物与 eIF4B 和 Poly(A) 结合蛋白 (PABP) 结合,并打开帽子附近的 mRNA 二级结构以释放核糖体结合位点。该过程需要 eIF4A 与 ATP,eIF4A 水解 ATP 提供能量。
★ poly (A) 尾部在翻译中的作用
① 增强翻译的效率:帽结合蛋白复合物中的起始因子 eIF4G 氨基末端结构域 与 PABP 的相互作用,这种相互作用 对于 mRNA 的有效翻译是必需的,它刺激 40S 核糖体与 mRNA 结合。
② mRNA 的 5’末端和 3’末端在翻译起始的早期阶段相互作用,导致 mRNA 的环化,从而形成环化的多核糖体。
● 在酵母中,eIF4G-PABP 相互作用受热休克蛋白 70 与辅助伴侣蛋白 Sis1(hsp40)一起刺激;在来自大鼠垂体的组织切片的电子显微照片中观察到环化的多核糖体。
● 优先翻译具有 pA 的 mRNA(易形成环状)
● 一旦核糖体完成了通过 poly-A 尾而环化的 mRNA 的翻译,新释放的核糖体被理想地置于同一 mRNA 的起始翻译位点上,提高 mRNA 的翻译效率。
eIF4G 水平的潜在自我调节
● eIF4G 有内部起始序列
● eIF4G mRNA 的内部起始提供了翻译水平上 eIF4G 自我调节的潜力。
● 内部起始的生物学意义
· 存在于从酵母到哺乳动物的大多数真核细胞中。
· 可以在临时关闭总体(帽依赖性)蛋白质合成的条件下发挥重要功能,维持重要蛋白质的表达量;
· 内部起始翻译还可维持有丝分裂和程序性细胞死亡期间重要蛋白质的合成。例如,在细胞凋亡期间通过特定的“死亡 IRES"刺激细胞凋亡蛋白的翻译。
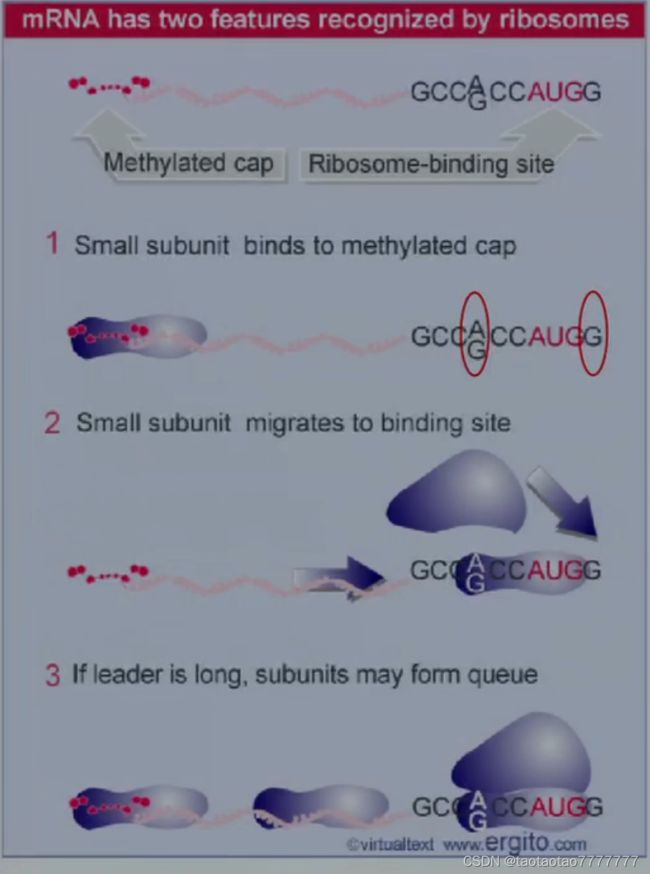
★ (2)Kozak 的“扫描模型”
● 真核生物核糖体小亚基起始复合物从 mRNA 的 5’端(帽子)向包括 AUG 起始密码子的核糖体结合位点滑动。
★Kozak 序列:AUG 前的序列(相当于原核生物的 SD 序列):CCACC 或 CCGCC。
● G(A) 及 AUG 后面的 G 可十倍地影啊翻译效率。构建载体时,为提高蛋白表达量,需要在 AUG 前加 Kozak 序列,即 CCACCAUGG 或 CCGCCAUGG。
● 扫描过程需要起始因子 eIF1 and eIF1A。缺少这两个因子时核糖体能结合帽结构但不能到达 AUG 密码子。
● 依赖于 ATP。
● (3)形成完整的核糖体-mRNA-起始 tRNA 复合物
在 AUG 密码子处,60S 亚基结合形成能够翻译延伸的 80S 核糖体。
(二) 帽不依赖的翻译起始(Cap-independent internal initiation)
现象:
● 某些病毒的 RNA 不被加帽修饰,并且具有异常长的 5’ 非翻译区(UTR,300-800nt)
● 它们的 前导区 (leader regions) 包含 多个 AUG 密码子
● 抑制 cap-dependent translation 的药物不能抑制它们的翻译
→ 预测这些 RNA 存在独特的翻译起始途径
★ IRES (internal ribosome entry site) sequences
(载体 P-IRES-EGFP 中有 IRES 元件)
● 在有或者没有起始因子的帮助下,核糖体能结合到 IRES 序列(一段富含嘧啶的 mRNA 序列),不同来源的 IRESs 的核苷酸序列是不同的,形成 RNA 结构来结合核糖体。
● 可以通过 ITAF 蛋白(IRES 反式作用因子)将核糖体运输到起始位点
● Viral IRES:AUG 密码子上游约 20 个核苷酸位置,含有聚嘧啶序列
(三) 重新起始
★ 原核生物中的重新起始途径
●RRF(核糖体释放因子)的失活导致终止密码子下游的翻译重新启动。
● 70S 核糖体在终止时不会从 mRNA 上脱落,并且在下游翻译起始位点起始翻译。
● 70S 核糖体跨越翻译偶联基因之间的边界
(四) 核糖体分流(Ribosome shunting )
- 适用于有多个 ORF 或 ORF 远离真核生物 mRNA 中的 Cap 时
- 核糖体以帽依赖的方式绑定到 mRNA 上,但随后跳过包 RNA 二级结构的 mRNA 的大区域,“跳跃” 到上游 AUG 和开放阅读框

花椰菜花叶病毒(CaMV) 中核糖体分流模型 ribosomal shunting Model
● 40S 亚基结合帽结构并开始扫描过程;
● 在小开放阅读框(sORF)中,核糖体在终止密码子处终止翻译;
● 40S 亚基恢复扫描并从供体位点(D)切换到 mRNA 的受体位点(A);
● A 区中的起始复合物然后扫描 mRNA,并在 ORF 的起始密码子处起始翻译。
5.4.3 肽链的延伸
- 生成起始复合物,第一个氨基酸(fMet/Met-tRNA)与核糖体结合以后,肽链开始伸长。
- 按照 mRNA 模板密码子的排列,氨基酸通过新生肽键的方式被有序地结合上去。
● 肽链的延伸需要组分
- 功能核糖体(起始复合物)
- AA-tRNA
- 延伸因子 (charged tRNA)
- GTP,Mg2+
- 肽基转移酶
● 肽链延伸中的每个循环都包括三步:
(1) AA-tRNA 与核糖体结合;
(2) 肽键的生成;
(3) 移位。
(1) AA-tRNA 与核糖体结合;
● 细菌中肽链延伸的第一步反应:新的氨酰-tRNA 结合到 A 位。(耗能)
● 该氨酰-tRNA 首先与 EF-Tu·GTP 形成复合物,进入核糖体的 A 位,水解产生 GDP 并在 EF-Ts 的作用下释放 GDP 并使 EF-Tu 结合另一分子 GTP,进入新一轮循环。
● 由于 EF-Tu 只能与 fMet-tRNA 以外的其他 AA-tRNA 起反应,所以起始 tRNA 不会被结合到 A 位上,mRNA 内部的 AUG 不会被起始 tRNA 读出,肽链中间不会出现甲酰甲硫氨酸。
(2) 肽键的生成
● 多肽链上肽键形成的化学反应——缩合反应
● N-to C-:蛋白质的合成方向是从氨基端向羧基端方向进行
● Peptide bonds are formed by transfer of the growing peptide chain from peptidyl-tRNA to aminoacyl-tRNA.
肽键的生成是在核糖体中进行的
● 在核糖体·mRNA·AA-tRNA 复合物中,AA-tRNA 占据 A 位,fMet-tRNAfMet 占据 P 位。
● 生长肽链的 C 端与 P 位的 tRNA 分离,与新的氨基酸之间形成肽键。
● 构象的变化导致大亚基的移动,使两个 tRNA 的 N 端移到大亚基的 E 和 P 位,而在小亚基中它们仍位于 P 和 A 位。
肽键的形成是由 23S rRNA 组分催化的:
● 核糖体是核酶:23S rRNA 催化肽键的生成
● 23S rRNA 与处于 A 和 P 位点的 tRNA 的 CCA 末端之间的碱基配对,帮助氨酰-tRNA 的α氨基基团攻击结合于肽酰-tRNA 的多肽的碳基团。
(3) 移位
● 核糖体通过 EF-G 介导的 GTP 水解所提供的能量向 mRNA 模板 3’末端移动一个密码子,使两个 tRNA 完全进入 E 位和 P 位(去氨酰-tRNA 被挤入 E 位;肽基-tRNA 进入 P 位),mRNA 上的第三位密码子对应于 A 位准备开始新一轮肽链延伸。
● 用嘌呤霉素 (AA-tRNA 的结构类似物,能占据 A 位)作为抑制剂做实验表明,核糖体沿 mRNA 移动与肽基-tRNA 的移位这两个过程是耦联的。
● 肽链延伸是由许多个这样的反应组成的:
· 原核生物中每次反应共需 3 个延伸因子,EF-Tu、EF-Ts 及 EF-G;
· 真核生物细胞需 EF-1 及 EF-2,消耗 2 个 GTP, 向生长中的肽链加上一个氨基酸。
5.4.4 肽链的终止
● 需要组分
- GTP
- mRNA 上的终止密码子
- 释放因子
肽链的终止
- 当终止密码子 UAA、UAG 或 UGA 出现在核糖体的 A 位时,没有相应的 AA-tRNA 能与之结合。
- 释放因子能识别这些密码子并与之结合,水解 P 位上多肽链与 t-RNA 之间的二酯键,释放新生的肽链和 tRNA。
- 核糖体大、小亚基解体,蛋白质合成结束。
- 释放因子 RF 具有 GTP 酶活性,它催化 GTP 水解,使肽链与核糖体解离。
释放因子(终止因子)
① Ⅰ类释放因子:
识别终止密码子,能催化新合成的多肽链从 P 位点的 tRNA 中水解释放出来;
② Ⅱ类释放因子:
在多肽链释放后刺激Ⅰ类释放因子从核糖体中解离出来。
● 细菌细胞中的释放因子:
- RF1(Ⅰ类)能识别 UAG 和 UAA
- RF2(Ⅰ类)识别 UGA 和 UAA
一旦 RF 与终止密码相结合,它们就能诱导肽基转移酶把一个水分子而不是氨基酸加到延伸中的肽链上。 - RF3 (Ⅱ类)与核糖体的解体有关。
● 真核细胞中的释放因子:
- eRF1 (Ⅰ类)能识别三个终止密码子
- eRF3 (Ⅱ类)
Generalized G protein cycle

顶部的 G 蛋白(红色三角形)处于未结合状态(失活状态),既没有 GDP 也没有 GTP 结合。这种状态通常是短暂的。
(a) GTP 与未结合的 G 蛋白结合,改变其构象(由三角形变为圆形表示),从而激活它。
(b) GTPase 激活蛋白(GAP)刺激 G 蛋白的内在 GTP 酶活性,使其将 GTP 水解为 GDP。这导致另一种构象变化,由方形变化代表,其使 G 蛋白失活。
© 鸟嘌呤核苷酸交换蛋白(GEP)从 G 蛋白中去除 GDP,将其变回原来的未结合状态,该结合状态准备接受另一个 GTP。
★ 真核生物和原核生物翻译的区别
5.4.5 新合成多肽链的折叠和加工
● 蛋白质前体的加工
新生的多肽链大多数没有功能,必须经过加工修饰才能转变为活性蛋白质。
- N 端 fMet 或 Met 的切除
无论原核生物还是真核生物,N 端的甲硫氨酸往往在多肽链合成完毕前就被一种氨肽酶切除。 - 二硫键的形成
· 蛋白质的二硫键是蛋白质合成后通过两个半胱氨酸的氧化作用产生的。
· 二硫键的正确形成对稳定蛋白质的天然构象具有重要的作用。
● 蛋白质前体的加工(1)———特定氨基酸的修饰
氨基酸侧链的修饰作用包括:
- 磷酸化(如核糖体蛋白质)
- 糖基化(如各种糖蛋白)
- 甲基化(如组蛋白)
- 乙酰化(如组蛋白)
- 泛素化
- 羟基化(如胶原蛋白)
- 羧基化等 …
磷酸化 (Phosphorylation)
● 主要由多种蛋白激酶催化。
● 发生在丝氨酸、苏氨酸和酪氨酸等三种氨基酸的侧链。
● PKs (protein kinases) and PPs (protein phosphatases) mediate phosphorylation and dephosphorylation of proteins respectively.PKs(蛋白激酶)和PPs(蛋白磷酸酶)分别介导蛋白质的磷酸化和去磷酸化。
糖基化
● 糖蛋白主要是蛋白质侧链上的 天冬氨酸、丝氨酸、苏氨酸残基 (都含羟基)加上糖基(也有羟基,两个羟基反应产生醚键)形成的;
● 内质网可能是蛋白质 N-糖基化的主要场所。
● 所有的分泌蛋白和膜蛋白几乎都是糖基化蛋白质。
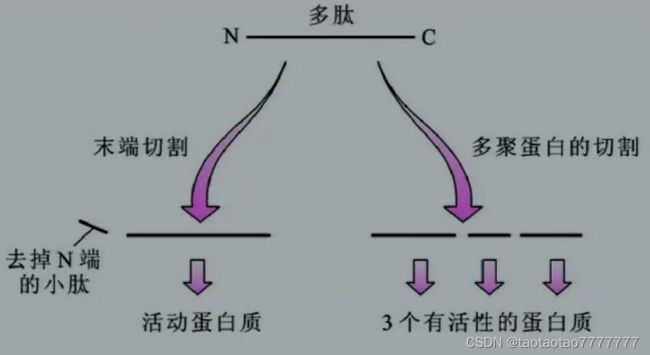
● 蛋白质前体的加工(2)——切除新生肽链中非功能片段
-
左:新生蛋白质在去掉 N 端一部分残基(比如膜蛋白的N端信号肽) 后变成有功能的蛋白质。
-
右:某些病毒或细菌可合成无活性的多聚蛋白质,经蛋白酶切割后成为有功能成熟蛋白。
● 蛋白质前体的加工(3)——蛋白质的折叠
- 蛋白质折叠是翻译后形成功能蛋白质必经阶段。
- 是一个复杂的过程:
首先折叠成二级结构,然后再进一步折叠盘绕成三级结构。
对于单链多肽蛋白质,三级结构就已具有蛋白质的功能;
对于寡聚蛋白质,仍需进一步组装成更为复杂的四级结构,才能表现出天然蛋白的活性或功能。
分子伴侣 (molecular chaperone)
● 分子伴侣是一类序列上没有相关性但有共同功能的保守性蛋白质,它们在细胞内能帮助其它多肽进行正确的折叠、组装、运转和降解。
伴侣蛋白在其内部对底物蛋白质进行折叠
● 分子伴侣的分类
- (1)
热休克蛋白 (heat shock protein)
它是一类应激反应性蛋白,包括 HSP70、HSP40 和 GrpE 三族,广泛存在于原核及真核细胞中。三者协同作用,促使某些能自发折叠的蛋白质正确折叠形成天然空间构象。 - (2)
伴侣素 (chaperonin)
包括 HSP60 和 HSP10 (原核细胞中的同源物分别为 GroEL 和 GroES),它主要是为 非自发性折叠蛋白提供能折叠形成天然结构的微环境。
● 伴侣分子在新生肽链折叠中的作用
- 防止或消除肽链的错误折叠
- 增加功能性蛋白质折叠产率来发挥作用,而非加快折叠反应速度
- 分子伴侣本身并不参与最终产物的形成。
★ 蛋白质合成抑制剂
- 蛋白质生物合成的抑制剂主要是一些抗生素,如嘌呤霉素、链霉素、四环素、氯霉素、红霉素等。
- 此外,5-甲基色氨酸、环已亚胺、白喉毒素、蓖麻蛋白和其他核糖体灭活蛋白都能抑制蛋白质的合成。
● 蛋白质生物合成抑制剂的作用原理(抑制蛋白质合成的任一步)
- 阻止 mRNA 与核糖体的结合;
- 阻止 AA-tRNA 与核糖体的结合;
- 干扰 AA-tRNA 与核糖体结合而产生错读;
- 作为竞争性抑制剂抑制蛋白质的合成。
● 常见抗生素抑制蛋白合成的作用原理
- 氯霉素阻止 mRNA 与核糖体的结合;
- 四环素类阻止 AA-tRNA 与核糖体的结合;
- 链霉素、新霉素、卡那霉素干扰 AA-tRNA 与核糖体结合而产生错读。
- 青霉素、四环素和红霉素只与原核细胞核糖体发生作用,从而阻遏原核生物蛋白质的合成,抑制细菌生长。
- 氯霉素和嘌呤霉素既能与原核细胞核糖体结合,又能与真核生物核糖体结合,妨碍细胞内蛋白质合成,影响细胞生长。
● 链霉素是一种碱性三糖,可以多种方式抑制原核生物核糖体:
- 能干扰 fMet-tRNA 与核糖体的结合,从而阻止蛋白质合成的正确起始;
- 也会导致 mRNA 的错读。若以多聚 (U) 作模板,则除苯丙氨酸(UUU) 外,异亮氨酸 (AUU) 也会被掺入。
- 链霉素的作用位点在 30S 亚基上。
● 嘌呤霉素 (puromycin)是 AA-tRNA 的结构类似物
- 嘌呤霉素通过提前释放肽链(提前终止)来抑制蛋白质合成
- 不需要延伸因子就可以结合在核糖体的 A 位上,抑制 AA-tRNA 的进入。
- 它所带的氨基也能与生长中的肽链上的羧基反应生成肽键,反应的产物是一条 3’羧基端挂了一个嘌呤霉素残基的小肽,肽酰嘌呤霉素随后从核糖体上解离出来。
翻译相关的生物学应用
- Kozak 序列 提高翻译效率,在要表达的序列起始密码子 AUG 前加入 Kozak 序列。
- SD 序列 在原核生物中表达多个蛋白质
- IRES 表达两个基因
- 体外翻译系统 研究蛋白的机理
- 抗生素与筛选系统、翻译机理研究
- ARS/AA-tRNA/tRNA
。。。
作业题
文献阅读:A semi-synthetic organism that stores and retrieves increased genetic information