iMeta|暨南大学陈嘉莉/白卫滨综述高脂饮食介导的肠菌紊乱与慢性疾病的互作机制...
点击蓝字 关注我们
新视角:高脂饮食介导的肠菌紊乱与慢性疾病的互作机制研究
原文链接DOI: https://doi.org/10.1002/imt2.69
综 述
● 2023年1月5日,暨南大学陈嘉莉和白卫滨团队在iMeta在线发表了题为“New insights into the mechanisms of high-fat diet mediated gut microbiota in chronic diseases”的文章。
● 本研究系统总结了在高脂饮食(HFD)介导的慢性疾病发病机制中,胆汁酸、脂多糖、短链脂肪酸和氧化三甲胺与特征肠道菌的协同机制,并提供了相关新的见解,指出 HFD 介导慢性疾病中肠道菌群紊乱的潜在生物标志物。
● 第一作者:陈嘉莉 ([email protected])
● 通讯作者:白卫滨([email protected])
● 合作作者:肖宇航、李冬梅、张世卿、吴英姿、张卿
● 主要单位:暨南大学食品安全与营养研究院、香港浸会大学癌症炎症研究中心、乔治城大学医学中心、暨南大学药学院
亮 点
● 肠菌紊乱增加宿主对疾病的易感性
● 系统总结了高脂肪饮食 (HFD) 介导的肥胖、糖尿病、胃肠疾病、神经退行性疾病和心血管疾病等五大类慢病中的特征肠道微生物
● 胆汁酸、脂多糖、短链脂肪酸和氧化三甲胺是 HFD 诱发的慢性疾病中肠菌互作机制的共性特征
● FXR、TGR5、NF-κB、PPAR-γ 和 PERK 是肠菌互作机制中的关键信号通路
● 为慢性疾病病程中肠道菌群、细菌代谢产物和免疫反应的互作机制提供了新的见解
摘 要
高脂饮食 (HFD) 已成为慢性疾病发生发展的主要风险因素。肥胖症、糖尿病、胃肠疾病、神经退行性疾病和心血管疾病长期以来被认为是世界范围内发病率高的慢性疾病。本文系统总结了在 HFD 介导的慢性疾病发病机制中,肠道菌群及其代谢产物所起到的不可忽视作用。众所周知,肠道菌群失调将增加宿主本身的疾病易感性。许多研究表明 HFD 使得肠道内 Erysipelotrichaceae、兼性厌氧细菌和机会性致病菌繁殖增多,并加剧许多慢性疾病的病程。胆汁酸、脂多糖、短链脂肪酸和氧化三甲胺长期以来被认为是细菌互作过程中的主要代谢产物,我们将在 HFD 诱导的慢性疾病的背景下探索这些代谢物和肠道菌群发挥的协同作用及互作机制。我们从 PubMed、Google Scholar 和 Scopus 收集了关于 HFD、肠道菌群相关的近期文献,系统阐述了上述机制并提供了相关新的见解,指出 HFD 介导慢性疾病中肠道菌群紊乱的潜在生物标志物。
视频解读
Bilibili:https://www.bilibili.com/video/BV1CP4y1C7eg/
Youtube:https://youtu.be/-iY-q4IJf84
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
日常饮食是人类获取营养最有效和最常见的方式之一。然而,过量摄入食物中的饱和脂肪和反式脂肪酸可能与一系列慢性疾病有关。食品制造业的快速发展使得人类生活方式和饮食模式发生着改变,尤其是高脂饮食 (HFD) 的普遍流行。有证据表明,人类最高可耐受到50%-60%的来自脂肪的能量,实际上典型的美国或欧洲饮食中由脂肪提供的能量约占总热量的 36%-40%。而目前临床实验中常采取的 HFD 中脂肪所提供的能量约占52%-65%。此外,大多数关于啮齿类鼠模型的基础研究中 HFD 的脂肪含量通常为45%或60%。大量研究表明,HFD 与人体健康呈负相关,包括体重增加、内脏脂肪蓄积、肠道菌群失调、胰岛素抵抗、结肠损伤、氧化应激和认知障碍。而慢性病的死亡率高达70%。Fanelli 等人发现,大多数慢性疾病患者都有特定的饮食特征,包括糖、饱和脂肪的过多摄入和碳水化合物、膳食纤维的低摄入。越来越多的证据表明,HFD 成为了慢性病的危险因素,这应该引起高度关注。
肠道微生物是人体胃肠道微生物群落的总称,包括了1000 种以上的细菌,其总数在1013-1014。肠菌紊乱和宿主健康负相关。大量研究表明,肠道菌群失调可能会对慢性疾病进程产生深远的负面影响,如肥胖、糖尿病、心血管疾病、胃肠道疾病和中枢神经系统疾病。而肠道微生物的组成可能受到各种潜在因素的影响,包括长期生活方式的改变、饮食、营养、药理学因素、感染、妊娠和宿主遗传等因素。因此,肠道菌群在高脂或高脂高糖饮食 (HF/HSD) 诱导的慢性疾病的病程中起着至关重要的作用。因此对 HFD、肠道菌群和慢性病之间的数据进行系统性总结和互作机制解析是非常有必要的。
迄今为止,许多综述总结都集中在基于某一类疾病与 HFD 介导的肠道菌群变化的联系讨论上。然而,关于 HFD 引起的特征微生物、代谢产物的丰度变化及其在主要慢性病中的共性机制整合,仍缺乏系统性的综述。因此,本文旨在充分挖掘高脂饮食模式下的特征肠道菌和代谢产物,及探讨胆汁酸、脂多糖、短链脂肪酸和氧化三甲胺与特征肠道菌的协同机制。以下部分系统地阐述了 HFD 对五种常见慢性病(包括肥胖、糖尿病、心血管疾病、胃肠疾病和神经退行性疾病)中肠道菌群的影响及其响应机制。
高脂饮食模式下肠道微生物与肥胖
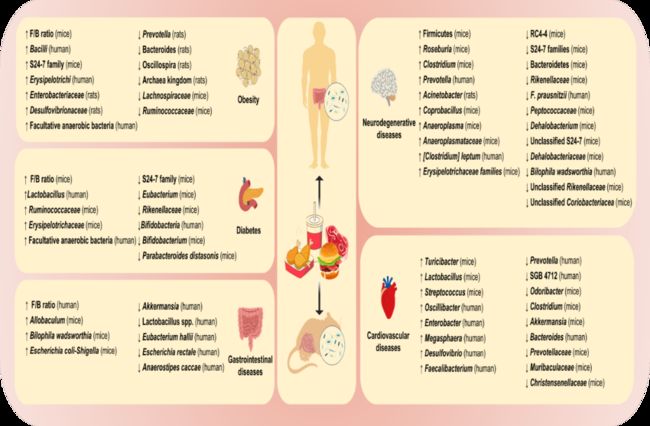
1977年,世界卫生组织首次将肥胖定义为一种慢性疾病。到2016年,全球肥胖发病率已达13%,这可能与人们高脂肪、高能量食物摄入的普遍过量有关。越来越多的证据表明,肠道菌群失调在饮食诱导的肥胖发病机制中起着重要作用。临床研究表明,Firmicutes/Bacteroidetes 的比例变化可能与肥胖的发生密切相关。Ley 等人还发现,肥胖人群体内 Bacteroidetes 数量相对较少。而 HFD 动物模型常用于评估肠道菌群与饮食诱导肥胖的相关性。与正常小鼠相比,HF/HSD 不能引发无菌小鼠肥胖。
肠道菌群变化可能是饮食诱导肥胖发病机制中涉及的靶途径。Cani 等人还指出,肥胖与 Bifidobacteria 的减少密切相关。Turnbaugh 等人揭示,与对照组相比,在HF/HSD 组观察到Firmicute中 Erysipelotrichi 和 Bacilli 成员的比例更高。Daniel 等人发现 HFD 组中 Ruminococcaceae 的比例下降,这与 HFD 配方中碳水化合物,尤其是植物多糖的比例显著下降有关。基于非靶向元蛋白质组学的研究表明,膳食模式的转变可以改变肠道微生物的组成,影响类固醇代谢途径。与此同时,另一项研究显示,低膳食纤维含量的饮食可能会导致大鼠体内 Archaea kingdom,降解植物多糖的 Prevotella 和 Oscillospira 的减少。部分肠菌与肥胖高度相关。Kuibecket 等人指出,在肥胖的发生中 Clostridium 的丰度显著增加,同时胆汁酸水平和胆固醇代谢也受到影响,这可能与肠道微生物区系的 FXR 信号转导途径有关。Kang 等人发现,高脂饮食可导致与产脂多糖 (LPS) 相关的 S24-7 丰度增加,进而增加体循环中细菌脂多糖水平。作为代谢性内毒素血症的特征之一的脂多糖会加重慢性低度炎症的肥胖。产脂多糖细菌的增多可能是 HFD 小鼠肥胖的潜在病因,如 Enterobacteriaceae 和 Desulfovibrionaceae。
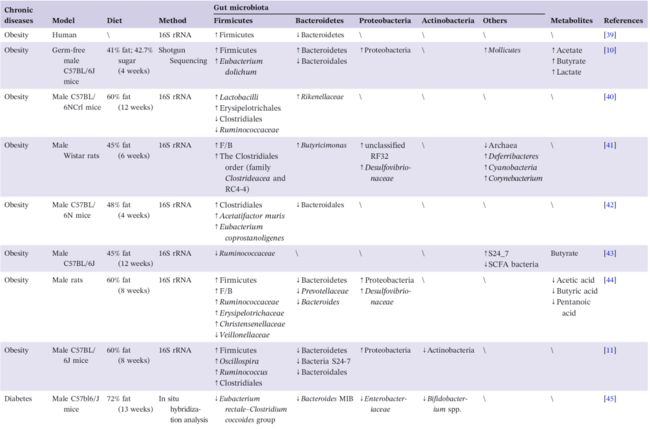
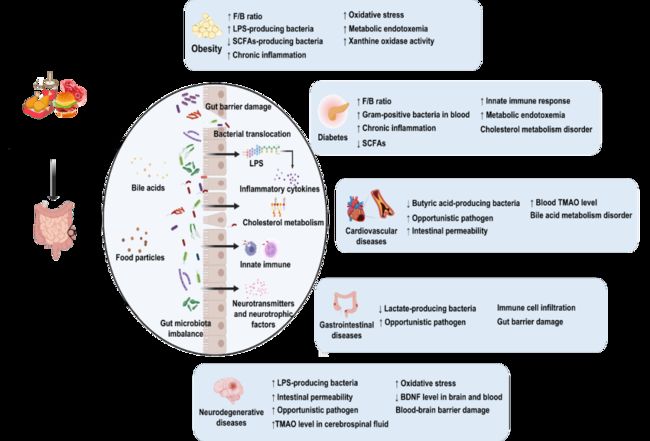
健康肠道中富含产生短链脂肪酸 (SCFAs) 的细菌,包括 Prevotella, Bacteroides,Ruminococcaceae, 和 Lachnospiraceae。这些 SCFAs 有利于维持肠道内的厌氧环境。研究表明,高脂食物和单糖的摄入会减少产 SCFAs 的肠道细菌的数量同时增加了兼性厌氧菌的生长。黄嘌呤氧化酶活性通常用于分析肥胖人群的氧化应激水平。因此,氧化应激水平可以被认为是脂肪蓄积的关键指标。Pan 等人指出,肠道菌群与嘌呤和尿酸代谢密切相关。综上所述,动物和流行病学研究表明,饮食诱导的肥胖与高水平的血糖、血脂和代谢性内毒素血症有关,主要通过影响肠道菌群的组成实现,譬如增加 Firmicutes/Bacteroidetes 的比例、产脂多糖细菌和兼性厌氧菌,或减少产 SCFAs 细菌的丰度(表1,图1)。如表1所示,HFD 诱导肥胖主要影响 Firmicutes 和 Bacteroidetes 中各类细菌丰度。然而,目前多数研究以 16S ribosomal RNA (rRNA) 测序为手段,而这在物种水平分类的准确性较低。因此,基于宏基因组测序,从物种水平对肠菌基因和功能研究的深入挖掘,对于研究饮食、肥胖和肠道微生物之间的潜在机制非常重要。而微生物高通量单细胞测序新技术进一步为菌株水平变化的独特见解提供了探讨的可能。
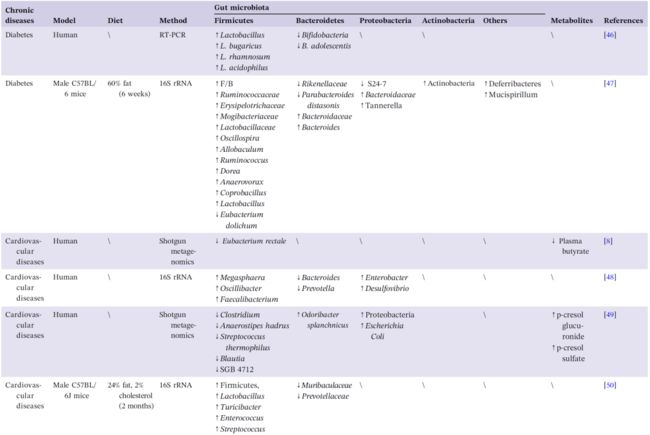
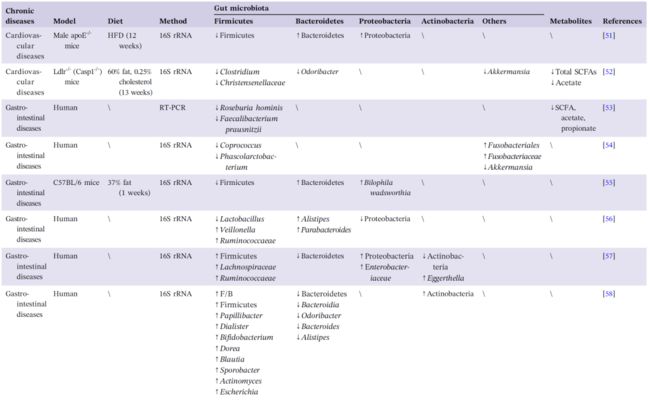
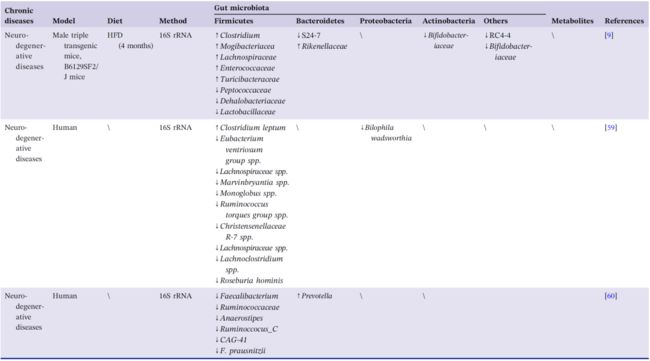
表1. 高脂饮食介导的肥胖、糖尿病、心血管疾病、胃肠疾病和神经退行性疾病中肠道生态的改变
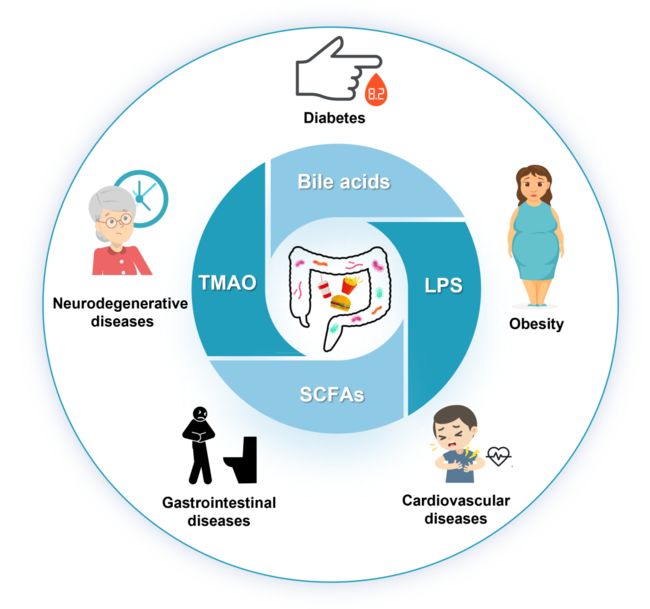
图1. 肠道菌群在高脂饮食介导的慢性疾病中的作用
高脂饮食模式下肠道微生物与糖尿病
糖尿病是一种严重的慢性疾病,伴有多系统并发症,包括肾病、视网膜病变、神经病变、缺血性心脏病、中风和外周血管疾病。2019年统计数据显示,全球糖尿病患者已高达4.63亿。更甚者,超半数糖尿病患者尚未意识到自身患有糖尿病。2020年,世界卫生组织指出,糖尿病已列于全球十大死因之内。二型糖尿病 (T2D) 是糖尿病中发病最为普遍的一种,其主要原因是胰岛素分泌不足,这可能与种族、家族史、年龄、不健康饮食、吸烟和肥胖等因素有关。
研究表明肠道细菌在 HFD 诱发的糖尿病中起着重要的作用。Cani 等人揭示了Bifidobacterium spp. 与高脂饮食小鼠内毒素血症呈负相关。伴随Bifidobacterium spp. 丰度恢复同时,胰岛素分泌、葡萄糖耐受性得到良好改善和炎症减轻。Lê等人的报告证实了这一结果,即Bifidobacteria 的丰度在糖尿病患者中显著下降,这表明Bifidobacteria 的丰度可以作为糖尿病的微生物标志物。流行病学研究还发现,糖尿病患者的血液存在着大量的革兰氏阳性厌氧菌。同时,另一项研究表明,二型糖尿病患者血液中90%以上的细菌属于革兰氏阴性变形菌门。上述数据表明,糖尿病可能影响肠道通透性,进一步导致血液中细菌的渗漏,危害人类健康。
Sato等人还报道了糖尿病组中兼性厌氧菌 (如Lactobacillus) 的丰度在粪便样品中显著增加,这与在肥胖症中观察到的变化相似。因此,兼性厌氧的Lactobacillus 可能是 HFD 诱导的糖尿病或肥胖症引发的“坏”肠道微生物的潜在目标。然而,Forslund 等人报道,在瑞典或丹麦的 T2D 患者中,Lactobacillus 没有明显变化。提示着,肠道菌群组成的变化可能只是一个值得进一步研究的动态参考。
“好”和“坏”肠道微生物失衡而出现的差异细菌代谢物也与 HFD 所致糖尿病有关。Wang 等人发现,在 HFD 诱导的糖尿病中,肠菌失衡导致细菌代谢物 SCFAs 的减少,并激活了肠道菌群-丁酸盐-胰岛素抵抗途径。Liu 等人还发现,高脂饮食能显著改变小鼠肠道微生物区系的组成及相关代谢途径,其中S24-7 family、Rikenellaceae,Parabacteroides distasonis (P. distasonis), 和 Eubacterium dolichum (E.dolichum) 的丰度显著降低(表1,图2)。
众所周知,糖尿病与肥胖症密切相关。如图1所示,肠道微生物组成变化和其潜在的作用机制在肥胖和糖尿病方面表现出高度共性。越来越多的证据表明, F/B 比率的增加、代谢性内毒素血症和慢性炎症对人类健康有害,而 SCFAs 对减肥和糖尿病有好处。具体来说,肠道微生物群丰度的影响在肥胖和糖尿病中也表现出一致性,如图2所示,都表现出Erysipelotrichaceae 和兼性厌氧菌的增加,还需进一步研究以确认它们的作用。
图2. 高脂饮食对肠道菌群的影响
高脂饮食模式下肠道微生物与心血管疾病
心血管疾病是全球死亡的首要原因,2019 年的死亡人数占全球死亡人数的32%。其中超过四分之三的心血管死亡发生在中低收入国家。在中国,有40%的死亡是由心血管疾病引起的。研究发现,高血压、动脉粥样硬化斑块形成、心肌梗死和心力衰竭等与肠道菌群高度相关。
Polsinelli 等人和 Tang 等人报道,肠上皮屏障损伤的患者也伴有心力衰竭。心力衰竭还与特定的肠道微生物高度相关,包括Escherichia coli, Klebsiella pneumoniae 和 Streptococcus viridans 的增加。提示肠道菌群及其代谢产物可能进入血液循环,进而损害各个器官。此外,Kim 等人还证明了高血压伴随着产丁酸细菌 Eubacterium rectale 的丰度显著降低。Yin 等人发现,中风或短暂性脑缺血发作患者的Bacteroides, Prevotella 和 Faecalibacterium丰度明显降低,但机会性致病菌如Enterobacter, Megasphaera, Oscillibacter 和 Desulfovibrio丰度增加。在受损的代谢状态和药物治疗中,与对甲酚的主要代谢物有关的 unknown Clostridiaceae (SGB 4712) 减少,并且急性冠状动脉综合征患者体内的 Proteobacteria 的丰度高于健康个体。综上所述,心血管疾病的发生和发展可能会影响特定微生物的数量,并导致肠道菌群失调。然而,受影响的肠道微生物对心血管疾病病程的潜在机制仍需进一步阐释。
HFD 被认为是导致高血压和高胆固醇血症的主要原因,可能通过增加肠道通透性和升高血清氧化三甲胺 (TMAO) 水平而加剧心肌损伤。HFD 可诱发动脉粥样硬化,并伴有 TMAO 引起的内皮功能障碍。TMAO 是一种氧化产物,由肠道微生物的代谢产物三甲基胺经 FMO3 代谢而成,是心血管疾病的不利因素。如图1所示,除了肠道通透性和 TMAO 水平之外,胆汁酸也是肠道菌群影响心血管疾病的作用途径之一。多组学分析显示,在心血管疾病状态下,Lachnoclostridium 和 unidentified Enterobacteriaceae 显著富集。还发现它们与牛磺胆酸密切相关,参与胆汁酸代谢。初级胆汁酸可以在肠道微生物群的帮助下转化为次级胆汁酸,包括牛磺胆酸。作为信号分子,胆汁酸可与 FXR 和 TGR5 结合,进一步调节脂质代谢。然而,过量的胆汁酸可能导致炎症和胆固醇代谢紊乱。在以高脂饮食饲养的 Ldlr-/- (Casp1-/-) 模型小鼠全身炎症伴随着肠道菌群组成的改变及 SCFAs 水平的降低,但不影响 TMAO 和肠道完整性,最终加速动脉粥样硬化。现有研究结果表明,HFD 可能会通过扰乱胆汁酸、TMAO 和 SCFAs 代谢进一步诱发心血管疾病(表1)。
高脂饮食模式下肠道微生物与胃肠道疾病
肠道生态系统的功能紊乱与胃肠疾病密切相关。溃疡性结肠炎 (UC) 和肠易激综合征 (IBS) 是常见的胃肠道慢性疾病,以反复发作和周期长为主要特征。新诊断的 UC 患者(确诊时间< 6个月)中高脂肪饮食的摄入人数明显高于对照组。肉类的高摄入量与结肠炎复发的风险增加有关。此外,Rashvand 等人注意到总多不饱和脂肪酸或单不饱和脂肪酸的高摄入与UC的高风险有关。Devkota 等人揭示了乳品中的脂肪可以改变胆汁酸组成以加剧结肠炎的发作,从而显著地促进致病细菌 B. wadsworthia 的增殖。进一步验证发现,在IL-/-老鼠体内的 B. wadsworthia 会在胆汁庇护下建立生态位。此外,代谢产物如 H2S 和次级胆汁酸可破坏肠道屏障,增加免疫浸润,进而加大炎症性肠病患病几率。此外,HS/HFD 会显著增加UC小鼠体内 Allobaculum 和 Escherichia 的丰度。
IBS 是最常见的胃肠道疾病之一,分为腹泻型和便秘型,两者都与肠道菌群有关。腹泻型 IBS 患者肠道细菌的变化主要与有益菌的减少有关,如 Lactobacillus spp.,Actinobacteria 和 Bacteroidetes 等,同时显著增加有害细菌数量如 Proteobacteria。而便秘型 IBS 患者的 Firmicutes 明显增多,产乳酸菌如 Eubacterium hallii 和 Anaerostipes caccae 减少。此外,粪菌移植 IBS 患者粪便于啮齿类动物体内,将导致类似 IBS 症状的出现,表明微生物在 IBS 的发生和发展中起着不可否认的作用。饮食是影响肠道细菌的直接因素之一。一项对197名 IBS 患者的研究表明,超过一半的患者病程状况与食用高脂肪或油炸食品有关。HFD 极大可能通过肠道细菌促进 UC 和 IBS 的发展(图1,表1),相应机制值得进一步探讨。
高脂饮食模式下肠道微生物与神经退行性疾病
人的身体机能会随着年龄的增长而逐渐退化。Feigin 等人指出,伴有记忆、思维、行为减退的认知障碍或痴呆以及自理能力的退化是老年人残疾的主要原因。由于人口老龄化和环境因素,痴呆正以惊人的速度增加,全球约有5000万痴呆症患者,同时每年以近1000万病例持续新增。阿尔茨海默病 (AD) 是一种最常见的痴呆症,临床表现为记忆丧失和认知障碍,且几乎无法治愈。
微生物可能是 AD 生物治疗干预的潜在候选者。与对照组相比,粪便中Faecalibacterium Prausnitzii (F. prausnitzii)的减少与较低的认知评分相关。而分离出的F. prausnitzii 的干预可以改善 AD 小鼠的认知障碍。此外,Verhaar 等人对荷兰170名 AD 患者进行的队列研究发现,低丰度的产短链脂肪酸细菌与痴呆生物标志物(如阳性淀粉样蛋白和血浆磷酸化 Tau 蛋白)的出现正相关。
如表1所示,HFD 可以通过影响肠道微生物群来促进 AD 的发生。在 AD 遗传易感小鼠模型中,HFD 喂养的结果和 AD 遗传易感性相似,并且这种影响是叠加的。异常的特定肠道细菌及其代谢产物可能比认知障碍的出现更早,提示着预测标记物的研究可行性。高脂饲料的喂养会使得肠道细菌失衡,表现为产脂多糖的 Acinetobacte 数量增加。Wei 等人研究明,含脂多糖外膜可引起认知障碍,主要通过屏障通透性增加、GSK3β 激活、tau 过度磷酸化、小胶质细胞激活而导致神经炎症。此外,长期 HFD 可能会破坏血脑屏障,使 LPS 到达与 AD 相关的大脑区域如新皮质和海马体。在小胶质细胞膜中,与 LPS 和 CD14 结合的 LPS-CD14 复合物进一步与 TLR-4 相互作用。TLR-4 继续激活星形胶质细胞并释放炎症介质诱导氧化应激和炎症,最终导致脑内 β 样蛋白和 NFT 的积聚。此外, LPS 在神经元细胞核附近的积累导致编码各种蛋白质的基因表达发生变化,如 synapsin-1。肠道病原体本身也可以穿过受损的肠道屏障,穿梭于体循环系统并引发炎症,并可能进入中枢神经系统参与小胶质细胞的激活。与认知功能密切相关的大多数神经递质可以由肠道菌群产生,包括 GABA (Lactobacillus 和 Bifidobacterium)、血清素和多巴胺 (Escherichia) 和乙酰胆碱 (Lactobacillus)。脑源性神经营养因子 (BDNF) 在高脂饮食动物的脑和血浆中的低表达也伴随着肠道细菌失衡。高饱和脂肪饮食将增加肠道微生物代谢产物 TMAO。而在轻度认知障碍和阿尔茨海默症患者脑脊液中高水平的 TMAO 可能与 tau 蛋白的病理学和神经变性有关。
因此,老年人应该特别注意饮食健康。因为 HFD 会增加认知障碍的风险,甚至加重 AD (图1,图2)。值得注意的是,现有的大多数研究集中在 HFD 诱导的认知障碍中肠菌发挥的作用。然而,很少有研究报道 HFD 如何通过肠道细菌促进 AD 疾病的发展。
高脂饮食介导的肠菌紊乱与慢性疾病的互作机制
如上所述,许多研究指出, HFD 与慢性疾病中的肠道菌群失调密切相关。表1、图1和图2总结了肠道特征菌及其对肥胖症、糖尿病、胃肠疾病、神经退行性疾病和心血管疾病的病程影响。HFD 介导的肠道菌群紊乱以及胆汁酸、脂多糖、短链脂肪酸和 TMAO 与慢性疾病的互作机制如下所示。
胆汁酸
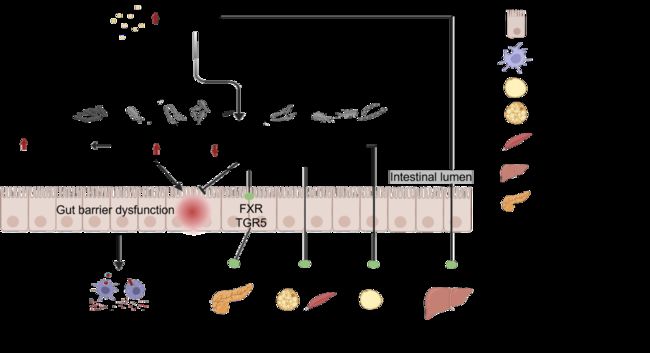
存在于肠肝循环系统的胆汁酸对脂肪代谢至关重要。特定的肠道细菌会与胆汁酸相互作用,通过 7α-脱羟基反应影响次级胆汁酸的水平,如 Eubacterium, Clostridium, Ruminococcaceae 和 Blautia 。HFD 可显著增加脱氧胆酸 (DCA) 的表达水平,同时降低熊去氧胆酸 (UDCA) 表达量。DCA 水平升高可破坏膜的完整性,而 UDCA 水平下降可导致肠屏障功能障碍,进一步促进病原体的生长,并伴随着损伤肠壁的 H2S 的产生。如图3所示,胆汁酸可能主要通过调节 TGR5 或 FXR 受体介导的信号传导来调节脂质代谢、胰岛素抵抗和免疫细胞浸润。总之,高脂肪摄入可能通过各种机制刺激胆汁酸的分泌而引发慢性疾病。胆酸 (CA)、鹅去氧胆酸 (CDCA)、石胆酸 (LCA) 和 DCA 被确定为FXR受体的激动剂,而 TβMCA 被视为 FXR 受体的拮抗剂。事实上,一些研究还发现, FXR 受体的抑制和 TGR5 介导的信号转导的激活与脂质代谢调节密切相关。
图3. 胆汁酸对 HFD 介导的慢性疾病的影响
胆固醇可以刺激胆汁酸的分泌,胆汁酸在肠道细菌的帮助下通过 7α-脱羟基反应形成次级胆汁酸。高疏水性的次级胆汁酸如 DCA 将破坏肠道屏障,而对胆汁有抗性的条件致病菌进一步迅速繁殖。作为信号分子,胆汁酸结合 FXR 和 TGR5 进一步促进免疫细胞浸润,胰岛素抵抗和脂质代谢改变。
脂多糖
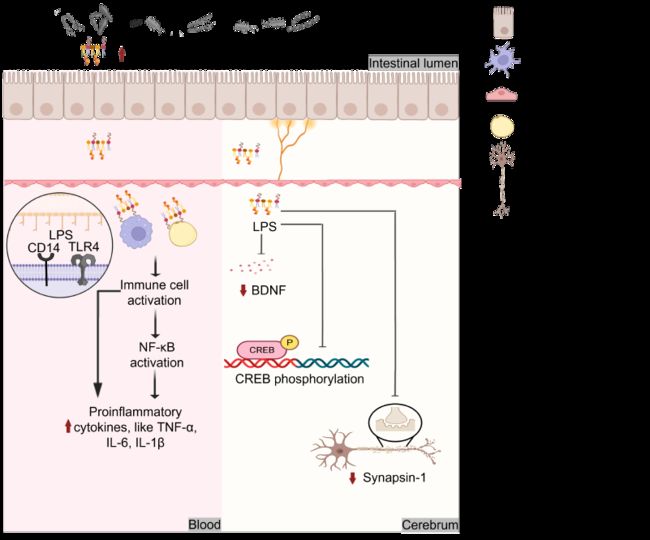
脂多糖 (LPS) 是革兰氏阴性菌膜的重要结构成分。证据表明 HFD 可导致慢性疾病,并伴有体循环中 LPS 水平的升高。一些产生 LPS 的细菌可能是 HFD 引起的慢性疾病的潜在病因,如 Enterobacteriaceae 和 Desulfovibrionaceae。如图4所示, LPS 可激活免疫细胞、脂肪细胞、神经胶质细胞表面的受体 CD14 和 TRL4。Zakaria等人和Jeong等人也证明了 LPS 可以通过激活 NF-κB 通路进一步刺激促炎因子的分泌。此外, HFD 将增加肠通透性,进一步导致 LPS 在体循环中的扩散。LPS 还会通过抑制 BDNF 表达和 CREB 的磷酸化水平,破坏血脑屏障,导致认知能力下降和焦虑情绪加重。LPS 对 synapsin-1 基因表达也有影响,该基因与 HFD 引发的精神障碍密切相关。现有结果表明, HFD 可能主要通过激活 TLR4/NF-κB 通路或抑制 BDNF、 CREB 和 synapsin-1 的表达来引发慢性疾病。但血脑屏障、肠脑轴和肠道免疫屏障之间的相互作用机制仍需明确。
图4. 脂多糖参与高脂饮食诱发慢性疾病的进程
脂多糖 (LPS) 是革兰氏阴性菌外膜的结构成分,可透过肠壁进入血液及脑部等相应组织。LPS 可激活免疫细胞、脂肪细胞、神经胶质细胞表面的受体 CD14 和 TRL4。而 NF-κB 的激活将引发炎症,从而加剧肥胖和大脑退化。此外, LPS 抑制 CREB 磷酸化、 BDNF 和 synapsin-1 的表达。
短链脂肪酸
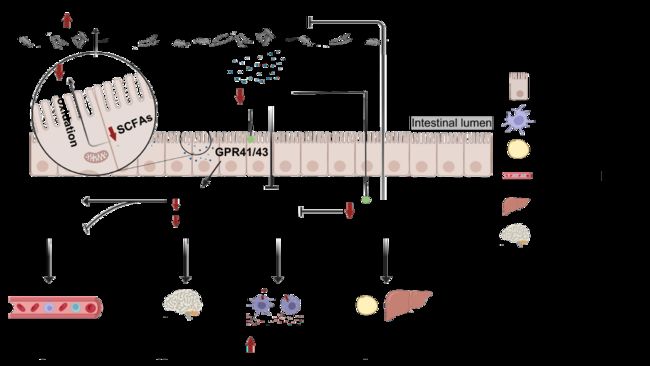
乙酸盐、丙酸盐和丁酸盐是结肠细菌厌氧发酵膳食纤维的代谢产物,可作为信号分子进一步调节宿主代谢稳态。通常,短链脂肪酸 (SCFAs),尤其是丁酸盐,通过激活 GPRs 和 PPAR-γ 来增加 GPL1 和 PYY 的表达。饱腹激素 GPL1 和 PYY 进一步作用于脑-肠轴,以调节食欲和能量代谢。PPAR-γ 能维持肠道厌氧环境(与 β-氧化有关),激活葡萄糖和脂质代谢基因和抑制炎症反应。此外,丁酸盐可作用于结肠细胞,促进线粒体的 β-氧化,并降低肠腔内氧饱和度。而 HFD 大大降低了 SCFAs 的含量,导致能量代谢紊乱和致病性兼性厌氧菌 Escherichia coli的过度繁殖以及促炎因子的产生(图5)。
图5. 短链脂肪酸影响慢性疾病的发展
短链脂肪酸可抑制炎症反应,维持肠腔的厌氧环境,并调节食欲、能量代谢、葡萄糖和脂质代谢。但高脂饮食降低机体短链脂肪酸含量。
氧化三甲胺
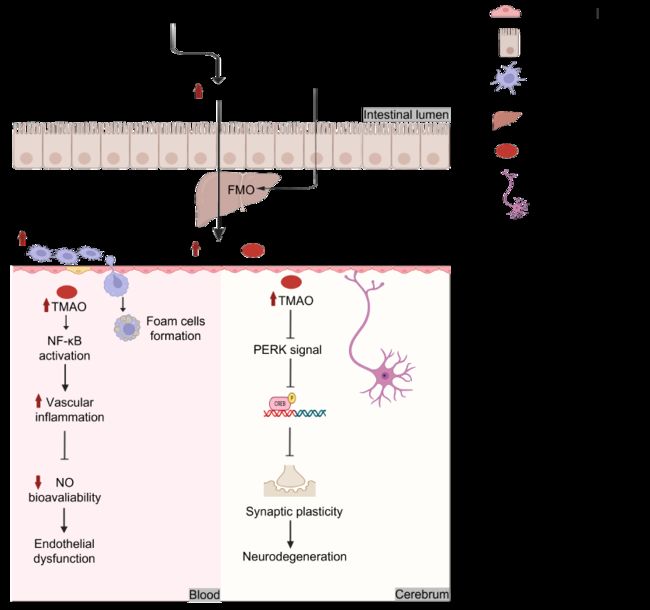
大量研究表明氧化三甲胺 (TMAO) 是心血管疾病的独立危险因素。大脑中高水平的 TMAO 与认知障碍和 AD 恶化呈正相关。含甲胺的营养物质如胆碱、卵磷脂和L-肉碱,通常存在于高脂肪含量的西方饮食中。长期西方饮食会大大增加心血管疾病和神经系统疾病的风险。如图6所示,胆碱可被 Clostridia 和 Enterobacteriaceae 进一步代谢并转化为三甲胺 (TMA),随后经肝脏中 FMO 转化为TMAO。值得注意的是, FMO 的表达水平也可能受到 HFD 介导的胆汁酸影响。TMAO 则激活 NF-κB 通路进一步刺激炎性细胞因子的分泌,导致内皮功能障碍。除此之外,TMAO 的增加还会通过抑制 PERK 信号通路而削弱突触可塑性,从而加剧神经退行性变。即 HFD 将通过增加 TMAO 的表达并激活 NF-κB 通路或抑制 PERK 信号通路而诱发心血管疾病。然而,TMAO 是否也在其他慢性疾病的发病机制中发挥重要作用,值得进一步探讨。
图6. TMAO 加剧慢病的发展
胆碱由肠道细菌代谢成 TMA,TMA 被肝脏中的FMO 进一步加工成 TMAO 。此外,FMO 的表达也受胆汁的影响。进入血液的 TMAO 与血管炎症、内皮功能障碍、泡沫细胞形成、动脉粥样硬化斑块以及胰岛素抵抗有关。而大脑中的 TMAO 将影响突触可塑性并引发神经变性。
结 语
慢性疾病已成为全球范围内最为主要的死亡原因。HFD 被认为是慢性病的主要危险因素,其介导的肠道菌群失调将进一步加重慢性疾病的发生和发展。本文系统综述了 HFD 对肠道菌群组成的影响及其导致相应慢性疾病的潜在机制。首先,HFD 诱导的肥胖和糖尿病在肠道微生物群的组成方面表现出高度共性和特性,伴有F/B比值的增加、代谢性内毒素血症和慢性炎症。Erysipelotrichaceae, Bifidobacteria 和兼性厌氧菌可能是介导肥胖症和糖尿病发病的细菌标志物。Enterobacteriaceae 和 Desulfovibrionaceae 可能是肥胖的潜在病因,而 P. distasonis 和 E. dolichum 与糖尿病密切相关。其次,本综述还确定了产丁酸细菌、条件致病菌、 Lachnoclostridium 和 unidentified Enterobacteriaceae 是 HFD 诱发心血管疾病的特征微生物。第三,产乳酸菌和条件致病菌是 HFD 诱发胃肠道疾病中常见的微生物标志物,详见表1和图2,包括 Proteobacteria、 Escherichia coli-Shigella 和 Allobaculum。第四,产脂多糖细菌和条件致病菌也是 HFD 诱发神经退行性疾病中的微生物标志物,包括 E.coli, Desulfovibrio 和 unidentified Enterobacteriaceae。
此外,本综述阐述了胆汁酸、脂多糖、短链脂肪酸和氧化三甲胺作为慢性疾病诱因的共性和特征。图3-6阐述了胆汁酸、脂多糖、短链脂肪酸和氧化三甲胺与 HFD 诱发的慢性疾病的互作机制。HFD 可能通过抑制 FXR 受体和激活 TGR5 介导的信号传导来影响肠道微生物群介导的胆汁酸代谢和慢性疾病进展。HFD 主要通过激活 NF-κB 通路和抑制 PPAR-γ 来影响肠道微生物介导的 SCFAs,进而影响慢性疾病发生和发展。大量研究结果还证实,微生物介导的 LPS 可能通过激活 TLR4/NF-κB 途径,抑制 BDNF、 CREB 和 synapsin-1 的表达水平,进一步影响 HFD 诱导的慢性疾病。TMAO 被认为是心血管疾病的独立危险因素。HFD 可能通过抑制 PERK 信号通路,调节肠道菌群与 TMAO 的相互作用,从而影响心血管疾病。然而,TMAO 是如何影响其他慢性疾病,值得进一步确认。目前大都研究是基于较为成熟的 16S rRNA 测序,但在物种水平分类的准确性较低。宏基因组测序可从物种水平对肠菌基因和功能研究的深入挖掘,将进一步揭示饮食、疾病和肠道微生物互作可能性。而微生物高通量单细胞测序新技术对菌株水平变化的独特见解提供了进一步探讨的可能。
尽管人体肠道微生物群调节的互作机制非常复杂,尤其将饮食纳入对慢性疾病的影响,但这仍是非常具有现实意义的。本文系统总结了肠道特征菌及其代谢产物变化和作用途径,希望能为慢性疾病中微生物群、代谢产物和免疫反应之间的机制提供新的见解。潜在生物标志物的提示可为长期健康护理和疾病管理的提供全方位思考和指导。
代码和数据可用性:
数据共享不适用于本文,因为本研究中没有创建或分析新数据。本文没有使用新的数据和脚本。补充材料(图表、表格、脚本、图形摘要、幻灯片、视频、中文翻译版本和更新材料)可在http://www.imeta.science/. 在线DOI或iMetaScience官网 http://www.imeta.science/ 上找到
引文格式:
Jiali Chen, Yuhang Xiao, Dongmei Li, Shiqing Zhang, Yingzi Wu, Qing Zhang, and Weibin Bai. 2022. “New Insights into the Mechanisms of High‐Fat Diet Mediated Gut Microbiota in Chronic Diseases.” iMeta. e69. https://doi.org/10.1002/imt2.69
作者简介
陈嘉莉(第一作者)
● 毕业于香港浸会大学,现为暨南大学食品科学与工程系副研究员
● 研究方向为食品营养学,药食同源功能食品开发和溃疡性结肠炎机制研究。主持国家自然科学基金青年基金1项,参与各类科研项目7项(其中国家基金3项)。以第一/通讯作者在Critical Reviews in Food Science and Nutrition、Food Chemistry、iMeta等期刊发表论文10余篇,申请专利六项(授权两项)
白卫滨(通讯作者)
● 暨南大学食品科学与工程系教授,博士生导师,担任理工学院副院长,兼食品安全与营养研究院常务副院长
● 2013年入选教育部“新世纪人才”计划,2013年入选广东省高校“优秀青年教师人才”计划,2019年入选“广东省特支人才”计划。担任中国食品科学技术学会特医分会秘书长,中国食品科学技术学会青年工作委员会委员,广东省食品学会青年工作委员会主任等。研究方向为食品天然功能色素、花色苷活性因子挖掘、功能性食品开发等,已有10余年的研究工作。近5年来,以第一或者通讯作者发表高水平论文60多篇,其中SCI中科院一区或本领域TOP期刊论文40篇,IF> 10论文11篇,高被引论文3篇,封面文章2篇, EI 论文5篇;申请发明专利13项,授权专利7项,并转让2项;获批国家标准样品4件
更多推荐
(▼ 点击跳转)
高引文章 ▸▸▸▸
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
▸▸▸▸
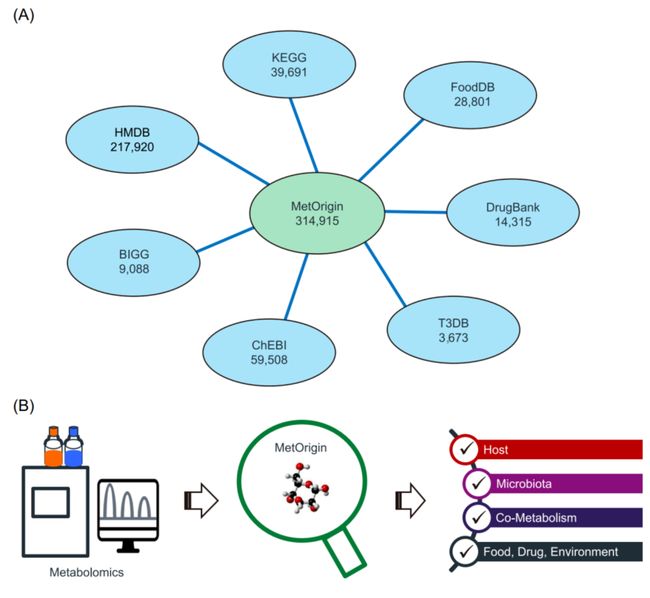
iMeta | 浙大倪艳组MetOrigin实现代谢物溯源和肠道微生物组与代谢组整合分析
▸▸▸▸
iMeta | 高颜值绘图网站imageGP+视频教程合集
第1卷第1期
第1卷第2期
第1卷第3期
第1卷第4期
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 15)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、前3年免出版费、50万用户的社交媒体宣传等。2022年2月正式创刊发行!
联系我们
iMeta主页:http://www.imeta.science
出版社:https://onlinelibrary.wiley.com/journal/2770596x
投稿:https://mc.manuscriptcentral.com/imeta
邮箱:[email protected]
往期精品(点击图片直达文字对应教程)
机器学习
后台回复“生信宝典福利第一波”或点击阅读原文获取教程合集