磁共振成像(MRI)连接组学的应用
前言
如何将磁共振成像(MRI)连接组学应用于研究典型的大脑结构和功能,并在临床环境中用于诊断、预后或治疗?本文将讨论MRI连接组学在评估功能和结构连接方面的可能应用。简而言之,功能连接是一种测量功能磁共振(fMRI)衍生的血氧水平依赖(BOLD)波动在不同脑区的关联,通常用相关系数表示。由于BOLD是神经元功能的间接测量指标,功能连接被认为反映了脑区之间系统水平的神经元信号。功能连接性较高的脑区被解释为具有更多的同步神经元信号,因此更有可能属于同一个神经网络。目前,已经确定了7-10个典型的内在连接网络(ICNs),包括感觉、运动和高级认知系统。当比较个体内部和个体之间的功能连接测量时,例如基于行为、年龄、身体健康等特征,很容易做出连接越高表明大脑功能越好的假设。然而,对连接差异的解释并不简单;根据涉及的特定脑区和其他情况,较低的连接性也可以被认为是有利的。
结构连接来自于扩散加权成像(DWI)。结构连接“强度”可以通过多种方式进行评估,例如每个感兴趣脑束的平均扩散测量值(如各向异性分数、平均扩散率、神经突密度等),或者使用概率纤维束成像技术评估感兴趣脑区之间的流线数量。弥散衍生的结构连接指标被认为反映了白质通路(即轴突的方向)。结构连接较高的脑区被认为具有更致密的白质束或更高的白质完整性,因而具有更完整或更强的解剖连接。然而,正如Jones等人(2013)所讨论的那样,这种解释并非没有争议,在解释结果时,需要仔细考虑所提取的实际测量值。
检查全脑或系统水平连接组学的一种常见方法是使用脑图(有关脑图分析的简要介绍参见Box 1)。脑图方法使我们能够确定特定的网络属性,也可以应用于从多种成像模态中提取的连接性测量。因此,在功能和结构连接组学研究中,都讨论了类似的网络属性。
连接特征在某种程度上是可遗传的,因此代表了一种保守的生物属性。连接模式被认为与认知功能有关,而偏离规范连接模式可以作为疾病过程的指标,从而作为疾病的生物标志物。目前,用于诊断或治疗的脑连接测量方法的直接临床应用有限。然而,许多基础和临床研究应用增加了我们对典型和非典型大脑结构和功能的理解。接下来将举例说明对以下几个方面的理解:(1)连接组对认知过程和行为的影响;(2)整个生命周期中的连接组;以及(3)连接组的临床研究应用。
连接组对认知过程和行为的影响
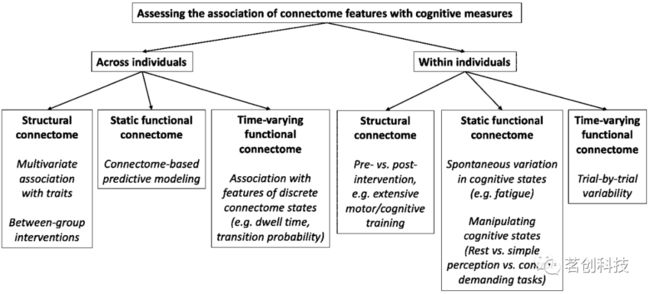
最终,连接组的功能意义在于其在健康认知中的作用,以及在连接组异常的认知结果中的作用。与认知能力和行为结果的关联对于证明神经成像衍生的结构和功能连接反映真实的神经连接而不是噪声更为重要。人们采用了几种一般方法来建立和描述这种对认知过程和行为的影响(图1)。具体而言,行为测量的差异与个体间或个体内连接组的差异有关。在这两种方法中,人们已经探索了DWI衍生的结构连接组、fMRI衍生的“静态”(即时间平均)功能连接组和fMRI衍生的“动态”(即时变)功能连接组重构的行为关联。接下来将讨论每种方法的示例。
图1.连接组特征与认知和行为过程关系的研究方法概述。
连接组特征与被试间认知能力的关联
理解连接组的认知相关性的一个重要途径是研究认知和连接组特征如何在个体间共变。对于个体间的比较,认知能力通常通过自我报告问卷、标准化神经心理测试或其他认知任务的表现进行评估。下面的例子探讨了哪些特定的结构和功能连接组特征与行为相关。
(1)个体间的结构连接
结构连接反映了基因与环境影响相结合的累积效应,后者包括终生的经验和学习。这种表征形式从单个突触延伸到DWI观察到的宏观连接组。因此,可以预期DWI衍生的结构连接组的特定特征与个体的认知有关。虽然单个连接与特定认知能力之间的关系已经被研究了很长时间,但最近的成像和分析技术的进步使分布式结构连接组的关联研究成为可能。具体而言,使用多变量分析同时评估了DWI衍生连接组的所有边或节点的认知关联,并使用网络科学评估了全局拓扑度量(见Box 1)。通过应用这些方法,可以确定与高级控制和执行功能之间的关联。这些关联涉及广泛分布于整个解剖空间的(通常是稀疏的)结构连接,而不是局限于特定典型ICNs内的连接。
(2)基于静态功能连接组的个体表型
所有人都有一个共同的静态功能连接组的空间结构,最明显的是前面提到的典型ICNs或静息态网络,每一个都包含一组特定的分布式脑区。然而,这种空间结构的确切实例在个体之间存在差异,其特征方式类似于个体的指纹。这些分布在整个大脑中的特征差异,可以用来区分个体和其他人。鉴于这种识别或功能连接组“指纹”的成功,人们可能期望可以从相关连接组特征中预测个体的认知能力(例如,使用基于连接组的预测模型)。事实上,尽管功能连接密切依赖于解剖学,但某些功能连接组特征与结构连接之外的认知能力具有独特的关联。静息态fMRI的这些特征与个体的认知能力有关,如流体智力(抽象推理和解决问题的能力)、持续性注意和感知任务的表现。
值得注意的是,尽管对个体间差异的研究通常使用静息态fMRI数据,但无论个体处于何种认知状态,其特有的功能连接组特征在个体内基本上都是稳定的。此外,在增强相关连接组特质的目标认知状态下获得fMRI时,可能会改善功能连接组对认知特征的预测。例如,在高要求的工作记忆和认知控制任务中,功能连接组的全局整合水平(即紧密连接的团簇之间相互连接的程度;见Box 1)与个体的任务表现相关。
(3)功能连接组的时变动力学特征
许多日常认知过程,如任务切换和多任务处理,需要认知灵活性的参与。有研究认为,时变功能连接组可以在脑区之间形成和分散出新的连接,这被称为“连接组灵活性”。这些不同的功能连接组结构被认为构成了不同的“认知架构”,每个架构支持不同类型的认知过程。根据这一观点,功能连接组动力学的一种方法是定义多个相对离散的连接组状态,并描述它们的空间、拓扑和时间特征如何影响认知。例如,在静息态下,更频繁地出现某种连接组状态(以连接强度的高变异性为特征)的个体在任务切换和工作记忆的常见测量中表现得更好。需要注意的是,由于技术上的限制,fMRI通常只能在几十秒的时间序列上捕捉到功能连接组的动态变化。因此,许多与认知相关的连接变化将需要MRI以外的方法。
连接组特征与被试内认知状态的关联
除了个体之间的比较,研究连接组特征认知意义的第二个窗口是研究这些特征如何随个体行为的变化而共同变化。这种方法通常利用行为和认知表现的自发变化,或者由于干预和训练而导致的这些功能的变化。通过相对长期和广泛的学习,可以观察到大尺度结构连接的变化。相反,静态功能连接可以捕获更快速的重组,例如在切换认知状态时(例如,跨静息态和不同的任务范式)。最后,即使在一个任务范式中,行为的试次间变异性也可以与功能连接组的动态变化联系起来。接下来将探讨结构、静态功能连接组和动态功能连接组特征与个体认知和行为之间的关联。
(1)结构连接组与学习
为了研究结构连接组改变对个体行为的影响,一种直接的干预方法是诱导学习。例如,两个月的工作记忆训练提高了额顶节点结构网络中的信息流效率(网络科学测量,见Box 1)。重要的是,与训练前相比,训练组(而非对照组)的被试在其他涉及工作记忆的任务中表现出了认知迁移。
(2)静态功能连接组与认知状态
虽然功能连接组的空间组织在认知环境中是非常稳定的,但这些环境之间发生的微妙变化可以与认知过程有意义地联系起来。这种微妙变化的一个强有力的例子是从静息态和简单运动任务到认知控制要求范式,全局拓扑整合水平(见Box 1)随着认知需求水平的增加而逐渐增加。在这里,认知的相关性要么通过被试之间与表现的关联来评估,要么通过预期认知要求高的任务(即需要在许多区域之间进行信息交换)来间接推断,从而受益于拓扑整合。除了实验控制的认知/心理状态的变化外,自发的波动(例如警觉和疲劳水平)也与功能连接组的细微变化有关。
(3)功能连接组的时变动力学和行为变异性
即使刺激和外部条件保持不变,个体的认知过程也常常是高度可变的。这种变异性与连接组瞬时状态变化之间的关联,揭示了后者的认知意义。如前所述,以类似于静息态的连续方式分析基于任务态的fMRI数据,提供了关于任务依赖性功能连接的重要信息。然而,内在驱动的功能连接组变化可能仍然与任务诱发的共激活不可分离。为了区分两者并了解前者如何影响后者,可以研究刺激前时间段内的连接性。这些研究在不同试次中使用相同或直接可比较的刺激,但每次都会导致不同的行为结果,如阈值水平或模糊的刺激。例如,应用于刺激前功能连接的机器学习方法(见Box 1)可以(以高于机会水平的精度)预测参与者在给定试次中检测微弱声音的成功或失败。此外,当功能群在声音出现之前更加分离(以高模块化衡量,见Box 1)时,被试更有可能听到声音。连接组很可能在更全局分离的状态(一方面最适合简单的感知或运动输出)和更全局整合的状态(另一方面适合需要认知控制的任务)之间切换。结合前面讨论的连续任务周期和无任务静息态的研究,越来越多的证据表明了功能连接组状态的全局拓扑分离/整合对认知的重要性。
整个生命周期中的连接组
如上所述,尽管一般的大脑网络组织在个体之间基本上是一致的,但也存在个体之间的差异。影响我们所有人的大脑连接组的一个重要因素是个体的年龄。在整个生命周期中观察到的与年龄相关的差异表明,连接组在发育和衰老过程中经历了结构和功能的变化。
与年龄相关的网络内部和网络之间的连接变化
基于前几十年的研究,我们知道人类的认知能力会随着年龄的增长而变化。通常,与年龄相关的认知变化轨迹在发育过程中逐渐完善,在成年早期达到峰值,然后随着年龄的增长逐渐下降。在大脑连接组中也可以观察到类似的发育成熟模式,随后出现与年龄相关的逐渐衰退(图2)。有研究(主要来自横断面研究)表明,默认模式网络(典型ICNs之一)中的功能连接会随着发育而增加,在老年期逐渐下降。默认模式网络由大脑的一些主要皮层中枢,如后扣带皮层和内侧前额叶皮层组成,通常参与自我参照过程、情绪过程和记忆功能。其在支持我们的认知能力方面起着核心作用,其与年龄相关的连接变化也反映在观察到的认知变化中。现有的关于结构连接的文献揭示了类似的模式,即富人俱乐部组织(包括与默认模式网络重叠的大脑区域)显示出与年龄相关的衰退变化。大量对同一样本的功能和结构连接研究表明,这些测量结果是紧密一致的(尽管在没有直接结构连接的情况下,大脑区域之间也可能存在功能连接),并且它们同样受到衰老的影响。
图2.整个生命周期中的连接组和记忆性能的差异。默认模式网络(DMN)功能连接(上)和场景记忆性能(下)(检索精度)随年龄变化的示意图。
除了默认模式网络的特定变化外,大脑的全局网络组织也在一生中不断发生变化。一些研究表明,在整个成年期中,网络内的连接减少,而网络间的连接增加。这些大脑变化表明了神经网络去分化,意味着随着年龄的增长,功能网络特化减少。这种网络去分化意味着不那么理想的脑功能可能反映了一种维持认知表现的补偿机制。为了做到这一点,额外的大脑区域被激活来补偿特定网络中的信号丢失。然而,它也可能反映出与年龄相关的病理所导致的噪声信号传播,从而导致神经选择性的降低。无论如何,在MRI衍生的脑网络测量中观察到与年龄相关的差异,使我们能够更好地理解整个生命周期中典型的脑衰老。
连接组学的临床研究应用
分析大脑连接主要是一种学术研究工具,以更好地了解大脑功能和组织。然而,自基于连接组的研究伊始,研究人员已经认识到基于连接性的测量在临床环境中的潜力。以下部分展示了连接组学在辅助诊断、预后和临床干预方面的应用实例。
连接组学很可能反映了疾病通路
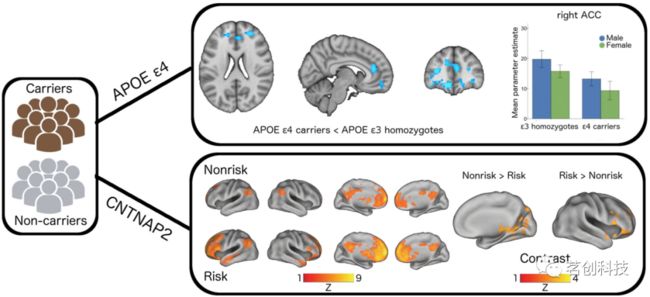
结构连接和功能连接都表现出相当程度的遗传性,即一个人的遗传标记[1] 控制着连接组的特征。同样,许多神经系统疾病也与遗传风险因素有关。一个相关问题是与疾病有关的遗传风险变异是否对健康个体的连接组特征产生影响,这将为疾病风险增加的人群提供更好的特征描述。事实上,在阿尔茨海默病(AD)这一最常见的痴呆症形式中,载脂蛋白E(APOE)的ε4等位基因(AD中最强的常见风险因子)在各种研究中显示,健康成年人中参与默认模式网络区域的连接发生了改变(图3)。同样,在一组典型发育的儿童队列中发现,自闭症风险基因CNTNAP2的风险变异携带者,其内侧前额叶皮层的连接发生了改变(图3)。
图3.遗传对功能连接的影响。
另一种用于精神分裂症研究的方法发现,多基因风险的增加与主要包括视觉、默认模式和额顶叶系统的团簇连接减少有关。综合各种研究,携带基因变异的健康人群罹患大脑疾病的风险会增加,其结构或功能连接组有可能在临床症状出现之前就发生了变化。
连接组学作为(鉴别)诊断工具
来自许多疾病(神经退行性疾病、自身免疫疾病、精神疾病和其他疾病)的证据表明,患者组和对照组之间的连接组学差异与不同认知能力水平的被试之间的差异相当。这些疾病的内表型通常不依赖于症状学,但其中许多与既定的诊断标准或临床量表显示出良好的统计关系。对于某些疾病,如多发性硬化症(MS),影像学症状学与临床量表之间缺乏相关性,这种现象被称为“临床-影像学悖论”。支持连接组学衍生生物标志物的一个原则是,这些生物标志物可以发现更微妙的疾病关联,并帮助弥合这一差距。
MS中的白质病变引起脱髓鞘和随后的轴突横断,从而导致白质连接的重要改变。众所周知,白质病变有一个空间分布偏好,特别是在脑室周围,这意味着特定的纤维束,如皮质脊髓束,经常受到影响。这种白质病变不仅影响结构连接组,而且还影响功能连接组的大规模组织,这表现为网络科学测量效率(Box 1)和小世界性指标的降低。这些大规模的变化可作为诊断MS患者的生物标志物,尽管其在临床应用中的特异性尚未完全建立,特别是用于鉴别诊断。
一个具有挑战性的临床问题是如何区分具有一系列共同症状的不同但相关的临床综合征。影像学生物标志物,包括结构和功能连接,正在被探索用于辅助鉴别诊断。在早期的工作中,Seeley等人(2009)报道了不同的神经退行性疾病表现出与经典ICNs空间重叠的灰质丢失特征模式。例如,AD的成像特征往往首先出现在默认模式网络,而额颞叶痴呆(FTD)的成像特征首先出现在所谓的突显ICN中。目前正在研究基于连接的生物标志物,以更好地理解和区分综合征亚型。例如,在创伤后应激障碍(PTSD)中,与对照组相比,患者中脑导水管周围灰质和情绪处理相关区域之间的功能连接增加。然而,只有分离性PTSD亚型患者的腹外侧导水管周围灰质与已知参与消极应对策略的脑区之间的连接也有所增加。
连接组学用于预后及其与临床量表的关系
通常,脑部疾病的预后取决于人口统计学因素、并发症、神经系统检查结果(包括专门的临床量表)、影像学检查结果(主要基于具有各种对比度的结构成像)和实验室检查。通过连接组学,大脑区域之间的关系和由疾病引起的连接组学的大规模变化,可以为患者通过适应性或非适应性可塑性大脑重组的可能未来进化提供新的视角。例如,在脑卒中患者中,有证据表明缺血性病变引起结构和功能连接组的变化,导致病变远端脑网络的断开和重构。观察脑网络是否仍然完整,是否受到中风的影响,或者是否存在未来风险,对特定患者的康复潜力和指导治疗具有重要意义。
另一个例子是额颞叶痴呆(FTD),其特征是额叶边缘连接中断,导致前额叶连接不受约束。研究表明,在行为变异型或语义性痴呆患者中,前额叶超连接和额叶边缘断开的程度分别反映了情感淡漠和去抑制得分。
连接组学用于治疗计划和应答预测
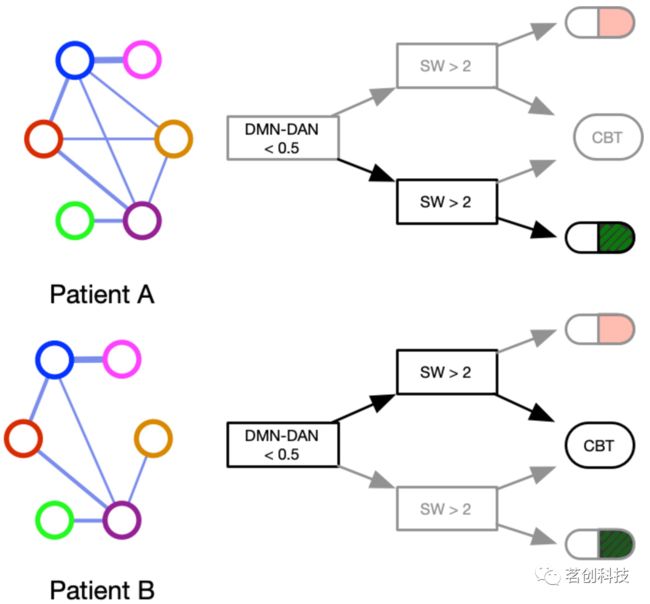
选择治疗方案是基于患者对特定治疗过程反应的假设。例如,这可以是药物治疗或手术干预之间的选择,几种类型的心理治疗,或几种可用于特定情况的药物。关于使用连接组学来指导治疗选择的研究越来越多,有时集中在特定脑区之间的连接,并且在神经精神疾病方面取得了一些有前景的结果(如图4所示)。
图4.在精神疾病治疗计划中使用连接组学的说明。根据某些ICNs之间的联系强度或特定的网络科学指标(见Box 1),每例患者都可以接受最合适的药物治疗(如绿色条纹药片或红色填充药片)或心理治疗(CBT,认知行为治疗)。DMN:默认模式网络。DAN:注意网络。SW:小世界指数。
例如,在抑郁症中,一些研究旨在基于功能连接来预测电休克治疗的反应。这些研究表明,电休克治疗后抑郁症状的减轻与干预前胼胝体下扣带回皮层的连接有关。另一个例子是帕金森氏症,脑深部电刺激(DBS)是一种既定的治疗方案。然而,临床应答的差异很大,可能取决于模拟脑区的连接特征。Horn等人(2017)确定了特定患者中DBS激活的组织体积,并将该信息与组水平的结构连接组相结合,以识别受影响的纤维束。此外,他们在一个大的队列中使用激活组织的体积作为种子点来建立功能连接图谱。使用这些组水平结构和功能连接组,可以提高对DBS治疗应答的运动评分(使用统一帕金森病评定量表-量表III)预测,并且可能用于修订或指导DBS。
难治性癫痫和脑肿瘤可能需要脑外科手术治疗。为了避免关键脑区(例如涉及记忆、语言和运动功能的脑区)受损,并保持术后可接受的生活质量,需要进行详细的规划。传统上,使用基于任务的fMRI或术中皮层电刺激来进行相关大脑区域(如功能区)的个性化映射。最近的研究进展使用功能连接来更好地预测治疗结果并精细绘制关键皮层区域。
研究和临床转化的局限性
考虑到本文所提到的这些有前景的结果,人们可能会问:这些工具在实际临床环境中的哪些地方使用?事实上,将这些结果付诸使用方面存在许多障碍,其中一些障碍是其他模态(如结构性MRI)所共有的。接下来将重点讨论阻碍MRI连接组学应用于临床以及对非临床研究造成影响的问题。
基于fMRI的连接组学和基于DWI的连接组学一直面临的一个问题是头部运动。连接是由运动以一种空间依赖的方式调制的,在长期和短期估计中具有不同的影响。当比较两组数据(例如患者组和对照组)时,这一问题尤其严重,因为运动的组间差异本身就会导致连接模式的组间差异,影响Box 1中列出的所有分析方法。可能的缓解策略包括前瞻性运动校正、用于头部运动跟踪的嵌入式摄像头或后验运动补偿,包括基于独立成分分析(ICA)的方法,如ICA-FIX或fMRI的运动“清洗”。其他不必要的生理信号,如呼吸或心率变异性,也会影响BOLD信号,这在很大程度上是由于低采样频率,导致混叠进入用于静息态分析的感兴趣频段。缓解策略包括低TR采集,或使用各种算法进行回溯校正。
与被试认知状态相关的功能连接还存在其他混杂因素。其中,睡眠(实际上是意识的丧失)导致连接组的剧烈重组,例如丘脑-皮层耦合的破坏(皮层下区域(SC)和大脑其余部分之间的功能连接差异如图5所示)。某些疾病或药物可能会影响被试的警觉性,使他们在进行核磁共振检查时更容易打瞌睡。看似没有影响的事情(比如享受一杯咖啡),也可能会改变功能连接。功能连接组对病理性情绪状态(如焦虑障碍)的敏感性使其容易受到“正常”情绪状态范围的影响,并影响其作为生物标志物的效用。最后,对于某些患者群体(如AD、ADHD、PD)来说,“静静地躺在MRI扫描仪中,不要想任何特别的事情”这一看似简单的指令可能很难遵循。
图5.警觉状态和运动伪影对功能连接的影响。
将fMRI和高质量DWI应用于临床的主要问题之一是采集时间。虽然获得高分辨率T1加权MRI(用于几乎所有脑部疾病)大约需要5分钟,但增加fMRI采集通常至少需要6-7分钟,增加足够质量的DWI(如多壳成像)则需要至少7分钟的扫描时间。尽管随着压缩感知、多波段成像或基于深度学习的重建等技术的广泛应用,这些采集时间正在稳步减少,但fMRI和DWI必须与其他已确立的序列(如FLAIR或灌注成像)竞争采集时间,这些序列已明确显示出其临床实用性。
最后,一个重要的问题是,不同机器(多个地点)采集的fMRI和DWI数据在技术参数方面可能存在很大差异,如空间和时间分辨率、对比度、扩散方向的数量和分布、扩散b值等。这些差异将导致不同的连接组,即使是对同一患者来说。有两种趋势为克服这些差异带来了希望:1)放射组学领域的一些举措正在尝试将特定的生物标志物标准化;2)在深度学习进展的推动下,采集后的调谐正在快速发展。
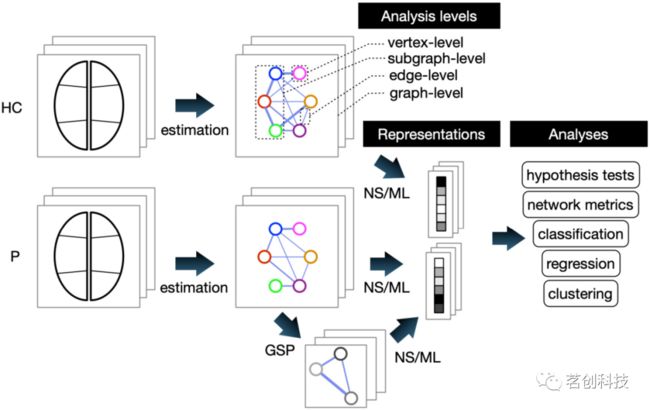
| Box 1.用脑图进行分析和推断 一旦构建好脑图,就可以根据分析的目标在全图水平、子图水平、顶点水平或连接水平上进行分析。用于分析和建模脑图的工具可以大致分为四类:统计方法、机器学习方法、网络科学方法和图信号处理方法(见图6)。在统计方法中,目标是对一组图、子图、顶点或边进行假设检验。机器学习方法侧重于使用单个图形进行预测,因此特别适合于临床应用。在过去的几年中,基于图的机器学习取得了巨大的进步,特别是在表征学习方面,无论是用图嵌入(将图表示为向量)还是用图神经网络(端到端学习)。虽然这些方法通常具有非常好的预测能力,但它们可能难以解释特定脑区及其相互作用。相反,网络科学方法提出了各种易于解释的图拓扑指标,可以很容易地进行解释。值得注意的是,模块化(代表功能的整合与分离)、枢纽(在信息交换中起核心作用的大脑部分)或效率的概念可以简洁地表达和估计。这些网络指标有助于将分析结果置于一个系统的参考框架内;然而,读者应该谨慎,因为研究者之间给出的数学定义往往不同。最后,图信号处理方法最近在神经影像领域越来越受欢迎,并提出将信号处理中的常见概念,如滤波、降采样或傅里叶分析转化到脑图领域中。 |
图6.分析和推断的概览图。HC:健康对照;P:病人;GSP:图形信号处理;NS:网络科学;ML:机器学习。在端到端方法中,如图卷积网络或图自编码器,表征是隐式学习的,目标是最小化预测或重建误差。
结论
近十年来,基于MRI的连接研究在全脑连接组研究和多元信息利用(如机器学习和网络科学)方面取得了快速进展。这一进展不仅得益于成像技术的进步,更重要的是得益于功能MRI在连接组内在结构上的发现。连接组方法已经揭示了与认知过程、发育和衰老、基因组成和神经与精神疾病的关联。这些关联尚未被用于临床诊断、预后和治疗应答预测。随着研究从群体水平发展到表征功能相关的个体差异,这种转化影响有望实现。在未来十年中,大脑基础研究和精准医疗都可能从这一发展中获益。
参考文献(上下滑动查看):
Argyelan, M., Lencz, T., Kaliora, S., Sarpal, D.K., Weissman, N., Kingsley, P.B., Malhotra, A.K., Petrides, G., 2016. Subgenual cingulate cortical activity predicts the efficacy of electroconvulsive therapy. Transl. Psychiatry 6, e789. https://doi.org/10.1038/tp.2016.54.
Caballero-Gaudes, C., Reynolds, R.C., 2017. Methods for cleaning the BOLD fMRI signal. NeuroImage 154, 128-149. https://doi.org/10.1016/j.neuroimage.2016.12.018. Cleaning up the fMRI time series: Mitigating noise with advanced acquisition and correction strategies.
Caeyenberghs, K., Metzler-Baddeley, C., Foley, S., Jones, D.K., 2016. Dynamics of the human structural connectome underlying working memory training. J. Neurosci. 36, 4056-4066. https://doi.org/10.1523/JNEUROSCI.1973-15.2016.
Cao, H., Zhou, H., Cannon, T.D., 2020. Functional connectome-wide associations of schizophrenia polygenic risk. Mol. Psychiatry. https://doi.org/10.1038/s41380-020-0699-3.
Carrera, E., Tononi, G., 2014. Diaschisis: past, present, future. Brain 137, 2408-2422. https://doi.org/10.1093/brain/awu101.
Cole, J.H., Franke, K., 2017. Predicting age using neuroimaging: innovative brain ageing biomarkers. Trends Neurosci. 40, 681-690. https://doi.org/10.1016/j.tins.2017.10.001.
Damoiseaux, J.S., 2017. Effects of aging on functional and structural brain connectivity. NeuroImage 160, 32-40. https://doi.org/10.1016/j.neuroimage.2017.01.077.
Damoiseaux, J.S., Seeley, W.W., Zhou, J., Shirer, W.R., Coppola, G., Karydas, A., Rosen, H.J., Miller, B.L., Kramer, J.H., Greicius, M.D., 2012. Gender modulates the APOE ε4 effect in healthy older adults: convergent evidence from functional brain connectivity and spinal fluid tau levels. J. Neurosci. 32, 8254-8262. https://
doi.org/10.1523/JNEUROSCI.0305-12.2012.
Faivre, A., Robinet, E., Guye, M., Rousseau, C., Maarouf, A., Le Troter, A., Zaaraoui, W., Rico, A., Crespy, L., Soulier, E., Confort-Gouny, S., Pelletier, J., Achard, S., Ranjeva, J.-P., Audoin, B., 2016. Depletion of brain functional connectivity enhancement leads to disability progression in multiple sclerosis: a longitudinal restingstate fMRI study. Mult. Scler. 22, 1695-1708. https://doi.org/10.1177/1352458516628657.
Farb, N.A.S., Grady, C.L., Strother, S., Tang-Wai, D.F., Masellis, M., Black, S., Freedman, M., Pollock, B.G., Campbell, K.L., Hasher, L., Chow, T.W., 2013. Abnormal network connectivity in frontotemporal dementia: evidence for prefrontal isolation. Cortex 49, 1856-1873. https://doi.org/10.1016/j.cortex.2012.09.008.
Ge, J., Peng, G., Lyu, B., Wang, Y., Zhuo, Y., Niu, Z., Tan, L.H., Leff, A.P., Gao, J.-H., 2015. Cross-language differences in the brain network subserving intelligible speech. Proc. Natl. Acad. Sci. USA 112, 2972-2977. https://doi.org/10.1073/pnas.1416000112.
Harricharan, S., Rabellino, D., Frewen, P.A., Densmore, M., Théberge, J., McKinnon, M.C., Schore, A.N., Lanius, R.A., 2016. fMRI functional connectivity of the periaqueductal gray in PTSD and its dissociative subtype. Brain Behav. 6, e00579. https://doi.org/10.1002/brb3.579.
Horn, A., Reich, M., Vorwerk, J., Li, N., Wenzel, G., Fang, Q., Schmitz-Hübsch, T., Nickl, R., Kupsch, A., Volkmann, J., Kühn, A.A., Fox, M.D., 2017. Connectivity predicts deep brain stimulation outcome in Parkinson disease. Ann. Neurol. 82, 67-78. https://doi.org/10.1002/ana.24974.
Jones, D.K., Knösche, T.R., Turner, R., 2013. White matter integrity, fiber count, and other fallacies: the do’s and don’ts of diffusion MRI. NeuroImage 73, 239-254. https://doi.org/10.1016/j.neuroimage.2012.06.081.
Liu, Y., Wang, H., Duan, Y., Huang, J., Ren, Z., Ye, J., Dong, H., Shi, F., Li, K., Wang, J., 2017. Functional brain network alterations in clinically isolated syndrome and multiple sclerosis: a graph-based connectome study. Radiology 282, 534-541. https://doi.org/10.1148/radiol.2016152843.
Meskaldji, D.-E., Vasung, L., Romascano, D., Thiran, J.-P., Hagmann, P., Morgenthaler, S., Van De Ville, D., 2015. Improved statistical evaluation of group differences in connectomes by screening–filtering strategy with application to study maturation of brain connections between childhood and adolescence. NeuroImage 108, 251-264. https://doi.org/10.1016/j.neuroimage.2014.11.059.
Nomi, J.S., Vij, S.G., Dajani, D.R., Steimke, R., Damaraju, E., Rachakonda, S., Calhoun, V.D., Uddin, L.Q., 2017. Chronnectomic patterns and neural flexibility underlie executive function. NeuroImage 147, 861-871. https://doi.org/10.1016/j.neuroimage.2016.10.026.
Sadaghiani, S., Poline, J.-B., Kleinschmidt, A., D’Esposito, M., 2015. Ongoing dynamics in large-scale functional connectivity predict perception. Proc. Natl. Acad. Sci. USA 112, 8463-8468. https://doi.org/10.1073/pnas.1420687112.
Sair, H.I., Yahyavi-Firouz-Abadi, N., Calhoun, V.D., Airan, R.D., Agarwal, S., Intrapiromkul, J., Choe, A.S., Gujar, S.K., Caffo, B., Lindquist, M.A., Pillai, J.J., 2016. Presurgical brain mapping of the language network in patients with brain tumors using resting-state fMRI: comparison with task fMRI. Hum. Brain Mapp. 37, 913-923. https://doi.org/10.1002/hbm.23075.
Schlemm, E., Schulz, R., Bönstrup, M., Krawinkel, L., Fiehler, J., Gerloff, C., Thomalla, G., Cheng, B., 2020. Structural brain networks and functional motor outcome after stroke—a prospective cohort study. Brain Commun. 2. https://doi.org/10.1093/braincomms/fcaa001.
Scott-Van Zeeland, A.A., Abrahams, B.S., Alvarez-Retuerto, A.I., Sonnenblick, L.I., Rudie, J.D., Ghahremani, D., Mumford, J.A., Poldrack, R.A., Dapretto, M., Geschwind, D.H., Bookheimer, S.Y., 2010. Altered functional connectivity in frontal lobe circuits is associated with variation in the autism risk gene CNTNAP2. Sci. Transl.
Med. 2, 56ra80. https://doi.org/10.1126/scitranslmed.3001344.
Seeley, W.W., Crawford, R.K., Zhou, J., Miller, B.L., Greicius, M.D., 2009. Neurodegenerative diseases target large-scale human brain networks. Neuron 62, 42-52. https://doi.org/10.1016/j.neuron.2009.03.024.
Shen, X., Finn, E.S., Scheinost, D., Rosenberg, M.D., Chun, M.M., Papademetris, X., Constable, R.T., 2017. Using connectome-based predictive modeling to predict individual behavior from brain connectivity. Nat. Protoc. 12, 506-518. https://doi.org/10.1038/nprot.2016.178.
Shine, J.M., Bissett, P.G., Bell, P.T., Koyejo, O., Balsters, J.H., Gorgolewski, K.J., Moodie, C.A., Poldrack, R.A., 2016. The dynamics of functional brain networks: integrated network states during cognitive task performance. Neuron 92, 544-554. https://doi.org/10.1016/j.neuron.2016.09.018.
Spoormaker, V.I., Schröter, M.S., Gleiser, P.M., Andrade, K.C., Dresler, M., Wehrle, R., Sämann, P.G., Czisch, M., 2010. Development of a large-scale functional brain network during human non-rapid eye movement sleep. J. Neurosci. 30, 11379-11387. https://doi.org/10.1523/JNEUROSCI.2015-10.2010.
Tax, C.M.W., Grussu, F., Kaden, E., Ning, L., Rudrapatna, U., John Evans, C., St-Jean, S., Leemans, A., Koppers, S., Merhof, D., Ghosh, A., Tanno, R., Alexander, D.C., Zappalà, S., Charron, C., Kusmia, S., Linden, D.E.J., Jones, D.K., Veraart, J., 2019. Cross-scanner and cross-protocol diffusion MRI data harmonisation: a benchmark
database and evaluation of algorithms. NeuroImage 195, 285-299. https://doi.org/10.1016/j.neuroimage.2019.01.077.
Zalesky, A., Fornito, A., Bullmore, E.T., 2010. Network-based statistic: identifying differences in brain networks. NeuroImage 53, 1197-1207. https://doi.org/10.1016/j.neuroimage.2010.06.041.