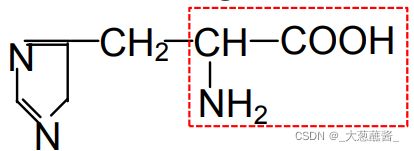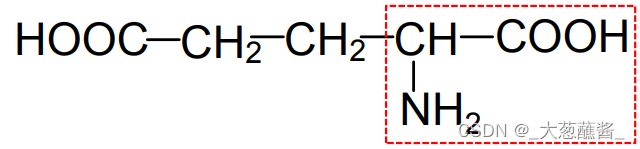生物化学-第二章-氨基酸
目录
一、蛋白质化学的研究历史
蛋白质的功能
组成蛋白质的元素
二、氨基酸的发现历史
三、氨基酸的基本结构
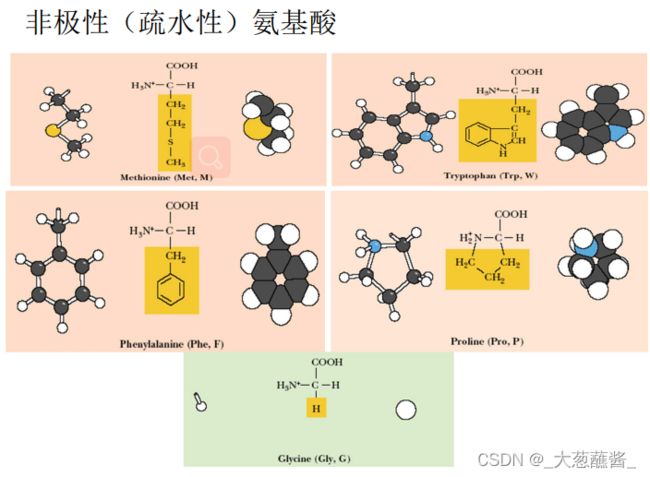
四、氨基酸的分类
不常见氨基酸-非蛋白氨基酸存在的意义
五、氨基酸的酸碱化学性质
物理性质:
氨基酸的解离性质
六、氨基酸的化学反应
七、氨基酸的光谱性质
八、氨基酸的分析分离
一、蛋白质化学的研究历史
蛋白质是一切生物体中普遍存在的,由天然氨基酸通过肽键连接而成的生物大分子;其种类繁多,各具有一定的相对分子质量,复杂的分子结构和特定的生物功能;是表达生物遗传性状的一类主要的物质。
蛋白质存在所有的生物细胞内,是构成生物体最基本的结构物质和功能物质。
蛋白质是生命活动的物质基础,几乎参与了所有的生命活动过程。
生物体最主要的特征是生命活动,蛋白质是生命活动的体现者。
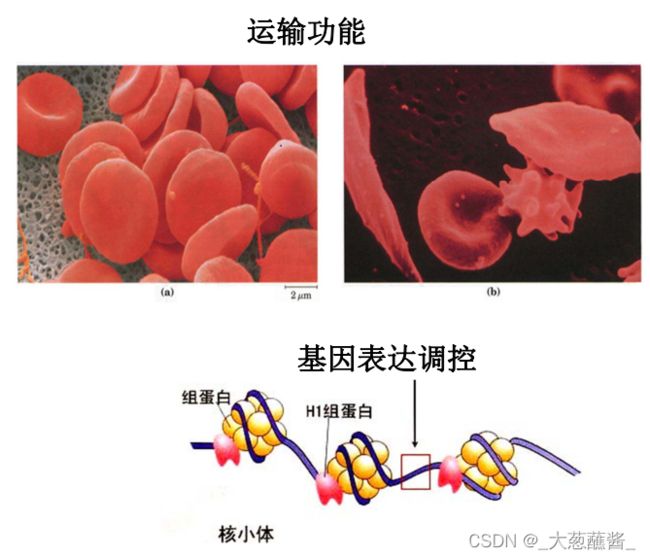
蛋白质的功能
酶的催化、结构组成、运动、保护作用、物质运输、信号传导、转录调控、营养物质存储
酶的催化:蛋白质作为酶,催化复杂的代谢反应。
结构组成:蛋白质作为结构蛋白,构建细胞骨架,维持蛋白质形态。
代谢调节:蛋白质作为激素进行代谢调节。
运动:蛋白质组成鞭毛、纤毛导致细胞运动和肌肉收缩。
保护作用:蛋白质组成防御体系,如抗体、补体系统等。
物质运输:血红蛋白、脂蛋白、细胞色素蛋白
信号传导:受体蛋白、味觉蛋白、细胞表面抗原
转录调控:转录因子、阻遏蛋白、细胞周期蛋白
营养物质的存储:酪蛋白、卵清蛋白、麦醇溶蛋白。
组成蛋白质的元素
组成蛋白质的元素有:C50、H7、O23、N16、S 0.3,
蛋白质含量的测定使用凯氏定氮法。
蛋白质含量=蛋白N×6.25.(凯氏定氮法)
氨基酸是构成蛋白质的基本单元
蛋白质使用强酸、强碱或酶进行处理之后,可以得到各种各样的氨基酸。
氨基酸是构成蛋白质的基本结构单元。参与组成蛋白质的氨基酸有20种,均属于L-氨基酸(甘氨酸除外),称为蛋白质氨基酸。
L-氨基酸 D-氨基酸的 区别 作用_百度知道![]() https://zhidao.baidu.com/question/152399853.html#:~:text=L-%E6%B0%A8%E5%9F%BA%E9%85%B8%EF%BC%9A%E6%98%AF%E6%9E%84,%E6%9C%89%E7%9D%80%E5%AF%86%E5%88%87%E7%9A%84%E5%85%B3%E7%B3%BB%E3%80%82
https://zhidao.baidu.com/question/152399853.html#:~:text=L-%E6%B0%A8%E5%9F%BA%E9%85%B8%EF%BC%9A%E6%98%AF%E6%9E%84,%E6%9C%89%E7%9D%80%E5%AF%86%E5%88%87%E7%9A%84%E5%85%B3%E7%B3%BB%E3%80%82
二、氨基酸的发现历史
1806年,发现的第一个氨基酸——天冬酰胺(Asn)。
三、氨基酸的基本结构
除脯氨酸和羟脯氨酸外,天然氨基酸在结构上有共同特点:
- A.分子种同时含有羟基和氨基,且与羟基相邻的α-碳原子上都有一个氨基,称为α-氨基酸。
- B.除甘氨酸外,其他氨基酸分子中的α-碳原子都为不对称碳原子,都有手性。
- C.都具有旋光性(溶液中的氨基酸使平面偏振光偏左的为左旋异构体,偏向右的是右旋异构体);
- D.都具有D-型和L-型两种立体异构体。已知天然蛋白质中的氨基酸都为L-型。
丙氨酸:Ala A,alanine
R基为:甲基
缬氨酸:Val V,valine
R基为:1-甲基乙基
亮氨酸:Leu L,leucine
R基为:2-甲基丙基
异亮氨酸:Ile I,Isoleucine
R基为:1-甲基丙基
脯氨酸:Pro P ,proline
R基为-丙基--NH-CH,连接成环
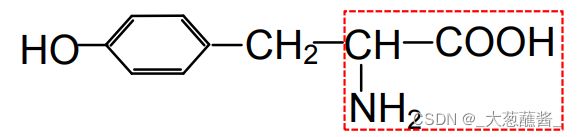
苯丙氨酸:Phe F
R基为苯甲基
色氨酸:Trp W
蛋氨酸 或 甲硫氨酸 Met M
甘氨酸 Gly G
丝氨酸 Ser S
苏氨酸 Thr T
半胱氨酸 Cys C
天冬酰胺 Asn N
谷氨酰胺 Gln Q
酪氨酸 Tyr Y
赖氨酸 Lys K
精氨酸 Arg R
组氨酸 His H
谷氨酸 Glu E
天冬氨酸 Asp D
氨基酸常见的有20种。
还有两种稀有的组成蛋白质的氨基酸:硒代半胱氨酸、吡咯酪氨酸。
稀有氨基酸一般是常见氨基酸的基础上修饰而来的。
残基:在肽链中每个氨基酸都脱去一个水分子,脱水后的 残余部分叫残基(residue), 因此蛋白质肽链中的氨基酸 统统是残基形式。
四、氨基酸的分类
按照R基团的酸碱性分:酸性:天冬谷;碱性:赖精组。
中性AA(15)、酸性AA(2)、碱性(3);
按照R基团的电性质:
疏水R基团(8)、不带电性质R基团AA(7)、带电荷R基团AA(5);
按照R基团的化学结构:
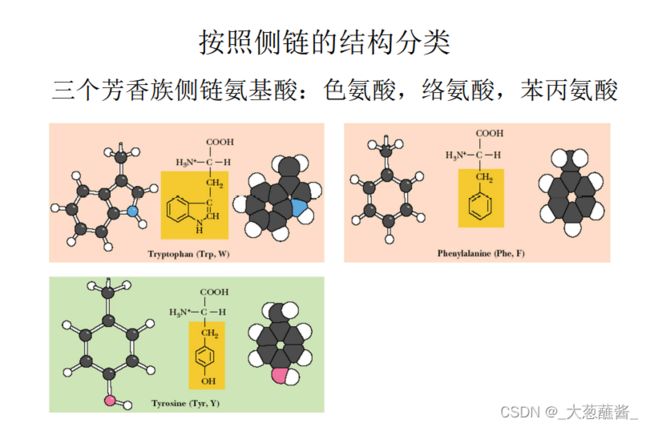
脂肪族AA、芳香族AA(Phe、Trp、Tyr)、杂环族AA(Pro、His)
人类所必须的八种氨基酸:
赖氨酸、缬氨酸、蛋氨酸(甲硫氨酸)、色氨酸、亮氨酸、异亮氨酸、苏氨酸、苯丙氨酸;
两种非必须氨基酸:
精氨酸、组氨酸
(蛋来写一本两色书)甲来写一本两色书
不常见氨基酸-非蛋白氨基酸存在的意义
- 作为细菌细胞壁种肽聚糖的组分:D-Glu,D-Ala。
- 作为一些重要代谢产物的前体或中间体:作为一些重要代谢物的前体或中间体:β-丙氨酸、鸟氨酸、瓜氨酸(尿素循环,西瓜含量多)
- 作为神经传导的化学物质:y-氨基丁酸
- 有些氨基酸只作为一种N素的转运和贮藏载体(刀豆氨酸)
- 调节生长作用杀虫防御作用
五、氨基酸的酸碱化学性质
物理性质:
(1)溶解性:各种氨基酸在水中的溶解度差别很大,并能溶解于稀酸或稀碱中,但不能溶解于有机溶剂。通常酒精能把氨基酸从溶液中沉淀析出。
(2)熔点:α-氨基酸都含有-COOH和-NH2,都是不挥发的固体结晶,氨基酸的熔点极高,熔点200-350℃;
(3)旋光性:除甘氨酸外,氨基酸都有旋光性,能够使偏振光平面向左或向右旋转,左旋使用(-),右旋(+)。
(4)光吸收:构成蛋白质的20种氨基酸在可见光区都没有光吸收,但在远紫外线区(<200nm)均有光吸收。在近紫外线区(220-300nm)只有酪氨酸、苯丙氨酸和色氨酸具有吸收光的能
力。
氨基酸的解离性质
在结晶水或水溶液中,氨基酸并不是游离的羧基或氨基的形式存在,而是解离成两性离子。在两性离子中,氨基以质子化(-NH3+)形式存在,羧基是以解离状态(-COO-)形式存在,在不同的PH状态下,两性离子的状态随之变化。
等电点(isoelectric point):氨基酸处于正负电荷相等即静电荷为零的兼性离子状态的PH值。
氨基酸在等电点的PH状态下溶解度最小。
PH>PI时,氨基酸带负电。
PH<PI时,氨基酸带正电。
氨基酸侧链的解离
带有可解离R基的氨基酸有三个PK‘
danshi
六、氨基酸的化学反应
与茆三酮(ninhydrin)的反应——定量反应
与亚硝酸的反应——Van Slyke定氮
与2,4-二硝基氟苯(FDNB)的反应——测序
与甲醛的反应—— 氨基滴定
与酰化基的反应——氨基保护基
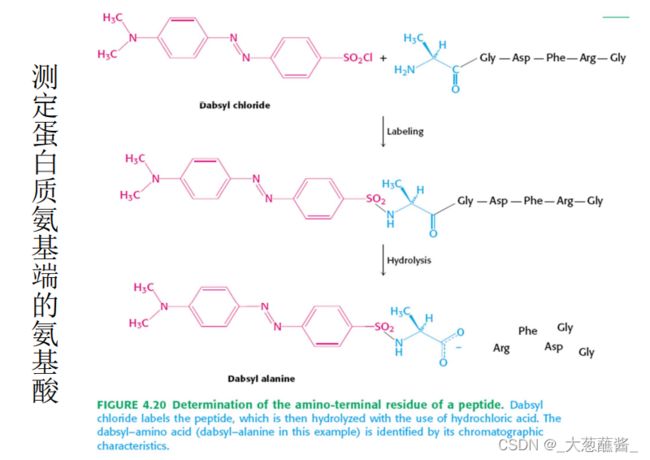
与二甲基氨基萘磺酰氯(DNS-CI)的反应——测序
与荧光胺的反应——微量检测
与Edman试剂(苯异硫氰酸酯)和有色Edman试剂的反应——测序
七、氨基酸的光谱性质
两种手性分子的命名系统
D,L系统,R,S系统
带芳香环侧链的氨基酸具有紫外线吸收能力,最大光吸收在280nm。
八、氨基酸的分析分离
色谱分析法