肠道菌群失衡的症状、原因和自然改善
谷禾健康
肠道菌群是居住在肠道中各种微生物。微生物群的建立甚至在个体出生之前就开始了,随着时间的推移而改变,并在体内持续存在,直到个体死亡。这些微生物群的组成是宿主特定的,在个体的一生中不断进化,并且容易受到各种因素的影响。
胎龄、分娩方式、饮食(母乳与配方奶)、卫生、抗生素,激素、疾病、衰老等都会影响并塑造肠道菌群。肠道菌群的定植、发育、成熟、稳定,老化与我们人类发育以及免疫成熟等高度吻合,不同阶段不同部位的菌群的构成以及丰度有不同特征。
肠道细菌是免疫系统发育和功能的重要组成部分。肠道菌群的变化可能是许多炎症性疾病发生的重要因素。而生活方式的改变可能改变了肠道菌群的初始发育或稳定维持。
本文从肠道菌群的功能,初始构建,到菌群健康/失衡的状态,以及相应的改善措施等进行全面阐述。
01 肠道菌群功能
肠道菌群,居住在肠道(宿主)内的所有本土细菌的总和,被视为一个器官,执行着一系列重要的、对健康至关重要的功能,而这些功能无法通过任何其他方式复制。
研究人员通过比较无菌实验动物(没有任何肠道菌群)和正常菌群对照动物来确定这些功能。这些发现也在人群中得到了证实。
以下是肠道菌群最重要功能的简要概述:
◥ 粪便中的水分滞留
粪便主要是由水组成(平均水含量75%;各项研究的平均范围为63-86%)。单细胞生物,如细菌,主要含有水,被无法穿透的膜包围。
◥ 形成正常粪便
由于细菌是正常粪便中最主要的成分,它们的缺失可能会导致持续性慢性腹泻。
◥ 生产必需维生素
细菌会合成各种物质,包括某些复合维生素 B、维生素 B12 和维生素 K,这些物质对血液正常凝固至关重要。
◥ 保护肠道上皮(粘膜)免受病原体侵害
正常的肠道菌群控制着不良细菌的数量,例如白色念珠菌(酵母)或大肠杆菌的感染性菌株。保护机制有很多种,食物供应的竞争、对肠粘膜的粘附、维持所需的 pH 值平衡以及产生过氧化物和酶,从而杀死外来细菌。
◥ 组织发育和再生
与健康动物相比,无菌实验动物的肠粘膜(上皮)和淋巴组织(派尔氏斑)发育不良,肠道健康黏膜薄弱、免疫淋巴组织不发达等存在许多缺点。
◥ 免疫
正常肠道细菌负责实现吞噬作用:吞噬细胞在全身范围内破坏致病细菌、病毒、过敏原和其他异物,吞噬细胞是负责非特异性(抗体前)免疫系统防御的专门血细胞。
02 肠道菌群构建及发育
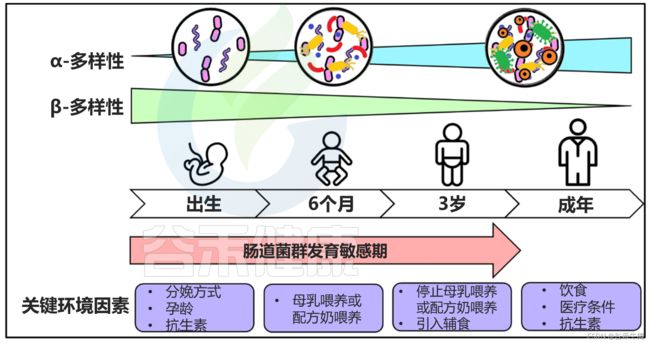
生命的前三年是可塑性增强的时期,肠道微生物群的发育很容易受到环境因素的影响。在婴儿期人与人之间的肠道微生物组差异变化最大,在成年期变得更加相似。
★ 婴幼儿
当婴儿出生后,在几口初乳后,大肠得到“培养”,初乳是一种淡黄色的液体,包含母亲的细菌,富含必需的营养。初乳先于富含脂肪和蛋白质的母乳流出。这个过程在母乳中继续,新生儿的肠道菌群在第6个月开始逐渐成熟,直到“成人”状态。
肠道微生物群的发育及主要影响环境因素
Parkin K et al., Microorganisms,2021
α-多样性(一个样本内的多样性)随着肠道微生物群的发展而增加。β多样性(样本之间的多样性)随着年龄的增长而下降。
在没有让新生儿品尝初乳和母乳的情况下开始配方奶粉可能会在未来几年困扰年轻的父母,因为他们要努力应对后代的食物过敏、腹泻、便秘和整体健康状况不佳。但对于许多母乳喂养的婴儿来说,即使是母乳也可能缺乏必需的细菌,因为他们的母亲可能之前接触过环境污染物、抗生素或重金属。这就是为什么如今,许多新生儿即使母乳喂养也会像配方奶喂养的婴儿一样经常患上胃肠道和自身免疫性疾病,部分原因来自他们的母亲患有菌群失调,正常肠道菌群的组成和/或功能发生变化。
母乳包含免疫球蛋白(IgA和IgG),溶菌酶,乳铁蛋白,免疫调节性细胞因子(例如TGF-β和IL-10)等。因此,肠道细菌定植会显着影响生命早期免疫系统的成熟和生理,并影响成年的健康和疾病,正如无菌小鼠免疫功能的丧失所指出的那样。
肠道微生物群落在断奶和引入固体食物后发生显着转变,丁酸盐生产者的数量增加,即拟杆菌属和梭菌属。抗生素的使用通过增加变形菌和降低放线菌数量来显着影响婴儿肠道微生物群的进化,降低整体多样性并选择耐药细菌。
扩展阅读:微生物群在婴儿健康中的作用:从早期到成年
★ 儿童
婴儿相比,儿童肠道微生物组的特点是稳定性更高,个体差异相对较小。儿童时期的环境,饮食对于菌群的发育成熟至关重要。比如农村儿童肠道多样性水平高,在儿童时期,肠道微生物群受地理和饮食文化的影响,发达国家和发展中国家以及工业化和农村地区之间存在差异。城市化过程显着塑造了肠道微生物群,从而可能影响肠道微生物群的整体功能。
★ 成年人
在成年期,肠道微生物群落在某种程度上最稳定的。成年人体内 30-40% 的肠道菌群可以在一生中改变,而饮食是实现这一目标的最有力工具之一。例如,在食用富含脂肪和蛋白质的饮食的个体中发现了拟杆菌属肠型,而在食用富含纤维的饮食的人的肠道微生物群中通常存在普氏菌属肠型。据估计,高脂肪饮食确实与低短链脂肪酸SCFA 和低双歧杆菌有关浓度。以棕榈油为基础的饮食喂养的小鼠显示出厚壁菌门与拟杆菌门的比例增加,梭菌属物种增加,以及整体微生物群多样性减少。
蛋白质是健康饮食不可或缺的一部分,具体来说,低于最低限度的摄入量与营养不足状态有关,而高于可耐受限度的摄入量与营养过剩疾病有关。已经证明,到达结肠的膳食蛋白质(约 10%)既是蛋白水解细菌的底物,也是糖解物种的氮源。蛋白质和氨基酸分解的产物是 SCFA、支链脂肪酸(BCFA;异丁酸、异戊酸和 2-甲基丁酸)、酚类化合物(苯丙酸、苯乙酸、对甲酚、丙酸吲哚和吲哚乙酸)、胺、硫化物和氨。参与脱氨微生物是梭状芽孢杆菌,拟杆菌和肠杆菌科细菌种类。例如,产乙酸盐的共生菌 Bacteroides thetaiotaomicron和Faecalibacterium prausnitzii诱导杯状细胞增殖和粘液产生,这两种作用都能够维持肠道稳态和上皮完整性。
★ 老年人
与年轻人相比,老年人的肠道微生物群组成存在更高水平的个体差异。长寿者肠道菌群多样性水平高,百岁老人的拟杆菌、双歧杆菌和肠杆菌的丰度降低,而梭状芽孢杆菌与年轻人相比,物种丰度有所增加。长寿者产短链脂肪酸菌增多,短链脂肪酸对维持肠道止血很重要。短链脂肪酸为结肠上皮细胞提供主要能量,并具有抗炎特性。这些产短链脂肪酸菌在长寿老人中的富集表明,这些细菌可能会减轻炎症及由此造成的损害,这可能是他们能够健康衰老的原因。
扩展阅读:健康长寿的步伐永不停歇
长寿者碳水化合物代谢相关基因减少,异种生物降解有关的基因数量增加,脂质代谢基因变化,多方面研究都清楚地表明,健康长寿的人存在更多样化且平衡的肠道菌群,而在患有不同合并症的老年人中观察到肠道菌群紊乱。
扩展阅读:肠道微生物群的老化及其对宿主免疫力的
03
肠道菌群平衡
健康的肠道菌群丰富且多样性高。不同生态位的微生物群落组成存在显着差异。在人体内,变形菌属和梭菌属主要分布在小肠;拟杆菌科和梭菌科主要分布在结肠和盲肠,乳酸杆菌、链球菌和肠球菌主要分布在空肠和回肠。
“好”细菌
每种类型的细菌都在维持其动态平衡方面发挥作用。肠道中的“好”细菌可以缓解许多疾病,对人体健康发挥积极作用。例如鼠李糖乳杆菌GG 分泌物通过增强 T 细胞反应能力来调节 DC 的功能,通过增加 IL-2 和产生 IFN-γ 的 T 细胞;凝结芽孢杆菌MTCC 5856 可改善重度 IBS 患者的抑郁和胃肠道症状;长双歧杆菌NCC3001 在 IBS 患者中也显示出类似的效果。
扩展阅读:双歧杆菌:长双歧杆菌
“坏”细菌
另一方面,肠道中的“坏”细菌会促进许多肠道疾病,并对人类健康产生负面影响。许多厌氧和需氧微生物,如肺炎克雷伯菌、大肠杆菌和胞核梭杆菌,具核梭杆菌,脆弱拟杆菌在肠道和全身伤口处定居。在肿瘤组织中检测到含有产肠毒素的脆弱拟杆菌和具核梭杆菌的生物膜。
肠道致病菌还可增加共生体的毒力,诱导其粘附和浸润,削弱上皮屏障,促进炎症反应。IBD 患者具有致密的脆弱拟杆菌生物膜。
空肠弯曲杆菌、沙门氏菌,或大肠杆菌会引发胃肠炎,加重 IBD 症状。从患有结肠炎的小鼠的肠道中可以分离出大肠杆菌,同时还观察到 DNA 损伤和癌症。
扩展阅读:细菌大盘点(二) | 葡萄球菌、沙门氏菌、弯曲杆菌
空肠弯曲杆菌也会破坏 TLR9 的极性,进而破坏 TLR9 诱导的上皮屏障并增加 CXCL8 的产生,表明空肠弯曲杆菌的感染可以诱导小鼠实验性结肠炎的炎症反应。这些发现可能揭示肠道病原体如何在感染的急性期将共生细菌转化为病原体。
04 肠道菌群失调
菌群失调是指体内微生物群不平衡,这可以表现为某些细菌的出现率较高,某些细菌的出现率较低,细菌的多样性不足,有害菌,有益菌比例失调等。
编辑
这里说的菌群失调与临床上讲的菌群失调有点区别:
临床上菌群失调
菌群失调(dysbacteriosis)是指机体某部位正常菌群中各菌种间的比例发生较大幅度变化而超出正常范围的状态,由此产生的病症,称为菌群失调症或菌群交替症(来源:百度百科)。
菌群平衡对应的异常称为肠道菌群失调,临床上有I度失调和更严重的II度失调。大便常规检查是通过显微镜下观察统计染色细菌中杆菌和球菌以及革兰氏阴性和阳性菌的比值是否超标来判别的。
其中致病菌多为球菌和革兰氏阴性菌,而肠道有益菌多为杆菌和阳性菌,因而在传统临床上较为粗放的比较两者的比值评估是否肠道菌群环境出现了紊乱。
谷禾菌群检测报告中的菌群失调:
基于高通量测序可以精准的检测低至万分之一水平的菌,甚至可以分类到种水平,因此可以更加精细化的评估菌群是否出现紊乱和异常。
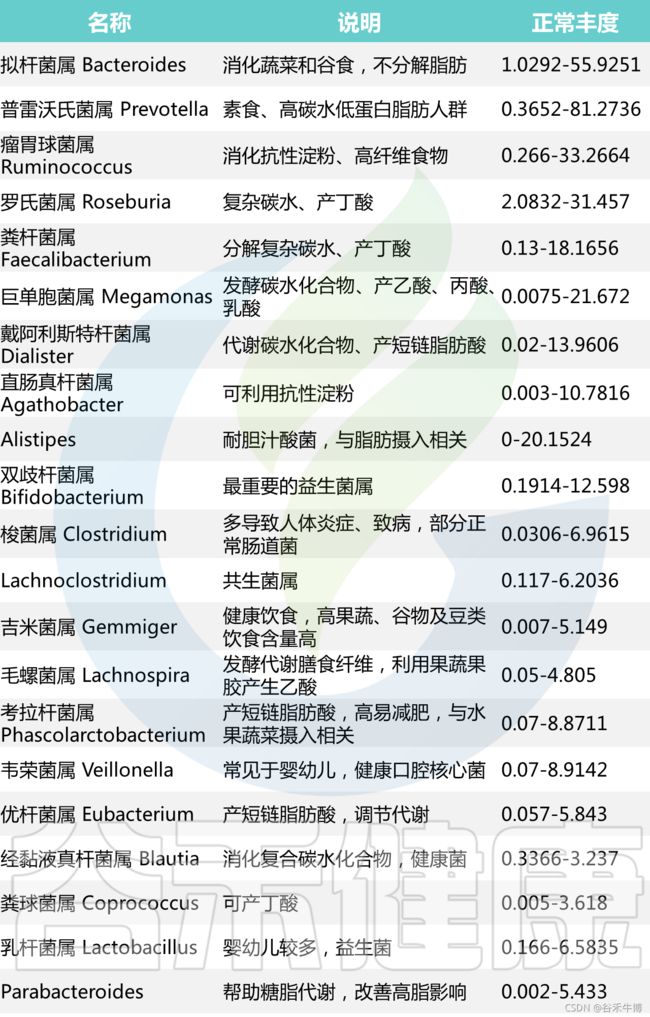
基于谷禾超过30万人群的菌群数据库分析结果,我们将在90%的人群都有检出,且人群平均丰度1%以上的菌属做为核心菌属。这些核心菌属通过长期与人类共生,在帮助消化复杂碳水化合物和产生短链脂肪酸外还影响整个肠道环境,抑制病原微生物的定植生长。因此当这些核心菌属占总肠道菌群比例低于60%时,肠道菌群很可能处于紊乱状态。
编辑
肠道菌群失调症状是什么
生态失调对身体的影响范围从消化系统疾病,如痉挛、腹泻和便秘,这些症状可能是轻微的、短暂的——到更严重的疾病和慢性病。
常见症状包括:
消化问题,包括便秘/腹泻、食物不耐受、胀气和腹胀
胃酸倒流或心脏灼伤
排尿困难,阴道感染或瘙痒
炎症、关节疼痛
痤疮、皮疹和牛皮癣
慢性疲劳
多动症或注意力不集中的问题
焦虑,易怒或抑郁
肠道菌群失调通常是更严重慢性病的先兆,包括:
肠道疾病,如消化性溃疡病,结肠炎,IBS等
炎症 点击查看:深度解析 | 炎症,肠道菌群以及抗炎饮食
肠漏 点击查看:什么是肠漏综合征,它如何影响健康?
结直肠癌 点击查看:结直肠癌防治新策略——微生物群
糖尿病 点击查看:2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
肥胖 点击查看:体重增长:目前为止我们所知道的一切
肝病 点击查看:深度解析 | 肠道菌群与慢性肝病,肝癌
高血压 点击查看:认识肠道微生物及其与高血压的关系
心脏疾病 点击查看:与心血管疾病相关的肠道菌群代谢或毒素
最新 | 肠道微生物群与心血管疾病:机遇与挑战
自身免疫性疾病,例如帕金森氏症,多发性硬化,类风湿关节炎
甲状腺 点击查看:肠道-甲状腺轴如何影响健康,怎么干预改善?
胰腺癌点击查看“隐藏高手” 胰腺癌的新出路——微生物
肺癌 点击查看:肺癌最新研究进展,与肠肺微生物息息相关
哮喘 「哮喘」最新研究已逐步渗透到更精细层面
过敏 点击查看:婴幼儿过敏有望改善,与肠道菌群密切相关
生命早期微生物接触和过敏风险:如何预防
>微生物群对三大过敏性疾病发展的影响
抑郁症 点击查看:抑郁症,恐惧,压力和肠道微生物群脱不开的关系
饮食与抑郁症密不可分,一文涵盖多种生物学机制
阿尔茨海默 点击查看:阿尔茨海默病de饮食-微生物-脑轴
妇科问题(包括多囊卵巢综合征) 点击查看:多囊卵巢综合征患者中,肠道菌群失调破坏糖脂代谢和内分泌功能
念珠菌疾病(一种真菌感染) 点击查看:肠道真菌与健康和疾病有关
牛皮癣 点击查看:牛皮癣看似皮肤病,实则关系到肠道
......
什么导致肠道菌群失调?
糖的摄入
在现代饮食中,糖无处不在,而且形式多种多样。我们大多数人现在都知道,过度消费“游离糖”的精制糖并不健康。糖也是造成菌群失调的主要因素。然而在忙碌的现代生活中,很难不过度摄入糖分。
高糖食物的常见罪魁祸首包括碳酸饮料、能量饮料、糖果、饼干、甜点、蛋糕、果汁和谷物等,它们都会导致菌群失调。
还有一些食物,含有的糖分更加隐蔽。这些包括:
即食食品、腌泡汁、酸辣酱和泡菜、一些酒精饮料、调味酱、白面包、白米饭和土豆。

为什么将土豆、白米饭和白面包归类为糖呢?
糖是一种碳水化合物,在消化过程中会分解成葡萄糖,然后被吸收到血液中并被身体用作能量。
这个过程适用于所有形式的糖,但淀粉也是一种碳水化合物,在消化过程中以完全相同的方式分解。所以 2 型糖尿病患者难以降低血糖水平,淀粉的摄入是个问题。
意面非常独特,因为它的升糖指数相对较低 。它具有低 GI,因为未糊化的淀粉颗粒被包裹在面食面团中的海绵状蛋白质(面筋)网络中。从糖尿病的角度来看,这很好,但面食仍然富含碳水化合物,可以适量吃点。注意,意面应该煮熟有嚼劲,因为过度烹饪会增加其血糖指数。
发酵/小肠细菌过度生长(SIBO)
这是由胃、小肠和大肠开始处的细菌过度生长引起的碳水化合物不耐受状况。这里的细菌过度生长是由胃酸过少、肠蠕动异常引起的淤滞、身体/手术异常、免疫缺陷或营养不良促进的。胃部细菌过度生长会增加全身感染的风险,并且患者会对碳水化合物产生不耐受。摄入的任何碳水化合物都会被细菌发酵并产生有毒废物。
膳食糖都可以发酵产生内源性乙醇。小肠长期暴露于乙醇本身可能会损害肠道通透性。大多数病例是由酵母过度生长引起的,大约 20% 是细菌来源。症状包括腹胀,碳水化合物不耐受,疲劳和受损的精神功能。
扩展阅读:>腹胀和胀气
SIBO 的风险因素包括胃酸不足;大便蠕动异常;外科手术;免疫缺陷;营养不良。SIBO 与胃癌有关,并且由于乳酸的产生增加会导致酸中毒。
蛋白质缺乏
肠道菌群的能量来自健康粘膜分泌的粘蛋白。粘蛋白是一种糖蛋白,一种将葡萄糖与氨基酸结合的分子。胃和肠粘液是由粘蛋白和水结合形成的。粘液保护胃和肠内壁免受机械损伤、酶、胃酸、涩胆汁和食源性病原体的侵害。例如,必需氨基酸苏氨酸的缺乏会抑制身体产生粘蛋白的能力,并相应地抑制细菌的功能和繁殖能力。
膳食纤维过多或过少
膳食纤维细菌发酵的产物(短链脂肪酸、乙醇和乳酸)过多会破坏细菌。
纤维也会让人“上瘾”,其发展方式:随着发酵破坏细菌,需要越来越多的纤维来形成粪便。
但是膳食纤维摄入不足或突然停止所有纤维摄入,也会发生菌群失衡,导致便秘或其他肠道问题。
肠道酸度
除发酵外,当胰腺因胰腺疾病或梗阻而不能中和胃内容物时,可能会出现酸度太过。在这种情况下,酸性消化液溢出进入大肠并破坏细菌。有趣的是,健康人最有可能的梗阻原因是胰管阻塞,因为十二指肠中有太多不可消化的纤维。
【粪便的正常酸度在6至7.2 pH范围内】
腹泻
急性肠道感染、食物中毒、泻药、医疗干预和其他情况可能导致长期腹泻,这可能清除肠道中的细菌。阑尾切除术也会增加菌群失调的风险,因为当腹泻发生时,阑尾保留了“起始”培养物。
抗生素
【如磺胺、磺胺衍生物、Dynapen、Urex、Nydrazid、Macrodantin、Rifadin 等】
抗生素在许多情况下都发挥着挽救生命的重要作用。然而,这些药物被广泛且不分青红皂白地过度滥用给儿童和成人,大批菌群被清除从而导致菌群失调。
家禽、鱼类、牲畜和牛奶中的抗生素残留。工业化养殖需要连续使用大剂量的抗生素来保持维持动物的生命。不可避免地,其中一些抗生素会转移到食物供应中,并影响人类。
扩展阅读: 细菌的天敌抗生素,如何用好这把救命的双刃剑?
重金属
汞、铅、砷、镉、镍、银和其他金属具有极强的毒性,即使是微量的也是如此。污染源多种多样,从工业污染物到家用化学品、从电池到电子元件、测量设备和其他来源。相对而言,儿童的菌群是脆弱的,易受影响。
牙科汞合金填充物会在口腔中释放元素汞。汞是一种强毒剂、神经毒素和致癌物,逐渐破坏神经系统,导致癌症。
人造食用色素
多年前,一种称为结晶紫(也称为水晶龙胆)的彩色颜料被广泛用作局部防腐剂。长期接触人造食用色素可能会像结晶紫影响(杀死)局部细菌一样影响肠道细菌。
医疗和环境污染物
化疗和放疗杀死细菌的原因与它们杀死癌细胞的原因相同。还有其他因素会对肠道菌群产生负面影响,例如工业污染物、家用化学品、抗菌肥皂以及牙膏、洗发水和洗涤剂中的有毒物质。
编辑
还有一些住在农场,或在经常抱宠物的儿童中,他们患哮喘或其他呼吸系统疾病的几率并不像城市生活的儿童那样频繁。
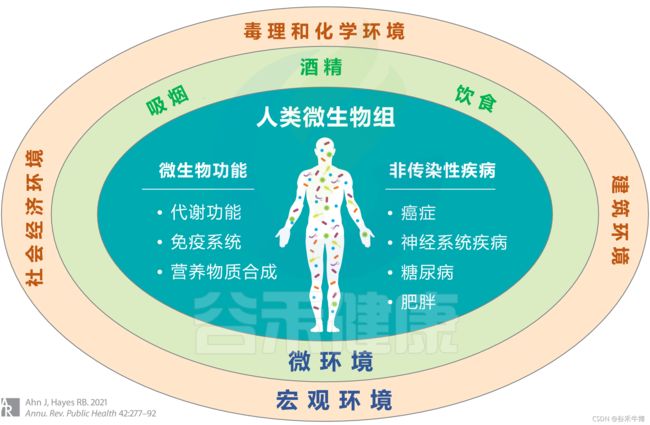
扩展阅读:环境对人类微生物组及其对非传染性疾病的影响
05
菌群失调改善和预防
通过饮食、抗菌物质和细菌替代或支持有效治疗生态失调必须区分生态失调的模式。不同的治疗和改善方法要依赖精准的肠道菌群检测技术手段,首先判别菌群组成和平衡状况。
选择合适的蛋白质
将红肉的消费量限制在每月两三次,可以将其视为一种“奢侈品”。它们富含饱和脂肪和蛋白质。如果遵循富含红肉的饮食,对心脏健康有明显的影响。
此外,还有一些影响会导致肠道菌群失调。由于红肉的热量密度很高,因此牺牲了富含纤维和抗氧化剂的食物。蛋白质或其组成部分氨基酸的持续供应到结肠,加上纤维供应的减少,将改变结肠细菌的平衡,有利于氨基酸降解细菌。这些细菌产生的代谢产物包括一些致癌毒素。
其次,有报道称富含肉类的饮食会导致或加剧痔疮,如前所述,高蛋白饮食会导致结肠微生物群发生变化。负责调节蠕动(通过胃肠道移动食物和废物的肌肉收缩)的细菌会减少,从而导致结肠运动减慢。粪便吸收了过多的水分,导致便秘。硬而干燥的大便会导致用力,进而导致痔疮。
根据构成个人微生物群的不同,也可能会产生相反的效果,蠕动加速,导致腹泻。
应避免含有硝酸盐、亚硝酸盐或亚硫酸盐的加工肉类。这包括培根、包装好的肉片和任何加工肉类。它们是肠道刺激物,且致癌。
最后,鸡蛋是一种非常有营养的蛋白质来源,可以经常食用。自由放养总是最好的,用亚麻籽喂养的母鸡产下的鸡蛋含有大量的Omega 3 脂肪酸。
编辑
扩展阅读:利用饮食精准干预肠道微生物群
选择健康的脂肪
越来越多的证据表明饱和脂肪不是有害于身体,值得记住的是,相关研究仍处于起步阶段。
三文鱼、鳟鱼等油性鱼类每周至少应食用两次。它们含有丰富的Omega 3 脂肪酸,能够降低坏胆固醇(低密度脂蛋白或 LDL),同时增加好胆固醇(高密度脂蛋白或 HDL)的水平,因此对心脏有益。
一般橄榄油仍然是烹饪和调味的首选脂肪。但是,如果食谱需要,可以适量使用黄油,植物油等。
黄油还具有隐藏的健康益处。黄油富含丁酸盐(短链脂肪酸的一种),它也由结肠中的某些细菌产生。它能帮助修复和维持肠道内的细胞(上皮细胞),并且是预防结肠炎和炎症性肠病的关键组成部分。丁酸盐是一种对抗菌群失调的脂肪酸。
在这一点上值得注意的是,所有脂肪和油都含有单不饱和、多不饱和和饱和脂肪酸的混合物,但它们通常以含量最高的脂肪酸的名称来命名。因此,饱和脂肪确实占我们总摄入量的一小部分。为了保持身体健康,关键在于比例和数量。
每周食用两到三次家禽。它的饱和脂肪和胆固醇比红肉少得多。
某些乳制品不错,酸奶和开菲尔具有益生菌的特性,当然低脂是最好的。奶酪含有丰富的益生菌,一些奶酪也含有益生菌。绵羊和山羊奶酪是低脂益生菌的良好来源。
适量食用坚果,因为它们是单不饱和脂肪的重要来源。它们富含大量营养素和纤维,是薯片/薯片的健康替代品。杏仁、巴西坚果、榛子、松子、开心果和核桃都是非常健康的坚果类型。
谨慎对待谷物
全谷物可以成为饮食中的营养补充剂,但只能适量食用,每周大约 2 ~ 3 次。
与每天食用全谷物的地中海饮食不同,菌群失调饮食是一种治愈性饮食,全谷物可能对消化道不利,食用全谷物会加剧肠易激综合征。
大多数全谷物含有高比例的不溶性纤维和可溶性纤维。高水平的不溶性纤维使粪便膨胀,从而压迫收缩的结肠壁。当膨胀的粪便通过收缩的结肠部分时,结肠壁会扩张,导致神经末梢发出疼痛信号。
糖和淀粉不会在胃中分解。酶在口腔中开始消化过程,然后在小肠中继续。它们只是增加了胃必须处理的食物量。这会导致酸溢出到食道中。
此外,尽管全麦面包含有纤维,但其血糖指数仅略低于白面包,也就是说它会增加血糖。这是由于碳水化合物与可溶性纤维的比例很高,可溶性纤维在小肠消化过程中提供的保护很少。
全麦食品的例子包括:
大麦、荞麦、弗里卡、燕麦、藜麦、糙米等。
扩展阅读:你吃的膳食纤维对你有帮助吗?
吃生食和酸的食物
多吃未煮熟的生食和酸化食物。它们含有大量的植物杀菌素、抗生素和酶。酶起着特别重要的作用,它们帮助身体分解和加工食物。例如,吃酸菜、酸苹果,喝蜂蜜苹果汁等。这对于使胃肠道的酸度正常化是必要的,因为酸性环境会阻止病原菌的发展。
药品抗生素
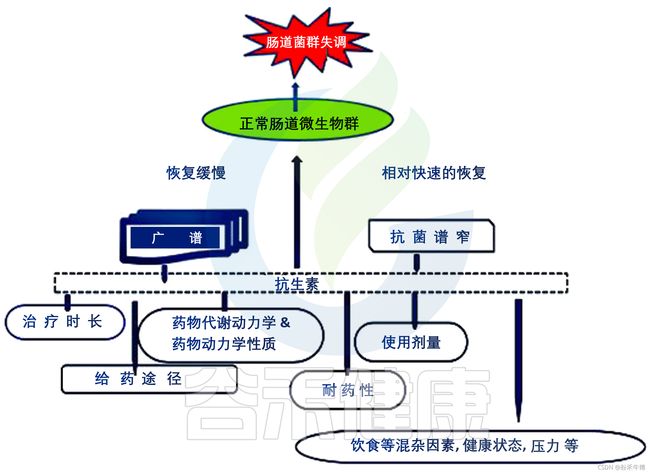
抗生素药物可能导致或帮助控制生态失调,这取决于药物和疾病的性质。如果厌氧菌对小肠造成污染,甲硝唑或四环素可能是有益的。当肠道细菌过度生长占主导地位时,环丙沙星通常是首选药物,因为它倾向于避免厌氧菌。
抗生素对肠道菌群的不同影响
编辑
Yang L, et al., AMB Express. 2021
详见:>抗生素对肠道微生物群的不同影响
益生菌、益生元
益生菌
如何理解 “好细菌” 可以控制坏细菌?
可以想象一个拥挤的剧院,你走进去发现所有的座位都被占用了,你就没地方坐了。细菌也是一样,结肠中只有一定数量的“座位”。如果它们都被好细菌占据,那么坏细菌就没有机会展开。
帮助菌群恢复平衡的方法之一是使用益生菌补充剂。可以使用广谱益生菌配方作为通用方法。当然更好的方法是通过检测来发现是否失衡,然后补充那些需要的特定菌群。使这些正常存在的细菌达到平衡将有助于防止更多病原生物的过度生长。
对人和动物施用短双歧杆菌可降低粪便中梭菌和肠杆菌属、氨和释放毒素的细菌酶(包括 β-葡萄糖醛酸酶和色氨酸酶)的浓度。
侧孢芽孢杆菌是一种被归类为对人类无致病性的新型生物,它产生具有抗生素、抗肿瘤和免疫调节活性的独特代谢物。已发现它是一种有效的辅助治疗,可用于控制许多患者与小肠生态失调相关的症状。
扩展阅读:>益生菌的简单入门指南
益生元
益生元可以促进有益菌群生长。益生元主要存在于可溶性和不溶性纤维含量高的蔬菜和水果中。含有这些益生元成分的食物似乎对肠道菌群特别友好。
比较常见的有“低聚果糖”和“菊粉”等,在洋葱和芦笋等蔬菜中发现的低聚果糖已被开发为一种食品补充剂,可提高粪便中双歧杆菌含量并降低粪便 pH 值。
含益生元成分的食物有:
朝鲜蓟、芦笋、香蕉、蓝莓、菊苣、蒜、韭菜、洋葱、黑麦等。
多吃发酵食品
发酵食品是已经含有有益菌菌株的活培养物的食品。这听起来可能很奇特,但你可能对以下例子非常熟悉:
开菲尔、泡菜、康普茶、酸奶、酸菜(未经高温消毒的生酸菜)
编辑
已知活细菌产生的乳酸会延迟胃排空,从而有助于调节血糖。它也是一种强大的杀菌剂,可杀死酵母菌和其他细菌,如大肠杆菌和弯曲杆菌,这些细菌会导致严重的疾病,并且是造成生态失调的关键。
发酵食品中存在的活菌也有助于结肠定植。乳酸菌尤其聚集在回盲瓣周围,这是小肠与结肠相连的地方。由于其乳酸防御机制,它们是结肠中的顶端细菌。在没有生态失调的结肠中,它们可以防止酵母菌在小肠中定殖。
选择发酵食品时需要注意以下几点:
最好没有经过巴氏消毒
检查以确保购买的商品没有经过巴氏消毒。大型超市里的所有酸菜都经过巴氏消毒。如果实在买不到也不要太担心,发酵食品的第一大好处是具有杀死致病性酵母菌和细菌的能力。巴氏杀菌不会影响这些特性。
是发酵而不是腌制
确保选择的食物实际上已经发酵而不是腌制。如果食物被腌制而不是发酵,那么它将失去其所有益生元和益生菌的益处。
最好是无糖或低糖酸奶
酸奶可能有问题,因为厂家有时会在其中添加糖。最好能找到每 100 克总糖含量只有约为 5~6 克的天然酸奶。有些酸奶中的糖分可能是这个数量的两倍。
多吃蔬菜、水果
◤ 蔬菜
蔬菜是维生素、矿物质、植物营养素和最重要的可溶性纤维的绝对强者。每顿饭最好都吃点蔬菜。蔬菜是菌群失调饮食中极其重要的食物,对治愈菌群失调极为重要。
由于部分蔬菜含有淀粉,因此最好将大部分含淀粉的蔬菜保持在最低限度,每周只吃一两次。淀粉类蔬菜包括:土豆、山药、玉米等。如果患有反流,那么这些蔬菜要避免。然而,它们中的大多数都富含可溶性纤维,因此不应完全避免。所以在菌群失调的饮食中每周至少吃一次,仍然有助于扭转菌群失调的斗争。
非淀粉类蔬菜可以适量多吃。它们热量低,但可溶性纤维含量高。非淀粉类蔬菜包括:
朝鲜蓟、西葫芦、西兰花、茄子、羽衣甘蓝、菠菜、卷心菜、生菜、黄瓜等。
编辑
◤ 水果
水果普遍含糖,以果糖、蔗糖或葡萄糖的形式存在。
过量摄入含糖量高的水果会加剧胃酸倒流,如果小肠真菌过度生长,白色念珠菌很容易消耗糖分。
为什么不限制饮食以低糖水果?
无论其含糖量如何,水果都应该成为均衡健康饮食计划的一部分。好处包括:
· 减肥或保持健康体重
· 获取必需的维生素、矿物质和纤维
· 降低患癌症和其他疾病的风险
对于胃酸倒流的患者,建议是至少在恢复菌群饮食的前 8 周坚持吃浆果(含糖量低但纤维含量高)和甜瓜(碱性和低糖)。这将确保口腔、喉咙和食道的发炎组织有时间愈合。下食道括约肌收紧,防止酸溢出到食道。
如果此后可以耐受,可以逐渐将含糖量较高的水果重新引入生态失调饮食。
水果中的糖分与可溶性纤维结合
在消化过程中,消化酶淀粉酶对糖的分解受到抑制,因为可溶性纤维是粘性的,并在糖周围提供保护涂层。这允许糖进一步向下移动到小肠,直到纤维最终在蠕动(消化系统的肌肉收缩)期间从糖中剥离。这允许发生自然代谢并确保血糖水平保持相对恒定。
水果是对抗菌群失调不可或缺的一部分,富含纤维、维生素、矿物质和植物营养素。与蔬菜不同,由于其含糖量,每天不要食用过多水果。
扩展阅读:常见水果对肠道菌群、肠道蠕动和便秘的影响
保持水分
◤ 拒绝含咖啡因的饮料
在生态失调饮食中需要避免含咖啡因的饮料,因为它们会导致胃酸倒流和肠易激综合征(IBS)。将糖和咖啡因从饮食中剔除,同时遵循菌群失调饮食,防止胃酸倒流。
咖啡因是一种兴奋剂,会导致身体进入战斗状态。压力激素皮质醇充斥身体,导致胃的质子泵产生更多的酸。这显然会导致反流,但也会导致胃炎和胃或十二指肠溃疡。
压力反应还会导致血液从结肠流出,从而导致 IBS。
◤避免碳酸饮料
由于含糖量高,碳酸汽水/苏打水也不在推荐之列。即便是现在很流行的低糖饮料,它们可能含有各种不同的甜味剂。甜味剂已被证明可以杀死结肠中的有益细菌。
◤ 多喝水(也包括水果蔬菜)
保持水分的最好方法是喝白开水,而且要多喝。当然,摄入足够的水果和蔬菜也是在帮助补充水分。
水果和蔬菜富含水分,食物中的液体在结肠中代谢。这就是缓慢蠕动会导致便秘的原因,因为在结肠中提取了过多的液体。快速蠕动会导致腹泻,结肠中提取的水太少。
扩展阅读: “便便”的形成
◤ 尽量不喝酒(红酒是例外)
此外,大量喝酒是导致菌群失调的主要原因,然而在现代社会中常常会有这种情况。这其中,红酒例外。
编辑
红酒富含抗氧化剂,但特别是白藜芦醇和槲皮素这两种,已被证明有利于稳定血糖、扩张血管、减少血栓、具有抗炎特性、对抗血液中的自由基、具有抗癌特性,并且可以帮助防止认知能力下降并防止大脑中的斑块形成。
它也是一种松弛剂,因此可能有助于缓解上面详述的压力反应。提醒一下,一些红葡萄酒已被证明会导致偏头痛,因为它们的单宁和亚硫酸盐含量很高。
其他方法
饮食和生活方式的改变可以在没有人造化学物质和副作用的情况下发挥作用。但如果情况较严重,可能需要其他治疗。
以下是一些医生可能会为开出的治疗肠道菌群失调的抗生素药物:
利福昔明、新霉素、甲硝唑或替硝唑、大扶康、制霉菌素等。
确实,这些抗生素可以治疗菌群失调的症状,同时可能会在此过程中杀死有益细菌。但在极端情况下,必须取得平衡。
粪便微生物群移植是另一种治疗肠道菌群失调的可能方法。研究表明粪菌移植可以防止消化道菌群失调。
粪菌移植目前是一种实验性治疗方法,还是有争议。然而,随着在人体临床试验中看到积极的结果,这种治疗似乎可能在逐渐变得更加普遍。
TIPs
以上所有改善或治疗的方法,都是建立在菌群的变化上的,因此,肠道菌群处于什么状态,是否失衡,哪些菌有明显缺失/过量等等这些问题的确定是至关重要的。目前肠道菌群健康检测可以很好地帮助了解菌群的状况,对自身菌群有所了解后才能针对性采取相应措施,从而帮助菌群恢复正常。
扩展阅读:
做肠镜——“清肠”对肠道菌群的影响及后续恢复建议
真实案例 | 儿童发育迟缓肠道菌群检测的应用
真实案例 | 克罗恩病患者肠道菌群检测
06 结 语
健康问题很少单独发生,身体是一个高度复杂、相互关联的系统。与其猜测可能出了什么问题,不如根据它提供的许多线索来发现身体内部的真实情况。
如果在菌群失调的时候及时发现并加以改善,那么许多其他健康问题(包括一些慢病)也会随之得到改善。
主要参考资料:
Thomas M. Ball, M.D., M.P.H, et al. Siblings, Day-Care Attendance, and the Risk of Asthma and Wheezing during Childhood, New England Journal of Medicine, 2000 Aug;343:538–543.
8Borody TJ, Warren EF, Leis S, Surace R, Ashman O.; Treatment of ulcerative colitis using fecal bacteriotherapy; Journal of Clinical Gastroenterology. 2003 Jul;37(1):42–7. PMID: 12811208.
R.F. Schmidt, G. Thews, CHAPTER 4. DYSBACTERIOSIS, Human Physiology, 2nd edition. gutsense.
Crowley, J., Ball, L., & Hiddink, G. J. (2019). Nutrition in medical education: a systematic review. The Lancet Planetary Health, 3(9), e379-e389.
Chong, P. P., Chin, V. K., Looi, C. Y., Wong, W. F., Madhavan, P., & Yong, V. C. (2019). The Microbiome and Irritable Bowel Syndrome–A Review on the Pathophysiology, Current Research and Future Therapy. Frontiers in microbiology, 10, 1136.
Magge, S., & Lembo, A. (2012). Low-FODMAP diet for treatment of irritable bowel syndrome. Gastroenterology & hepatology, 8(11), 739.
Altobelli, E., Del Negro, V., Angeletti, P. M., & Latella, G. (2017). Low-FODMAP diet improves irritable bowel syndrome symptoms: a meta-analysis. Nutrients, 9(9), 940.
Wosinska, L., Cotter, P. D., O’Sullivan, O., & Guinane, C. (2019). The Potential Impact of Probiotics on the Gut Microbiome of Athletes. Nutrients, 11(10), 2270.
Sharma, V., Rodionov, D. A., Leyn, S. A., Tran, D., Iablokov, S. N., Ding, H., … & Peterson, S. N. (2019). B vitamin sharing promotes stability of gut microbial communities. Frontiers in microbiology, 10, 1485.
Chaplin, A., Parra, P., Laraichi, S., Serra, F., & Palou, A. (2016). Calcium supplementation modulates gut microbiota in a prebiotic manner in dietary obese mice. Molecular nutrition & food research, 60(2), 468-480.
Crowley, E. K., Long-Smith, C. M., Murphy, A., Patterson, E., Murphy, K., O’Gorman, D. M., … & Nolan, Y. M. (2018). Dietary supplementation with a magnesium-rich marine mineral blend enhances the diversity of gastrointestinal microbiota. Marine drugs, 16(6), 216.
Kumar Singh, A., Cabral, C., Kumar, R., Ganguly, R., Kumar Rana, H., Gupta, A., … & Pandey, A. K. (2019). Beneficial effects of dietary polyphenols on gut microbiota and strategies to improve delivery efficiency. Nutrients, 11(9), 2216.
Schmidt, E. K., Torres-Espin, A., Raposo, P. J., Madsen, K. L., Kigerl, K. A., Popovich, P. G., … & Fouad, K. (2020). Fecal transplant prevents gut dysbiosis and anxiety-like behaviour after spinal cord injury in rats. Plos one, 15(1), e0226128.
Kelly, C. R., Ihunnah, C., Fischer, M., Khoruts, A., Surawicz, C., Afzali, A., … & Gordon, S. (2014). Fecal microbiota transplant for treatment of Clostridium difficile infection in immunocompromised patients. The American journal of gastroenterology, 109(7), 1065.
Wilkins, L. J., Monga, M., & Miller, A. W. (2019). Defining Dysbiosis for a cluster of chronic diseases. Scientific reports, 9(1), 1-10.