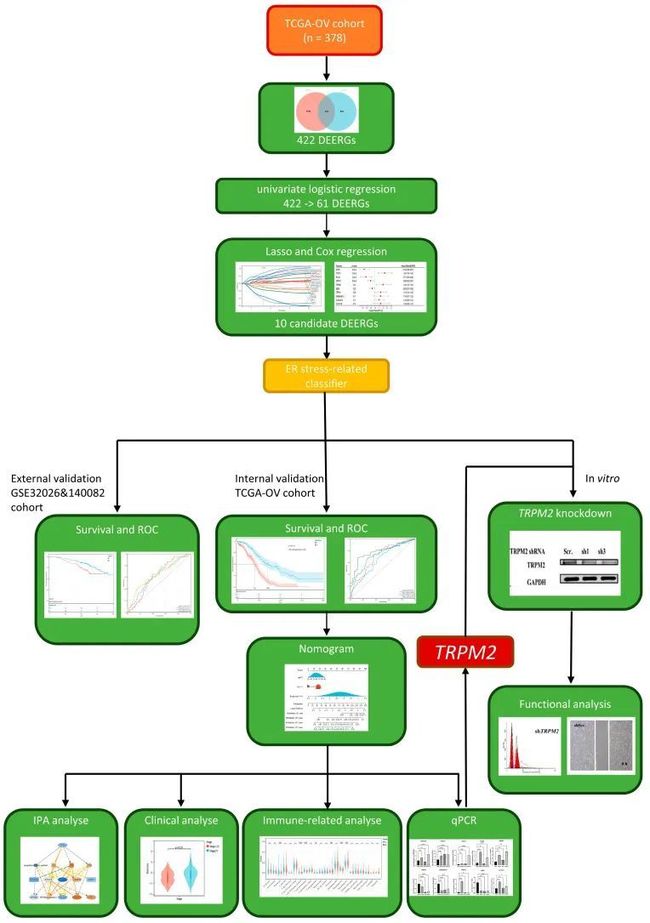
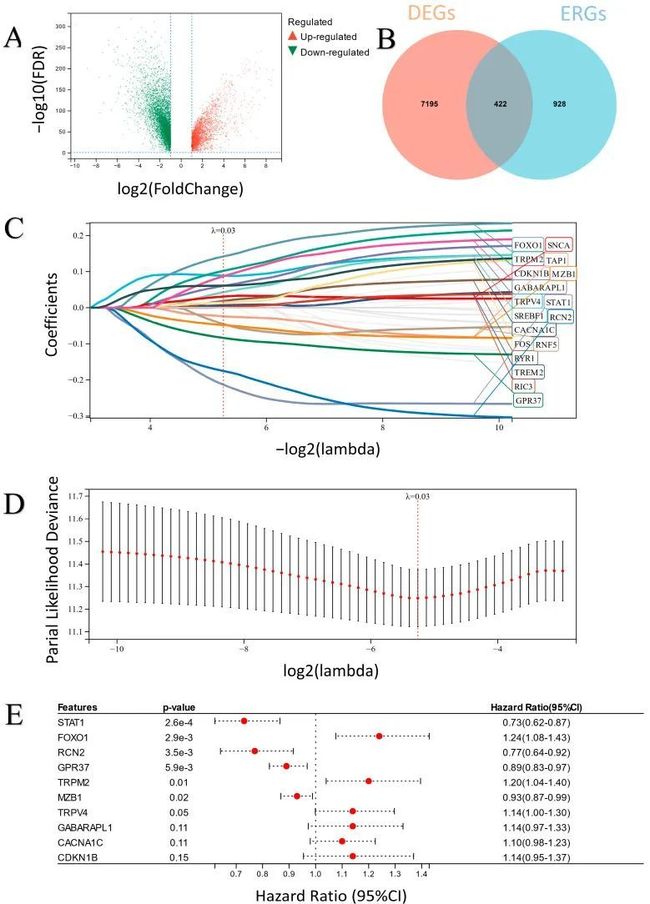
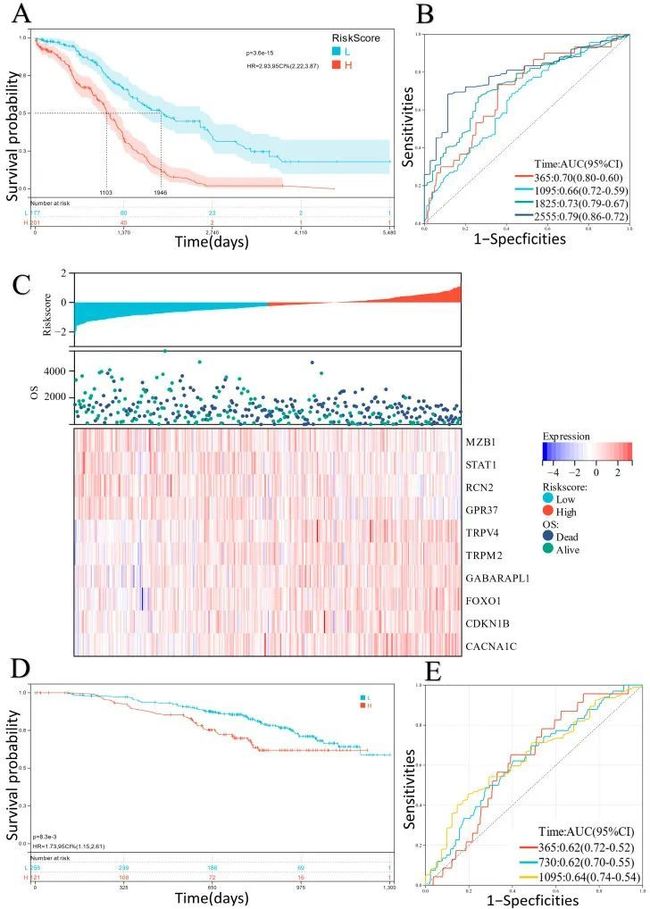
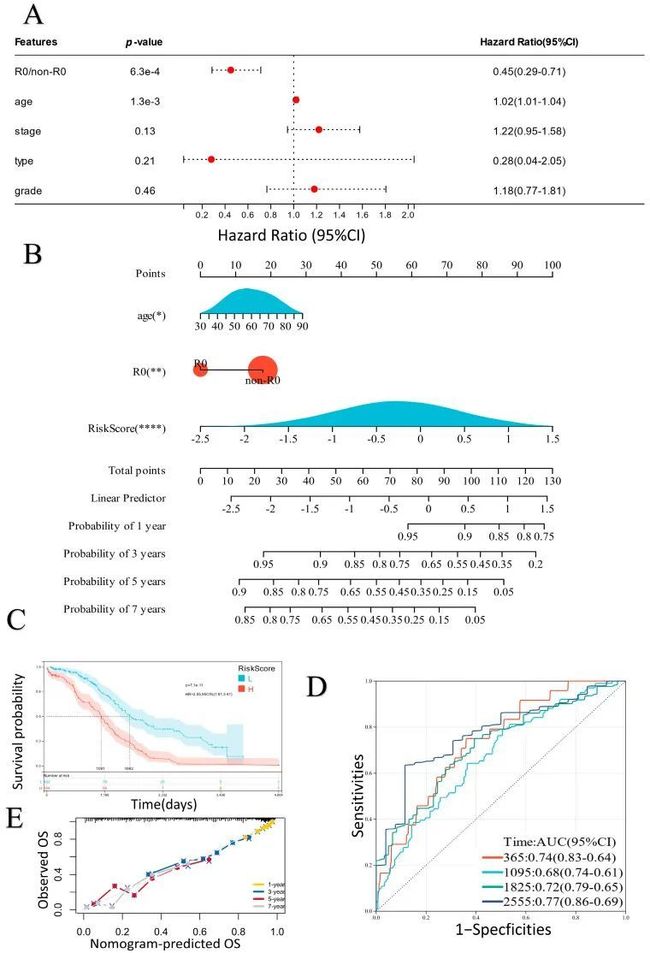
- Nexus zkVM 3.0 及未来:迈向模块化、分布式的零知识证明
mutourend
zkVMzkVM
1.引言2025年3月,Nexus团队发布了NexuszkVM3.0,本文将更详细地介绍其设计意图与功能。零知识虚拟机(zkVM)领域正在迅速演进,推动力来自于对可扩展、高效且可靠的系统的需求——这些系统应能够在不受计算规模、编程语言或底层架构限制的前提下,证明任意程序的正确执行。Nexus正是基于这一愿景推出了NexuszkVM3.0,它是一次经过深思熟虑的虚拟机重构,解决了长期存在的限制问题,
- 什么是零知识证明(Zero-Knowledge Proof, ZKP)
MonkeyKing.sun
零知识证明区块链
零知识证明(Zero-KnowledgeProof,ZKP)是一种密码学技术,它允许你向对方证明你“知道一个秘密”,但又不泄露这个秘密的任何信息。它的最大特点是:✅证明有效性,❌不暴露内容。一、零知识证明是什么?(通俗理解)想象你是爱丽丝(Alice),你知道一个藏宝图的密码,你想向鲍勃(Bob)证明你确实知道这个密码,但又不想告诉他密码是什么。零知识证明就像魔法一样地完成这件事:你证明你知道答案
- 什么是零知识证明?
前端
从第一篇你的隐私可能在网上“裸奔”?中,我们知道了中间人攻击无处不在,数据泄露太容易了,风险不可忽视。比如一些城际穿梭的大巴公众号,买票的时候都要填写乘车人信息(姓名、身份证和手机号),但很多时候如果该网站没有做好数据保护措施,是很容易泄露个人信息的。想想第一篇文章中介绍到的知识点,你大概就知道了。什么是零知识证明?指的是客户端向服务器证明,我知道这个数据是什么,但绝不透露数据本身。比如:当你想向
- 区块链与AI融合:智能合约的自动化与可验证性
威哥说编程
人工智能学习资料库区块链人工智能智能合约
随着区块链和人工智能(AI)技术的迅速发展,它们的结合带来了前所未有的创新机会,尤其是在智能合约的自动化和可验证性方面。智能合约是一种自执行的协议,通常在区块链平台上运行,并且能够在符合特定条件时自动执行。然而,传统的智能合约在执行和验证过程中仍存在一些挑战,比如执行的透明性、自动化和高效性等。近年来,结合RISC-V虚拟机(VM)和零知识证明(ZK)技术,尤其是在AI驱动的智能合约方面,展现了新
- PRUD币推动健康数据资产化,开启Web3隐私金融新时代
在全球健康科技与数据主权浪潮下,PRUD币(PrudentialUtility&DataToken)正成为Web3健康金融领域中的重要通证。项目通过链上身份绑定、健康行为证明、隐私计算与NFT机制,为用户打造了“健康数据资产化”的创新路径,为数据流转、权益分配与保险服务带来革命性升级。PRUD币生态构建在Solana高性能公链之上,采用去中心化身份识别协议(DID)与零知识证明技术(ZK-SNAR
- NFT模式:数字资产确权与链游经济系统构建
Lovely_xwys
区块链开发区块链智能合约去中心化web3
NFT模式:数字资产确权与链游经济系统构建——从技术架构到可持续生态的范式革命一、确权技术革新:构建可信数字资产基石1.区块链底层架构的进化跨链互操作协议:基于LayerZero协议实现以太坊、Solana等公链资产互通,通过零知识证明(zk-SNARKs)验证所有权,跨链确认时间压缩至5秒内。动态元数据扩展:ERC-4907标准分离NFT所有权与使用权,支持租赁场景(如虚拟土地出租收益分成),使
- 【Python高级编程】第五章:Web3与区块链开发
AI_DL_CODE
pythonweb3区块链python高级编程智能合约IPFS零知识证明
摘要:本文深入探讨Python在Web3与区块链开发领域的核心技术、应用场景及实践案例。详细剖析Web3.py与智能合约交互、IPFS分布式存储集成、零知识证明(ZK-SNARKs)等核心技术,结合NFT元数据自动化生成、DeFi协议自动化套利等应用场景,通过基于Brownie的ERC20代币发行工具链案例,展示完整实操流程与代码实现。提供可复现的Docker环境和GoogleColab链接,对比
- 区块链密码学核心
倒霉男孩
区块链知识区块链密码学
文章目录概要1.基础密码学哈希函数(HashFunction)对称加密与非对称加密数字签名(DigitalSignature)密钥管理2.区块链专用密码学技术零知识证明(Zero-KnowledgeProof,ZKP)同态加密(HomomorphicEncryption)环签名(RingSignature)与混币技术阈值签名(ThresholdSignature)3.共识机制中的密码学4.隐私与扩
- Public Key Cryptography文章分类总结( PKC 2022)
打工小熊猫
密码学文献分类总结分类网络大数据密码学网络攻击模型安全威胁分析
分类文章编号多方计算1-5理论6-7加密8-14密码分析15-20密码协议21-25工具26零知识证明27-31密钥交互32-33签名34-39MPC&SecretSharing1.ReusableTwo-RoundMPCfromLPNSanjamGarg,AkshayaramSrinivasan,JamesBartusek,YinuoZhang,问题与挑战文章解决的主要问题是如何在多方计算(MP
- 希腊证券交易所 ATHEX 基于 Sui 构建链上订单簿技术设计
Sui_Network
Sui合作伙伴游戏区块链web3人工智能大数据
继2024年3月6日首次宣布合作以来,希腊交易所集团(ATHEX)近日与MystenLabs宣布,已成功完成将ATHEX的电子订单簿平台(ElectronicBookBuilding,EBB)迁移至Sui的技术设计与业务需求分析。在去年建立的合作基础上,双方下一阶段将把创新性的零知识证明(Zero-KnowledgeProof,ZKP)机制集成至EBB的竞价流程中,确保参与者在提交保密出价的同时,
- 区块链技术在数据隐私保护中的应用:从去中心化到零知识证明
Echo_Wish
前沿技术人工智能区块链去中心化零知识证明
区块链技术在数据隐私保护中的应用:从去中心化到零知识证明在数字化时代,数据隐私已成为全球关注的焦点。无论是个人身份信息、医疗数据还是企业的敏感业务数据,都面临着泄露、篡改和滥用的风险。传统的安全方案依赖中心化服务器进行加密和访问控制,但这些方案存在单点故障和信任问题。而区块链技术凭借去中心化、不可篡改、智能合约等特性,为数据隐私保护提供了一种新的解决方案。本文将深入探讨区块链技术如何提升数据隐私保
- Grass.io项目现状:DePIN亮眼明星,扩张中的AI数据银行
黄汉
人工智能
Grass.io项目现状:DePIN亮眼明星,扩张中的AI数据银行Grass如何在DePIN项目丛林中脱颖而出?答案在于其"零门槛"策略——用户是基石,其他一切皆为杠杆。Grass通过"技术+模式"双轮驱动打破行业内卷:零知识证明技术与SolanaLayer2架构确保数据真实性,直击AI行业"脏数据"痛点;同时创新性地采用"带宽挖矿→积分激励"模式,将250万普通用户转化为高效数据节点,构筑了难以
- 指纹浏览器与Web3的深度耦合:构建去中心化时代的隐私堡垒与交互范式革新——基于零知识证明与分布式节点网络的工程实践(2025技术前瞻)
大富大贵7
程序员知识储备1程序员知识储备2程序员知识储备3web3去中心化零知识证明
指纹浏览器与Web3的深度耦合:构建去中心化时代的隐私堡垒与交互范式革新——基于零知识证明与分布式节点网络的工程实践摘要随着区块链技术和Web3的崛起,去中心化已成为互联网发展的关键趋势。指纹浏览器(FingerprintBrowser)作为一种新的隐私保护技术,与Web3结合展现出独特的优势。本文深入探讨了指纹浏览器在Web3生态中的应用,分析其如何通过零知识证明和分布式节点网络来实现隐私保护和
- Web3.0与数据隐私计算的融合革命:重构数字社会信任基石
知识产权13937636601
计算机web3.0
Web3.0与隐私计算的交汇正在引发数据生产要素的范式革命。本文深入解析去中心化数字身份、零知识证明与联邦学习的技术融合路径,通过政务数据开放、医疗影像共享、金融反洗钱三大场景实践,揭示如何构建“数据可用不可见”的新型基础设施。研究提出跨链隐私计算中间件架构,在保障GDPR、CCPA等合规要求的同时,实现数据要素流转效率提升300%,为构建可信数据社会提供关键技术支撑。一、Web3.0时代的数据主
- 2024 信息安全专业毕业设计(论文)选题题目推荐合集 选题指导
面试题开源
2024年程序员学习课程设计
基于机器学习的网络入侵检测与防御系统基于对抗性机器学习的网络入侵检测系统支持零知识证明的交易数据隐私保护方案基于图神经网络的门级硬件木马检测系统基于隐私风险评估的脱敏算法自适应系统基于区块链的电商诚信问答关键技术研究基于文本的网络安全事件检测系统与探索基于区块链的医疗数据分类加密共享系统用于缝纫设备远程维护的系统及加密系统基于联邦学习的分布式虚假新闻检测系统基于人脸识别技术的实验室身份验证系统基于
- 熊出没之小素数域大集锦
mutourend
零知识证明零知识证明
1.引言近年来,密码学,特别是零知识证明(ZK证明)领域的进展,极大地推动了对小素数域(≤64位素数)的兴趣,因为它们在高效算术和实现方面具有良好的特性。著名的例子包括:广泛使用的Mersenne-31(M31):详情见:Polygon团队2023年6月论文《Reed-Solomoncodesoverthecirclegroup》。Goldilocks:详情见:NCCGroup团队2022年2月论
- 神奇的零知识证明是什么?
BlockOne11
区块链
1985年,零知识证明(ZKP)的原始概念出现在一篇同行评审的学术论文中,题为“交互式证明系统的知识复杂性”,标志着密码学的突破。研究人员ShafiGoldwasser、SilvioMicali和CharlesRackoff探索了是否有可能在不透露数据本身以外的任何信息的情况下证明数据有效。近40年后,ZKP已成为许多区块链的基本组成部分,通过增强隐私和安全性为用户提供支持。什么是零知识证明?(Z
- 第十五章 | Layer2、Rollup 与 ZK 技术实战解析
白马区块Crypto100
区块链智能合约soliditypythonweb3
第十五章|Layer2、Rollup与ZK技术实战解析——构建下一代高性能区块链应用,从Solidity到zkSync!✅本章导读Layer2和零知识证明(ZK)正成为区块链发展的核心方向。随着主网Gas居高不下、TPS无法满足需求,越来越多的项目和开发者开始部署在Layer2Rollup上(如zkSync、StarkNet、Arbitrum、Optimism)。本章将从开发者视角,讲清楚:Lay
- 区块链与去中心化技术
boring_student
区块链去中心化
区块链与去中心化技术核心进展区块链从加密货币(如比特币)扩展至智能合约和供应链管理。以太坊2.0引入分片技术提升交易吞吐量,而零知识证明(ZKP)增强了隐私保护15。企业级应用如IBM的FoodTrust平台通过区块链追踪农产品全生命周期,减少供应链欺诈1。应用场景数字身份:去中心化身份(DID)系统允许用户自主管理个人数据5。版权保护:NFT技术为数字艺术品提供唯一所有权证明9。跨境支付:Rip
- Proof Beyond Boundaries: Hong Kong zkNight——零知识证明技术的未来之夜
TechubNews
web3科技大数据
请于2025年2月19日加入我们,参加一场仅限邀请的专属晚宴,地点选在香港核心地段最时尚的奢华餐厅。在这里,创新与享乐交织融合,科技与艺术共同奏响颠覆想象的跨界盛宴。当科技邂逅优雅:跨界盛宴的独特魅力本次活动以“创新与享乐交融”为核心理念,巧妙融合硬核技术讨论与高端社交体验。ZEROBASE创始人将在开场致辞中分享对零知识证明如何重塑隐私与效率的见解,并激发跨领域的合作灵感。届时,嘉宾将共聚一堂,
- **zkEVM Node:为未来区块链搭建的高性能节点**
黎杉娜Torrent
zkEVMNode:为未来区块链搭建的高性能节点去发现同类优质开源项目:https://gitcode.com/在不断演进的区块链世界中,zkEVMNode作为一款由Go语言构建的核心组件,正引领着零知识证明技术与以太坊虚拟机(EVM)的融合革命,旨在优化PolygonzkEVM网络的运行效率和安全性。技术亮点:构建下一代区块链基础设施零知识证明(ZKP)与EVM的完美结合zkEVMNode的设计
- 麦萌《至尊红颜归来》技术架构拆解:从复仇算法到分布式攻防的终极博弈
短剧萌
架构重构
系统设计核心逻辑剧情主线可抽象为高鲁棒性安全系统的构建与攻防对抗:加密协议与身份隐匿:叶念君隐藏身份映射为零知识证明(ZKP)协议,通过环签名(RingSignature)技术实现“青木令主”权限的匿名验证。分布式任务调度:勇闯修罗九塔对应多层防御链(Defense-in-Depth)架构,每层塔可视为独立微服务,通过Kafka实现异步攻击流量编排。对抗性训练框架:修罗门诱捕圈套可建模为GAN(生
- 【分享】一个查看无线网络密钥的小方法(查看 WiFi密码,热点密码)| 区块链 面试题:区块链技术中,如何保证交易的匿名性和隐私性?| 公钥加密,数字签名,零知识证明
追光者♂
工具技巧解决办法百题千解计划(项目实战案例)网络wlan热点密码WiFi密码区块链面试WiFi
“你不是我,你不会懂。”作者主页:追光者♂个人简介:[1]计算机专业硕士研究生[2]2023年城市之星领跑者TOP1(哈尔滨)[3]2022年度博客之星人工智能领域TOP4[4]阿里云社区特邀专家博主[5]CSDN-人工智能领域优质创作者无限进步,一起追光!!!感谢大家点赞收藏⭐留言!!!目录一、基础回顾步骤1、win+R:cmd,进入Dos命令窗口
- 区块链的数学基础:核心原理与应用解析
一休哥助手
区块链
引言区块链技术作为分布式账本系统,成功地解决了传统中心化系统中的信任问题。其背后隐藏着复杂而精妙的数学原理,包括密码学、哈希函数、数字签名、椭圆曲线、零知识证明等。这些数学工具不仅为区块链提供了安全保障,也为智能合约和去中心化应用(DApps)的开发奠定了基础。本文将深入剖析区块链中的核心数学基础,帮助读者理解其工作原理与实际应用。一、区块链数学基础概述区块链的数学基础可以分为以下几个核心领域:密
- 零知识证明-公钥分发方案DH((六)
yunteng521
区块链零知识证明算法区块链密钥分发DH
前言椭圆曲线配对,是各种加密构造方法(包括确定性阀值签名、zk-SNARKs以及相似的零知识证明)的关键元素之一。椭圆曲线配对(也叫“双线性映射”)有了30年的应用历史,然而最近这些年才把它应用在密码学领域。配对带来了一种“加密乘法”的形式,这很大的拓展了椭圆曲线协议的应用范围。本文的目的是详细介绍椭圆曲线配对,并大致解释它的内部原理先了解DH协议Diffie-Hellman协议简称DH,是一种公
- 零知识证明:哈希函数-Poseidon2代码解析与benchmark
HIT夜枭
零知识证明零知识证明哈希算法区块链
1、哈希函数(HashFunction)与Poseidon在密码学中,哈希函数是一种将任意大小的数据映射到固定大小的输出的函数。哈希函数的输出称为哈希值或哈希码。哈希函数具有单向性和抗碰撞性。一些常见的哈希函数包括MD5、SHA-1、SHA-256和SHA-3。例如,假设您要验证一个文件的完整性。您可以使用哈希函数来计算该文件的哈希值。然后,您可以将该哈希值与文件的预期哈希值进行比较。如果两个哈希
- 零知识证明框架:gnark
孙绿如叶~
零知识证明(ZKP)密码学
一.zkSNARKs的一般构造流程首先将一个NP问题拍平(Flatten)构成电路(若干个乘法门/加法门构成),在电路的基础上构造约束,也就是R1CS,有了约束就可以把NP问题抽象成QAP问题。有了QAP问题的描述,就可以在QAP上构建zkSNARKs。二.gnarkgnark是consenSys开发的一个zkSARNK实现,采用Go语言,目前支持groth16,github地址:https://
- 实践指南:构建一个零知识证明 DApp [译]
扣3039046426
区块链
实践指南:构建一个零知识证明DApp[译]零知识证明DAppcircomsnarkjs本文将构建一个zk-dApp(零知识证明DApp),以证明用户是否属于某个特定组,而无需透露用户具体是谁。阅读本文前,最好先对以下内容有所了解:public-keycryptographycircom及snarkjs使用truffle使用ethers连接合约前言在过去的几个月中,我在以太坊eth上利用了零知识证明
- Zcash-草稿
歌白梨
Zcash,也叫大零币,从zerocoin发展而来,是使用零知识证明机制的区块链系统,通过完全匿名交易特性在区块链的生态中独树一帜。现在,Zcash市值是41.10亿。2016年10月28日,ZEC从比特币代码库0.11上分叉,所以他可以算比特币的一个克隆体,与比特币一样,Zcash(ZEC)的总量是2100万,采用PoW共识机制。与比特币不同的是,为了防止矿霸的产生,ZEC的加密不是通过SHA2
- 金融科技力
nightluo
基础学习金融科技
金融科技区块链二级目录三级目录区块链区块链安全:保密性、完整性、可用性最重要的点:保密性零知识证明:1、完整性(真的假不了)2、可靠性(假的真不了)3、零知识性(知道真的,但是不需要知道内容)共识算法安全:抗崩溃性与容错性确定性终结与概率终结FLP不可能性:在完全异步消息系统中如果单个节点发生故障,则不可能达成共识安全性与活性CAP定理:只能得到三个中的两个去中心化、可扩展性和安全三角“参数永远是
- TOMCAT在POST方法提交参数丢失问题
357029540
javatomcatjsp
摘自http://my.oschina.net/luckyi/blog/213209
昨天在解决一个BUG时发现一个奇怪的问题,一个AJAX提交数据在之前都是木有问题的,突然提交出错影响其他处理流程。
检查时发现页面处理数据较多,起初以为是提交顺序不正确修改后发现不是由此问题引起。于是删除掉一部分数据进行提交,较少数据能够提交成功。
恢复较多数据后跟踪提交FORM DATA ,发现数
- 在MyEclipse中增加JSP模板 删除-2008-08-18
ljy325
jspxmlMyEclipse
在D:\Program Files\MyEclipse 6.0\myeclipse\eclipse\plugins\com.genuitec.eclipse.wizards_6.0.1.zmyeclipse601200710\templates\jsp 目录下找到Jsp.vtl,复制一份,重命名为jsp2.vtl,然后把里面的内容修改为自己想要的格式,保存。
然后在 D:\Progr
- JavaScript常用验证脚本总结
eksliang
JavaScriptjavaScript表单验证
转载请出自出处:http://eksliang.iteye.com/blog/2098985
下面这些验证脚本,是我在这几年开发中的总结,今天把他放出来,也算是一种分享吧,现在在我的项目中也在用!包括日期验证、比较,非空验证、身份证验证、数值验证、Email验证、电话验证等等...!
&nb
- 微软BI(4)
18289753290
微软BI SSIS
1)
Q:查看ssis里面某个控件输出的结果:
A MessageBox.Show(Dts.Variables["v_lastTimestamp"].Value.ToString());
这是我们在包里面定义的变量
2):在关联目的端表的时候如果是一对多的关系,一定要选择唯一的那个键作为关联字段。
3)
Q:ssis里面如果将多个数据源的数据插入目的端一
- 定时对大数据量的表进行分表对数据备份
酷的飞上天空
大数据量
工作中遇到数据库中一个表的数据量比较大,属于日志表。正常情况下是不会有查询操作的,但如果不进行分表数据太多,执行一条简单sql语句要等好几分钟。。
分表工具:linux的shell + mysql自身提供的管理命令
原理:使用一个和原表数据结构一样的表,替换原表。
linux shell内容如下:
=======================开始
- 本质的描述与因材施教
永夜-极光
感想随笔
不管碰到什么事,我都下意识的想去探索本质,找寻一个最形象的描述方式。
我坚信,世界上对一件事物的描述和解释,肯定有一种最形象,最贴近本质,最容易让人理解
&
- 很迷茫。。。
随便小屋
随笔
小弟我今年研一,也是从事的咱们现在最流行的专业(计算机)。本科三流学校,为了能有个更好的跳板,进入了考研大军,非常有幸能进入研究生的行业(具体学校就不说了,怕把学校的名誉给损了)。
先说一下自身的条件,本科专业软件工程。主要学习就是软件开发,几乎和计算机没有什么区别。因为学校本身三流,也就是让老师带着学生学点东西,然后让学生毕业就行了。对专业性的东西了解的非常浅。就那学的语言来说
- 23种设计模式的意图和适用范围
aijuans
设计模式
Factory Method 意图 定义一个用于创建对象的接口,让子类决定实例化哪一个类。Factory Method 使一个类的实例化延迟到其子类。 适用性 当一个类不知道它所必须创建的对象的类的时候。 当一个类希望由它的子类来指定它所创建的对象的时候。 当类将创建对象的职责委托给多个帮助子类中的某一个,并且你希望将哪一个帮助子类是代理者这一信息局部化的时候。
Abstr
- Java中的synchronized和volatile
aoyouzi
javavolatilesynchronized
说到Java的线程同步问题肯定要说到两个关键字synchronized和volatile。说到这两个关键字,又要说道JVM的内存模型。JVM里内存分为main memory和working memory。 Main memory是所有线程共享的,working memory则是线程的工作内存,它保存有部分main memory变量的拷贝,对这些变量的更新直接发生在working memo
- js数组的操作和this关键字
百合不是茶
js数组操作this关键字
js数组的操作;
一:数组的创建:
1、数组的创建
var array = new Array(); //创建一个数组
var array = new Array([size]); //创建一个数组并指定长度,注意不是上限,是长度
var arrayObj = new Array([element0[, element1[, ...[, elementN]]]
- 别人的阿里面试感悟
bijian1013
面试分享工作感悟阿里面试
原文如下:http://greemranqq.iteye.com/blog/2007170
一直做企业系统,虽然也自己一直学习技术,但是感觉还是有所欠缺,准备花几个月的时间,把互联网的东西,以及一些基础更加的深入透析,结果这次比较意外,有点突然,下面分享一下感受吧!
&nb
- 淘宝的测试框架Itest
Bill_chen
springmaven框架单元测试JUnit
Itest测试框架是TaoBao测试部门开发的一套单元测试框架,以Junit4为核心,
集合DbUnit、Unitils等主流测试框架,应该算是比较好用的了。
近期项目中用了下,有关itest的具体使用如下:
1.在Maven中引入itest框架:
<dependency>
<groupId>com.taobao.test</groupId&g
- 【Java多线程二】多路条件解决生产者消费者问题
bit1129
java多线程
package com.tom;
import java.util.LinkedList;
import java.util.Queue;
import java.util.concurrent.ThreadLocalRandom;
import java.util.concurrent.locks.Condition;
import java.util.concurrent.loc
- 汉字转拼音pinyin4j
白糖_
pinyin4j
以前在项目中遇到汉字转拼音的情况,于是在网上找到了pinyin4j这个工具包,非常有用,别的不说了,直接下代码:
import java.util.HashSet;
import java.util.Set;
import net.sourceforge.pinyin4j.PinyinHelper;
import net.sourceforge.pinyin
- org.hibernate.TransactionException: JDBC begin failed解决方案
bozch
ssh数据库异常DBCP
org.hibernate.TransactionException: JDBC begin failed: at org.hibernate.transaction.JDBCTransaction.begin(JDBCTransaction.java:68) at org.hibernate.impl.SessionImp
- java-并查集(Disjoint-set)-将多个集合合并成没有交集的集合
bylijinnan
java
import java.util.ArrayList;
import java.util.Arrays;
import java.util.HashMap;
import java.util.HashSet;
import java.util.Iterator;
import java.util.List;
import java.util.Map;
import java.ut
- Java PrintWriter打印乱码
chenbowen00
java
一个小程序读写文件,发现PrintWriter输出后文件存在乱码,解决办法主要统一输入输出流编码格式。
读文件:
BufferedReader
从字符输入流中读取文本,缓冲各个字符,从而提供字符、数组和行的高效读取。
可以指定缓冲区的大小,或者可使用默认的大小。大多数情况下,默认值就足够大了。
通常,Reader 所作的每个读取请求都会导致对基础字符或字节流进行相应的读取请求。因
- [天气与气候]极端气候环境
comsci
环境
如果空间环境出现异变...外星文明并未出现,而只是用某种气象武器对地球的气候系统进行攻击,并挑唆地球国家间的战争,经过一段时间的准备...最大限度的削弱地球文明的整体力量,然后再进行入侵......
那么地球上的国家应该做什么样的防备工作呢?
&n
- oracle order by与union一起使用的用法
daizj
UNIONoracleorder by
当使用union操作时,排序语句必须放在最后面才正确,如下:
只能在union的最后一个子查询中使用order by,而这个order by是针对整个unioning后的结果集的。So:
如果unoin的几个子查询列名不同,如
Sql代码
select supplier_id, supplier_name
from suppliers
UNI
- zeus持久层读写分离单元测试
deng520159
单元测试
本文是zeus读写分离单元测试,距离分库分表,只有一步了.上代码:
1.ZeusMasterSlaveTest.java
package com.dengliang.zeus.webdemo.test;
import java.util.ArrayList;
import java.util.List;
import org.junit.Assert;
import org.j
- Yii 截取字符串(UTF-8) 使用组件
dcj3sjt126com
yii
1.将Helper.php放进protected\components文件夹下。
2.调用方法:
Helper::truncate_utf8_string($content,20,false); //不显示省略号 Helper::truncate_utf8_string($content,20); //显示省略号
&n
- 安装memcache及php扩展
dcj3sjt126com
PHP
安装memcache tar zxvf memcache-2.2.5.tgz cd memcache-2.2.5/ /usr/local/php/bin/phpize (?) ./configure --with-php-confi
- JsonObject 处理日期
feifeilinlin521
javajsonJsonOjbectJsonArrayJSONException
写这边文章的初衷就是遇到了json在转换日期格式出现了异常 net.sf.json.JSONException: java.lang.reflect.InvocationTargetException 原因是当你用Map接收数据库返回了java.sql.Date 日期的数据进行json转换出的问题话不多说 直接上代码
&n
- Ehcache(06)——监听器
234390216
监听器listenerehcache
监听器
Ehcache中监听器有两种,监听CacheManager的CacheManagerEventListener和监听Cache的CacheEventListener。在Ehcache中,Listener是通过对应的监听器工厂来生产和发生作用的。下面我们将来介绍一下这两种类型的监听器。
- activiti 自带设计器中chrome 34版本不能打开bug的解决
jackyrong
Activiti
在acitivti modeler中,如果是chrome 34,则不能打开该设计器,其他浏览器可以,
经证实为bug,参考
http://forums.activiti.org/content/activiti-modeler-doesnt-work-chrome-v34
修改为,找到
oryx.debug.js
在最头部增加
if (!Document.
- 微信收货地址共享接口-终极解决
laotu5i0
微信开发
最近要接入微信的收货地址共享接口,总是不成功,折腾了好几天,实在没办法网上搜到的帖子也是骂声一片。我把我碰到并解决问题的过程分享出来,希望能给微信的接口文档起到一个辅助作用,让后面进来的开发者能快速的接入,而不需要像我们一样苦逼的浪费好几天,甚至一周的青春。各种羞辱、谩骂的话就不说了,本人还算文明。
如果你能搜到本贴,说明你已经碰到了各种 ed
- 关于人才
netkiller.github.com
工作面试招聘netkiller人才
关于人才
每个月我都会接到许多猎头的电话,有些猎头比较专业,但绝大多数在我看来与猎头二字还是有很大差距的。 与猎头接触多了,自然也了解了他们的工作,包括操作手法,总体上国内的猎头行业还处在初级阶段。
总结就是“盲目推荐,以量取胜”。
目前现状
许多从事人力资源工作的人,根本不懂得怎么找人才。处在人才找不到企业,企业找不到人才的尴尬处境。
企业招聘,通常是需要用人的部门提出招聘条件,由人
- 搭建 CentOS 6 服务器 - 目录
rensanning
centos
(1) 安装CentOS
ISO(desktop/minimal)、Cloud(AWS/阿里云)、Virtualization(VMWare、VirtualBox)
详细内容
(2) Linux常用命令
cd、ls、rm、chmod......
详细内容
(3) 初始环境设置
用户管理、网络设置、安全设置......
详细内容
(4) 常驻服务Daemon
- 【求助】mongoDB无法更新主键
toknowme
mongodb
Query query = new Query(); query.addCriteria(new Criteria("_id").is(o.getId())); &n
- jquery 页面滚动到底部自动加载插件集合
xp9802
jquery
很多社交网站都使用无限滚动的翻页技术来提高用户体验,当你页面滑到列表底部时候无需点击就自动加载更多的内容。下面为你推荐 10 个 jQuery 的无限滚动的插件:
1. jQuery ScrollPagination
jQuery ScrollPagination plugin 是一个 jQuery 实现的支持无限滚动加载数据的插件。
2. jQuery Screw
S