易基因:ChIP-seq揭示组蛋白修饰H3K27me3调控高温下棉花的雄性不育机制|Plant Com
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
气候变化导致极端天气事件更加频繁地发生,包括反常的高温(high temperature,HT),HT胁迫对作物的生长发育和产量有严重的负面影响,如平均生长温度每升高1°C,水稻产量就会下降10%,这一下降主要是由于对生殖发育的影响。棉花(Gossypium spp.)是世界上最重要的经济作物之一,陆地棉(Gosspyium hirsutum)因其天然和可纺纤维而被广泛种植。在中国,高温通常发生在7月和8月,高峰温度可能在35°C以上或接近40°C,一次持续数周。而棉花通常在这一时期开花,这种高温胁迫对棉花花药发育产生不利影响,阻止花粉释放,从而降低结实率和纤维产量。为了确定解决这些产量损失的生物技术、遗传或化学解决方案,必须详细了解棉花雄性育性如何应对高温胁迫。尽管有一些证据表明组蛋白修饰会响应HT应激而发生变化,但对组蛋白修饰如何调控下游事件知之甚少,尤其是在雄性育性中。
2023年7月17日,华中农业大学博士后李焱龙为论文第一作者,作物遗传改良全国重点实验室和湖北洪山实验室张献龙教授和闵玲教授为论文共同通讯作者在《Plant Communications》杂志在线发表了题为“Histone H3 lysine 27 trimethylation suppresses jasmonate biosynthesis and signaling to affect male fertility under high temperature in cotton”的研究论文,该研究以棉花为对象,通过RNA-seq和ChIP-seq等实验揭示了HT影响H3K27me3水平,从而抑制茉莉酸(jasmonic acid,JA)生物合成基因表达,进而影响JA稳态,导致棉花雄性不育。
标题:Histone H3 lysine 27 trimethylation suppresses jasmonate biosynthesis and signaling to affect male fertility under high temperature in cotton(H3K27me3抑制茉莉酸生物合成和信号传导从而影响高温下棉花的雄性育性)
时间:2023-07-17
期刊:Plant Communications
影响因子:IF 10.5
技术平台:ChIP-seq、RNA-seq数据分析等
研究摘要:
高温胁迫导致作物雄性不育,从而降低产量。为研究组蛋白修饰在HT条件下对雄性育性的可能贡献,本研究通过染色质免疫沉淀测序(ChIP-seq)在两个不同品种的陆地棉(Gossypium hirsutum)中绘制了组蛋白H3赖氨酸27三甲基化(H3K27me3)和组蛋白H3-赖氨酸4三甲基化(H3K4me3)的组蛋白甲基化图谱。分析结果表明,在高温处理的棉花花药中,H3K4me3和H3K27me3修饰,特别是H3K27me3的整体破坏。高温处理对二价H3K4me3-H3K27me4修饰的影响大于对任一单价修饰的影响。研究鉴定出茉莉酸(JA)相关基因启动子区H3K27me3敲除增加了其表达水平,在花药开裂期的耐高温品种中,在高温下保持了雄性不育性。调节茉莉酸稳态或信号传导导致高温下花药不裂表型,化学抑制H3K27me3沉积增加了茉莉酸含量,并在高温下保持了雄性育性。总之,本研究为高温(HT)下组蛋白修饰对雄性育性调控提供了新的见解,并提出了提高棉花耐高温性的潜在策略。
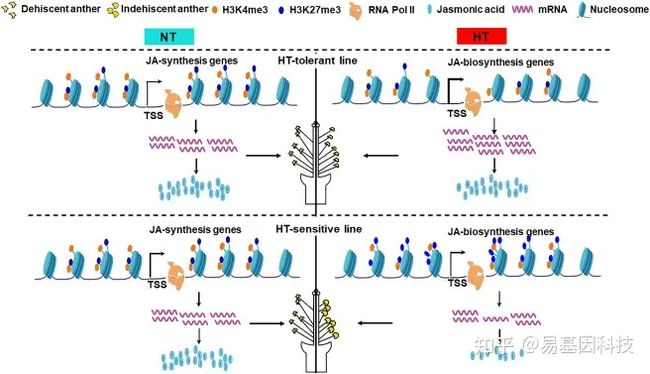
图形摘要:H3K27me3通过介导茉莉酸(jasmonate)稳态调控棉花雄性耐高温模型
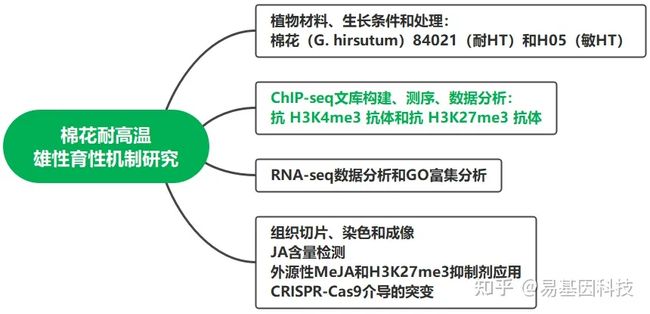
研究方法:
本研究中使用的棉花(G.hirsutum)品系84021(耐高温)和H05(敏高温),在温室中生长,光照周期为14小时/10小时。常温条件(NT)为白天29°C–35°C,夜间25°C–28°C。HT处理中,植物在温室中种植,白天温度为38°C–40°C,晚上温度为28°C–31°C。当棉花进入开花期时,一半植株做HT处理,另一半则保持在NT条件下。HT处理7天后,收集不同长度芽的花药(芽长从蜜腺到芽顶部测量),并将其分为绒毡层降解期(tapetum degradation stage,TDS,9-14mm芽)和花药开裂期(anther dehiscence stage,ADS,>24mm芽)。
总共收集16个样品:H05和84021在NT和HT条件下TDS和ADS的花药,每个样品类型有两个生物重复。每个样品立即在液氮中冷冻,并在−70°C下储存,直至使用。
为深入探究高温胁迫下组蛋白修饰变化与雄性育性之间的关系,研究者对“84021” (耐高温)和“H05 ”(敏高温)分别在正常条件和高温胁迫条件下,构建了绒毡层降解时期和花药开裂期两个对高温敏感的花药发育时期的H3K4me3和H3K27me3两种组蛋白修饰图谱。
研究结果
(1)高温下棉花花药H3K4me3和H3K27me3修饰的全基因组图谱
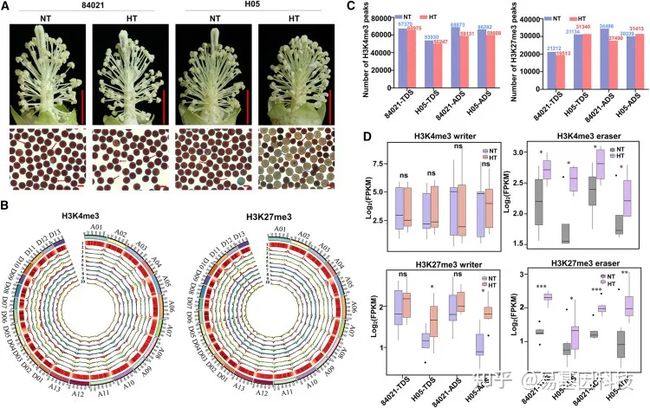
图1: HT胁迫下花药发育过程中的雄性育性表型和组蛋白甲基化模式。
(A) H05的HT依赖性花粉育性表型。84021和H05花药开裂期(ADS)的花药代表性图像(上图),以及通过0.8%(w/v)2,3,5-三苯基四氮唑(TTC)染色测定的花粉活力(下图)。红色箭头表示可育花粉,蓝色箭头表示不育花粉。比例尺,1cm(上),100μm(下)。
(B) Circos图总结了G. hirsutum基因组26条染色体(At亚基因组为A01–A13,Dt亚基因组为D01–D13)的H3K4me3和H3K27me3图谱。编号轨迹如下,1:转座元件密度;2:蛋白质编码(PC)基因数量;3 ~ 6:NT下84021绒毡层降解期(TDS)的H3K4me3或H3K27me3修饰水平(3)、HT处理下84021绒毡层降解期(TDS)的H3K4me3修饰水平(4)、NT处理下84021绒毡层降解期(ADS)的H3K4me3修饰水平(5)、HT处理下84021绒毡层降解期(ADS)的H3K27me3修饰水平;7–10 :NT处理下TDS(7)、H05处理下TDS(8)、H05处理下ADS(9)和H05处理下ADS(10)的H3K4me3和H3K27me3修饰水平变化。
(C) 所有样品中H3K4me3 peaks和H3K27me3 peaks的数量。
(D) 基于RNA-seq数据,84021和H05植株编码H3K4me3和H3K27me3 的writers基因和erasers基因在NT和HT条件下的TDS和ADS表达水平。NT常温;HT高温。统计显著性采用配对双尾Student’s t检验确定,***p< 0.001;**p< 0.01;*p< 0.05;ns,不显著。
(2)高温下H3K4me3和H3K27me3修饰变化调控基因表达
图2:HT条件下H3K4me3和H3K27me3的变化及其表达调控。
(A) 与NT样品相比,不同样本在HT条件下获得(右)或丢失(左)H3K4me3或H3K27me3标记的启动子数量。
(B) NT和HT条件下84021和H05启动子区H3K4me3和H3K27me3标签密度归一化meta图。
(C) 84021中NT条件下ADS期蛋白质编码基因的基因体上的归一化H3K4me3信号(右)和H3K27me3信号(中)的Meta图,横跨TSS上游-2kb至下游+4kb。根据基因的表达水平对基因进行排序。计数的正则对数(rlog),右侧红线。
(D) H05中NT下ADS期H3K4me3修饰状态或H3K27me3修饰状态。P值通过Kolmogorov–Smirnov检验计算。*** p< 0.001;**p<0.01;*p<0.05;ns, P>0.05。
(E和G)Venn图显示了84021 在HT和NT条件下ADS期的差异表达基因(DEGs)和其启动子H3K4me3水平变化的基因(E)或DEGs以及其启动子H3K27me3水平变化(G)的基因之间的重叠程度。共有元件的显著性水平通过超几何检验确定:***P<0.01;*P<0.05;ns,P>0.05。
(F) 所有样品的启动子H3K4me3水平在相同方向或相反方向上发生变化的DEG比例。
(H) ADS样品的启动子中H3K27me3水平在相同方向或相反方向上发生变化的DEG比例。统计显著性通过配对双尾Student‘s t检验确定(F和H):**P<0.01;*P<0.05;ns,P>0.05。TSS,转录起始位点;TDS,绒毡层降解时期;ADS,花药开裂期。
(3) 二价H3K4me3–H3K27me3标记在HT下表现出更显著的变化
图3:HT条件下,二价H3K4me3–H3K27me3标记的变化更为明显。
(A和B)HT条件下,启动子区域H3K4me3(A)或H3K27me3(B)水平显著变化的基因富集的生物学过程。颜色键表示GO富集分析中上调(右)和下调(左)DEG的显著性(log10(P值))。
(C) Venn图显示了在NT条件下H05的ADS期H3K4me3修饰的启动子和H3K27me3修饰的启动子基因之间的重叠程度。
(D) NT下的H05 ADS期启动子仅携带H3K4me3、仅携带H3K27me3或同时携带两种标记的基因归一化表达水平。
(E和F)NT条件下H05 ADS期,具有二价H3K4me3–H3K27me3标记或仅H3K4me3标记的启动子(E)归一化标记meta图,具有二价H3K4me3-H3K27me4标记或仅有H3K27me3标记的启动子归一化标记Meta图(F)。
(G) 在H05的ADS期,具有二价H3K4me3–H3K27me3标记或单H3K4me3标记启动子中在HT和NT之间的H3K4me3信号强度比值。
(H) 在H05的ADS期,具有二价H3K4me3–H3K27me3标记或单H3K27me3标记启动子中在HT和NT之间的H3K27me3信号强度比值。
(I) NT条件下具有二价标记的启动子数量及其在HT条件下所有样品中的显著变化。上图,在HT下丢失二价标记的启动子数量;下图,在HT下获得二价标记的启动子数量。
(J) 启动子在二价标记上显著变化的基因富集生物学过程。颜色键指示与二价标记的丢失(右)或获得(左)相关的富集GO分析的显著性(log10(P值))。使用(D)中的Kolmogorov–Smirnov检验和(E)–(H)中的配对Student’s t检验确定统计显著性:***P<0.001;**P<0.01;*P<0.05;ns,不显著。
(4)敲除H3K27me3可增加高温下茉莉酸(JA)含量并保持雄性育性
图4:HT条件下,H3K27me3通过调控JA相关基因来调节JA稳态。
(A–D)NT和HT条件下,84021和H05中ADS期所有JA生物合成基因(A和B)和所有JA信号传导基因(C和D)在启动子区域的表达水平(B和D)和H3K27me3(A和C)修饰水平热图。
(E) NT和HT条件下,H05和84021在TDS期和ADS期的JA含量。从大田中采集样本。数值为六个生物学重复的平均值±SE。星号表示基于Student’s t检验的显著差异(**P<0.01)。
(F) 每种处理的代表性花药表型。H05+ddH2O→HT和H05+MeJA→ HT表示分别用蒸馏去离子水或MeJA处理H05花蕾四次(持续HT暴露7d,在温度升高到应力点之前的7、5、3和0d)。然后将温度恢复正常1周,并拍照。比例尺,1cm。
(5)GhAOS和GhAOC2突变、GhJAZ1过表达通过抑制JA信号导致雄性不育
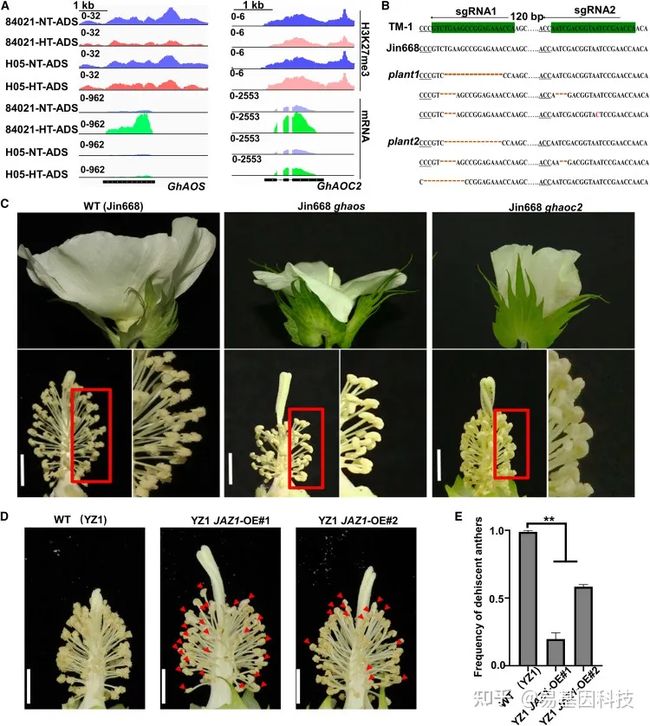
图5:JA相关基因功能异常导致雄性不育。
(A) GhAOS和GhAOC2位点的IGV图显示84021和H05中的H3K27me3信号及其在ADS中的表达水平。
(B) 对GhAOS进行基因组编辑,得到GhAOS plant1和plant2。sgRNA靶位点和原间隔区相邻基序(protospacer adjacent motif,PAM)区域分别以绿色和下划线突出显示。
(C) WT、Ghaos突变体和Ghooc2突变体的花的代表性图像。Ghaos和Ghaoc2花药不开裂。比例尺,5 mm。
(D) NT条件下,WT(YZ1)和GhJAZ1过表达系(JAZ1-OE#1和JAZ1-OE#2)的花的代表性图像。红色箭头表示花药不开裂。比例尺,5 mm。
(E) WT和GhJAZ1过表达系花药开裂频率。使用非配对Student’s t检验确定统计显著性:**P<0.01;*P<0.05;ns,不显著。
(6) 抑制H3K27me3沉积可挽救HT条件下的男性育性
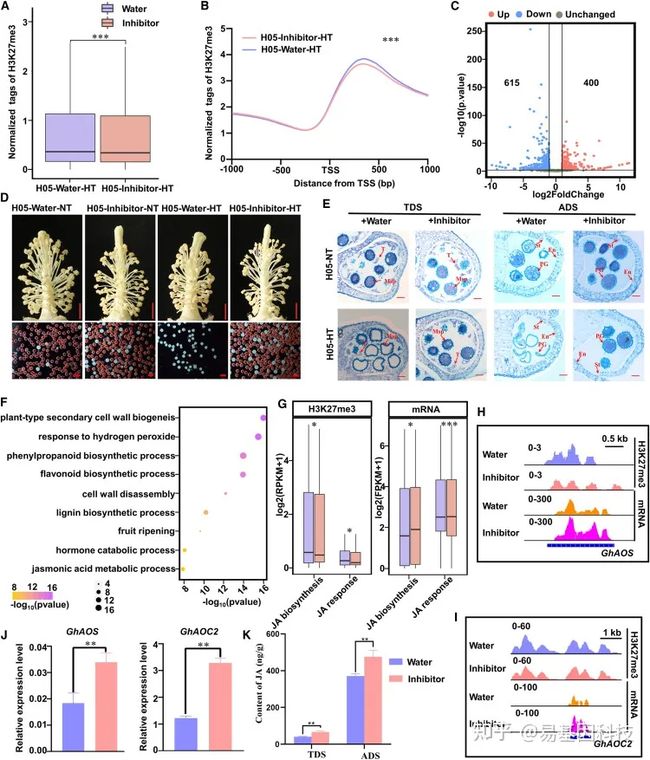
图6:在高温条件下抑制H3K27me3沉积挽救了棉花的雄性育性。
(A和B)在H05–H3K27me3抑制剂-HT处理和H05–water-HT处理中,ADS启动子区的H3K27me3修饰水平的归一化图(A)和meta图(B)。
(C) ADS期H05–H3K27me3抑制剂-HT处理和H05–water-HT处理之间的DEG火山图。红圈,H05–H3K27me3抑制剂-HT处理中上调基因;蓝色圆圈,在H05–H3K27me3抑制剂–HT处理中下调基因。
(D) 外源性H3K27me3抑制剂对H05花药处理挽救其不育缺陷。红色花粉粒可育,白色花粉粒不育。比例尺,5 mm(上),100μm(下)。
(E) H05-water-NT、H05-water-HT、H05-H3K27me3抑制剂-NT和H05-H3K27me3抑制剂-HT在TDS和ADS期的花药切片显示H3K27mp3抑制剂处理对花粉发育的挽救作用。比例尺:50μm。T:tapetum;MSP:microspore;PG:花粉粒pollen grain;En:endothecium内层。
(F) ADS期H05–H3K27me3抑制剂-HT处理和H05–water-HT处理的DEG中GO显著富集。
(G) ADS期的H05–H3K27me3抑制剂-HT处理下,与JA生物合成和JA反应相关的基因的H3K27me3修饰和mRNA表达水平变化。
(H和I)GhAOS(H)和GhAOC2(I)位点的IGV图显示H05–H3K27me3抑制剂-HT处理和H05–water-HT处理中ADS的的H3K27me3信号和mRNA水平。
(J) RT–qPCR检测ADS期H05–H3K27me3抑制剂-HT处理和H05–water-HT处理中,GhAOS和GhAOC2的相对表达水平。使用GhUBQ7(Ghir_A11G011460)作为内部参考。数值为平均值±SE(n=4)。
(K) H05–H3K27me3抑制剂-HT处理和H05–water-HT处理中的JA含量。样品是在温室里采集的。数值为六个生物学重复的平均值±SE。使用Wilcoxon秩和检验(A和G)和配对Student’s t检验(B、J和K)确定统计显著性。***P<0.001;**P<0.01;*P<0.05;ns,P>0.05。
关于易基因染色质免疫共沉淀测序 (ChIP-seq)
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
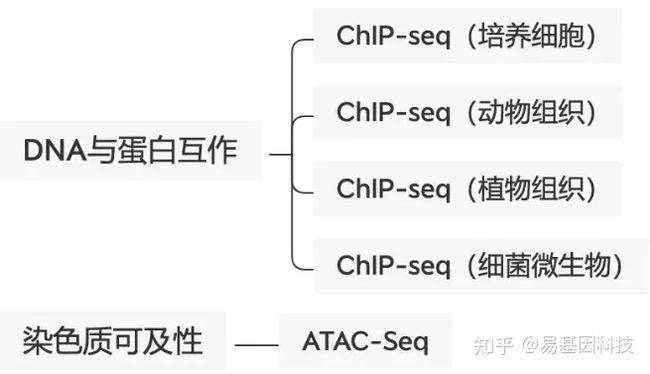
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
- 转录因子和辅因子结合作用
- 复制因子和 DNA 修复蛋白
- 组蛋白修饰和变异组蛋白
技术优势:
- 物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
- 微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
- 方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
技术路线:
易基因提供全面的DNA与蛋白互作测序方案,详询易基因:0755-28317900.
参考文献:
Li et al., Histone H3 lysine 27 trimethylation suppresses jasmonate biosynthesis and signaling to affect male fertility under high temperature in cotton, Plant Communications (2023), https://doi.org/10.1016/j.xplc.2023.100660
相关阅读:
项目集锦 | 易基因近期染色质免疫共沉淀测序(ChIP-seq)研究成果
干货系列:高通量测序后的下游实验验证方法——ChIP-seq篇
干货系列:染色质免疫共沉淀测序(ChIP-seq)的数据挖掘思路
ChIP-seq分析方法:实用的工作流程和高级应用