- 法律科技领域人工智能代理构建的十个经验教训,一位人工智能工程师通过构建、部署和维护智能代理的经验教训来优化法律工作流程的历程。
知识大胖
NVIDIAGPU和大语言模型开发教程人工智能ai
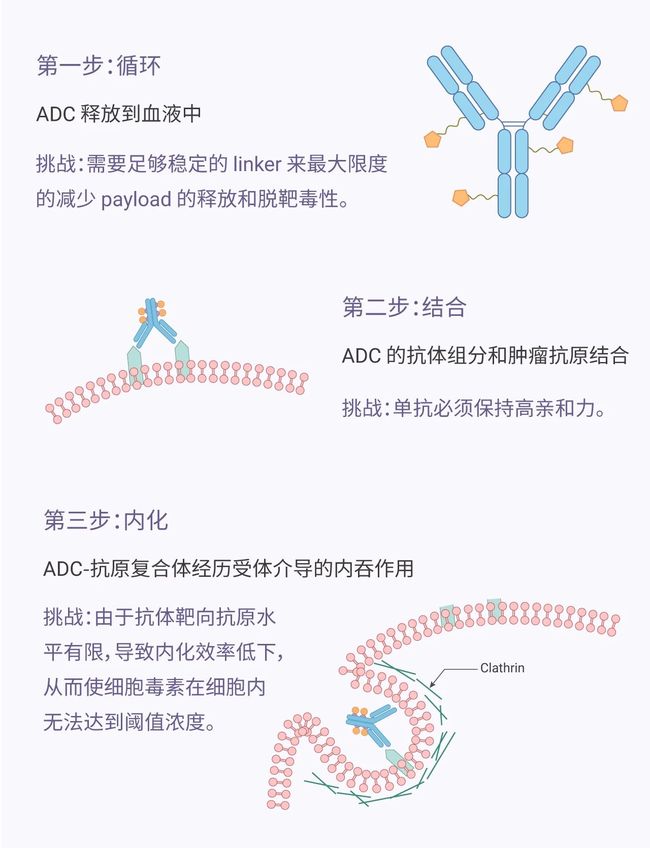
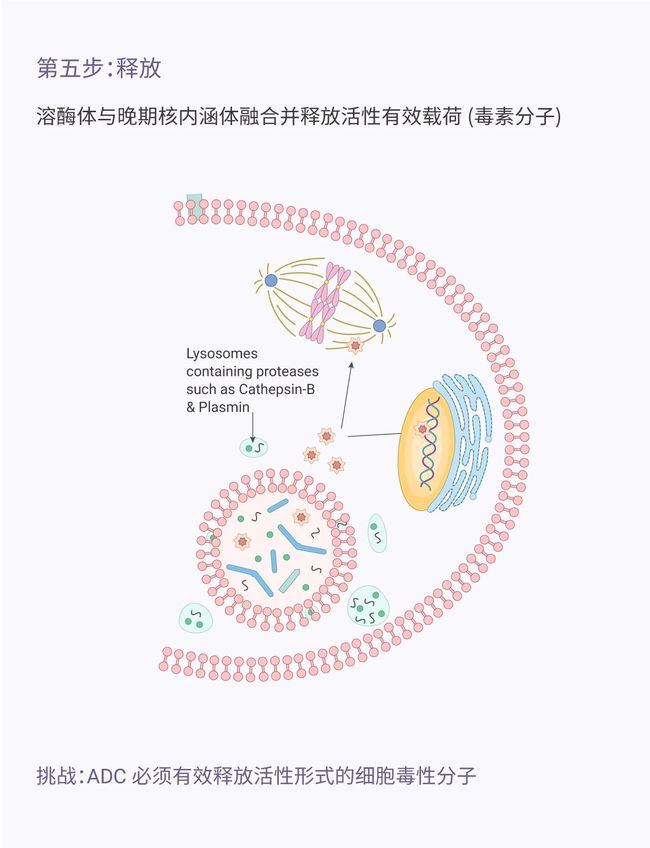
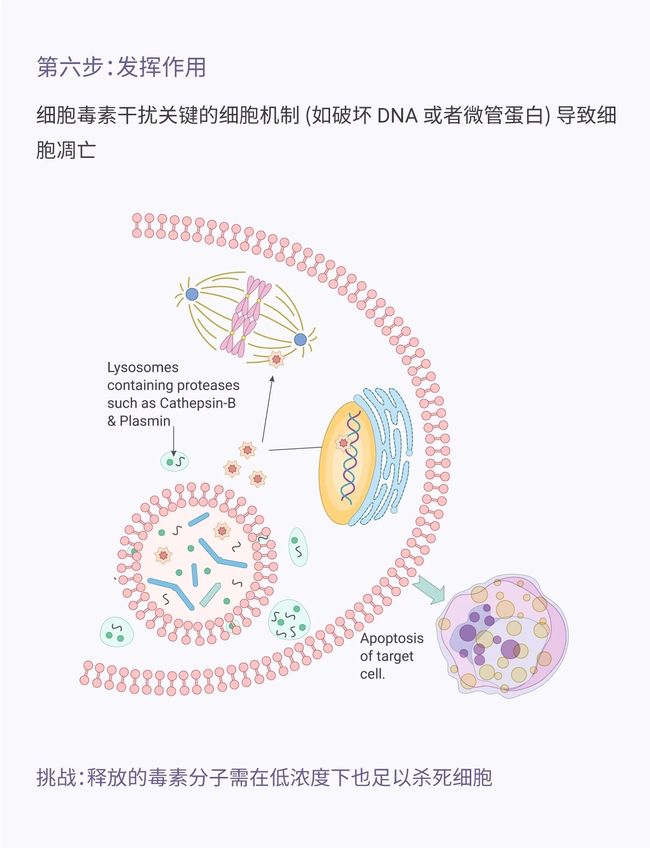
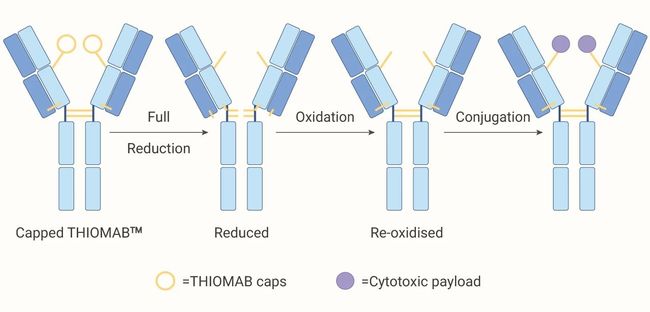
目录介绍什么是代理人?为什么它对法律如此重要?法律技术中代理用例示例-合同审查代理-法律研究代理在LegalTech中使用代理的十个教训-教训1:即使代理很酷,它们也不能解决所有问题-教训2:选择最适合您用例的框架-教训3:能够快速迭代不同的模型-教训4:从简单开始,必要时扩展-教训5:使用跟踪解决方案;您将需要它-教训6:确保跟踪成本,代理循环可能很昂贵-教训7:将控制权交给最终用户(人在环路中
- 微算法科技的前沿探索:量子机器学习算法在视觉任务中的革新应用
MicroTech2025
量子计算算法
在信息技术飞速发展的今天,计算机视觉作为人工智能领域的重要分支,正逐步渗透到我们生活的方方面面。从自动驾驶到人脸识别,从医疗影像分析到安防监控,计算机视觉技术展现了巨大的应用潜力。然而,随着视觉任务复杂度的不断提升,传统机器学习算法在处理大规模、高维度数据时遇到了计算瓶颈。在此背景下,量子计算作为一种颠覆性的计算模式,以其独特的并行处理能力和指数级增长的计算空间,为解决这一难题提供了新的思路。微算
- 数字经济时代科技创业的巨大潜力
2025年3月,42岁的字节跳动创始人张一鸣以655亿美元身家成为中国新首富。这位"80后"企业家白手起家的故事,展现了数字经济时代科技创业的巨大潜力。本文将带您了解张一鸣的成功秘诀,分析网络安全行业的最新趋势,并为计算机专业学生提供实用建议。张一鸣的成功之道张一鸣的财富增长主要得益于字节跳动的全球化布局和技术创新。2024年上半年,公司营收达730亿美元,其中海外收入占比23%。旗下TikTok
- MCP协议:AI时代的“万能插座”如何重构IT生态与未来
MCP协议:AI时代的“万能插座”如何重构IT生态与未来在人工智能技术爆炸式发展的浪潮中,一个名为ModelContextProtocol(MCP)的技术协议正以惊人的速度重塑IT行业的底层逻辑。2024年11月由Anthropic首次发布,MCP在短短半年内获得OpenAI、谷歌、亚马逊、阿里、腾讯等全球科技巨头的支持,被业内誉为AI时代的HTTP协议或USB-C接口,正在成为连接大模型与现实世
- 酒店新科技,飞睿智能毫米波雷达人体存在感应器,智能照明创新节能新风尚
飞睿科技
飞睿智能雷达人体存在感应器毫米波雷达人体传感器无线WiFi感应
在这个日新月异的时代,科技正以未有的速度改变着我们的生活。从智能手机到智能家居,每一个细微之处都渗透着科技的魅力。而今,这股科技浪潮已经席卷到了酒店行业,为传统的住宿体验带来了翻天覆地的变化。其中,引人注目的莫过于飞睿智能人体存在感应器的应用,它以其独特的毫米波雷达技术,实现了人来灯亮、人走灯灭的智能照明效果,不仅极大地提升了客户的住宿体验,更为酒店节能降耗开辟了一条全新的道路。你是否有过这样的经
- 影华科技与迷你世界官方签约,共筑线下IP潮玩店新蓝图
2025年6月27日,于影华总部(广州),广州影华科技有限公司(以下简称影华)与深圳格物工坊电子商务有限公司(迷你世界官方)(以下简称格物电子)签约仪式圆满举行,双方正式构建深度战略合作伙伴关系。广州影华科技有限公司是一家专注于VR、AR及5D动感技术应用设备研发、生产、销售及运营服务的高科技企业,致力于打造沉浸式体验项目并推动数字化技术在文旅及虚拟现实领域的应用。深圳格物工坊电子商务有限公司是深
- Maven 构建性能优化深度剖析:原理、策略与实践
越重天
JavaMaven实战maven性能优化java
博主简介:CSDN博客专家,历代文学网(PC端可以访问:https://literature.sinhy.com/#/?__c=1000,移动端可微信小程序搜索“历代文学”)总架构师,15年工作经验,精通Java编程,高并发设计,Springboot和微服务,熟悉Linux,ESXI虚拟化以及云原生Docker和K8s,热衷于探索科技的边界,并将理论知识转化为实际应用。保持对新技术的好奇心,乐于分
- 稀土化合物的分类
DeepCeLa
稀土科技稀土氧化物稀土化合物
稀土化合物是由稀土元素(如镧系元素及钇、铈等)与其他元素组成的化学物质,因其独特的光、电、磁性能,在多个高科技和民用领域中发挥重要作用。根据其组成和用途,稀土化合物主要分为以下几类:1.稀土氧化物:如氧化铈、氧化镧、氧化钕、氧化钇、氧化镨等,广泛应用于冶金、陶瓷、电子和催化领域。2.稀土氯化物:如氯化铈、氯化镧(、氯化钕、氯化钇等,通常呈白色或无色结晶,用于催化和光电材料。3.稀土硫化物:硫化铈、
- 佰力博科技与您探讨电晕极化和油浴极化有什么区别?
2401_83530248
科技制造材料工程
电晕极化和油浴极化是两种常见的极化方法,广泛应用于压电陶瓷、聚合物薄膜等材料的极化处理中。它们在原理、操作方式、适用材料和优缺点等方面存在显著差异。电晕极化:电晕极化是一种非接触极化方法,通过在高压电场下产生电晕放电,使空气中的电子和离子被加速并注入到材料表面,从而实现材料的极化。这种极化方式依赖于电场的不均匀性,通常需要尖锐的电极(如针状电极)来产生电晕放电。电晕极化过程中,电荷主要通过电晕放电
- 专题:2025供应链数智化与效率提升报告|附100+份报告PDF、原数据表汇总下载
拓端研究室
php开发语言
全文链接:https://tecdat.cn/?p=42926在全球产业链重构与数字技术革命的双重驱动下,供应链正经历从传统经验驱动向数据智能驱动的范式变革。从快消品产能区域化布局到垂类折扣企业的效率竞赛,从人形机器人的成本优化到供应链金融对中小企业的赋能,技术创新与模式重构正在重塑行业价值网络。本报告洞察基于《灼识咨询:2025中国供应链金融科技行业蓝皮书》《中国银河证券:折扣业态供应链效率深度
- 【kafka】在Linux系统中部署配置Kafka的详细用法教程分享
景天科技苑
linux基础与进阶shell脚本编写实战kafkalinux分布式kafka安装配置kafka优化
✨✨欢迎大家来到景天科技苑✨✨养成好习惯,先赞后看哦~作者简介:景天科技苑《头衔》:大厂架构师,华为云开发者社区专家博主,阿里云开发者社区专家博主,CSDN全栈领域优质创作者,掘金优秀博主,51CTO博客专家等。《博客》:Python全栈,PyQt5和Tkinter桌面应用开发,小程序开发,人工智能,js逆向,App逆向,网络系统安全,云原生K8S,Prometheus监控,数据分析,Django
- 赛博半仙占卜系统-仅供娱乐
Mbblovey
娱乐人工智能服务器网络AI编程
“赛博半仙占卜系统”的网页应用程序,其主要用途是为用户提供多种类型的占卜服务,包括塔罗牌占卜、星座运势查询、测字算命和八字命理分析,仅供娱乐参考。以下是对该系统各项功能的详细介绍:1.用户界面布局整体设计:网页采用暗色背景(#1a1a2e),以一个居中的容器展示内容,容器具有圆角和阴影效果,营造出科技感和神秘感。标题:页面标题为“赛博半仙占卜系统”,搭配一个星星和月牙的图标,突出主题。占卜类型选择
- LDR6500,C转DP双向互传解决方案
随着科技的飞速发展,数字接口技术也在不断演进。在众多接口标准中,Type-C转DP(DisplayPort)技术凭借其出色的兼容性、高清视频输出和多功能应用,逐渐成为广大消费者的优选。本文将详细介绍Type-C转DP接口的技术原理、适用设备以及性能参数,帮助您更好地理解这一技术。一、Type-C转DP的技术原理Type-C转DP接口技术利用Type-C接口中的AltMode(交替模式)功能,实现了
- 街道垃圾识别难?陌讯视觉算法实测准确率突破95%
2501_92487900
算法边缘计算目标检测视觉检测计算机视觉
开篇痛点:街道垃圾识别的技术挑战在智慧城市和环保监管场景中,街道垃圾的实时检测一直是个难题。传统视觉算法(如YOLOv5、FasterR-CNN)在复杂街道场景下表现不佳,主要面临以下问题:光照干扰:早晚光线变化导致误检(如阴影被识别为垃圾)小目标漏检:饮料瓶、烟头等小物体在640x640输入下仅占10x10像素遮挡问题:垃圾桶周边堆积物造成特征混淆某环保科技公司实测数据显示,开源模型在真实场景中
- 上海夏致云计算数字科技公司 Java 实习面经
上海夏致云计算数字科技公司Java实习面经本文作者:程序员小白条本站地址:https://xbt.xiaobaitiao.top1)面试官:先自我介绍一下我:大家先写个文档记录一下,然后按流程进行背诵就好了,如果有新的获奖和实习,直接按时间顺序进行增加即可,面的多了基本就麻木了…2)面试官:你的项目是为了什么而做的?我:反复介绍API,自圆其说即可,我主要做了拓展,最近考虑加点东西和参数优化,别说
- 信息安全专业全国院校排名(非常全面),收藏这一篇就够了_有信息安全学院的大学有哪些
程序员小雨Y
web安全网络安全网络安全linux
信息安全专业国家级一流本科专业大学序号学校名称专业名称级别1复旦大学信息安全国家级2上海交通大学信息安全国家级3浙江大学信息安全国家级4中国科学技术大学信息安全国家级5中国人民大学信息安全国家级6北京航空航天大学信息安全国家级7武汉大学信息安全国家级8华中科技大学信息安全国家级9哈尔滨工业大学信息安全国家级10南开大学信息安全国家级11西北工业大学信息安全国家级12山东大学信息安全国家级13重庆大
- 科技快讯 | 美团就“擦边骑手服”发声;微软365 Copilot引入非OpenAI模型;百川智能发布全链路领域增强金融大模型Baichuan4-Finance
美团就“擦边骑手服”发声美团声明,近日社交平台流传的“点男模”等字样骑手工服为不法商家私下定制,非官方正品,不符合着装要求。此类行为损害骑手形象,违反公序良俗,且存在安全隐患。美团已公证证据并报送公安机关,将通过法律手段维权。自2019年起,多起制售假冒骑手装备案件被破获,涉案人员被判刑,今年警方在多地捣毁制假窝点,抓获6名嫌疑人,查扣近万顶假冒头盔和4万套标识,涉案金额达500万元。美团对制假售
- 美团辟谣「30万本科生送外卖」;微软裁员再引争议,员工未归属股票被全部回收;传OpenAI“开放权重模型”最快下周上线|极客头条
极客日报
microsoft
「极客头条」——技术人员的新闻圈!CSDN的读者朋友们好,「极客头条」来啦,快来看今天都有哪些值得我们技术人关注的重要新闻吧。(投稿或寻求报道:
[email protected])整理|苏宓出品|CSDN(ID:CSDNnews)一分钟速览新闻点!美团辟谣「30万本科生送外卖」传字节跳动旗下沐瞳科技已收购杭州心光流美2025福布斯中国最佳CEO榜单揭晓:马化腾、雷军、王传福排名前三武汉大学集成电路学
- 巅峰对决,超三十万奖金等你挑战!第十届信也科技杯全球AI算法大赛火热开赛!
信也科技今年跟IJCAI和CIKM这两大全球顶级AI会议合作,这场比赛被全球人工智能顶会CIKM收录为官方赛事单元,获奖选手有机会全球人工智能顶会创造更大的影响力。巅峰对决,超三十万奖金等你挑战!第十届信也科技杯全球AI算法大赛火热开赛!赛事概况随着深度伪造技术的高度发展,人工智能产业走深向实,生成合成技术开始呈现工具化和普及化趋势。在生成合成内容质量显著提升的当下,基于换脸攻击的身份冒用和欺诈事
- 华为OD机试统一考试D卷C卷 - 整数对最小和 python
打卡第二十六天#和牛牛一起刷题打卡#第一天第一天南京市电信有消息了吗有没有投递IT岗的兄弟啊树米科技嵌入式实习面经1在tcp三次握手中,假如第三次握手失败,客户端仍然发送数据到服务端,此时服务端和会怎么处理?发#牛客在线求职答疑中心(35799)##牛客在线求职答疑中心#三环到底是什么套路#牛客在线求职答疑中心(35799)##牛客在线求职答疑中心#国能技经院博士待遇#牛客在线求职答疑中心(357
- 达摩院发布2022十大科技趋势!俺是一个也看不懂鸭!
xhmj12
人工智能网络大数据机器学习编程语言
上一篇:MVVM已过时?MVVM升级版:MVI架构来了来源|达摩院/阿里技术 小伙伴们大家好。2021年12月28日,阿里巴巴达摩院发布了2022年的十大科技趋势预测(https://damo.alibaba.com/techtrends/2022),作为一个打工人,俺也第一时间追了一波。虽说很多都看不懂,但是我想着多了解了解趋势和方向总是好的,所以咱们这里也分享一波。这次应该是达摩院连续第四年发
- 3D 可视化技术开启污水治理全新发展阶段
广州华锐视点
3d
3D可视化大屏展示技术在污水厂的应用,已然开启了污水处理的全新篇章。它不仅为污水厂解决了当下管理和展示的难题,更如同一座灯塔,照亮了未来污水处理领域的发展道路。随着科技的持续进步,3D可视化大屏展示技术必将迎来更加辉煌的发展。一方面,其与人工智能、大数据、物联网等前沿技术的融合将愈发紧密。借助人工智能算法,大屏系统将具备更强大的自主学习和分析能力,能够根据实时数据和历史经验,自动优化污水处理工艺参
- 博物馆元宇宙:重塑文化体验与教育的新维度
2401_89984614
人工智能
在科技日新月异的今天,虚拟现实(VR)、增强现实(AR)以及人工智能(AI)等前沿技术正深刻改变着我们的生活,包括我们如何接触和理解文化遗产。博物馆元宇宙,作为这一变革浪潮中的先锋概念,正逐步将传统的实体博物馆体验带入一个全新的数字化时代。本文旨在探讨博物馆元宇宙的内涵、其对文化传播与教育的影响,以及面临的挑战与未来展望。###一、博物馆元宇宙的概念博物馆元宇宙是指利用VR、AR、3D建模、AI等
- 机器学习深度学习驱动在光子学设计中的应用与未来【专题培训会议邀您共探科技前沿】
软研科技
信息与通信信号处理量子计算人工智能
一、背景介绍在智能科技飞速发展的今天,光子学设计与智能算法的结合正成为科研创新的热点。深度学习、机器学习等算法在光子器件的逆向设计、超构表面材料设计、光学神经网络构建等方面展现出巨大潜力。二、会议亮点由北京软研国际信息技术研究院主办的“智能算法驱动的光子学设计与应用”专题培训会议,将深入探讨以下核心内容:光子器件的逆向设计:利用深度学习优化多参数光子器件设计。超构表面与超材料设计:智能算法在新型光
- 新型BERT勒索软件肆虐:多线程攻击同时针对Windows、Linux及ESXi系统
趋势科技安全分析师发现,一个代号为BERT(内部追踪名WaterPombero)的新型勒索软件组织正在亚洲、欧洲和美国展开多线程攻击。该组织主要针对医疗保健、科技和会展服务行业,其活动范围显示其正成为勒索软件生态中的新兴威胁力量。攻击技术分析在Windows系统中,BERT通过PowerShell加载器(start.ps1)实施攻击,该脚本会执行以下操作:禁用WindowsDefender防火墙和
- 探秘未来智能:Solace,你的AI私人助手
蓬玮剑
探秘未来智能:Solace,你的AI私人助手去发现同类优质开源项目:https://gitcode.com/遇见未来的助手——Solace欢迎来到一个全新的世界,这里有一位神奇的伙伴正等待着你,那就是Solace——一款超越传统概念的AI个人助手,旨在提升你的工作效率,激发灵感,并与你共享无尽的想象空间。想象一下,在你需要的时候,一个全能的助手就在你的指尖,随时准备满足你的需求,用科技的魔力简化生
- 专题:2025数据资产AI价值化:安全、战略与应用报告|附400+份报告PDF、原数据表汇总下载
拓端研究室
人工智能大数据
原文链接:https://tecdat.cn/?p=42885在数字经济加速渗透的今天,数据作为核心生产要素的价值愈发凸显。上市公司作为经济高质量发展的微观主体,其数据价值化进程不仅关乎企业自身竞争力,更折射出中国产业数字化转型的深度与广度。本报告洞察基于《上海数据交易所:上市公司数据价值化研究报告(2025)》《绿盟科技:全球云上数据泄露风险分析报告(第五期)》《DigitalRealty:全球
- 用Keras构建爱情模型:破解情侣间的情感密码
忆愿
高质量领域文章keras人工智能深度学习python机器学习自然语言处理神经网络
文章目录一、给情话穿上数字马甲1.1中文分词那些坑1.2停用词过滤玄学二、给神经网络装个情感温度计2.1记忆增强套餐2.2注意力机制实战三、给模型喂点狗粮数据3.1数据增强七十二变3.2标注的艺术四、调参比哄对象还难4.1超参数扫雷指南4.2可视化调参黑科技五、实战演练之保命指南5.1部署成求生APP5.2案例分析库六、当AI遇见现实:模型局限与伦理困境6.1隐私雷区七、从玩具模型到生产系统7.1
- 标准引领|美创参编两项国家标准正式发布!
安全发展标准先行近日,国家标准化领域传来喜讯!杭州美创科技股份有限公司深度参与编制的两项国家标准,于2025年6月30日正式发布,并将于2026年1月1日起正式实施。GB/T20988-2025《网络安全技术信息系统灾难恢复规范》GB/T45909-2025《网络安全技术数字水印技术实现指南》GB/T20988-2025《网络安全技术信息系统灾难恢复规范》GB/T20988-2025《网络安全技术
- 微算法科技(NASDAQ MLGO)研究非标准量子预言机,拓展量子计算边界
MicroTech2025
量子计算
在当今科技飞速发展的时代,量子计算作为极具潜力的前沿领域,正不断探索着突破传统计算局限的新路径。然而,标准量子预言机在面对一些复杂且特殊的计算需求时,逐渐显现出其局限性,难以满足日益多样化的科研及应用场景。微算法科技(NASDAQMLGO)开始深入研究非标准量子预言机,试图通过拓展预言机的功能,进一步推动量子计算的发展。非标准量子预言机的研究不仅有助于深入理解量子计算的内在机制,还为解决复杂问题提
- 集合框架
天子之骄
java数据结构集合框架
集合框架
集合框架可以理解为一个容器,该容器主要指映射(map)、集合(set)、数组(array)和列表(list)等抽象数据结构。
从本质上来说,Java集合框架的主要组成是用来操作对象的接口。不同接口描述不同的数据类型。
简单介绍:
Collection接口是最基本的接口,它定义了List和Set,List又定义了LinkLi
- Table Driven(表驱动)方法实例
bijian1013
javaenumTable Driven表驱动
实例一:
/**
* 驾驶人年龄段
* 保险行业,会对驾驶人的年龄做年龄段的区分判断
* 驾驶人年龄段:01-[18,25);02-[25,30);03-[30-35);04-[35,40);05-[40,45);06-[45,50);07-[50-55);08-[55,+∞)
*/
public class AgePeriodTest {
//if...el
- Jquery 总结
cuishikuan
javajqueryAjaxWebjquery方法
1.$.trim方法用于移除字符串头部和尾部多余的空格。如:$.trim(' Hello ') // Hello2.$.contains方法返回一个布尔值,表示某个DOM元素(第二个参数)是否为另一个DOM元素(第一个参数)的下级元素。如:$.contains(document.documentElement, document.body); 3.$
- 面向对象概念的提出
麦田的设计者
java面向对象面向过程
面向对象中,一切都是由对象展开的,组织代码,封装数据。
在台湾面向对象被翻译为了面向物件编程,这充分说明了,这种编程强调实体。
下面就结合编程语言的发展史,聊一聊面向过程和面向对象。
c语言由贝尔实
- linux网口绑定
被触发
linux
刚在一台IBM Xserver服务器上装了RedHat Linux Enterprise AS 4,为了提高网络的可靠性配置双网卡绑定。
一、环境描述
我的RedHat Linux Enterprise AS 4安装双口的Intel千兆网卡,通过ifconfig -a命令看到eth0和eth1两张网卡。
二、双网卡绑定步骤:
2.1 修改/etc/sysconfig/network
- XML基础语法
肆无忌惮_
xml
一、什么是XML?
XML全称是Extensible Markup Language,可扩展标记语言。很类似HTML。XML的目的是传输数据而非显示数据。XML的标签没有被预定义,你需要自行定义标签。XML被设计为具有自我描述性。是W3C的推荐标准。
二、为什么学习XML?
用来解决程序间数据传输的格式问题
做配置文件
充当小型数据库
三、XML与HTM
- 为网页添加自己喜欢的字体
知了ing
字体 秒表 css
@font-face {
font-family: miaobiao;//定义字体名字
font-style: normal;
font-weight: 400;
src: url('font/DS-DIGI-e.eot');//字体文件
}
使用:
<label style="font-size:18px;font-famil
- redis范围查询应用-查找IP所在城市
矮蛋蛋
redis
原文地址:
http://www.tuicool.com/articles/BrURbqV
需求
根据IP找到对应的城市
原来的解决方案
oracle表(ip_country):
查询IP对应的城市:
1.把a.b.c.d这样格式的IP转为一个数字,例如为把210.21.224.34转为3524648994
2. select city from ip_
- 输入两个整数, 计算百分比
alleni123
java
public static String getPercent(int x, int total){
double result=(x*1.0)/(total*1.0);
System.out.println(result);
DecimalFormat df1=new DecimalFormat("0.0000%");
- 百合——————>怎么学习计算机语言
百合不是茶
java 移动开发
对于一个从没有接触过计算机语言的人来说,一上来就学面向对象,就算是心里上面接受的了,灵魂我觉得也应该是跟不上的,学不好是很正常的现象,计算机语言老师讲的再多,你在课堂上面跟着老师听的再多,我觉得你应该还是学不会的,最主要的原因是你根本没有想过该怎么来学习计算机编程语言,记得大一的时候金山网络公司在湖大招聘我们学校一个才来大学几天的被金山网络录取,一个刚到大学的就能够去和
- linux下tomcat开机自启动
bijian1013
tomcat
方法一:
修改Tomcat/bin/startup.sh 为:
export JAVA_HOME=/home/java1.6.0_27
export CLASSPATH=$CLASSPATH:$JAVA_HOME/lib/tools.jar:$JAVA_HOME/lib/dt.jar:.
export PATH=$JAVA_HOME/bin:$PATH
export CATALINA_H
- spring aop实例
bijian1013
javaspringAOP
1.AdviceMethods.java
package com.bijian.study.spring.aop.schema;
public class AdviceMethods {
public void preGreeting() {
System.out.println("--how are you!--");
}
}
2.beans.x
- [Gson八]GsonBuilder序列化和反序列化选项enableComplexMapKeySerialization
bit1129
serialization
enableComplexMapKeySerialization配置项的含义
Gson在序列化Map时,默认情况下,是调用Key的toString方法得到它的JSON字符串的Key,对于简单类型和字符串类型,这没有问题,但是对于复杂数据对象,如果对象没有覆写toString方法,那么默认的toString方法将得到这个对象的Hash地址。
GsonBuilder用于
- 【Spark九十一】Spark Streaming整合Kafka一些值得关注的问题
bit1129
Stream
包括Spark Streaming在内的实时计算数据可靠性指的是三种级别:
1. At most once,数据最多只能接受一次,有可能接收不到
2. At least once, 数据至少接受一次,有可能重复接收
3. Exactly once 数据保证被处理并且只被处理一次,
具体的多读几遍http://spark.apache.org/docs/lates
- shell脚本批量检测端口是否被占用脚本
ronin47
#!/bin/bash
cat ports |while read line
do#nc -z -w 10 $line
nc -z -w 2 $line 58422>/dev/null2>&1if[ $?-eq 0]then
echo $line:ok
else
echo $line:fail
fi
done
这里的ports 既可以是文件
- java-2.设计包含min函数的栈
bylijinnan
java
具体思路参见:http://zhedahht.blog.163.com/blog/static/25411174200712895228171/
import java.util.ArrayList;
import java.util.List;
public class MinStack {
//maybe we can use origin array rathe
- Netty源码学习-ChannelHandler
bylijinnan
javanetty
一般来说,“有状态”的ChannelHandler不应该是“共享”的,“无状态”的ChannelHandler则可“共享”
例如ObjectEncoder是“共享”的, 但 ObjectDecoder 不是
因为每一次调用decode方法时,可能数据未接收完全(incomplete),
它与上一次decode时接收到的数据“累计”起来才有可能是完整的数据,是“有状态”的
p
- java生成随机数
cngolon
java
方法一:
/**
* 生成随机数
* @author
[email protected]
* @return
*/
public synchronized static String getChargeSequenceNum(String pre){
StringBuffer sequenceNum = new StringBuffer();
Date dateTime = new D
- POI读写海量数据
ctrain
海量数据
import java.io.FileOutputStream;
import java.io.OutputStream;
import org.apache.poi.xssf.streaming.SXSSFRow;
import org.apache.poi.xssf.streaming.SXSSFSheet;
import org.apache.poi.xssf.streaming
- mysql 日期格式化date_format详细使用
daizj
mysqldate_format日期格式转换日期格式化
日期转换函数的详细使用说明
DATE_FORMAT(date,format) Formats the date value according to the format string. The following specifiers may be used in the format string. The&n
- 一个程序员分享8年的开发经验
dcj3sjt126com
程序员
在中国有很多人都认为IT行为是吃青春饭的,如果过了30岁就很难有机会再发展下去!其实现实并不是这样子的,在下从事.NET及JAVA方面的开发的也有8年的时间了,在这里在下想凭借自己的亲身经历,与大家一起探讨一下。
明确入行的目的
很多人干IT这一行都冲着“收入高”这一点的,因为只要学会一点HTML, DIV+CSS,要做一个页面开发人员并不是一件难事,而且做一个页面开发人员更容
- android欢迎界面淡入淡出效果
dcj3sjt126com
android
很多Android应用一开始都会有一个欢迎界面,淡入淡出效果也是用得非常多的,下面来实现一下。
主要代码如下:
package com.myaibang.activity;
import android.app.Activity;import android.content.Intent;import android.os.Bundle;import android.os.CountDown
- linux 复习笔记之常见压缩命令
eksliang
tar解压linux系统常见压缩命令linux压缩命令tar压缩
转载请出自出处:http://eksliang.iteye.com/blog/2109693
linux中常见压缩文件的拓展名
*.gz gzip程序压缩的文件
*.bz2 bzip程序压缩的文件
*.tar tar程序打包的数据,没有经过压缩
*.tar.gz tar程序打包后,并经过gzip程序压缩
*.tar.bz2 tar程序打包后,并经过bzip程序压缩
*.zi
- Android 应用程序发送shell命令
gqdy365
android
项目中需要直接在APP中通过发送shell指令来控制lcd灯,其实按理说应该是方案公司在调好lcd灯驱动之后直接通过service送接口上来给APP,APP调用就可以控制了,这是正规流程,但我们项目的方案商用的mtk方案,方案公司又没人会改,只调好了驱动,让应用程序自己实现灯的控制,这不蛋疼嘛!!!!
发就发吧!
一、关于shell指令:
我们知道,shell指令是Linux里面带的
- java 无损读取文本文件
hw1287789687
读取文件无损读取读取文本文件charset
java 如何无损读取文本文件呢?
以下是有损的
@Deprecated
public static String getFullContent(File file, String charset) {
BufferedReader reader = null;
if (!file.exists()) {
System.out.println("getFull
- Firebase 相关文章索引
justjavac
firebase
Awesome Firebase
最近谷歌收购Firebase的新闻又将Firebase拉入了人们的视野,于是我做了这个 github 项目。
Firebase 是一个数据同步的云服务,不同于 Dropbox 的「文件」,Firebase 同步的是「数据」,服务对象是网站开发者,帮助他们开发具有「实时」(Real-Time)特性的应用。
开发者只需引用一个 API 库文件就可以使用标准 RE
- C++学习重点
lx.asymmetric
C++笔记
1.c++面向对象的三个特性:封装性,继承性以及多态性。
2.标识符的命名规则:由字母和下划线开头,同时由字母、数字或下划线组成;不能与系统关键字重名。
3.c++语言常量包括整型常量、浮点型常量、布尔常量、字符型常量和字符串性常量。
4.运算符按其功能开以分为六类:算术运算符、位运算符、关系运算符、逻辑运算符、赋值运算符和条件运算符。
&n
- java bean和xml相互转换
q821424508
javabeanxmlxml和bean转换java bean和xml转换
这几天在做微信公众号
做的过程中想找个java bean转xml的工具,找了几个用着不知道是配置不好还是怎么回事,都会有一些问题,
然后脑子一热谢了一个javabean和xml的转换的工具里,自己用着还行,虽然有一些约束吧 ,
还是贴出来记录一下
顺便你提一下下,这个转换工具支持属性为集合、数组和非基本属性的对象。
packag
- C 语言初级 位运算
1140566087
位运算c
第十章 位运算 1、位运算对象只能是整形或字符型数据,在VC6.0中int型数据占4个字节 2、位运算符: 运算符 作用 ~ 按位求反 << 左移 >> 右移 & 按位与 ^ 按位异或 | 按位或 他们的优先级从高到低; 3、位运算符的运算功能: a、按位取反: ~01001101 = 101
- 14点睛Spring4.1-脚本编程
wiselyman
spring4
14.1 Scripting脚本编程
脚本语言和java这类静态的语言的主要区别是:脚本语言无需编译,源码直接可运行;
如果我们经常需要修改的某些代码,每一次我们至少要进行编译,打包,重新部署的操作,步骤相当麻烦;
如果我们的应用不允许重启,这在现实的情况中也是很常见的;
在spring中使用脚本编程给上述的应用场景提供了解决方案,即动态加载bean;
spring支持脚本