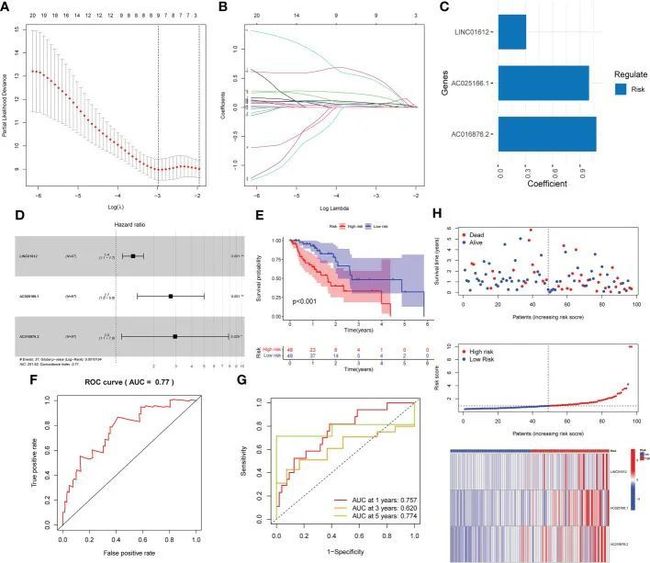
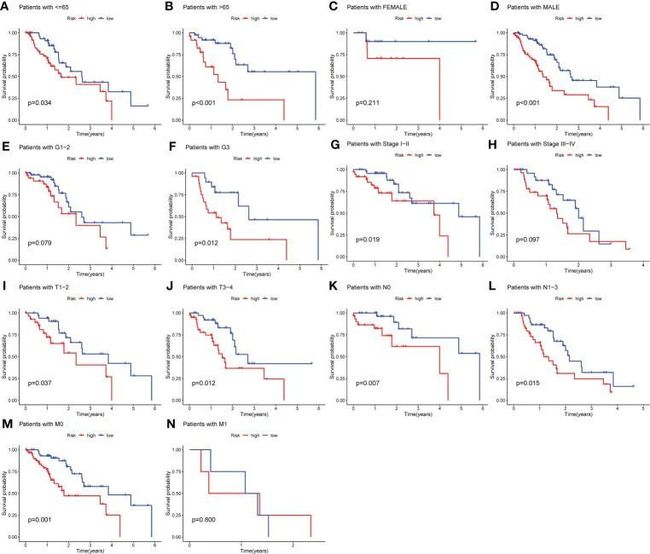
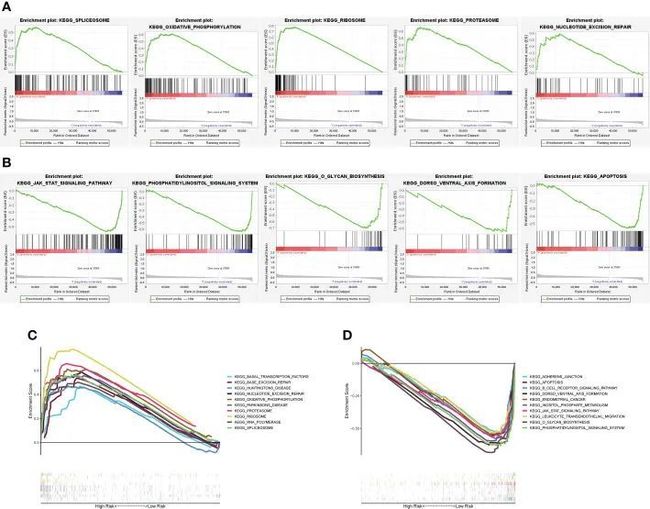
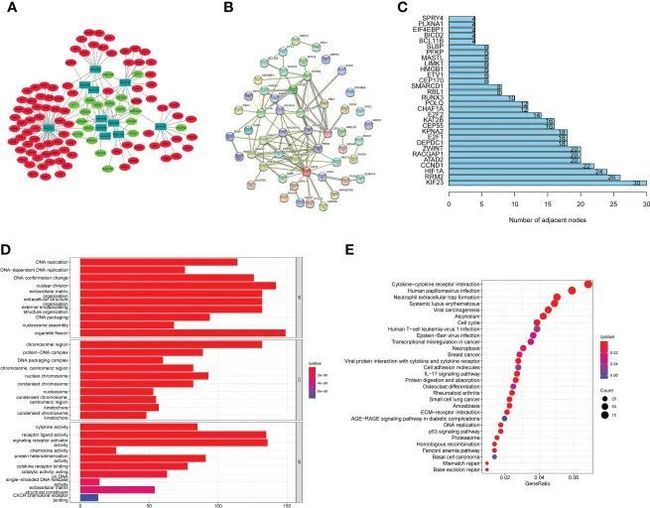
- [论文阅读] 软件工程 | 探索软件生态系统中的开发者体验关键因素
探索软件生态系统中的开发者体验关键因素:从研究到实践引文格式@article{Zacarias2025,title={ExploringDeveloperExperienceFactorsinSoftwareEcosystems},author={Zacarias,RodrigoOliveiraandAntunes,L{\'e}oCarvalhoRamosandBarros,M{\'a}rciod
- Fast Image Deconvolution using Hyper-Laplacian Priors论文阅读
青铜锁00
#退化论文阅读论文阅读图像处理
FastImageDeconvolutionusingHyper-LaplacianPriors1.论文的研究目标与实际意义2.论文的创新方法2.1核心框架:交替最小化(AlternatingMinimization)2.2x子问题:频域FFT加速2.3w子问题:高效求解的核心创新2.3.1问题形式2.3.2查找表法(LUT)2.3.3解析解法(特定α\alphaα)2.3.4通用α\alphaα
- [论文阅读] 人工智能 + 软件工程 | AI 与敏捷开发的破局之路:从挫败到成功的工作坊纪实
张较瘦_
前沿技术论文阅读人工智能软件工程
AI与敏捷开发的破局之路:从挫败到成功的工作坊纪实论文信息arXiv:2506.20159AIandAgileSoftwareDevelopment:FromFrustrationtoSuccess–XP2025WorkshopSummaryTomasHerda,VictoriaPichler,ZheyingZhang,PekkaAbrahamsson,GeirK.HanssenSubjects:
- Diff-Retinex: Rethinking Low-light Image Enhancement with A Generative Diffusion Model 论文阅读
钟屿
论文阅读人工智能深度学习学习图像处理计算机视觉
Diff-Retinex:用生成式扩散模型重新思考低光照图像增强摘要本文中,我们重新思考了低光照图像增强任务,并提出了一种物理可解释的生成式扩散模型,称为Diff-Retinex。我们的目标是整合物理模型和生成网络的优点。此外,我们希望通过生成网络补充甚至推断低光照图像中缺失的信息。因此,Diff-Retinex将低光照图像增强问题表述为Retinex分解和条件图像生成。在Retinex分解中,我
- 【论文阅读】人工智能在直升机航空电子系统中的应用
肥鼠路易
论文阅读人工智能航空电子系统应用
人工智能在直升机航空电子系统中的应用论文摘要文章结构参考文献论文摘要论文摘要:在现代战争形势日趋信息化、智能化的背景下,将人工智能应用于武器装备已经是大势所趋。针对直升机飞行任务的特征,对其发展状况进行了描述,并对其作业能力进行了分析,探索了人工智能技术在直升机航电系统中的应用方向,为推进人工智能在直升机上的转化与应用奠定基础。通过对国外先进直升机智能技术的运用现状及对其作业能力的要求进行分析,探
- [论文阅读] 人工智能+软件工程 | 用大语言模型架起软件需求形式化的桥梁
张较瘦_
前沿技术人工智能论文阅读软件工程
用大语言模型架起软件需求形式化的桥梁:一篇ACM调查草案的深度解读论文信息arXiv:2506.14627ACMSurveyDraftonFormalisingSoftwareRequirementswithLargeLanguageModelsArshadBeg,DiarmuidO’Donoghue,RosemaryMonahanComments:22pages.6summarytablesSu
- Reti-Diff: Illumination Degradation Image Restoration with Retinex-based Latent Diffusion Model论文阅读
青铜锁00
深度学习论文阅读#退化论文阅读
Reti-Diff:IlluminationDegradationImageRestorationwithRetinex-basedLatentDiffusionModel1.研究目标与实际意义1.1研究目标1.2实际意义2.创新方法与模型设计2.1整体框架2.2RetinexPriorExtraction(RPE)模块2.2.1Retinex分解2.2.2先验压缩2.3Retinex-guide
- SIMPL论文阅读
ZHANG8023ZHEN
论文阅读
论文链接:https://arxiv.org/pdf/2402.02519文章还没细看,但主要贡献点应该是SymmetricFusionTransformer和Bezier-basedMotionDecoder.对Bezier-basedMotionDecoder比较感兴趣,之后对这块细看一下
- 【论文阅读笔记】《CodeS: Towards Building Open-source Language Models for Text-to-SQL 》
柠石榴
text2sql论文论文阅读笔记语言模型
文章目录一、论文基本信息1.文章标题2.所属刊物/会议3.发表年份4.作者列表5.发表单位二、摘要三、解决问题四、创新点五、自己的见解和感想六、研究背景七、研究方法模型实验数据评估指标八、总结九、相关重要文献一、论文基本信息1.文章标题CodeS:TowardsBuildingOpen-sourceLanguageModelsforText-to-SQL2.所属刊物/会议未明确标注(会议缩写为“C
- agentformer论文阅读
ZHANG8023ZHEN
论文阅读
参考了这篇博文:https://zhuanlan.zhihu.com/p/512764984主要有这几个部分a.map_encoderi.对地图进行CNNb.ContextEncoderi.timeencoder–将时间信息用transformer和positionemb进行融合,加入到特征中ii.agent-awareattention–self和selfattentionother和other
- 【论文阅读】DynamicControl :一种新的controlnet多条件控制方法
prinTao
pytorchDiffusion论文阅读
背景现有方法要么处理条件效率低下,要么使用固定数量的条件,这并不能完全解决多个条件的复杂性及其潜在冲突。这强调了需要创新方法来有效管理多种条件,以实现更可靠和详细的图像合成。为了解决这个问题,我们提出了一个新的框架DynamicControl,它支持不同控制信号的动态组合,允许自适应选择不同数量和类型的条件。本文方法从一个双循环控制器开始,它通过利用预先训练的条件生成模型和判别模型为所有输入条件生
- 论文阅读:2018 arxiv CrowdHuman: A Benchmark for Detecting Human in a Crowd
CSPhD-winston-杨帆
论文阅读
https://www.doubao.com/chat/9226473480559618https://arxiv.org/pdf/1805.00123CrowdHuman:ABenchmarkforDetectingHumaninaCrowd文章目录论文翻译CrowdHuman:用于检测人群中人体的基准摘要1.引言2.相关工作2.1.人体检测数据集2.2.人体检测框架。论文翻译CrowdHuma
- 论文阅读:arxiv 2025 OThink-R1: Intrinsic Fast/Slow Thinking Mode Switching for Over-Reasoning Mitigation
CSPhD-winston-杨帆
论文阅读
总目录大模型安全相关研究:https://blog.csdn.net/WhiffeYF/article/details/142132328https://www.doubao.com/chat/8815924393371650https://arxiv.org/pdf/2506.02397#page=17.09OThink文章目录速览研究背景与问题核心思路与方法实验结果结论与意义速览这篇论文聚焦于
- 论文阅读:arxiv 2025 Not All Tokens Are What You Need In Thinking
总目录大模型安全相关研究:https://blog.csdn.net/WhiffeYF/article/details/142132328https://arxiv.org/pdf/2505.17827https://www.doubao.com/chat/8814790364572162文章目录速览研究背景提出的解决方案:条件token选择(CTS)实验结果核心贡献研究局限总结速览这篇论文主要探
- [论文阅读]PIDNet: A Real-time Semantic Segmentation Network Inspired by PID Controllers
颜笑晏晏
论文阅读
1.摘要双分支网络结构已显示出其对实时语义分割任务的效率性和有效性。然而,低级细节和高级语义的直接融合将导致细节特征容易被周围上下文信息淹没,即本文中的超调(overshoot),这限制了现有两个分支模型的准确性的提高。在本文中,我们在卷积神经网络(CNN)和比例积分微分(PID)控制器之间架起了桥梁,并揭示了双分支网络只是一个比例积分(PI)控制器,当然也会存在类似的超调问题。为了解决这个问题,
- [论文阅读] 人工智能+软件工程 | 用 LLM + 静态代码分析自动化提升代码质量
张较瘦_
前沿技术论文阅读人工智能软件工程
用LLM+静态代码分析自动化提升代码质量论文信息AugmentingLargeLanguageModelswithStaticCodeAnalysisforAutomatedCodeQualityImprovements@article{abtahi2025augmenting,title={AugmentingLargeLanguageModelswithStaticCodeAnalysisfo
- 经典论文阅读《A Framework for Unifying Reordering Transformations》《统一重排序变换的框架》
好好学习啊天天向上
自动性能优化
1)摘要我们提出了一个用于统一迭代重排序变换的框架,这些变换包括循环交换、循环分布、倾斜、分块、索引集拆分和语句重排序。该框架基于这样一种思想:变换可以表示为将原始迭代空间映射到新迭代空间的调度。框架旨在为变换提供一种统一的表示和推理方式。作为框架的一部分,我们提供了辅助构建和使用调度的算法,特别是用于检验调度合法性、对齐调度以及为调度生成优化代码的算法。2)优化编译器会对语句的迭代进行重新排序,
- [论文阅读] 系统架构 | 零售 IT 中的微服务与实时处理:开源工具链与部署策略综述
张较瘦_
前沿技术论文阅读大数据零售
零售IT中的微服务与实时处理:开源工具链与部署策略综述论文信息MicroservicesandReal-TimeProcessinginRetailIT:AReviewofOpen-SourceToolchainsandDeploymentStrategiesAaditaaVashisht(DepartmentofInformationScienceandEngineering,RVCollege
- [论文阅读]人工智能 | CoMemo:给大视觉语言模型装个“图像记忆”
张较瘦_
前沿技术人工智能论文阅读语言模型
【论文速览】CoMemo:给大视觉语言模型装个“图像记忆”论文信息Liu,S.,Su,W.,Zhu,X.,Wang,W.,&Dai,J.(2025).CoMemo:LVLMsNeedImageContextwithImageMemory.arXivpreprintarXiv:2506.06279.一、研究背景:当LVLMs遇到“视觉健忘症”想象一下,你在阅读一本图文并茂的小说时,随着文字篇幅越来越
- [论文阅读] 人工智能+软件工程 | 结对编程中的知识转移新图景
张较瘦_
前沿技术人工智能软件工程结对编程
当AI成为编程搭档:结对编程中的知识转移新图景论文信息论文标题:FromDeveloperPairstoAICopilots:AComparativeStudyonKnowledgeTransfer(从开发者结对到AI副驾驶:知识转移的对比研究)作者及机构:AlisaWelter等来自德国萨尔兰大学,ChristofTinnes同时隶属于西门子公司发表平台:arXiv预印本平台发表时间:2025年
- 【论文阅读笔记】HaDes幻觉检测benchmark
zsq
论文分享论文阅读笔记NLP大语言模型幻觉
0论文信息题目:AToken-levelReference-freeHallucinationDetectionBenchmarkforFree-formTextGeneration作者:TianyuLiu,YizheZhang,ChrisBrockett,YiMao,ZhifangSui,WeizhuChen,BillDolan会议:ACL,2022链接:https://arxiv.org/ab
- 论文阅读:Enhancing Retrieval and Managing Retrieval: A Four-Module Synergy for Improved Quality and Ef
clvsit
RAG论文阅读LLM
检索增强生成(RAG)技术利用大型语言模型(LLM)的上下文学习能力,生成更准确、更相关的响应。RAG框架起源于简单的“检索-阅读”方法,现已发展成为高度灵活的模块化范式。其中一个关键组件——查询重写模块,通过生成搜索友好的查询来增强知识检索。这种方法能使输入问题与知识库更紧密地结合起来。作者的研究发现了将QueryRewriter模块增强为QueryRewriter+的机会,即通过生成多个查询来
- 论文阅读:HySCDG生成式数据处理流程
论文地址:TheChangeYouWantToDetect:SemanticChangeDetectionInEarthObservationWithHybridDataGenerationAbstract摘要内容介绍问题背景“Bi-temporalchangedetectionatscalebasedonVeryHighResolution(VHR)imagesiscrucialforEarth
- [论文阅读] 人工智能 | 搜索增强LLMs的用户偏好与性能分析
张较瘦_
前沿技术人工智能论文阅读
【论文解读】SearchArena:搜索增强LLMs的用户偏好与性能分析论文信息作者:MihranMiroyan,Tsung-HanWu,LoganKing等标题:SearchArena:AnalyzingSearch-AugmentedLLMs来源:arXivpreprintarXiv:2506.05334v1,2025一、研究背景:当LLMs需要“上网查资料”时,我们如何评估它?想象你在问AI
- [论文阅读] 人工智能 | 如何快速检测LLM生成的代码?这篇论文提出了一个巧妙的方法
张较瘦_
前沿技术人工智能论文阅读
如何快速检测LLM生成的代码?这篇论文提出了一个巧妙的方法论文引文格式@misc{ashkenazi2025zero,title={Zero-ShotDetectionofLLM-GeneratedCodeviaApproximatedTaskConditioning},author={MaorAshkenaziandOfirBrennerandTalFurmanShohetandEranTrei
- [论文阅读] 人工智能+软件工程 | 理解GitGoodBench:评估AI代理在Git中表现的新基准
张较瘦_
前沿技术论文阅读人工智能软件工程
理解GitGoodBench:评估AI代理在Git中表现的新基准论文信息GitGoodBench:ANovelBenchmarkForEvaluatingAgenticPerformanceOnGitTobiasLindenbauer,EgorBogomolov,YaroslavZharovCiteas:arXiv:2505.22583[cs.SE]研究背景:当AI走进开发者的协作工具箱在软件开发
- [论文阅读] 人工智能+软件工程(软件测试) | 当大语言模型遇上APP测试:SCENGEN如何让手机应用更靠谱
张较瘦_
前沿技术人工智能论文阅读软件工程
当大语言模型遇上APP测试:SCENGEN如何让手机应用更靠谱?一、论文基础信息论文标题:LLM-GuidedScenario-basedGUITesting(《大语言模型引导的基于场景的GUI测试》)作者及机构:ShengchengYu等(德国慕尼黑工业大学、南京大学、同济大学等)发表来源:IEEETransactionsonSoftwareEngineering(IEEE软件工程汇刊)发表时间
- [论文阅读] 人工智能+软件工程 | 用大模型优化软件性能
张较瘦_
前沿技术论文阅读人工智能软件工程
用大模型优化软件性能?这篇论文让代码跑出新速度!arXiv:2506.01249SysLLMatic:LargeLanguageModelsareSoftwareSystemOptimizersHuiyunPeng,ArjunGupte,RyanHasler,NicholasJohnEliopoulos,Chien-ChouHo,RishiMantri,LeoDeng,KonstantinLäuf
- Enhanced Sparse Model for Blind Deblurring论文阅读
青铜锁00
#退化论文阅读论文阅读图像处理
EnhancedSparseModelforBlindDeblurring1.研究目标与意义1.1研究目标1.2实际意义与产业价值2.论文提出的新思路、方法及模型2.1增强稀疏模型(EnhancedSparseModel,lel_ele)模型定义与数学表达闭式解与稀疏性增强机制2.2改进的噪声建模策略噪声拟合函数的构建空间随机性建模2.3整体优化框架与半二次分裂法目标函数设计优化步骤拆分参数设置与
- [论文阅读] 人工智能+软件工程 | MemFL:给大模型装上“项目记忆”,让软件故障定位又快又准
张较瘦_
前沿技术论文阅读人工智能软件工程
【论文解读】MemFL:给大模型装上“项目记忆”,让软件故障定位又快又准论文信息arXiv:2506.03585ImprovingLLM-BasedFaultLocalizationwithExternalMemoryandProjectContextInseokYeo,DuksanRyu,JongmoonBaikSubjects:SoftwareEngineering(cs.SE)一、研究背景:
- Enum用法
不懂事的小屁孩
enum
以前的时候知道enum,但是真心不怎么用,在实际开发中,经常会用到以下代码:
protected final static String XJ = "XJ";
protected final static String YHK = "YHK";
protected final static String PQ = "PQ";
- 【Spark九十七】RDD API之aggregateByKey
bit1129
spark
1. aggregateByKey的运行机制
/**
* Aggregate the values of each key, using given combine functions and a neutral "zero value".
* This function can return a different result type
- hive创建表是报错: Specified key was too long; max key length is 767 bytes
daizj
hive
今天在hive客户端创建表时报错,具体操作如下
hive> create table test2(id string);
FAILED: Execution Error, return code 1 from org.apache.hadoop.hive.ql.exec.DDLTask. MetaException(message:javax.jdo.JDODataSto
- Map 与 JavaBean之间的转换
周凡杨
java自省转换反射
最近项目里需要一个工具类,它的功能是传入一个Map后可以返回一个JavaBean对象。很喜欢写这样的Java服务,首先我想到的是要通过Java 的反射去实现匿名类的方法调用,这样才可以把Map里的值set 到JavaBean里。其实这里用Java的自省会更方便,下面两个方法就是一个通过反射,一个通过自省来实现本功能。
1:JavaBean类
1 &nb
- java连接ftp下载
g21121
java
有的时候需要用到java连接ftp服务器下载,上传一些操作,下面写了一个小例子。
/** ftp服务器地址 */
private String ftpHost;
/** ftp服务器用户名 */
private String ftpName;
/** ftp服务器密码 */
private String ftpPass;
/** ftp根目录 */
private String f
- web报表工具FineReport使用中遇到的常见报错及解决办法(二)
老A不折腾
finereportweb报表java报表总结
抛砖引玉,希望大家能把自己整理的问题及解决方法晾出来,Mark一下,利人利己。
出现问题先搜一下文档上有没有,再看看度娘有没有,再看看论坛有没有。有报错要看日志。下面简单罗列下常见的问题,大多文档上都有提到的。
1、没有返回数据集:
在存储过程中的操作语句之前加上set nocount on 或者在数据集exec调用存储过程的前面加上这句。当S
- linux 系统cpu 内存等信息查看
墙头上一根草
cpu内存liunx
1 查看CPU
1.1 查看CPU个数
# cat /proc/cpuinfo | grep "physical id" | uniq | wc -l
2
**uniq命令:删除重复行;wc –l命令:统计行数**
1.2 查看CPU核数
# cat /proc/cpuinfo | grep "cpu cores" | u
- Spring中的AOP
aijuans
springAOP
Spring中的AOP
Written by Tony Jiang @ 2012-1-18 (转)何为AOP
AOP,面向切面编程。
在不改动代码的前提下,灵活的在现有代码的执行顺序前后,添加进新规机能。
来一个简单的Sample:
目标类:
[java]
view plain
copy
print
?
package&nb
- placeholder(HTML 5) IE 兼容插件
alxw4616
JavaScriptjquery jQuery插件
placeholder 这个属性被越来越频繁的使用.
但为做HTML 5 特性IE没能实现这东西.
以下的jQuery插件就是用来在IE上实现该属性的.
/**
* [placeholder(HTML 5) IE 实现.IE9以下通过测试.]
* v 1.0 by oTwo 2014年7月31日 11:45:29
*/
$.fn.placeholder = function
- Object类,值域,泛型等总结(适合有基础的人看)
百合不是茶
泛型的继承和通配符变量的值域Object类转换
java的作用域在编程的时候经常会遇到,而我经常会搞不清楚这个
问题,所以在家的这几天回忆一下过去不知道的每个小知识点
变量的值域;
package 基础;
/**
* 作用域的范围
*
* @author Administrator
*
*/
public class zuoyongyu {
public static vo
- JDK1.5 Condition接口
bijian1013
javathreadConditionjava多线程
Condition 将 Object 监视器方法(wait、notify和 notifyAll)分解成截然不同的对象,以便通过将这些对象与任意 Lock 实现组合使用,为每个对象提供多个等待 set (wait-set)。其中,Lock 替代了 synchronized 方法和语句的使用,Condition 替代了 Object 监视器方法的使用。
条件(也称为条件队列或条件变量)为线程提供了一
- 开源中国OSC源创会记录
bijian1013
hadoopsparkMemSQL
一.Strata+Hadoop World(SHW)大会
是全世界最大的大数据大会之一。SHW大会为各种技术提供了深度交流的机会,还会看到最领先的大数据技术、最广泛的应用场景、最有趣的用例教学以及最全面的大数据行业和趋势探讨。
二.Hadoop
&nbs
- 【Java范型七】范型消除
bit1129
java
范型是Java1.5引入的语言特性,它是编译时的一个语法现象,也就是说,对于一个类,不管是范型类还是非范型类,编译得到的字节码是一样的,差别仅在于通过范型这种语法来进行编译时的类型检查,在运行时是没有范型或者类型参数这个说法的。
范型跟反射刚好相反,反射是一种运行时行为,所以编译时不能访问的变量或者方法(比如private),在运行时通过反射是可以访问的,也就是说,可见性也是一种编译时的行为,在
- 【Spark九十四】spark-sql工具的使用
bit1129
spark
spark-sql是Spark bin目录下的一个可执行脚本,它的目的是通过这个脚本执行Hive的命令,即原来通过
hive>输入的指令可以通过spark-sql>输入的指令来完成。
spark-sql可以使用内置的Hive metadata-store,也可以使用已经独立安装的Hive的metadata store
关于Hive build into Spark
- js做的各种倒计时
ronin47
js 倒计时
第一种:精确到秒的javascript倒计时代码
HTML代码:
<form name="form1">
<div align="center" align="middle"
- java-37.有n 个长为m+1 的字符串,如果某个字符串的最后m 个字符与某个字符串的前m 个字符匹配,则两个字符串可以联接
bylijinnan
java
public class MaxCatenate {
/*
* Q.37 有n 个长为m+1 的字符串,如果某个字符串的最后m 个字符与某个字符串的前m 个字符匹配,则两个字符串可以联接,
* 问这n 个字符串最多可以连成一个多长的字符串,如果出现循环,则返回错误。
*/
public static void main(String[] args){
- mongoDB安装
开窍的石头
mongodb安装 基本操作
mongoDB的安装
1:mongoDB下载 https://www.mongodb.org/downloads
2:下载mongoDB下载后解压
- [开源项目]引擎的关键意义
comsci
开源项目
一个系统,最核心的东西就是引擎。。。。。
而要设计和制造出引擎,最关键的是要坚持。。。。。。
现在最先进的引擎技术,也是从莱特兄弟那里出现的,但是中间一直没有断过研发的
- 软件度量的一些方法
cuiyadll
方法
软件度量的一些方法http://cuiyingfeng.blog.51cto.com/43841/6775/在前面我们已介绍了组成软件度量的几个方面。在这里我们将先给出关于这几个方面的一个纲要介绍。在后面我们还会作进一步具体的阐述。当我们不从高层次的概念级来看软件度量及其目标的时候,我们很容易把这些活动看成是不同而且毫不相干的。我们现在希望表明他们是怎样恰如其分地嵌入我们的框架的。也就是我们度量的
- XSD中的targetNameSpace解释
darrenzhu
xmlnamespacexsdtargetnamespace
参考链接:
http://blog.csdn.net/colin1014/article/details/357694
xsd文件中定义了一个targetNameSpace后,其内部定义的元素,属性,类型等都属于该targetNameSpace,其自身或外部xsd文件使用这些元素,属性等都必须从定义的targetNameSpace中找:
例如:以下xsd文件,就出现了该错误,即便是在一
- 什么是RAID0、RAID1、RAID0+1、RAID5,等磁盘阵列模式?
dcj3sjt126com
raid
RAID 1又称为Mirror或Mirroring,它的宗旨是最大限度的保证用户数据的可用性和可修复性。 RAID 1的操作方式是把用户写入硬盘的数据百分之百地自动复制到另外一个硬盘上。由于对存储的数据进行百分之百的备份,在所有RAID级别中,RAID 1提供最高的数据安全保障。同样,由于数据的百分之百备份,备份数据占了总存储空间的一半,因而,Mirror的磁盘空间利用率低,存储成本高。
Mir
- yii2 restful web服务快速入门
dcj3sjt126com
PHPyii2
快速入门
Yii 提供了一整套用来简化实现 RESTful 风格的 Web Service 服务的 API。 特别是,Yii 支持以下关于 RESTful 风格的 API:
支持 Active Record 类的通用API的快速原型
涉及的响应格式(在默认情况下支持 JSON 和 XML)
支持可选输出字段的定制对象序列化
适当的格式的数据采集和验证错误
- MongoDB查询(3)——内嵌文档查询(七)
eksliang
MongoDB查询内嵌文档MongoDB查询内嵌数组
MongoDB查询内嵌文档
转载请出自出处:http://eksliang.iteye.com/blog/2177301 一、概述
有两种方法可以查询内嵌文档:查询整个文档;针对键值对进行查询。这两种方式是不同的,下面我通过例子进行分别说明。
二、查询整个文档
例如:有如下文档
db.emp.insert({
&qu
- android4.4从系统图库无法加载图片的问题
gundumw100
android
典型的使用场景就是要设置一个头像,头像需要从系统图库或者拍照获得,在android4.4之前,我用的代码没问题,但是今天使用android4.4的时候突然发现不灵了。baidu了一圈,终于解决了。
下面是解决方案:
private String[] items = new String[] { "图库","拍照" };
/* 头像名称 */
- 网页特效大全 jQuery等
ini
JavaScriptjquerycsshtml5ini
HTML5和CSS3知识和特效
asp.net ajax jquery实例
分享一个下雪的特效
jQuery倾斜的动画导航菜单
选美大赛示例 你会选谁
jQuery实现HTML5时钟
功能强大的滚动播放插件JQ-Slide
万圣节快乐!!!
向上弹出菜单jQuery插件
htm5视差动画
jquery将列表倒转顺序
推荐一个jQuery分页插件
jquery animate
- swift objc_setAssociatedObject block(version1.2 xcode6.4)
啸笑天
version
import UIKit
class LSObjectWrapper: NSObject {
let value: ((barButton: UIButton?) -> Void)?
init(value: (barButton: UIButton?) -> Void) {
self.value = value
- Aegis 默认的 Xfire 绑定方式,将 XML 映射为 POJO
MagicMa_007
javaPOJOxmlAegisxfire
Aegis 是一个默认的 Xfire 绑定方式,它将 XML 映射为 POJO, 支持代码先行的开发.你开发服 务类与 POJO,它为你生成 XML schema/wsdl
XML 和 注解映射概览
默认情况下,你的 POJO 类被是基于他们的名字与命名空间被序列化。如果
- js get max value in (json) Array
qiaolevip
每天进步一点点学习永无止境max纵观千象
// Max value in Array
var arr = [1,2,3,5,3,2];Math.max.apply(null, arr); // 5
// Max value in Jaon Array
var arr = [{"x":"8/11/2009","y":0.026572007},{"x"
- XMLhttpRequest 请求 XML,JSON ,POJO 数据
Luob.
POJOjsonAjaxxmlXMLhttpREquest
在使用XMlhttpRequest对象发送请求和响应之前,必须首先使用javaScript对象创建一个XMLHttpRquest对象。
var xmlhttp;
function getXMLHttpRequest(){
if(window.ActiveXObject){
xmlhttp:new ActiveXObject("Microsoft.XMLHTTP
- jquery
wuai
jquery
以下防止文档在完全加载之前运行Jquery代码,否则会出现试图隐藏一个不存在的元素、获得未完全加载的图像的大小 等等
$(document).ready(function(){
jquery代码;
});
<script type="text/javascript" src="c:/scripts/jquery-1.4.2.min.js&quo