- mysql和neo4j组合使用_Neo4j学习
大禹昆仑
mysql和neo4j组合使用
NEO4J基本命令1.CREATECREATE(NODE_NAME:LABEL_NAME>,{PROPERTY1:VALUE1,PROPERTY2:VALUE2,})示例create(person:zhanglisheng,{age:43,height:174})注意点:当属性值是字符串时候,必须加单引号或双引号,否则报错invalidliteralnumber(line1,column44(of
- 【推荐算法课程二】推荐算法介绍-深度学习算法
盒子6910
运维视角下的广告业务算法推荐算法深度学习运维开发运维人工智能
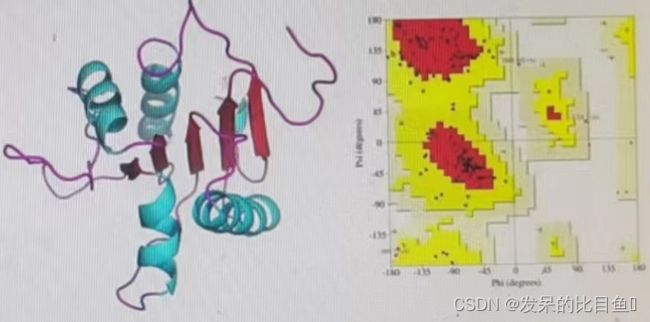
三、深度学习在推荐系统中的应用3.1深度学习推荐模型的演化关系图3.2AutoRec——单隐层神经网络推荐模型3.2.1AutoRec模型的基本原理AutoRec模型是一个标准的自编码器,它的基本原理是利用协同过滤中的共现矩阵,完成物品向量或者用户向量的自编码。再利用自编码的结果得到用户对物品的预估评分,进而进行推荐排序。什么是自编码器?自编码器是指能够完成数据“自编码”的模型。无论是图像、音频,
- 【AI智能推荐系统】第二篇:深度学习在推荐系统中的架构设计与优化实践
DeepFaye
人工智能深度学习
第二篇:深度学习在推荐系统中的架构设计与优化实践提示语:“从Wide&Deep到Transformer,深度推荐模型如何突破性能瓶颈?本文将揭秘Netflix、淘宝都在用的深度学习推荐架构,手把手教你设计高精度推荐系统!”目录深度学习推荐系统的核心优势主流深度学习推荐架构解析2.1Wide&Deep模型2.2DeepFM与xDeepFM2.3神经协同过滤(NCF)2.4基于Transformer的
- Python设置国内镜像教程
wh3933
python开发语言
####引言Python是一种广泛使用的高级编程语言,用于各种编程任务,从简单的脚本到复杂的机器学习算法。在安装Python包时,通常需要从Python包索引(PyPI)下载。由于网络原因,直接从PyPI下载可能速度较慢,因此,使用国内的镜像源可以显著提高下载速度。本文将详细介绍如何在Python中设置国内镜像。####文章目的本篇文章旨在指导用户如何将Python的包管理工具`pip`的默认源切
- Java+Python智能化云盘【Day3】
关沐吖
Java+PythonAi智能云盘项目开发专栏javapython开发语言
提示词工程Prompt简介:大模型必备Prompt提示词工程讲解什么是PromptEngineering提示词工程通过特定格式的文本输入引导AI模型生成期望输出的技术,明确地告诉模型你想要解决的问题或完成的任务也是大语言模型理解用户需求并生成相关、准确回答或内容的基础类比:给Java程序员的任务需求文档(越清晰明确,结果越符合预期)为什么需要学习?大模型就是你的员工,你可以有多个助手,OpenAI
- css3:css的3种引入方式
ksw000
csscss3html
css基本知识你好!这是你第一次使用css所需要了解的知识点。如果你想学习如何使用css,可以仔细阅读这篇文章,了解一下css的基本语法知识。CSS的引入方式共有三种:行内样式、内部样式表、外部样式表。一、行内样式使用style属性引入CSS样式。示例:style属性的应用直接在HTML标签中设置的样式实际在写页面时不提倡使用,在测试的时候可以使用。行内样式LeapingAboveTheWater
- 基于uniapp小程序的诗词学习系统附带文章源码部署视频讲解等
文章目录前言详细视频演示具体实现截图核心技术介绍小程序框架Uniapp前端框架Vue持久层框架MyBaits为什么选择我代码参考数据库参考测试用例参考源码获取前言博主介绍:✌CSDN特邀作者、资深全栈开发程序员,曾在互联网大厂担任高级职位、码云/掘金/华为云/阿里云/InfoQ/StackOverflow/github等平台优质作者、专注于Java、小程序、前端、python等技术领域毕业项目实战
- 鸿蒙设备开发OpenHarmony深度解读之设备认证:HiChain机制部分源码解析1(推荐模块之外)
往期推文全新看点(文中附带最新·鸿蒙全栈学习笔记)鸿蒙(HarmonyOS)北向开发知识点记录~鸿蒙(OpenHarmony)南向开发保姆级知识点汇总~鸿蒙应用开发与鸿蒙系统开发哪个更有前景?嵌入式开发适不适合做鸿蒙南向开发?看完这篇你就了解了~对于大前端开发来说,转鸿蒙开发究竟是福还是祸?鸿蒙岗位需求突增!移动端、PC端、IoT到底该怎么选?记录一场鸿蒙开发岗位面试经历~持续更新中……一、概述H
- 计算机毕业设计之springboot书法字典小程序的设计与实现
2301_77990509
课程设计springboot小程序
本项目旨在设计与实现一个基于SpringBoot的书法字典小程序,通过整合现代互联网技术与传统书法艺术,为用户提供一个便捷的书法字典查询平台。该小程序主要功能包括书法字的查询、学习资料、字帖的存储及分享等。首先,项目采用SpringBoot框架进行后端开发,利用其简化的配置和强大的模块支持,提高开发效率。为了实现高效的数据存储与查询,系统使用了MySQL数据库,存储书法字的基本信息、释义及相关图片
- NestJS 系列教程(一):认识 NestJS 与项目初始化
onebyte8bits
nestjs后端javascript前端框架node.js
NestJS系列教程(一):认识NestJS与项目初始化✨前言NestJS是一个用于构建高效、可扩展Node.js服务端应用程序的框架。它使用TypeScript构建,结合了面向对象编程(OOP)、函数式编程(FP)和函数响应式编程(FRP)等概念,非常适合用于构建微服务、RESTfulAPI等现代服务端应用。本系列教程将以NestJS官方中文文档为蓝本,逐章精讲配套代码,带你系统学习这一现代No
- 嵌入式入门学习——5了解寄存器如何控制单片机
星火嵌入式
嵌入式入门学习单片机
0系列文章入口嵌入式入门学习——0快速入门,Let‘sDoIt!1.内容简介武侠的内功和招式之间的关系类似于编程中的技术和计算原理之间的关系。招式是千变万化的,而内功心法则稳定而深厚。内功心法的深度决定了可以学习的招式变术的上限高度。单片机的控制最终是要落实到寄存器上的。使用库函数或者使用高级语言是招式,了解单片机的寄存器则是内功。2.引言练习武功讲究内外兼修,一味学习技巧,而忽略本质的结果就是一
- (阳:算法霸权 / 阴:数据确权)→当GDPR类法规覆盖53%经济体量时,催生出隐私计算新范式
百态老人
人工智能机器学习深度学习算法
当GDPR类法规覆盖53%经济体量时,隐私计算新范式的兴起可归因于以下多维度因素的相互作用:一、算法霸权与数据确权的矛盾激化算法霸权的危害大型科技公司通过算法歧视、大数据杀熟等手段形成垄断优势,利用数据优势操控用户行为,导致消费者权益受损。这种"算法黑箱"不仅加剧市场不公平,还阻碍数据要素的自由流动。例如,算法框架的底层逻辑掌握在少数企业手中,产生"数据黑箱"问题。数据确权的立法需求数据权属不明确
- ElasticSearch中的分片是什么?
java1234_小锋
javaelasticsearch大数据搜索引擎
大家好,我是锋哥。今天分享关于【ElasticSearch中的分片是什么?】面试题。希望对大家有帮助;ElasticSearch中的分片是什么?超硬核AI学习资料,现在永久免费了!在Elasticsearch中,分片(Shard)是将数据拆分成更小的部分,允许在分布式环境中并行处理和存储数据的机制。它是Elasticsearch在水平扩展时用于管理大量数据的关键概念。主要概念:主分片(Primar
- 机器学习宝典——第6章
爱看烟花的码农
机器学习人工智能
第6章:聚类算法(Clustering)你好,同学!欢迎来到无监督学习的世界。与监督学习不同,这里的我们没有“标准答案”(标签),我们的目标是在数据中发现隐藏的、内在的结构。聚类算法就是实现这一目标的核心工具,它试图将数据集中的样本划分为若干个不相交的子集,我们称之为“簇”(cluster)。本章我们将深入探讨三种最具代表性的聚类算法:K-均值(K-Means)、层次聚类(Hierarchical
- 【深度学习】神经网络剪枝方法的分类
烟锁池塘柳0
机器学习与深度学习深度学习神经网络剪枝
神经网络剪枝方法的分类摘要随着深度学习模型,特别是大语言模型(LLM)的参数量爆炸式增长,模型的部署和推理成本变得异常高昂。如何在保持模型性能的同时,降低其计算和存储需求,成为了工业界和学术界的核心议题。神经网络剪枝(Pruning)作为模型压缩的关键技术之一,应运而生。本文将解析剪枝技术的不同分类,深入探讨其原理、优缺点。文章目录神经网络剪枝方法的分类摘要1为什么我们需要剪枝?2分类方法一:剪什
- Python 图像分类入门
超龄超能程序猿
机器学习python分类开发语言
一、介绍图像分类作为深度学习的基础任务,旨在将输入图像划分到预定义的类别集合中。在实际的业务中,图像分类技术是比较常用的一种技术技能。例如,在安防监控中,可通过图像分类识别异常行为;在智能交通系统中,实现对交通标志和车辆类型的快速识别等。本文将通过安装包已有数据带你逐步了解使用Python进行图像分类的全过程。二、环境搭建在开始图像分类项目前,需要确保Python环境中安装了必要的库。主要包括:T
- 初始CNN(卷积神经网络)
超龄超能程序猿
机器学习cnn人工智能神经网络
卷积神经网络(ConvolutionalNeuralNetwork,简称CNN)作为深度学习的重要分支,在图像识别、目标检测、语义分割等领域大放异彩。无论是手机上的人脸识别解锁,还是自动驾驶汽车对道路和行人的识别,背后都离不开CNN的强大能力一、CNN诞生的背景与意义在CNN出现之前,传统的图像识别方法主要依赖人工提取特征,例如使用SIFT(尺度不变特征变换)、HOG(方向梯度直方图)等算法。这些
- 结构型智能科技的关键可行性——信息型智能向结构型智能的转变(修改提纲)
刘海东刘海东
人工智能机器学习算法
结构型智能科技的关键可行性——信息型智能向结构型智能的转变1.信息型智能科技概述1.1传统计算机科技的信息型继承者1.2信息型智能环境1.3信息型智能主体1.4机器学习创造的智能1.5信息型智能科技的缺陷2.结构型智能科技概述2.1传统计算机科技向生命结构的发展2.2结构型智能科技的环境2.3结构型智能科技创造的机器生命2.4结构型智能科技的科学性3.结构型智能科技的关键可行性——信息型智能向结构
- 深度学习实验:GPU加速,突破性能瓶颈
AI天才研究院
AgenticAI实战计算AI人工智能与大数据计算科学神经计算深度学习神经网络大数据人工智能大型语言模型AIAGILLMJavaPython架构设计AgentRPA
深度学习实验:GPU加速,突破性能瓶颈1.背景介绍随着深度学习模型变得越来越复杂和庞大,传统的CPU已经无法满足训练和推理的计算需求。GPU凭借其强大的并行计算能力和专门为矩阵运算优化的架构,成为了深度学习领域的核心加速器。本文将探讨如何利用GPU加速深度学习实验,突破性能瓶颈,提高模型训练和推理的效率。2.核心概念与联系2.1GPU架构GPU(图形处理器)最初是为了加速图形渲染而设计的,但由于其
- 匿名科创无人机学习心得
heng6868
嵌入式项目物联网网络iot
*1.*飞控stm32串口5连接imu,串口五发送的指令会发送到imu中,如果是自定义的用户格式帧(比如:AAFFF103010101A067)会先到imu,imu的串口1接stm飞控。串口2接数传,从串口1接收到的数据会通过串口二发送给数传,数传传给另一个数传,在通过USB线传输给上位机。但是如果不是属于用户自定义的格式帧,imu会进行处理,比如飞控串口5一上电就会输出电池信息(如:AAFF0D
- 深度学习相关指标工作笔记
Victor Zhong
AI框架深度学习笔记人工智能
这里写目录标题检测指标iou/Gou/Diou/CiouMSE(MeanSquaredError)(均方误差)(回归问题)交叉熵损失函数(CrossEntropyErrorFunction)(分类问题)检测指标iou/Gou/Diou/CiouIntersectionoverUnion(IoU)是目标检测里一种重要的评价值交并比令人遗憾的是IoU无法优化无重叠的bboxes如果用IoU作为loss
- 解析大数据领域结构化数据的管理模式
大数据洞察
大数据ai
解码结构化数据:大数据时代的高效管理模式与实践指南关键词结构化数据、大数据管理、数据建模、分布式数据库、数据仓库、数据治理、性能优化摘要在大数据的洪流中,结构化数据犹如隐藏在波涛之下的磐石,虽然不如非结构化数据那般引人注目,却是企业决策的基石。本文深入剖析了大数据环境下结构化数据的管理模式,从传统关系型数据库到现代分布式系统,从数据建模到存储架构,全面解读了结构化数据管理的核心技术与实践方法。通过
- 介绍electron
几道之旅
electronjavascript前端
一、Electron是什么?Electron是一个基于Chromium和Node.js的框架,允许开发者使用前端技术(HTML/CSS/JavaScript)构建原生桌面应用。其核心优势在于:跨平台:一次开发,生成Windows、macOS、Linux三端应用;技术栈统一:前端开发者无需学习新语言,直接复用Web生态(如Vue/React);混合架构:Chromium:负责渲染界面,支持现代CSS
- LK32T102学习-0
和风化雨
嵌入式系统LK32T单片机嵌入式硬件
工程建立步骤:建立一个文件夹,文件夹的名称就是任务名称,如XX将test1-gpio文件夹中的内容全部拷贝到XX通过uVision(或直接点击XX文件夹下的*.uvprojx)打开工程打开工程文件夹下的main.c文件修改main函数,其余不动main函数结构intmain(){ Device_Init();//不要动 //添加你的其他初始化代码 while(1){//工作循环//添加
- LK32T102学习2-GPIO
GPIO即可编程输入输出口,LK32T102有3组GPIO口,每组最多32条口线。GPIO口线可以实现很多的功能,可以说掌握了GPIO功能也就MCU编程也就基本实现了MCU的入门。GPIO功能使用要注意LTK320T的管脚是多功能的,可作为数字量管脚,也可以作为模拟量管脚。输入模式浮空输入模式输入完全由外部输入决定PU,PD都不导通上拉输入模式IO悬空时输入为高电平PU导通,PD不导通下拉输入模式
- 【计算机三级】网路技术学习笔记 第二章 中小型网络系统总体规划与设计
努力的小刘@
计算机等级考试网络计算机网络网络协议
计算机三级网络技术二、中小型网络系统总体规划与设计考点(一):网络总体设计基本方法1.核心层网络结构设计整个网络系统的主干部分是核心层网络,是设计与建设的重点,目前应用于核心层网络的技术标准主意要是GE/10GE,核心设备是高性能路由器,连接核心路由器的是具有冗余链路的光纤,整个网络流量的40%-60%都需要有核心层网络来承载直接接入核心路由器采取链路冗余的办法,直接连接两台核心路由器,其特点是直
- STM32开发方式及基本介绍
相关推荐STM32新建一个工程STM32的开发有三种方式1.寄存器版本2.库函数版本3.HAL库版本一、库函数开发与寄存器开发的关系很多人都是从学51单片机转而想进一步学习STM32,他们习惯了51单片机的寄存器开发方式,ST官方库摆在面前会不知道从何下手。其实简单来说,固件库就是函数的集合,固件库函数的作用是向下负责与寄存器直接打交道,向上提供用户函数调用的接口。举一个例子来解释STM32固件库
- 线性代数在图像处理中的应用 --- 纳尼? 2D的高斯核可以通过1D的高斯核直接生成?(秩为1的矩阵)
松下J27
LinearAlgebra线性代数图像处理人工智能
二维高斯核,Rank秩等于一的矩阵之前,我在学习图像处理的时候,会经常用到Gaussianblur,也就是二维高斯低通滤波。当时用的都是Matlab中,现成的图像处理库。只需要输入sigma和kernelsize这些参数就行了,完全不需要考虑高斯核中的每个点长啥样。虽然教科书里面也会有一些配图,例如:直到后来,我学习高斯图像金字塔的时候发现,在别人的代码里面,他在生成二维高斯核的时候,并不是直接写
- 【深度学习新浪潮】基于扩散模型的图像编辑加速方法
小米玄戒Andrew
深度学习新浪潮深度学习人工智能扩散模型TransformerDiT图像编辑模型加速
在基于扩散模型的图像编辑任务中,实现高质量与高效加速的平衡需要综合运用模型架构优化、采样策略创新、条件控制增强及硬件加速等多维度技术。一、一步反演与掩码引导的编辑框架通过一步反演框架将输入图像映射到可编辑的潜在空间,结合掩码引导的注意力重缩放机制,实现文本引导的局部编辑。例如,SwiftEdit通过一步反演和注意力重缩放,将编辑时间压缩至0.23秒,比传统多步方法快50倍。具体步骤包括:一步反演:
- spring-ai-alibaba 1.0.0.2 学习(十二)——聊天记忆扩展包
学习spring-ai时提到过,spring-ai除了内置的InMemoryChatMemoryRepository,还提供jdbc、cassandra、neo4j三个扩展包。而spring-ai-alibaba则提供了jdbc、redis、elasticsearch三个扩展包。两者都提供了jdbc扩展包,有什么区别呢?spring-aijdbc和spring-ai-alibabajdbc对比sp
- Java开发中,spring mvc 的线程怎么调用?
小麦麦子
springmvc
今天逛知乎,看到最近很多人都在问spring mvc 的线程http://www.maiziedu.com/course/java/ 的启动问题,觉得挺有意思的,那哥们儿问的也听仔细,下面的回答也很详尽,分享出来,希望遇对遇到类似问题的Java开发程序猿有所帮助。
问题:
在用spring mvc架构的网站上,设一线程在虚拟机启动时运行,线程里有一全局
- maven依赖范围
bitcarter
maven
1.test 测试的时候才会依赖,编译和打包不依赖,如junit不被打包
2.compile 只有编译和打包时才会依赖
3.provided 编译和测试的时候依赖,打包不依赖,如:tomcat的一些公用jar包
4.runtime 运行时依赖,编译不依赖
5.默认compile
依赖范围compile是支持传递的,test不支持传递
1.传递的意思是项目A,引用
- Jaxb org.xml.sax.saxparseexception : premature end of file
darrenzhu
xmlprematureJAXB
如果在使用JAXB把xml文件unmarshal成vo(XSD自动生成的vo)时碰到如下错误:
org.xml.sax.saxparseexception : premature end of file
很有可能时你直接读取文件为inputstream,然后将inputstream作为构建unmarshal需要的source参数。InputSource inputSource = new In
- CSS Specificity
周凡杨
html权重Specificitycss
有时候对于页面元素设置了样式,可为什么页面的显示没有匹配上呢? because specificity
CSS 的选择符是有权重的,当不同的选择符的样式设置有冲突时,浏览器会采用权重高的选择符设置的样式。
规则:
HTML标签的权重是1
Class 的权重是10
Id 的权重是100
- java与servlet
g21121
servlet
servlet 搞java web开发的人一定不会陌生,而且大家还会时常用到它。
下面是java官方网站上对servlet的介绍: java官网对于servlet的解释 写道
Java Servlet Technology Overview Servlets are the Java platform technology of choice for extending and enha
- eclipse中安装maven插件
510888780
eclipsemaven
1.首先去官网下载 Maven:
http://www.apache.org/dyn/closer.cgi/maven/binaries/apache-maven-3.2.3-bin.tar.gz
下载完成之后将其解压,
我将解压后的文件夹:apache-maven-3.2.3,
并将它放在 D:\tools目录下,
即 maven 最终的路径是:D:\tools\apache-mave
- jpa@OneToOne关联关系
布衣凌宇
jpa
Nruser里的pruserid关联到Pruser的主键id,实现对一个表的增删改,另一个表的数据随之增删改。
Nruser实体类
//*****************************************************************
@Entity
@Table(name="nruser")
@DynamicInsert @Dynam
- 我的spring学习笔记11-Spring中关于声明式事务的配置
aijuans
spring事务配置
这两天学到事务管理这一块,结合到之前的terasoluna框架,觉得书本上讲的还是简单阿。我就把我从书本上学到的再结合实际的项目以及网上看到的一些内容,对声明式事务管理做个整理吧。我看得Spring in Action第二版中只提到了用TransactionProxyFactoryBean和<tx:advice/>,定义注释驱动这三种,我承认后两种的内容很好,很强大。但是实际的项目当中
- java 动态代理简单实现
antlove
javahandlerproxydynamicservice
dynamicproxy.service.HelloService
package dynamicproxy.service;
public interface HelloService {
public void sayHello();
}
dynamicproxy.service.impl.HelloServiceImpl
package dynamicp
- JDBC连接数据库
百合不是茶
JDBC编程JAVA操作oracle数据库
如果我们要想连接oracle公司的数据库,就要首先下载oralce公司的驱动程序,将这个驱动程序的jar包导入到我们工程中;
JDBC链接数据库的代码和固定写法;
1,加载oracle数据库的驱动;
&nb
- 单例模式中的多线程分析
bijian1013
javathread多线程java多线程
谈到单例模式,我们立马会想到饿汉式和懒汉式加载,所谓饿汉式就是在创建类时就创建好了实例,懒汉式在获取实例时才去创建实例,即延迟加载。
饿汉式:
package com.bijian.study;
public class Singleton {
private Singleton() {
}
// 注意这是private 只供内部调用
private static
- javascript读取和修改原型特别需要注意原型的读写不具有对等性
bijian1013
JavaScriptprototype
对于从原型对象继承而来的成员,其读和写具有内在的不对等性。比如有一个对象A,假设它的原型对象是B,B的原型对象是null。如果我们需要读取A对象的name属性值,那么JS会优先在A中查找,如果找到了name属性那么就返回;如果A中没有name属性,那么就到原型B中查找name,如果找到了就返回;如果原型B中也没有
- 【持久化框架MyBatis3六】MyBatis3集成第三方DataSource
bit1129
dataSource
MyBatis内置了数据源的支持,如:
<environments default="development">
<environment id="development">
<transactionManager type="JDBC" />
<data
- 我程序中用到的urldecode和base64decode,MD5
bitcarter
cMD5base64decodeurldecode
这里是base64decode和urldecode,Md5在附件中。因为我是在后台所以需要解码:
string Base64Decode(const char* Data,int DataByte,int& OutByte)
{
//解码表
const char DecodeTable[] =
{
0, 0, 0, 0, 0, 0
- 腾讯资深运维专家周小军:QQ与微信架构的惊天秘密
ronin47
社交领域一直是互联网创业的大热门,从PC到移动端,从OICQ、MSN到QQ。到了移动互联网时代,社交领域应用开始彻底爆发,直奔黄金期。腾讯在过去几年里,社交平台更是火到爆,QQ和微信坐拥几亿的粉丝,QQ空间和朋友圈各种刷屏,写心得,晒照片,秀视频,那么谁来为企鹅保驾护航呢?支撑QQ和微信海量数据背后的架构又有哪些惊天内幕呢?本期大讲堂的内容来自今年2月份ChinaUnix对腾讯社交网络运营服务中心
- java-69-旋转数组的最小元素。把一个数组最开始的若干个元素搬到数组的末尾,我们称之为数组的旋转。输入一个排好序的数组的一个旋转,输出旋转数组的最小元素
bylijinnan
java
public class MinOfShiftedArray {
/**
* Q69 旋转数组的最小元素
* 把一个数组最开始的若干个元素搬到数组的末尾,我们称之为数组的旋转。输入一个排好序的数组的一个旋转,输出旋转数组的最小元素。
* 例如数组{3, 4, 5, 1, 2}为{1, 2, 3, 4, 5}的一个旋转,该数组的最小值为1。
*/
publ
- 看博客,应该是有方向的
Cb123456
反省看博客
看博客,应该是有方向的:
我现在就复习以前的,在补补以前不会的,现在还不会的,同时完善完善项目,也看看别人的博客.
我刚突然想到的:
1.应该看计算机组成原理,数据结构,一些算法,还有关于android,java的。
2.对于我,也快大四了,看一些职业规划的,以及一些学习的经验,看看别人的工作总结的.
为什么要写
- [开源与商业]做开源项目的人生活上一定要朴素,尽量减少对官方和商业体系的依赖
comsci
开源项目
为什么这样说呢? 因为科学和技术的发展有时候需要一个平缓和长期的积累过程,但是行政和商业体系本身充满各种不稳定性和不确定性,如果你希望长期从事某个科研项目,但是却又必须依赖于某种行政和商业体系,那其中的过程必定充满各种风险。。。
所以,为避免这种不确定性风险,我
- 一个 sql优化 ([精华] 一个查询优化的分析调整全过程!很值得一看 )
cwqcwqmax9
sql
见 http://www.itpub.net/forum.php?mod=viewthread&tid=239011
Web翻页优化实例
提交时间: 2004-6-18 15:37:49 回复 发消息
环境:
Linux ve
- Hibernat and Ibatis
dashuaifu
Hibernateibatis
Hibernate VS iBATIS 简介 Hibernate 是当前最流行的O/R mapping框架,当前版本是3.05。它出身于sf.net,现在已经成为Jboss的一部分了 iBATIS 是另外一种优秀的O/R mapping框架,当前版本是2.0。目前属于apache的一个子项目了。 相对Hibernate“O/R”而言,iBATIS 是一种“Sql Mappi
- 备份MYSQL脚本
dcj3sjt126com
mysql
#!/bin/sh
# this shell to backup mysql
#
[email protected] (QQ:1413161683 DuChengJiu)
_dbDir=/var/lib/mysql/
_today=`date +%w`
_bakDir=/usr/backup/$_today
[ ! -d $_bakDir ] && mkdir -p
- iOS第三方开源库的吐槽和备忘
dcj3sjt126com
ios
转自
ibireme的博客 做iOS开发总会接触到一些第三方库,这里整理一下,做一些吐槽。 目前比较活跃的社区仍旧是Github,除此以外也有一些不错的库散落在Google Code、SourceForge等地方。由于Github社区太过主流,这里主要介绍一下Github里面流行的iOS库。 首先整理了一份
Github上排名靠
- html wlwmanifest.xml
eoems
htmlxml
所谓优化wp_head()就是把从wp_head中移除不需要元素,同时也可以加快速度。
步骤:
加入到function.php
remove_action('wp_head', 'wp_generator');
//wp-generator移除wordpress的版本号,本身blog的版本号没什么意义,但是如果让恶意玩家看到,可能会用官网公布的漏洞攻击blog
remov
- 浅谈Java定时器发展
hacksin
java并发timer定时器
java在jdk1.3中推出了定时器类Timer,而后在jdk1.5后由Dou Lea从新开发出了支持多线程的ScheduleThreadPoolExecutor,从后者的表现来看,可以考虑完全替代Timer了。
Timer与ScheduleThreadPoolExecutor对比:
1.
Timer始于jdk1.3,其原理是利用一个TimerTask数组当作队列
- 移动端页面侧边导航滑入效果
ini
jqueryWebhtml5cssjavascirpt
效果体验:http://hovertree.com/texiao/mobile/2.htm可以使用移动设备浏览器查看效果。效果使用到jquery-2.1.4.min.js,该版本的jQuery库是用于支持HTML5的浏览器上,不再兼容IE8以前的浏览器,现在移动端浏览器一般都支持HTML5,所以使用该jQuery没问题。HTML文件代码:
<!DOCTYPE html>
<h
- AspectJ+Javasist记录日志
kane_xie
aspectjjavasist
在项目中碰到这样一个需求,对一个服务类的每一个方法,在方法开始和结束的时候分别记录一条日志,内容包括方法名,参数名+参数值以及方法执行的时间。
@Override
public String get(String key) {
// long start = System.currentTimeMillis();
// System.out.println("Be
- redis学习笔记
MJC410621
redisNoSQL
1)nosql数据库主要由以下特点:非关系型的、分布式的、开源的、水平可扩展的。
1,处理超大量的数据
2,运行在便宜的PC服务器集群上,
3,击碎了性能瓶颈。
1)对数据高并发读写。
2)对海量数据的高效率存储和访问。
3)对数据的高扩展性和高可用性。
redis支持的类型:
Sring 类型
set name lijie
get name lijie
set na
- 使用redis实现分布式锁
qifeifei
在多节点的系统中,如何实现分布式锁机制,其中用redis来实现是很好的方法之一,我们先来看一下jedis包中,有个类名BinaryJedis,它有个方法如下:
public Long setnx(final byte[] key, final byte[] value) {
checkIsInMulti();
client.setnx(key, value);
ret
- BI并非万能,中层业务管理报表要另辟蹊径
张老师的菜
大数据BI商业智能信息化
BI是商业智能的缩写,是可以帮助企业做出明智的业务经营决策的工具,其数据来源于各个业务系统,如ERP、CRM、SCM、进销存、HER、OA等。
BI系统不同于传统的管理信息系统,他号称是一个整体应用的解决方案,是融入管理思想的强大系统:有着系统整体的设计思想,支持对所有
- 安装rvm后出现rvm not a function 或者ruby -v后提示没安装ruby的问题
wudixiaotie
function
1.在~/.bashrc最后加入
[[ -s "$HOME/.rvm/scripts/rvm" ]] && source "$HOME/.rvm/scripts/rvm"
2.重新启动terminal输入:
rvm use ruby-2.2.1 --default
把当前安装的ruby版本设为默