酵母双杂交服务专题(三)
当开始研究某个基因时,除了识别其功能之外,还必须分析它与其他蛋白质或分子的相互作用关系。这是因为基因通常不是孤立发挥作用,而是通过与其他蛋白或分子的互动参与调节下游基因的表达。酵母双杂交技术是检测蛋白质间相互作用的一种标准方法,可根据诱饵蛋白的位置分为核内系统和膜系统两种。在双杂交筛库实验中,如果诱饵蛋白位于细胞核内,通常会选择核内系统的文库;若诱饵蛋白位于细胞膜上,则更倾向于选择膜系统的文库进行研究。
核体系酵母双杂
当拥有一个定位在细胞核或细胞质的目的蛋白,需要筛选可能的互作蛋白时,这个时候我们就需要选择核体系酵母双杂交筛库实验。
一、核体系酵母双杂的原理:
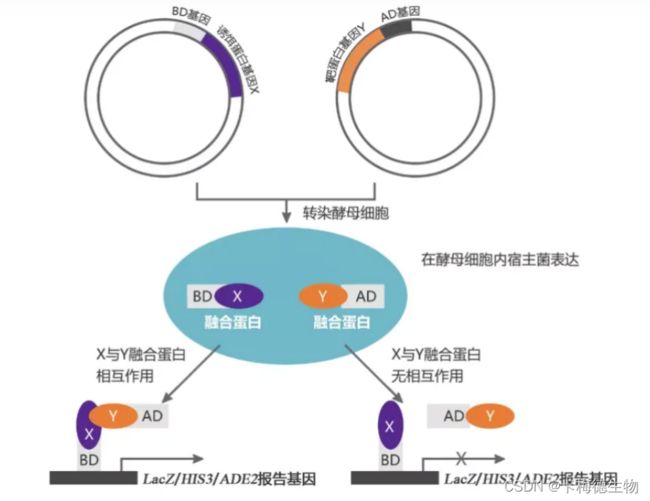
最早由Fields团队在研究GAL4这一酵母转录因子时提出的核蛋白酵母双杂交技术,随着时间的推移,已经演变成一种用于研究蛋白质相互作用的先进工具。这一技术的开发建立在深入理解真核细胞中转录因子,尤其是酵母中GAL4转录因子的特性基础之上。GAL4由两个关键的功能域构成:一个位于N端的DNA结合域(BD),负责识别和结合到GAL4响应基因的上游激活序列(UAS);另一个位于C端的转录激活域(AD),负责启动UAS下游基因的转录。这两个域在分离状态下不能激活转录,但当它们空间上足够接近时,能够表现出完整的GAL4转录因子活性,从而激活UAS下游的启动子,进而促使下游基因的转录和表达。
图1 核体系酵母双杂交原理
二、核体系酵母双杂交筛库常用方法
1、诱饵质粒的初步处理:首先,将诱饵质粒引入MATa型酵母株(例如Y2HGold或AH109),以测试诱饵质粒是否具有自我激活的特性。然后,将诱饵质粒与文库质粒一起转化到相同的酵母菌株中进行筛选。
2、诱饵质粒的另一种处理方法:同样,首先将诱饵质粒转化到MATa型酵母株(如Y2HGold或AH109),并对诱饵质粒进行自激活测试。接着,将处理过的诱饵酵母制备成感受态细胞,随后将文库质粒转入这些酵母细胞中。
3、利用配对筛选:在这个方法中,诱饵质粒首先被转化到MATa型酵母(例如Y2HGold或AH109)并进行自激活测试。接下来,文库质粒被转化到MATα型酵母(如Y187)。之后,这两种不同类型的酵母通过配对(mating)进行筛选实验,以探索蛋白质间的相互作用。
膜体系酵母双杂
当拥有一个定位在细胞膜或细胞质的目的蛋白,需要筛选可能的互作蛋白时,这个时候我们就需要选择膜体系酵母双杂交筛库实验。
泛素是一种含76个aa的converse protein,它经常作为降解信号连接在蛋白质的N端。泛素能被其特异性的蛋白酶(ubiquitin-specific proteases, UBPs)识别并从所连接的蛋白上切割下来,切割位点总是位于泛素蛋白的C端。在酵母细胞中,泛素可以分成两部分单独表达,即其N端部分(NubI, 第1~34位aa)和C端部分(Cub, 第35~76位aa)。
一、膜体系酵母双杂的原理:
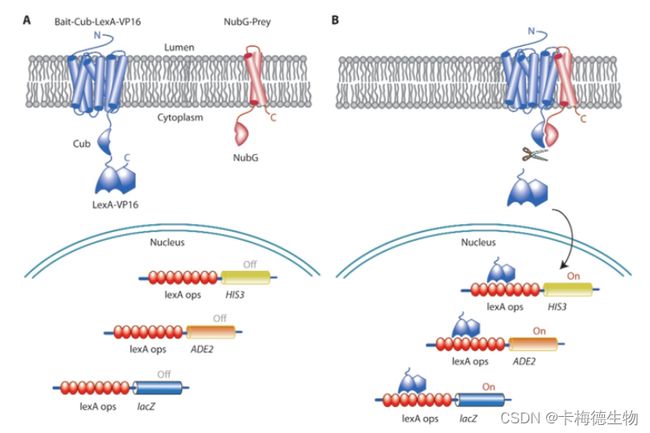
DUALmembrane技术是在经典的酵母双杂交系统基础上发展起来的,它巧妙地应用了分裂的泛素系统(split-ubiquitin)来进行蛋白质间相互作用的筛选。泛素,作为一个降解信号分子,被人为分割为两个部分:N端泛素(Nub)和C端泛素(Cub)。当这两部分泛素重组形成完整的泛素分子时,它可以被泛素专一性蛋白酶(UBPs)识别,触发与泛素连接的蛋白质的降解。
在膜蛋白酵母双杂交系统中,两个待测蛋白分别与突变后的分离泛素N端(NubG,即Nub的某一位亮氨酸被甘氨酸替换)和C端(Cub)融合。如果这两个待测蛋白存在相互作用,它们会使分裂的泛素N端和C端相互靠近,被泛素专一性蛋白酶识别,导致与之相连的报告蛋白(如转录激活因子或酶)被释放,从而确定蛋白质间的相互作用。这种基于split-ubiquitin的膜蛋白酵母双杂交系统不依赖于传统的核内转录激活机制,因而可以广泛应用于研究细胞膜和细胞质内蛋白质间的相互作用。
图2 膜体系酵母双杂交原理
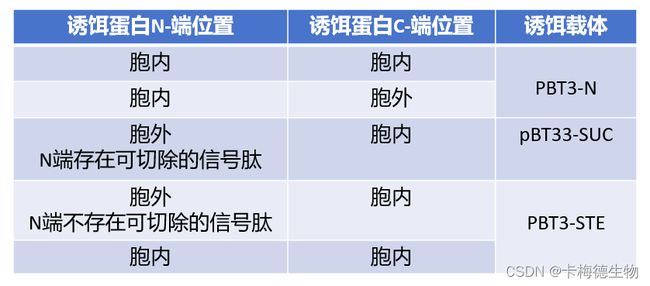
二、诱饵载体选择方法:
在进行膜蛋白酵母双杂交实验时,根据诱饵蛋白的定位差异,需采用特定的载体。这是为了确保诱饵蛋白与其互作蛋白所连接的泛素NubG和Cub-LexA-VP16能够有效相互作用,并被泛素特异性蛋白酶(UBPs)准确识别和切割,进而触发报告基因的表达。诱饵蛋白的结构特性决定了选择何种类型的诱饵载体。
备注:在诱饵蛋白的N端和C端均位于细胞外的情况下,可以通过截短手段使C端位于细胞内部,并据此选择合适的载体进行实验。
图3 诱饵载体选择方法
核/膜体系酵母双杂的异同
在核体系酵母双杂交实验中,一个关键的步骤是检查诱饵基因是否存在自激活现象,特别是当BD(DNA结合域)基因本身是一个转录因子的情况下。因此,在完成诱饵载体的构建之后,首要任务是进行诱饵基因的自激活测试。
另一方面,膜体系酵母双杂交实验中的情况有所不同。由于诱饵蛋白质定位于细胞质膜上,当没有相互作用蛋白接近时,泛素的两个部分是分离的,这意味着转录因子不会被裂解,从而不会触发报告基因的表达。在这种情况下,由于诱饵蛋白在细胞膜上的定位方式有所不同,构建BD载体时所选择的质粒也有所区别。因此,在BD载体构建完成后,首先需要进行的是功能性验证,即检验所构建的BD质粒是否适合该系统的要求。
卡梅德生物(KMD Bioscience)(https://www.kmdbioscience.cn/) 可提供酵母杂交文库构建、核酵母双杂交筛选、膜酵母双杂交筛选及酵母单/双杂交验证服务。
以下是文章解读的案例分析:
案例
膜体系酵母双杂交:
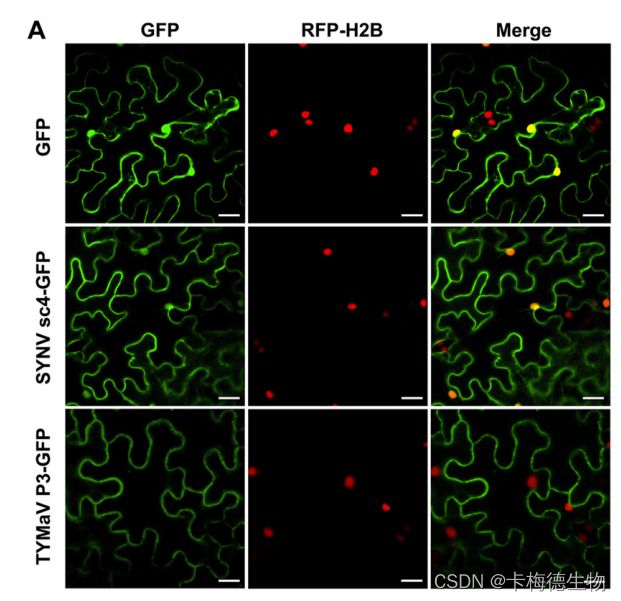
在这项研究中,作者采用了分裂泛素膜蛋白酵母双杂交技术来探索两种蛋白之间的相互作用。研究的一部分涉及了对SYNV和TYMaV蛋白在亚细胞水平上的定位分析。如图所示,SYNV sc4-GFP和TYMaV P3-GFP主要集中在质膜上,而SYNV sc4-GFP还在少量出现在细胞核内。
基于这些蛋白的亚细胞定位结果,研究者决定利用分裂泛素膜酵母双杂交技术来检验SYNV和TYMaV蛋白是否与其他蛋白(如N蛋白或P蛋白)存在相互作用,具体结果如下:
Fig.1 Analyses of rhabdovirus MP-nucleocapsid core proteins interactions by split-ubiquitin membrane yeast two-hybrid (MYTH) assays. (A to D) The bait constructs contain the Cub fusions to either SYNV sc4 (A and C) or TYMaV P3 (B and D), and the prey constructs encode the N (A and B) and P (C and D) proteins of SYNV, RSMV, or TYMaV fused to the N terminus (N-NubG) or C terminus (NubG-N) of NubG. Yeast cells were cotransformed with the bait and prey plasmids. Transformants were spotted as 10-fold serial dilutions (top) on synthetic dropout medium lacking leucine and tryptophan (SD-LW) to confirm the presence of both plasmids. Medium lacking leucine, tryptophan, histidine and adenine (SD-LWHA) was used to screen for positive interactions.【Specificity of Plant Rhabdovirus Cell-to-Cell Movement. DOI:10.1128/jvi.00296-19】
在这项研究中,研究者针对与膜相关的SYNV sc4和TYMaV P3蛋白进行了实验,将这两种蛋白与泛素(Cub)和人工转录因子LexA-VP16的C端进行了融合。同时,SYNV、TYMaV和RSMV的N蛋白被融合到了经突变的泛素N端(NubG),要么连接在N端(形成X-NubG结构),要么连接在C端(形成NubG-X结构)。通过这一实验设置,研究者观察到SYNV sc4与SYNV的N蛋白之间存在特异性的相互作用,但它并未与TYMaV和RSMV的N蛋白发生相互作用(如图A所示)。同理,TYMaV P3蛋白仅与其同源的TYMaV N蛋白相互作用(如图B所示)。
进一步地,SYNV、TYMaV和RSMV的P蛋白也以类似方式融合到NubG上。在MYTH实验中发现,SYNV sc4特异性地与其同源的P蛋白发生相互作用,而不与非同源的P蛋白互动(如图C所示)。此外,TYMaV P3与其同源的P蛋白之间的互作被确认,尽管TYMaV P3与RSMV P蛋白之间的互作相对较弱(如图D所示)。
核体系酵母双杂交:
光是光合作用的关键因素,但光照强度超出生物同化能力时可能会对生物造成伤害。为了应对这种情况,光合生物发展了一套被统称为非光化学猝灭2的防护机制,以最小化潜在的光损伤。其中,一种称为qE猝灭的非光化学猝灭机制能在高光环境下迅速激活,将过剩能量以热量形式释放。在绿藻莱茵衣藻3中,采光复合应激相关蛋白1和3(即LHCSR1和LHCSR3)是介导qE猝灭的关键元素。特别地,LHCSR3的激活需要蓝光光感受器(PHOT)的参与,尽管PHOT和LHCSR3之间的确切信号转导路径尚未明确。
在这项研究中,发现了两个与qE淬火过程相关的光抑制基因,即去黄化1(det1)和受损的DNA结合1(ddb1)。利用酵母双杂交技术的分析揭示了这两个遗传因子是包含CULLIN 4(CUL4)的蛋白质复合体的组成部分。这些发现表明,被假定为E3泛素连接酶的CUL4-DDB1 DET1复合体在单细胞光合生物中起着光保护作用,并可能在介导LHCSR1和LHCSR3基因表达的蓝光信号传导中发挥重要角色。
将每个编码序列融合到GAL4结合域或GAL4激活域,并将这对编码序列引入酵母宿主细胞,以确定GAL4转录活性是否由两个编码序列的物理相互作用诱导。在选择性介质(−His)上转化和生长后,检测到CrCUL4和CrDDB1之间以及CrDDB1和CrDET1之间的强相互作用,但CrCUL4和CrDET1之间没有相互作用,表明CrDDB1和CrDET1参与了LHCSR1/3作为CRL4DET1的调控。
Fig. 1 Yeast two-hybrid assay, neddylation inhibitor assay and schematic model. (A)Yeast cells co-expressing the indicated combinations of constructs were grown on non-selective (+His) or selective (–His) media. Yeast growth on the selective media indicated protein–protein interactions. The empty activation domain (AD) vector (vector) was used as a negative control. Fivefold, serially diluted cell cultures were inoculated on each spot as indicated by the triangle widths. A representative data set of an experiment replicated three times on different biological samples is shown. BD, binding domain. (B)Effect of the neddylation inhibitor MLN4924 on the expression of LHCSR1 and LHCSR3. (C)Schematic model for HL induction of LHCSR1, LHCSR3.1/3.2 and PSBS via the CUL4–DDB1DET1 putative E3 ligase complex (CRL4DET1). U, ubiquitin; X and Y, unknown targets of CRL4DET1 possibly with the help of COP1–SPA. See the main text for discussion.【Genetic and physiological responses to light quality in a deep ocean ecotype of Ostreococcus, an ecologically important photosynthetic picoeukaryote.DOI:10.1093/jxb/erad347】
核体系酵母双杂交:
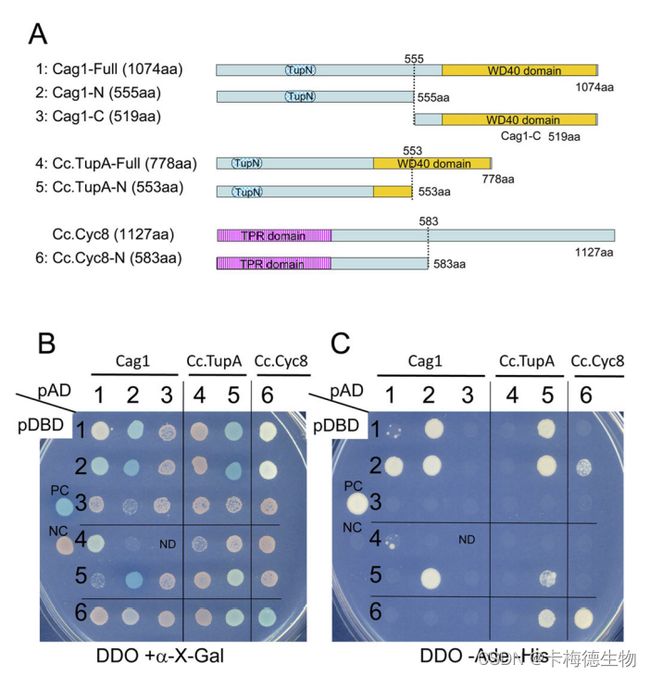
在研究中,发现Cag1基因编码酿酒酵母Tup1的同源物。C. cinerea基因组包含另一个Tup1同源基因被称为Cc.tupA。Cag1 和 Cc.TupA 的互作标记表明,这两个 Tup1的同源物在细胞核中共定位。并且在酿酒酵母中的Tup1p通过Tup_N结构域与自身相互作用是已经证明的事实。Cag1和Cc.Tup1 都具有 Tup_N 结构域,这促使作者研究Cag1 是否与 Cc.TupA具有互作。使用酵母双杂交(Y2H)分析,研究使用六种融合蛋白检测了Cag1、Cc.TupA和Cc.Cyc8的N-末端区域之间的相互作用:
Fig. 1 Yeast two-hybrid assays of Cag1, Cc.TupA and Cc.Cyc8. (A) Strain Y2HGold was transformed with constructs encoding fusion proteins of the DNA-binding domain (BD) of GAL4 with the six proteins indicated. Strain Y187 was also transformed with constructs encoding fusion proteins of the activation domain (AD) of GAL4 with the six proteins indicated. (B,C) Transformed strains were mated with each other, and the resulting diploids were selected on SD/-Trp/-Leu (DDO) medium before spotting onto DDO/+α-X-Gal and DDO/-Ade/-His to assess activation of the MEL1 reporter (B) or the ADE2 and HIS3 reporters (C). ND indicates no growth of mated cells.【The Coprinopsis cinerea Tup1 homologue Cag1 is required for gill formation during fruiting body morphogenesis.DOI:10.1242/bio.021246】
Y2H结果表明:Cag1的N端区域和 Cc.UpA的N端区域C可以独立于融合结构域自组装。此外,Cag1的N末端区域(图中的2)与Cc.TupA的N末端区强烈相互作用(图中的5)独立于融合结构域。根据Y2H测定结果的强相互作用表明,Cag1和Cc.TupA可能相互作用,在表现出共定位的特定细胞中发挥其功能。正如预期的那样,Cc.Cc8的N末端区域(图中的6)可以与Cag1的N末端区(图中2)或Cc.TupA(图中5)相互作用,尽管相互作用受到融合结构域的影响。这些结果表明,Cc.Cyc8与Cag1或Cc.TupA相互作用,在灰葡萄球菌细胞中形成复合物,如在酿酒酵母中发现的那样。酵母双杂交分析表明,Cag1在某些细胞的细胞核中与Cc.tup相互作用。
这篇文章可供科研爱好者参考。它不能代替需要更详细和专业信息的专业知识或实践实验程序。如果有任何内容侵权,请联系作者立即删除有争议的材料。