Nature Commun|ATAC-seq探究复发性小儿B系急性淋巴细胞白血病的染色质可及性图谱
表观基因组学分析是解释非编码基因组功能的重要方法之一。表观基因组学特征作为肿瘤细胞的基本特征,对发病机制、临床行为和治疗具有影响。在所有表观基因组标记中,组蛋白修饰和 DNA 甲基化已得到最广泛的研究,以深入了解表观基因组失调。
染色质可及性是 DNA 调控元件的一个标志,新出现的证据表明它在癌症中发挥着重要作用。使用测序 (ATAC-seq) 检测转座酶可及染色质的方法的出现和优化使得在原发性癌症的全基因组范围内分析染色质可及性成为可能。利用这项技术,最近的一项研究表明,淋巴细胞特异性开放染色质区域预先决定了 ALL 的糖皮质激素耐药性,这表明染色质可及性特征在 B-ALL 耐药和复发中的潜在作用。然而,关于原发性儿童 B-ALL 的染色质可及性概况以及复发期间发生的可及性变化的认知仍然缺乏。
2023年10月25日,国家儿童医学中心/上海儿童医学中心刘宇和沈树红研究团队在 期刊Nature Communications发表题为 Chromatin accessibility landscape of relapsed pediatric B-lineage acute lymphoblastic leukemia 的研究论文,该研究从染色质可及性(accessibility)的角度对复发B-ALL基因组特征进行了分析。
-
研究单位:国家儿童医学中心/上海儿童医学中心
-
发表时间:2023年10月25日
-
发表杂志:Nature Communications(16.6/Q1)
-
研究技术:ATAC-seq、RNA-seq和ChIP-seq等(爱基百客可提供)
01 研究背景
急性淋巴细胞白血病(ALL)是最常见的儿童癌症。B 系急性淋巴细胞白血病 (B-ALL) 约占儿童 ALL 病例的 80%。对大型队列的基因组分析已识别出 20 多种具有不同遗传改变的 B-ALL 亚型,这使得风险分层和精准治疗成为可能。这与其他治疗进展相结合,已将患者生存率提高到 90% 以上。然而,难治性和复发性B-ALL患者的预后较差,5年生存率<50% ,对于大约一半的儿童 B 系急性淋巴细胞白血病 (B-ALL) 患者来说,复发的分子机制仍不清楚。
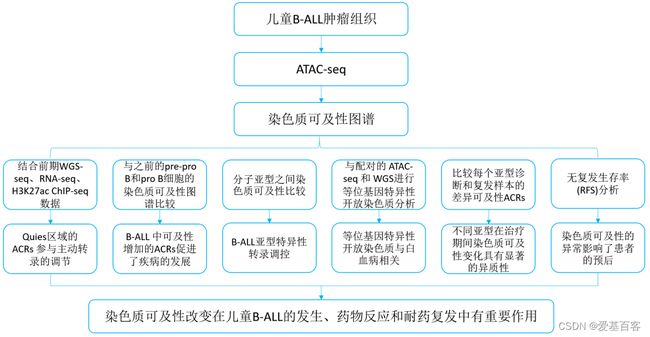
02 研究思路
03 研究结果
1.儿童B-ALL的染色质可及性景观
从上海儿童医学中心治疗的61名复发B-ALL患者收集的79个儿童B-ALL肿瘤中生成了总共144个染色质可及性图谱。先前的研究也提供了多个基因组测序数据,包括来自32名患者的诊断-缓解-复发三组的WGS数据、来自57名B-ALL患者的89个肿瘤的RNA-seq数据,以及来自11名 B-ALL 患者的12个肿瘤的H3K27ac ChIP-seq数据(图 1a)。通过整合WGS的驱动基因组易位、RNA-seq的融合和基因表达特征以及临床测试的核型和FISH 结果来确定每位 B-ALL 患者的分子亚型。
本分析共纳入以下11种B-ALL亚型,分别为:超二倍体 (n= 20)、ETV6::RUNX1 ( n = 11)、TCF3::PBX1 ( n = 5)、KMT2A 重排 (n = 5)、BCR ::ABL1 ( n = 3)、BCR::ABL1-like ( n = 4)、ZNF384 ( n = 3)、PAX5alt ( n = 2)、TCF3::HLF ( n = 1)、亚二倍体 ( n = 1) ), MEF2D (n = 1),还有 5 例未分类亚型,命名为B-other。
经过质量控制和重复组合后,获得了59名患者的75份高质量ATAC-seq 图谱。每个B-ALL样本中鉴定出的ACRs中位数为138,366,范围为57,941 至204,563。这些ACRs进一步合并为代表儿童B-ALL队列ACR 758,738 个 ACRs(c-ACR)。根据表观基因组路线图项目将ACRs注释到八个功能基因组区域。通过在Blueprint epigenomics Consortiumwith ChromHMM中分析从原代B-ALL细胞收集的全基因组组蛋白修饰,获得B-ALL基因组的功能划分。
作者观察到在B-ALL肿瘤基因组中,ACRs的功能分布具有可比性(图 1b)。就 ACRs 的数量和开放性而言,与活跃基因转录相关的基因组区域显示出更高的染色质可及性(图 1b)。与增强子区域(Enh)相关的ACRs中位数占基因组中所有ACRs的31.30%,其次是活性转录位点(TssA,20.38%)、转录相关区域(Tx,6.38%)和二价Tss/Enh (BivR,4.24%)(图 1b)。
另一方面,转录抑制相关区域的可及性较低,包括PolyComb区域(ReprPC, 8.00%)、异染色质区域(Het, 0.87%)和ZNF基因和重复序列(ZNF/Rpts, 0.03%)(图1b)。此外,与活跃转录区域的ACRs相比,抑制区域的ACRs更具异质性。令人惊讶的是,代表没有明确组蛋白修饰的基因组区域的Quies区域在 B-ALL 中也显示出染色质可及性,占所有 ACR 的中位数为 27.95%(图1b )。超过一半 (54.94%) 的 c-ACR 与Quies区域重叠。为了进一步表征Quies 区域,作者对12个B-ALL肿瘤样本进行了H3K27ac ChIP-seq分析。结果显示,64.83%的Quies ACR位于基因区域。在这些基因中,中位数为70.59%的基因也显示出 H3K27ac 信号,并且基因转录增加。这些数据表明Quies区域的 ACR 参与主动转录的调节。
Fig 1a-b.儿童B-ALL患者染色质可及性模式
2. 与白血病发生相关的B-ALL特异性染色质可及区域
目前认为B-ALL起源于B细胞前体,作者将上述鉴定的c-ACRs与先前发表的从胎儿骨髓中分选的pre-pro B和pro B细胞的染色质可及性谱进行了比较,这些细胞代表了B细胞祖细胞中可接近的染色质状态。作者发现,与pre-pro B和pro B细胞相比,B-ALL在整个基因组中染色质可及性的数量上没有显著差异。在pre-pro B细胞(98.57%)和pro B细胞(98.35%)中检测到的大部分ACRs在B-ALL中仍然是开放的(图1c)。这些数据支持B-ALL来源于pre-pro/pro B细胞。另一方面,585,248个 (78.39%)ACRs是B-ALL特异性的。进一步分析发现,与B-ALL和B细胞祖细胞之间重叠的ACRs相比,B-ALL特异性ACRs的异质性明显更高(图1d),与上述B-ALL肿瘤细胞染色质可及性的异质性一致。
接下来,作者比较了B-ALL和B细胞祖细胞之间的差异 ACRs。总共 252,028 个ACRs在B-ALL中显示出更高的可及性。这些ACRs位于2332个蛋白质编码基因的启动子区域 (TSS ±1 kb) 内。富集分析表明,这些基因与肿瘤相关的生物过程相关,包括增殖和分化、信号转导、免疫过程、细胞反应和代谢过程( 图1e)。其中,有61个潜在癌基因,包括IL7R、TCL1A、TCF3、RHOA和ELL。如图 1f所示,在这些癌基因的启动子区域观察到染色质可及性增加,表明这些 ACRs 具有潜在的调节功能。此外,在远端增强子区域也观察到染色质可及性增加的 ACRs。图1g中给出了一个例子是远端血液增强子簇(BENC),据报道它是激活MYC转录的超级增强子,在该区域的多个增强子中观察到染色质可及性增加,这与B-ALL中MYC活性的增加一致。这些发现表明,B-ALL中可及性增加的ACRs参与了疾病的发展。
Fig 1c-g.B-ALL与B细胞祖细胞染色质可及性对比
3. B-ALL 中染色质可及性与亚型特异性转录调控相关
除了B-ALL和B细胞祖细胞(pre-pro B和pro B细胞)之间的 ACRs 存在差异外,作者还观察到分子亚型之间染色质开放程度的显著差异。如图2a所示,将B-ALL与复发性c-ACRs进行无监督聚类时,将B-ALL按亚型分组。这通过计算 B-ALL 样本之间ACRs的成对相关性得到了支持(图2b)。所有功能基因组区域均观察到与亚型相关的可及性(图 2c),包括Enh和 BivR在内的远端调控区显示出最显著的亚型特异性(图 2c),这与之前报道的远端染色质开放区域的组织特异性一致。接下来作者分析了不同亚型间 ACRs的差异,该分析仅包括具有三个以上亚型的病例,在亚型之间观察到不同的染色质可及性。作者发现, ETV6::RUNX1和ZNF384 B-ALL样本的 ACRs明显低于其他B-ALL样本。在 625,287个复发性c-ACRs中,17,981 个被确定为亚型特异性ACRs,每个亚型的ACRs中位数为3083个(范围708-5288)。分层聚类热图显示,这些ACRs显示出很强的亚型特异性可及性(图 2d)。
通过将转录因子(TF)基序分析与使用RNA-seq数据的基因转录分析相结合,作者鉴定了109个与这些亚型特异性ACRs相关的TF。这些转录因子根据它们在每个亚型中的富集程度分为九个簇(图 2e)。除了针对特定B-ALL亚型富集的TF 之外,作者还观察到某些亚型之间TF富集高度相似。这包括TCF3::PBX1和ETV6::RUNX1亚型,KMT2A和ZNF384亚型,以及BCR::ABL1\BCR::ABL1样亚型和超二倍体亚型的共享TF。其中一些观察结果得到了之前报道的支持。例如,KMT2A重排亚型和 ZNF384 B-ALL亚型之间的重叠与这两种亚型都显示出骨髓转录趋势的事实一致。虽然机制仍有待进一步研究,但共享的转录调控表明亚型之间细胞分化状态相似。
为了进一步探讨这些TF的调节作用,作者对富集亚组的肿瘤样本与其他亚组的肿瘤样本之间的TF及其潜在靶基因进行了表达分析。在富集亚型中发现14个TF的转录显著增加(图 2f),表明与TF表达直接相关的转录调控。对于靶基因分析,作者重点分析了53个在基因启动子区(TSS±1 kb)具有结合基序的TF,并将这些基因作为每个转录因子的靶基因进行了分析。进一步组合单个靶基因分析的结果来代表富集亚型中转录因子的调节功能。如图2g所示,该分析中包含的53个转录因子中有13个被发现靶基因的表达显著升高,支持在富集亚型中增加转录调控活性。作者注意到靶基因分析中的13个TF中有12个没有显示TF本身的表达变化,这表明B-ALL亚型之间存在上下文依赖的转录调控。在13个TF 中,E2F6被鉴定为在 ETV6::RUNX1 亚型中特异性富集。该基因在细胞周期的控制中起着至关重要的作用,并且与多种肿瘤的肿瘤生长或化疗敏感性相关。与此同时,与其他亚型相比,ETV6::RUNX1 B-ALL亚型中E2F6及其靶基因的转录明显更高(图2f, g)。这些结果进一步揭示了B-ALL亚型特异性转录调控。
Fig2.B-ALL亚型特异性染色质可及性
4. B-ALL 中等位基因特异性开放染色质与白血病相关
对来自32名B-ALL患者的总共44份样本(包括13份诊断样本和31份复发样本)以及配对的 ATAC-seq 和 WGS 数据进行了等位基因特异性开放染色质 (ASOC) 分析。每个样本平均识别出 3616个ASOC 区域。ASOC区域占全基因组ACRs的中位数14.39%,显著低于双等位基因开放染色质 (BiOC) 区域(图3a)。此外,与BiOCs相比,在活性转录相关区域(TssA、Tx 和 Enh)中发现的ASOC区域较少(图3b)。进一步分析表明,与 BiOC ACRs相比,ASOC ACRs之间的距离更近,并且更有可能被归为单个拓扑相关域(TAD)。这些数据表明,等位基因之间染色质可及性的调节符合三维基因组结构的调节。
接下来,作者使用EpiMap 32的白血病相关单核苷酸多态性 (SNP) 研究了染色质可及性。在ASOC区域中总共发现了46个与白血病相关的等位基因之间染色质可及性不平衡的SNP,其中至少5个样本中存在的7个SNP(图3c, d)。在这些最常见的SNP中,rs7090445是先前预测的通过破坏RUNX3与c等位基因的结合来减少ARID5B的转录。有趣的是,作者观察到,在21个具有杂合C/T等位基因的B-ALL样本中,有14个样本 (66.67%) 中该位点的 T 等位基因的染色质可及性显着高于C等位基因的染色质可及性,这与C等位基因在白血病中的作用一致。另一个复发性SNP是 rs13401811,G 等位基因先前被报道为慢性淋巴细胞白血病的风险等位基因。ATAC-seq数据显示,9个G/A基因型B-ALL样本中有8个(88.89%)G等位基因的染色质可及性显著高于A等位基因。值得注意的是,rs13401811位于BCL2L11上游约262 kb, BCL2L11编码一种参与ALL耐药的促凋亡蛋白20。这些结果表明,染色质可及性与这些疾病相关SNP的功能有关
Fig3.B-ALL等位基因特异性开放染色质(ASOC)区
5. B-ALL 治疗后染色质可及性发生变化
作者分析了每个亚型的诊断和复发之间具有差异可及性的ACRs。本分析仅纳入具有超过五个诊断或复发样本的亚型。每个亚型中鉴定出平均有945个差异ACRs,范围从268到4072(图 4a)。值得注意的是,在复发样本(高复发)中只有 1.54%(5911例中有91例)具有较高可及性的ACRs 中,在复发样本(低复发)中只有0.14%(1423例中有2例)具有较低可及性的ACRs在两个或多个亚型之间共享,这表明不同亚型在治疗期间染色质可及性变化具有显著的异质性(图4b)。
为了获得这些在复发期间失调的差异ACRs的靶基因,作者使用配对的 ATAC-seq和RNA-seq数据对总共52个B-ALL样本进行了ACRs到基因预测,并定义了116,307个ACRs-gene相关性。由此,总共1259个基因被确定为复发期间ACRs失调的潜在靶标。正如预期的那样,观察到显著的异质性,在任意两个亚型之间只有13.98%(1259个中有176个)靶基因是共享的(图4c,d)。富集分析表明,这些靶基因与细胞粘附相关的生物过程相关(图 4e),表明骨髓微环境中白血病细胞和间充质基质细胞之间的相互作用可能失调,这在之前已被证明与白血病细胞的化疗耐药有关。
在此基础上,作者整合了CTD^236的药物敏感性数据,以研究在复发B-ALL患者中观察到的基因失调是否与临床治疗相关。首先,作者确定了来自着11个B-ALL细胞系(从CCLE项目收集)的基因转录数据与细胞对8种常用B-ALL治疗药物(包括阿糖胞苷和甲氨蝶呤)的反应之间的关系。该分析总共产生了14,680对drug-gene对,代表与药物反应相关的转录改变。有趣的是,由复发相关的ACRs调控的潜在靶基因与药物治疗显著相关,包括伊马替尼和依托泊苷(图 4f)。当作者对个体B-ALL亚型中鉴定的药物基因对进行分析时,观察到类似的结果。BCR::ABL1\BCR::ABL1 样亚型差异ACRs的靶基因与伊马替尼和达沙替尼显著相关(图4f),两者都是用于BCR::ABL1\BCR::ABL1样B-ALL治疗的酪氨酸激酶抑制剂,而 ETV6::RUNX1 亚型则观察到与多柔比星显著相关(如图 4f)。这些结果表明,治疗可以重塑染色质的可及性,从而影响B-ALL复发期间的基因转录调控。
Fig4. 复发B-ALL患者染色质可及性的改变
6. 染色质可及性特征影响患者预后
作者分析了无复发生存率 (RFS)来研究染色质可及性与B-ALL预后的关系。对42例接受CCCG-ALL-2009 ( n = 37) 和 CCCG-ALL-2015 ( n = 5)方案治疗的复发B-ALL患者的ATAC-seq数据进行了分析。两种方案之间没有观察到患者预后的显著差异。在 625,287 个复发性 c-ACRs 中,总共鉴定出了 70,573 个 (11.29%) RFS相关 ACRs(FDR < 0.05)。根据ACRs与基因的联系预测,这些RFS相关ACRs的潜在靶标在细胞周期和白细胞分化相关的生物过程中富集(图 5a),表明这些ACRs对B-ALL母细胞的增殖和分化有调节作用。使用RFS相关ACRs对42例复发 B-ALL 患者进行无监督聚类,结果得出两个B-ALL 组(A 组和 B 组)的复发时间和预后不同(图 5b,c)。使用不同的聚类方法观察到一致的结果。为了验证这一观察结果,作者用来自治疗适用研究以产生有效治疗 (TARGET) 项目的数据进行分析,结果表明染色质可及性的异常反映了患者的预后。
与之前的报道一致,A组患者富含ETV6::RUNX1和超二倍体亚型,预后相对较好,而B组患者主要为KMT2A和BCR::ABL1\BCR:ABL1样亚型,预后较差(图 5b,c)。值得注意的是,尽管TCF3::PBX1 B-ALL 患者通常被认为是低风险,在本分析中,所有4例TCF3::PBX1病例与kmt2a和BCR::ABL1\BCR::ABL1样病例在B组进行分组,并在诊断后22个月内复发(图 5b)。有趣的是,超二倍体B-ALL病例被分为两个不同的组(图 5b)。3例复发的超二倍体病例(A118R、A174R 和 A233R)聚集在B组,具有KMT2A和BCR-ABL1\BCR::ABL1样,并且显示较差的RFS(图5b, c)。在两个超二倍体亚组之间总共鉴定出 7566 个差异ACRs(图5d)。在这3156个ACRs中,B 组RFS较差的超二倍体病例中染色质可及性增加。作者从ACR-gene的结果中获得了这些ACRs的603个潜在靶基因。
进一步分析表明,这些靶基因模仿干细胞和骨髓祖细胞的表达特征,包括巨核细胞-红细胞祖细胞和粒细胞-巨噬细胞祖细胞(图5e)。从功能上讲,目标基因被发现富集在与耐药性相关的迁移/粘附/运动相关类别。这表明,与其他超二倍体 B-ALL 患者相比,3例超二倍体 B-ALL 患者表现出更高的谱系可塑性,具有更多的骨髓样细胞和较差的治疗反应。作者进一步分析了与TARGET队列高二倍体b - all患者不良预后相关的ACRs模式。43例高二倍体样本(7例为诊断-复发配对)根据上述603个靶基因聚类为3组(图5f)。聚类3由3例患者的5个样本组成,其靶基因表达最高,代表高危人群。因此,簇3患者在EFS和OS方面的预后最差(图5g),跟作者的观察结果一致。然而,该分析的患者数量有限,异常ACRs仍有待进一步的大队列研究。
Fig5.染色质可及性特征与B-ALL预后相关
04 总 结
本文的研究展示了儿童B-ALL染色质可及性的概况,并描述了B-ALL患者和不同分子亚型中特异富集的ACRs。更重要的是,该研究展示了药物治疗下染色质重塑的发生,并确定了与早期复发相关的染色质可及性特征。这些结果扩展了研究者对B-ALL背后的基因组畸变的理解,并强调了表观基因组特征对于这种恶性肿瘤风险分层的重要性。