- 《重生到现代之从零开始的C++生活》—— 入门基础语法2
yttandb
c++生活
缺省参数缺省参数就是在函数的声明和定义里制定一个缺省值,如果没有指定的实参就用该形参的缺省值voidadd(inta=0,intb=0){returna+b;}简单的的说就是将形式参数附一个值,如果没有实参传入的话,就默认用形参的值voidadd(inta=0,intb=3){returna+b;}intmain(){inta=1;intb=5;add(a,b);//结果为6add(a);//结果
- 《重生到现代之从零开始的数据结构生活》—— 复杂度
yttandb
c语言数据结构c++
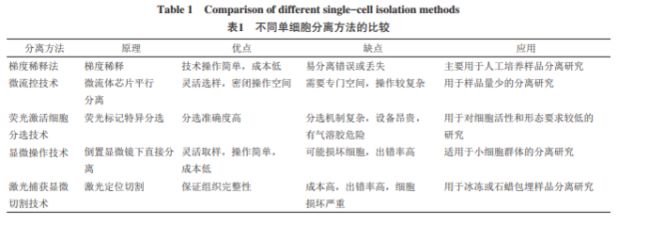
前言进入代码世界已经有一阵了,C语言学的差不多了打算看看数据结构以前都没想过我能学到这嘞哈哈哈哈所以,《重生到现代之从零开始的数据结构生活》开始啦数据结构我们天天说数据结构怎么怎么了,那什么是数据结构你知道吗数据结构(DataStructure)是计算机存储、组织数据的⽅式,指相互之间存在⼀种或多种特定关系的数据元素的集合这么说可能有点抽象了,但是如果举一个例子:intarr[3]={0};不就是
- 大华测试笔试题_大华软件测试笔试题目 大华软件测试笔试题
zh222333
大华测试笔试题
软件测试工程师笔试试题首先,我不急于回答你的问题你先自己检查一下自己所说的话语中有没有错误,软件测试最关键在于是细心,认真。其次,你的问题1.你们是怎样进行回归测试的,一般进行几轮,具体说一下?2.你们一个项目总工要写多少用例?3.你知道一个项目代码有多大?4.你们公司的测试流程?5.在测试之前,你们干什么?6.测试计划中,你们项目经理是依据什么给你们分配任务的?7.你们的测试数据主要来自哪?8.
- 宠物用品企业的智选之道:看板软件选品指南
团队协作工具
中国宠物市场规模持续扩大,预计到2024年,中国宠物消费市场规模将突破3000亿元大关,同比增长率达到5.5%。同时,全球宠物用品市场规模也在稳步增长,2024年达到1625.9亿元,预计未来几年将保持较高的增长率。宠物用品行业蓬勃向上,如何达到满足消费者的用品选择?宠物用品企业利用看板软件进行选品分析,可以系统地跟踪市场动态、评估产品性能、分析消费者需求,从而做出更加明智的选品决策。以下是一个详
- 编程语言也给你挑上了
爱码士~
低代码平台低代码团队开发前端运维后端
现在的实习生都这么趾高气扬啦,会个java给你骄傲上了?上月组里调来了个实习生,说是上个导师训不服他。据说还是老板看上的可塑之才,有过独立游戏的开发经验。我倒是看看是个什么天才。听前科室说,这小子规范一塌糊涂。代码一堆嵌套,能省的全省了,隔着大肠包小肠呢,说自己一直都这么写。对接的同事查代码时,看得头皮发麻。让他换个语言适应下团队,他说会java不就够了吗,那还需要什么其他语言。然后上个科室最近又
- linux中and运算符文件重定向,linux 重定向问题详解
上世是朵花
Linux重定向是指修改原来默认的一些东西,对原来系统命令的默认执行方式进行改变,比如说简单的我不想看到在显示器的输出而是希望输出到某一文件中就可以通过Linux重定向来进行这项工作。Linux默认输入是键盘,输出是显示器。你可以用重定向来改变这些设置。比如用wc命令的时候本来是要手动输入一篇文字来计算字符数的,用了重定向后可以直接把一个已经写好的文件用‘STDIN0键盘输入STDOUT1输出信息
- 我的编程入门成长之路
ocean2103
成长职场和发展学习方法程序人生
接触说起我的编程入门,其实惨不忍睹。我是2001年上的大学,只是觉得计算机是个高科技,就稀里糊涂的报了个计算机专业。上大学前没摸过电脑,以为大块头显示器就是电脑;也没有摸过键盘,以为学计算机就是学打字的…刚上大一的时候,那时候学校不让大一新生自己买电脑,网吧还很流行,于是有天晚上就和同学一起去网吧包宿。同学帮我申请了个QQ号,结果整个晚上,我在网上跟别人诉苦说我是计算机专业的,但是打字都打不好,将
- 大数据学习(37)- Flink运行时架构
viperrrrrrr
学习flink大数据
&&大数据学习&&系列专栏:哲学语录:承认自己的无知,乃是开启智慧的大门如果觉得博主的文章还不错的话,请点赞+收藏⭐️+留言支持一下博主哦1)作业管理器(JobManager)JobManager是一个Flink集群中任务管理和调度的核心,是控制应用执行的主进程。也就是说,每个应用都应该被唯一的JobManager所控制执行。JobManger又包含3个不同的组件。(1)JobMasterJobM
- linux centos 7.6 搭建docker及安装环境部署项目
小猪与二哈
Javalinuxdockercentosjavamysql
linuxcentos7.6搭建docker及安装环境部署项目一.配置linux环境目前docker安装只支持centOS7、centOS6.5也就是说centOS7是需要3.1以上内核centOS6.5是需要2.6以上内核linux输出命令uname-a使用腾讯云服务centos7.6重装系统,重置实例的密码[外链图片转存失败,源站可能有防盗链机制,建议将图片保存下来直接上传(img-ZG2SU
- 如何正确学习软件工程
会振刀的程序员
程序人生程序人生软件工程师
如何正确学习软件工程友友们,又是一破干货来袭。我觉得我可能会被批斗,但我还是要表达一下自己的观点。1、前言之前看到我一朋友用jupyter训练模型。我问他:“你训练完然后呢”。他说:‘‘调参’’。我说你最终的目的是什么呢,他就不说话了。我想说的是,不管你是练习也好、开发也好,做之前一定是有目的的。没有目的的话那便没有了意义,那就没有做的必要。2、目的指向不管做任何行业任何事,最终的目的一定是以人为
- python实现冒泡排序完整算法_利用python实现冒泡排序算法实例代码
weixin_39610759
利用python实现冒泡排序算法实例代码冒泡排序冒泡排序(英语:BubbleSort)是一种简单的排序算法。它重复地遍历要排序的数列,一次比较两个元素,如果他们的顺序错误就把他们交换过来。遍历数列的工作是重复地进行直到没有再需要交换,也就是说该数列已经排序完成。这个算法的名字由来是因为越小的元素会经由交换慢慢“浮”到数列的顶端。冒泡排序算法的运作如下:1、比较相邻的元素。如果第一个比第二个大(升序
- 你说通过Kafka AdminClient获取Lag会有性能问题?尊嘟假嘟0.o
javakafka大数据
版本日期备注1.02024.8.25文章首发本文内容已用一种抽象的方式做成了视频,喜欢看视频的同学可以在B站上搜索“抽象狗哥”观看相应的内容。0.前言前阵子团队里出了个大故障,本质是因为其他语言实现的client有问题,非常频繁的请求大量元数据,而Kafka服务端这边也没有做什么限制,导致KafkaBroker宕了。在相关的复盘报告中,复盘方提到了我这边的监控程序(用于观察线上实时作业的堆压)会频
- Python mysql数据库连接池
戴**
Python
最近在写一个Python的文本分析,需要大量的读取数据库(千万级别mysql)并进行更新操作,运行着程序发现一个问题,过了一会儿程序就报错说链接已经满了,或者是端口不可重复使用,因此我在网上找到了一个连接池的代码用于解决这个问题,在此处贴出代码本身是有配置文件的,因为我觉得在我的项目中不必要所以就删除了#!/usr/bin/envpython#-*-coding:utf-8-*-importpym
- 04-初识Docker-Docker架构
我以为心都空了
微服务docker架构容器
04-初识Docker-Docker架构1.镜像和容器:(1)镜像(Image):Docker将应用程序及其所需的依赖、函数库、环境、配置等文件打包在一起,称为镜像。解释:比如之前讲过的Mysql镜像,它里面肯定就会有各种各样所需要的依赖。这些东西最终落到硬盘就是一个一个的文件。比如说这里有Mysql运行时需要写数据的data目录文件,还有log日志文件,当然还有bin里面的可执行文件,这些就组成
- springboot配置logback日志
hrthntyj
springbootlogbackjava
SpringBoot的默认日志框架选用的是Logback)在需要记录日志的地方加上staticLoggerlogger=LoggerFactory.getLogger(Main.class);就可以使用logger.info()显示日志Logger的默认日志级别是INFO级别的,也就是说小于INFO级别的日志都不会记录,只有大于等于INFO级别的日志才会被记录。Logback的日志级别是这样的:T
- 边缘计算的方式
黑石云
边缘计算
做边缘计算这个行业要想赚得到收益,那一定要找到适合自己参与的一种方式。目前参与边缘计算的话,它主要有两个渠道。第一个就是用盒子来跑,这个盒子的话包括光猫、路由器、摄像头等等,盒子是一条网线带动一个盒子,它的门槛会比较低,支持30到300兆上行,所以的话盒子它是非常好入手的。但是如果说想把盒子做好就需要在渠道这一方面有一定的能力。就可以把盒子给铺出去。盒子量增大了,自然而然你的收益也会更高。只要带宽
- python的schedule模块
weijiuzhu007
python
这里写自定义目录标题一,schedule模块1.什么是schedule模块2.具体应用二,详细源码一,schedule模块1.什么是schedule模块schedule模块进行job管理,具体可以执行定时任务,schedule方法是串行的,也就是说,如果各个任务之间时间不冲突,那是没问题的;如果时间有冲突的话,会串行的执行命令2.具体应用1,安装方法pipinstallschedule2,使用im
- 跳一跳分数
qq_42724075
算法游戏
问题描述跳一跳是一款微信小游戏,游戏规则非常简单,只需玩家要从一个方块跳到下一个方块,如果未能成功跳到下一个方块则游戏结束。计分规则如下:如果成功跳到下一个方块上,但未跳到方块中心,加1分如果成功跳到下一个方块上,且刚好跳到方块中心,则第一次加2分,此后连续跳到中心时每次递增2分。也就是说,第一次跳到方块中心加2分,连续第二次跳到方块中心加4分,连续第三次跳到方块中心加6分,…,以此类推。如果未能
- MySQL 很重要的库 - 信息字典
shenghuiping2001
网络安全mysqladbandroidinformation
在做owaspSQL注入的时候,有个很重要的库,那就是信息库:这个库就是:information_schema;(准确的说,数据字典)mysql>showdatabases;+--------------------+|Database|+--------------------+|information_schema|下面区这个库里面看看table:mysql>select*fromTABLES
- 【YashanDB知识库】关于表空间压缩
数据库
本文内容来自YashanDB官网,原文内容请见https://www.yashandb.com/newsinfo/7106886.html?templateId=171...实现方法1、YashanDB的表空间压缩通过文件打洞(HolePunching)实现。2、“文件打洞”简单地说,如果文件中有连续字节0x00出现,只需要记录0字节数据块开始出现位置和块长度,而不需要实际保存原数据块。3、表空间
- 如何使用wireshark 解密TLS-SSL报文
风清扬-独孤九剑
wireshark测试工具网络
目录前言原理操作前言现在网站都是https或者很多站点都支持http2。这些站点为了保证数据的安全都通过TLS/SSL加密过,用wireshark并不能很好的去解析报文,我们就需要用wireshark去解密这些报文。我主要讲解下mac在chrome怎么配置的,浏览器一定要支持HTTP2。原理获取TLS握手阶段生成的密钥,也就是说通过Chrome浏览器DEBUG日志中的握手信息生成密钥,wiresh
- ai照片放大python源码_AI新时代-大牛教你使用python+Opencv完成人脸解锁(附源码)...
weixin_39639505
ai照片放大python源码
好吧,伙计们,我回来了。说我拖更不写文章的可以过来用你的小拳拳狠命地捶我胸口....那么今天我们来讲关于使用python+opencv+face++来实现人脸验证及人脸解锁。代码量同样不多,你可以将这些代码运用在其它一些智能领域,如智能家居,进门的时候判断你是谁,也可以加入机器学习判断来的人是客人还是熟人。在讲之前我们会先适当的拓扑一下关于人脸识别的知识点。OK废话少说下面开始正是话题。解锁原理:
- 架构验证的时间
张友邦
架构与设计架构设计soa文档
架构设计的各种方法论是为把事情变得更简单易懂而准备的,它们帮我们梳理复杂应用的逻辑头绪,把我们不能一下子掌握的事情通过一种有条不紊的途径消化掉。可以说,把事情变得更简单是架构设计的远景和目标。但这种简单是有条件的,实用就是它的条件。所谓实用就是要满足各种各样外部环境并尽可能的提供更多的指标,这些指标包括可伸缩性、可维护性、学习曲线、稳定性等。所谓的尽可能就意味着需要有一个平衡点,我们需要通过各种努
- 架构验证的时间 (转)
hyzhx
架构设计soa文档
架构设计的各种方法论是为把事情变得更简单易懂而准备的,它们帮我们梳理复杂应用的逻辑头绪,把我们不能一下子掌握的事情通过一种有条不紊的途径消化掉。可以说,把事情变得更简单是架构设计的远景和目标。但这种简单是有条件的,实用就是它的条件。所谓实用就是要满足各种各样外部环境并尽可能的提供更多的指标,这些指标包括可伸缩性、可维护性、学习曲线、稳定性等。所谓的尽可能就意味着需要有一个平衡点,我们需要通过各种努
- PDF 解析问题调研
水的精神
RAGpdfPDF解析调研PDF解析工具
说点真实的感受:网上看啥组件都好,实际测,啥组件都不行。效果好的不开源收费,开源的效果不好。测试下来,发现把组件融合起来,还是能不花钱解决问题的,都是麻烦折腾一些。这里分享了目前网上能够看到的资料。很多资料都是反复重复的,且效果不好的。目前网上基本没有太好用的工具,也没有太好的方案资料。剩下的就是收费效果好的。PDF解析中的诸多挑战版面分析:如何得到标题、如何的得到段落(正确的段落)、如何得到表格
- 为什么说网络安全行业是IT行业最后的红利?
网络安全技术分享地
web安全安全docker网络安全网络攻击模型
一、为什么选择网络安全?这几年随着我国《国家网络空间安全战略》《网络安全法》《网络安全等级保护2.0》等一系列政策/法规/标准的持续落地,网络安全行业地位、薪资随之水涨船高。未来3-5年,是安全行业的黄金发展期,提前踏入行业,能享受行业发展红利。二、为什么说网络安全行业是IT行业最后的红利?根据腾讯安全发布的《互联网安全报告》,目前中国网络安全人才供应严重匮乏,每年高校安全专业培养人才仅有3万余人
- Mybatis面试题
青木川崎
面试题mybatisjava开发语言
Mybatis面试题什么是MyBatis?讲下MyBatis的缓存Mybatis是如何进行分页的?分页插件的原理是什么?简述Mybatis的插件运行原理,以及如何编写一个插件?Mybatis动态sql是做什么的?都有哪些动态sql?能简述一下动态sql的执行原理不?#{}和${}的区别是什么?为什么说Mybatis是半自动ORM映射工具?它与全自动的区别在哪里?Mybatis是否支持延迟加载?如果
- Java基础——String
白暮晚
Java八股java
Java基础——StringString是Java基础类型中较为特殊的一个类,我们这里着重探讨一下这个类。StringString底层使用一个char类型的数组来存储字符串,且该数组使用了private和final修饰为什么说String是不可变的final与private修饰该字符数组且未暴露修改方法,杜绝了从外部修改该对象的可能性由于final的使用导致子类无法继承该对象,进而导致子类不可能修
- 你能读懂微服务架构深度解析:架构设计背后的哲学吗?
写代码的珏秒秒
程序员Java编程java架构程序人生后端微服务
架构设计哲学如果说软件开发的本质是不断挖掘问题领域中隐藏的错综复杂性,那么架构解决的问题就是如何管理这些复杂性。而在软件领域,最为复杂的软件实体莫过于软件操作系统。从数以千计的工程师参与开发的UNIX操作系统到Linux开源系统的成功,越来越多的人开始关注和思考UNIX技术背后隐藏的设计哲学。UNIX设计哲学概括为一句话就是“小而专注”。可以说,微服务架构理念和UNIX设计哲学一脉相承,微服务将U
- 大数据湖仓一体架构未来思考
王知无(import_bigdata)
架构
湖仓一体架构是最近1-2年时间开始频繁出现在数据开发领域的新名词。也是各大公司竞相投入的对象。网络上关于湖仓一体架构的实践文章很多,看得也很眼花缭乱。我们今天站在一个「接地气」的角度,来说一说湖仓一体架构中未来需要关注的核心框架有哪些。文章内容也没有经过仔细的斟酌,完全是一点不成熟的想法,而且站的角度不是高屋建瓴的而是从下往上的。一个基本判断是湖仓一体架构在形式上不止一种大家可以从网上看到很多关于
- 算法 单链的创建与删除
换个号韩国红果果
c算法
先创建结构体
struct student {
int data;
//int tag;//标记这是第几个
struct student *next;
};
// addone 用于将一个数插入已从小到大排好序的链中
struct student *addone(struct student *h,int x){
if(h==NULL) //??????
- 《大型网站系统与Java中间件实践》第2章读后感
白糖_
java中间件
断断续续花了两天时间试读了《大型网站系统与Java中间件实践》的第2章,这章总述了从一个小型单机构建的网站发展到大型网站的演化过程---整个过程会遇到很多困难,但每一个屏障都会有解决方案,最终就是依靠这些个解决方案汇聚到一起组成了一个健壮稳定高效的大型系统。
看完整章内容,
- zeus持久层spring事务单元测试
deng520159
javaDAOspringjdbc
今天把zeus事务单元测试放出来,让大家指出他的毛病,
1.ZeusTransactionTest.java 单元测试
package com.dengliang.zeus.webdemo.test;
import java.util.ArrayList;
import java.util.List;
import org.junit.Test;
import
- Rss 订阅 开发
周凡杨
htmlxml订阅rss规范
RSS是 Really Simple Syndication的缩写(对rss2.0而言,是这三个词的缩写,对rss1.0而言则是RDF Site Summary的缩写,1.0与2.0走的是两个体系)。
RSS
- 分页查询实现
g21121
分页查询
在查询列表时我们常常会用到分页,分页的好处就是减少数据交换,每次查询一定数量减少数据库压力等等。
按实现形式分前台分页和服务器分页:
前台分页就是一次查询出所有记录,在页面中用js进行虚拟分页,这种形式在数据量较小时优势比较明显,一次加载就不必再访问服务器了,但当数据量较大时会对页面造成压力,传输速度也会大幅下降。
服务器分页就是每次请求相同数量记录,按一定规则排序,每次取一定序号直接的数据
- spring jms异步消息处理
510888780
jms
spring JMS对于异步消息处理基本上只需配置下就能进行高效的处理。其核心就是消息侦听器容器,常用的类就是DefaultMessageListenerContainer。该容器可配置侦听器的并发数量,以及配合MessageListenerAdapter使用消息驱动POJO进行消息处理。且消息驱动POJO是放入TaskExecutor中进行处理,进一步提高性能,减少侦听器的阻塞。具体配置如下:
- highCharts柱状图
布衣凌宇
hightCharts柱图
第一步:导入 exporting.js,grid.js,highcharts.js;第二步:写controller
@Controller@RequestMapping(value="${adminPath}/statistick")public class StatistickController { private UserServi
- 我的spring学习笔记2-IoC(反向控制 依赖注入)
aijuans
springmvcSpring 教程spring3 教程Spring 入门
IoC(反向控制 依赖注入)这是Spring提出来了,这也是Spring一大特色。这里我不用多说,我们看Spring教程就可以了解。当然我们不用Spring也可以用IoC,下面我将介绍不用Spring的IoC。
IoC不是框架,她是java的技术,如今大多数轻量级的容器都会用到IoC技术。这里我就用一个例子来说明:
如:程序中有 Mysql.calss 、Oracle.class 、SqlSe
- TLS java简单实现
antlove
javasslkeystoretlssecure
1. SSLServer.java
package ssl;
import java.io.FileInputStream;
import java.io.InputStream;
import java.net.ServerSocket;
import java.net.Socket;
import java.security.KeyStore;
import
- Zip解压压缩文件
百合不是茶
Zip格式解压Zip流的使用文件解压
ZIP文件的解压缩实质上就是从输入流中读取数据。Java.util.zip包提供了类ZipInputStream来读取ZIP文件,下面的代码段创建了一个输入流来读取ZIP格式的文件;
ZipInputStream in = new ZipInputStream(new FileInputStream(zipFileName));
&n
- underscore.js 学习(一)
bijian1013
JavaScriptunderscore
工作中需要用到underscore.js,发现这是一个包括了很多基本功能函数的js库,里面有很多实用的函数。而且它没有扩展 javascript的原生对象。主要涉及对Collection、Object、Array、Function的操作。 学
- java jvm常用命令工具——jstatd命令(Java Statistics Monitoring Daemon)
bijian1013
javajvmjstatd
1.介绍
jstatd是一个基于RMI(Remove Method Invocation)的服务程序,它用于监控基于HotSpot的JVM中资源的创建及销毁,并且提供了一个远程接口允许远程的监控工具连接到本地的JVM执行命令。
jstatd是基于RMI的,所以在运行jstatd的服务
- 【Spring框架三】Spring常用注解之Transactional
bit1129
transactional
Spring可以通过注解@Transactional来为业务逻辑层的方法(调用DAO完成持久化动作)添加事务能力,如下是@Transactional注解的定义:
/*
* Copyright 2002-2010 the original author or authors.
*
* Licensed under the Apache License, Version
- 我(程序员)的前进方向
bitray
程序员
作为一个普通的程序员,我一直游走在java语言中,java也确实让我有了很多的体会.不过随着学习的深入,java语言的新技术产生的越来越多,从最初期的javase,我逐渐开始转变到ssh,ssi,这种主流的码农,.过了几天为了解决新问题,webservice的大旗也被我祭出来了,又过了些日子jms架构的activemq也开始必须学习了.再后来开始了一系列技术学习,osgi,restful.....
- nginx lua开发经验总结
ronin47
使用nginx lua已经两三个月了,项目接开发完毕了,这几天准备上线并且跟高德地图对接。回顾下来lua在项目中占得必中还是比较大的,跟PHP的占比差不多持平了,因此在开发中遇到一些问题备忘一下 1:content_by_lua中代码容量有限制,一般不要写太多代码,正常编写代码一般在100行左右(具体容量没有细心测哈哈,在4kb左右),如果超出了则重启nginx的时候会报 too long pa
- java-66-用递归颠倒一个栈。例如输入栈{1,2,3,4,5},1在栈顶。颠倒之后的栈为{5,4,3,2,1},5处在栈顶
bylijinnan
java
import java.util.Stack;
public class ReverseStackRecursive {
/**
* Q 66.颠倒栈。
* 题目:用递归颠倒一个栈。例如输入栈{1,2,3,4,5},1在栈顶。
* 颠倒之后的栈为{5,4,3,2,1},5处在栈顶。
*1. Pop the top element
*2. Revers
- 正确理解Linux内存占用过高的问题
cfyme
linux
Linux开机后,使用top命令查看,4G物理内存发现已使用的多大3.2G,占用率高达80%以上:
Mem: 3889836k total, 3341868k used, 547968k free, 286044k buffers
Swap: 6127608k total,&nb
- [JWFD开源工作流]当前流程引擎设计的一个急需解决的问题
comsci
工作流
当我们的流程引擎进入IRC阶段的时候,当循环反馈模型出现之后,每次循环都会导致一大堆节点内存数据残留在系统内存中,循环的次数越多,这些残留数据将导致系统内存溢出,并使得引擎崩溃。。。。。。
而解决办法就是利用汇编语言或者其它系统编程语言,在引擎运行时,把这些残留数据清除掉。
- 自定义类的equals函数
dai_lm
equals
仅作笔记使用
public class VectorQueue {
private final Vector<VectorItem> queue;
private class VectorItem {
private final Object item;
private final int quantity;
public VectorI
- Linux下安装R语言
datageek
R语言 linux
命令如下:sudo gedit /etc/apt/sources.list1、deb http://mirrors.ustc.edu.cn/CRAN/bin/linux/ubuntu/ precise/ 2、deb http://dk.archive.ubuntu.com/ubuntu hardy universesudo apt-key adv --keyserver ke
- 如何修改mysql 并发数(连接数)最大值
dcj3sjt126com
mysql
MySQL的连接数最大值跟MySQL没关系,主要看系统和业务逻辑了
方法一:进入MYSQL安装目录 打开MYSQL配置文件 my.ini 或 my.cnf查找 max_connections=100 修改为 max_connections=1000 服务里重起MYSQL即可
方法二:MySQL的最大连接数默认是100客户端登录:mysql -uusername -ppass
- 单一功能原则
dcj3sjt126com
面向对象的程序设计软件设计编程原则
单一功能原则[
编辑]
SOLID 原则
单一功能原则
开闭原则
Liskov代换原则
接口隔离原则
依赖反转原则
查
论
编
在面向对象编程领域中,单一功能原则(Single responsibility principle)规定每个类都应该有
- POJO、VO和JavaBean区别和联系
fanmingxing
VOPOJOjavabean
POJO和JavaBean是我们常见的两个关键字,一般容易混淆,POJO全称是Plain Ordinary Java Object / Plain Old Java Object,中文可以翻译成:普通Java类,具有一部分getter/setter方法的那种类就可以称作POJO,但是JavaBean则比POJO复杂很多,JavaBean是一种组件技术,就好像你做了一个扳子,而这个扳子会在很多地方被
- SpringSecurity3.X--LDAP:AD配置
hanqunfeng
SpringSecurity
前面介绍过基于本地数据库验证的方式,参考http://hanqunfeng.iteye.com/blog/1155226,这里说一下如何修改为使用AD进行身份验证【只对用户名和密码进行验证,权限依旧存储在本地数据库中】。
将配置文件中的如下部分删除:
<!-- 认证管理器,使用自定义的UserDetailsService,并对密码采用md5加密-->
- mac mysql 修改密码
IXHONG
mysql
$ sudo /usr/local/mysql/bin/mysqld_safe –user=root & //启动MySQL(也可以通过偏好设置面板来启动)$ sudo /usr/local/mysql/bin/mysqladmin -uroot password yourpassword //设置MySQL密码(注意,这是第一次MySQL密码为空的时候的设置命令,如果是修改密码,还需在-
- 设计模式--抽象工厂模式
kerryg
设计模式
抽象工厂模式:
工厂模式有一个问题就是,类的创建依赖于工厂类,也就是说,如果想要拓展程序,必须对工厂类进行修改,这违背了闭包原则。我们采用抽象工厂模式,创建多个工厂类,这样一旦需要增加新的功能,直接增加新的工厂类就可以了,不需要修改之前的代码。
总结:这个模式的好处就是,如果想增加一个功能,就需要做一个实现类,
- 评"高中女生军训期跳楼”
nannan408
首先,先抛出我的观点,各位看官少点砖头。那就是,中国的差异化教育必须做起来。
孔圣人有云:有教无类。不同类型的人,都应该有对应的教育方法。目前中国的一体化教育,不知道已经扼杀了多少创造性人才。我们出不了爱迪生,出不了爱因斯坦,很大原因,是我们的培养思路错了,我们是第一要“顺从”。如果不顺从,我们的学校,就会用各种方法,罚站,罚写作业,各种罚。军
- scala如何读取和写入文件内容?
qindongliang1922
javajvmscala
直接看如下代码:
package file
import java.io.RandomAccessFile
import java.nio.charset.Charset
import scala.io.Source
import scala.reflect.io.{File, Path}
/**
* Created by qindongliang on 2015/
- C语言算法之百元买百鸡
qiufeihu
c算法
中国古代数学家张丘建在他的《算经》中提出了一个著名的“百钱买百鸡问题”,鸡翁一,值钱五,鸡母一,值钱三,鸡雏三,值钱一,百钱买百鸡,问翁,母,雏各几何?
代码如下:
#include <stdio.h>
int main()
{
int cock,hen,chick; /*定义变量为基本整型*/
for(coc
- Hadoop集群安全性:Hadoop中Namenode单点故障的解决方案及详细介绍AvatarNode
wyz2009107220
NameNode
正如大家所知,NameNode在Hadoop系统中存在单点故障问题,这个对于标榜高可用性的Hadoop来说一直是个软肋。本文讨论一下为了解决这个问题而存在的几个solution。
1. Secondary NameNode
原理:Secondary NN会定期的从NN中读取editlog,与自己存储的Image进行合并形成新的metadata image
优点:Hadoop较早的版本都自带,