Single cell transcriptome analysis reveals disease-defining T cell subsets in the tumor microenvironment of classic Hodgkin lymphoma
19年12月在线发表在Cancer Discovery上的单细胞文章
doi: 10.1158/2159-8290.CD-19-0680
Highlight
•Identified a novel HL-associated subset of T cells with prominent expression of the inhibitory receptor LAG3.
•Multiplexed spatial assessment of immune cells in the microenvironment also revealed increased LAG3+ T cells in the direct vicinity of MHC class-II deficient tumor cells.
•Provide novel insights into TME biology and suggest new approaches to immune checkpoint targeting in HL.
单细胞表达谱鉴定了一个新的霍奇金淋巴瘤相关的T细胞亚群,该亚群具有显著的抑制性受体LAG3的表达,并对其进行了功能分析。对微环境中免疫细胞的空间估算也显示,在MHC二类缺陷肿瘤细胞的附近,LAG3阳性T细胞增加。研究结果为肿瘤微环境提供了新的见解,并为霍奇金淋巴瘤靶向免疫检查点提供了新的方法。
Results
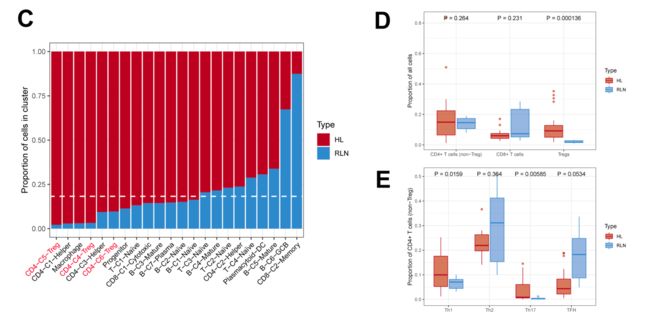
Fig1.Immunecell atlas of the Hodgkin lymphoma microenvironment at single-cellresolution.
为了研究霍奇金淋巴瘤里免疫细胞的转录组数据,作者选择了22个经典霍奇金淋巴瘤患者的淋巴结进行单细胞转录组测序,包括12个NS亚型,9个MC亚型,和一个LR亚型,也对5个正常人的淋巴结进行了单细胞测序。根据已知的marker的表达情况,作者将免疫细胞分成了22个亚型。但是并没有发现HRS细胞。
作者发现所有的三个treg cluster的来源组成中都只有一小部分是来源于正常组织。并对Treg的细胞来源比例做了t-test检验,发现淋巴瘤患者中的Treg显著高于正常人。在这三个Treg cluster中,细胞来源于淋巴瘤患者最多比例的是C5,呈现出LAG3和CTLA4的高表达。并且作者发现在非Treg的CD4细胞中,主要由Th2细胞组成,Th1和Th17细胞在淋巴瘤患者中显著高于正常人。
由于40%的经典霍奇金淋巴瘤与EBV感染恶性HRS细胞相关,并且有研究表明EBV可以在霍奇金淋巴瘤的肿瘤微环境中募集Treg细胞。所以作者比较了5位EBV阳性和17位EBV阴性患者的RNA测序数据。发现在EBV阳性肿瘤中Th17细胞显著降低。在Treg和CD8阳性T细胞中并没有发现差异。相似的是,与结节硬化的NS亚型相比,与EBV更相关的混合型MC亚型Th17细胞比例更低。
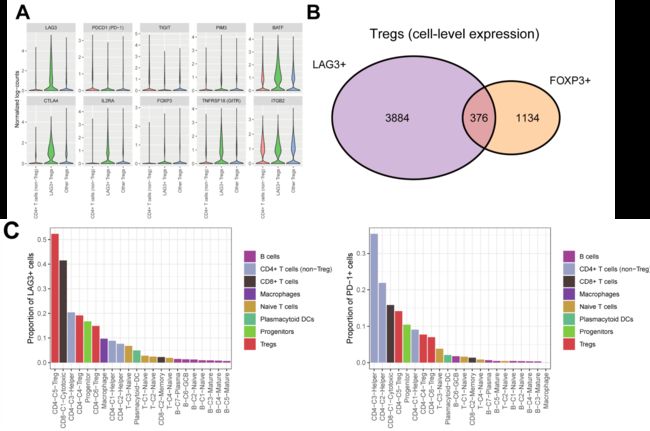
Fig2.Detailedcharacterization and co-expression patterns of regulatory T cells in thetumor microenvironment of classicHodgkin Lymphoma.
本研究中已经得到Treg细胞在肿瘤中占比更多,并且考虑到免疫抑制的肿瘤微环境作为肿瘤标志的重要性,作者将研究重点放在了Treg细胞中。尤其是肿瘤占比最高的C5。在C5中高表达LAG3和其他的经典Treg marker,比如IL2RA和TNFRSF18.但是也有一些经典marker比如FOXP3在这个cluster里并不共表达,暗示这群细胞是一型T reg细胞。为了更深入研究免疫抑制受体表达的特点,进一步研究了T细胞,发现LAG3表达的细胞多来自Treg,PD-1表达的细胞多少非Treg的CD4阳性T细胞,而且CD8细胞不是LAG3和PD1表达最高的细胞类型,说明CD4的再免疫检查点调节中作用更大。
从图D中也可以看出这几种免疫细胞LAG3和PD1的表达情况。接着在图E中展示了在不同的T细胞亚型中免疫抑制受体的的表达变化,说明每种免疫抑制受体在不同的T细胞亚型中的独特作用。并且在图F中可以看出大部分的LAG3阳性T细胞和CTLA4共表达,而不是PD1。为了探索LAG3阳性T细胞的功能,研究人员用所有的CD4T细胞根据分化状态绘制了Diffusion map。Dimension1从naiveT开始到Treg结束,LAG3阳性T细胞富集在这个维度的尾部,和终端分化的特征的基因相关。之前有报道称LAG3阳性T细胞通过显著抑制增殖活性来表达其免疫抑制的活性。而且LAG3阳性T细胞在Dimension2中处于中间到结束的部分,这个维度是和细胞周期和糖酵解相关联的。总之这个图提供了LAG3阳性的细胞具有增殖活性下降的依据。
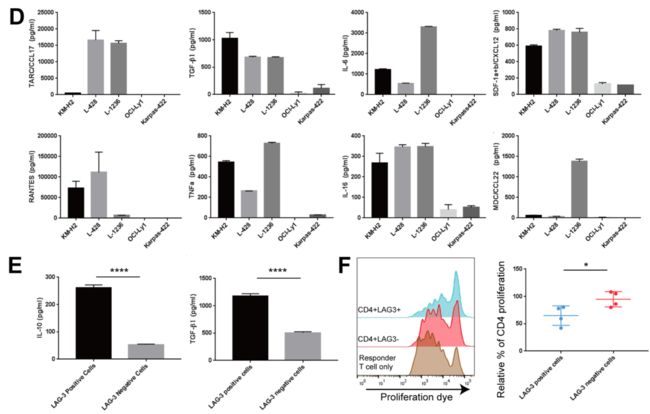
Figure3. An immune suppressive microenvironment is characteristic of cHLand is associated with LAG3 positivity.
为了判定在经典霍奇金淋巴瘤中Treg的免疫抑制特征,研究人员调查令LAG3阳性T细胞中的细胞因子的表达。用单细胞数据发现在LAG3阳性T细胞也就是蓝色代表的部分中免疫抑制的细胞因子IL10,TGFβ,IFNγ等表达比阴性也就是红色部分更高。这点和一型Treg细胞表达相近。为了研究LAG3阳性T细胞免疫抑制的表型,研究人员做了一系列实验验证。首先评估了不同淋巴瘤细胞系培养的上清液对T细胞体外扩增的影响。将PBMC和经典霍奇金淋巴瘤细胞系和弥漫性大b细胞淋巴瘤细胞系共培养还有单纯培养基培养作为对照等。图B为经典霍奇金淋巴瘤细胞系L1236共培养和单纯培养基培养的T细胞流式图,证明淋巴瘤中的LAG3阳性细胞确实比普通的CD4T细胞中比例高。图C也能说明在霍奇金淋巴瘤中LAG3T阳性T细胞的数量显著高于弥漫性大B细胞淋巴瘤和对照。
研究人员使用液相芯片技术测得和霍奇金淋巴瘤细胞系共培养的的上清中有比弥漫性大B细胞淋巴瘤的显著高表达的TARC,CCL17,TGFβ,IL6等已知的Treg迁移和分化的细胞因子。和单细胞转录组数据一致,通过流式分选出来的CD4阳性LAG3阳性的T细胞分泌的IL10 和TGFβ显著高于LAG3阴性的T细胞。通过F图可以看出在体外共培养的时候,CD4阳性LAG3阳性的T细胞抑制了responder CD4T细胞的增殖,进一步确定了LAG3阳性T细胞的免疫抑制作用。
Figure4. Spatial distribution of Hodgkin and Reed-Sternberg cells and LAG3+T cells in cHLtumors.
接下来作者想要研究LAG3阳性T细胞与恶性HRS细胞在空间上的关系。免疫组化证明了在经典霍奇金淋巴瘤中LAG3阳性T细胞数量确实显著高于正常淋巴结,并且在一部分霍奇金淋巴瘤中,HRS细胞被LAG3阳性细胞紧密包围。值得注意的是,在单细胞数据分析中MHC二类阴性的HRS细胞的6位患者中的LAG3的表达显著高于MHC二类阳性的16位患者。并且在MHC二类阴性患者和阳性患者的C5 treg细胞的差异基因对比中,LAG3是最高表达的。作者还进行了一系列免疫组化,染了很多marker 不仅说明LAG3在MHC二类阴性HRS细胞附近的T细胞中增高,也发现了FOXP3的降低。
作者还估算了HRS细胞到LAG3阳性CD4阳性T细胞之间的空间关系,包括分布密度和平均的最短相邻距离,都进行了量化,得到LAG3在MHC二类阴性HRS细胞附近的密度显著高于MHC二类阳性,并且距离也更近,然而FOXP3正好相反。通过多色免疫组化染色也能够证明LAG3和MHC二类阴性HRS细胞间的关系。
Figure5. Co-expression patterns and localization of immune cells according to HRS MHC-II status, using imaging mass cytometry.
为了进一步研究HRS细胞和他们周围细胞间的空间关系,研究人员选择了IMC成像质谱流式的方法,能够在肿瘤微环境中同时检测和可视化35个蛋白质标记的空间环境。与免疫组化结果一致,IMC也证明了MHC二类阴性的霍奇金淋巴瘤患者中LAG3阳性CD4阳性的细胞更多而且,FOXP3阳性CD4阳性的细胞更少。最右侧两张图是研究人员用算法将IMC的图计算后得到更清晰的图片。研究人员又扩大了cohort,在166名接受一线化疗药治疗的患者的免疫组化中进行验证,将LAG3阳性细胞在肿瘤组织的比例在MHC二类阳性阴性的病例中比较,得到结果与单细胞数据一致。MHC阴性患者中LAG3阳性细胞更多,而且与EBV的感染没有关系。
并且在大的cohort中发现了LAG3潜在的预后价值,但是P值不显著。
Figure6. Interactions of HRS cells and CD4+ LAG3+ T cells.
为研究HRS细胞与霍奇金淋巴瘤免疫微环境的联系,研究人员测得了显微切割得到的MHC二类阴性和阳性的HRS细胞和来自扁桃体生发中心的GCB细胞中各种细胞因子和趋化因子的蛋白表达。其中IL6是一种一型Treg分化的promoter,也是唯一一个在MHC二类阴性阳性中有差异的细胞因子。将PBMC分布和霍奇金淋巴瘤的细胞中共培养,在加入了IL6的培养基中培养,在只有培养基的细胞中培养,获得LAG3阳性T细胞在CD4阳性T细胞中的比例,前两者没有差异,后两者差异明显,说明IL6可以诱导CD4阳性LAG3阳性T细胞的生成。
已知MHC二类分子是LAG3的配体,为了研究LAG3阳性T细胞和HRS细胞中MHC二类分子的关系。对CIITA进行敲除,CIITA是MHC二类分子的主调节因子,已证实CIITA敲除细胞室MHC二类分子阴性的状态。发现MHC二类分子阳性的野生型中LAG3表达显著降低,说明LAG3阳性T细胞功能受到MHC二类分子的负调控。
之后研究人员想查看LAG3T细胞在病理中的作用,将从4位病人的T细胞和CD4,LAG3,CD25阳性的T细胞体外共培养,发现T细胞的增殖被抑制,增殖相关的细胞因子也被抑制。结果支持CD4阳性LAG3阳性的T细胞在经典霍奇金淋巴瘤的临床样本中的免疫抑制作用,为以LAG 3阳性T细胞及其相互作用为靶点,促进一部分患者T细胞的活化提供了临床前的理论基础。
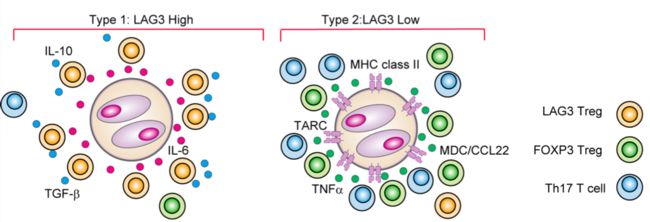
Figure7. A model of LAG3+ T cell and HRS cell interactions in classicHodgkin lymphoma.
整个实验结果验证了一个经典霍奇金淋巴瘤的免疫抑制微环境模型。
MHC-II阴性HRS细胞(1型)分泌细胞因子,诱导CD4+ T细胞中的LAG3。CD4+ LAG3+ T细胞包围HRS细胞并分泌抑制细胞因子。
MHC-II阳性细胞(2型)分泌一组独特的细胞因子,吸引FOXP3+和Th17细胞。
总之这些发现将有助于更深入地了解cHL免疫逃逸表型的机制,并有助于开发新的生物标志物和治疗策略。