说明:此篇笔记系2016-2017年由克里克学院与康昱盛主办的蛋白质组学网络大课堂整理而成,侵删。该课程由复旦大学生物医学研究院(IBS)的刘晓慧博士所授。
主要知识点:
--自动化样品前处理的新方法一:StageTips
--自动化样品前处理的新方法二:PCT压力循环系统
--样本前处理总结
背景介绍
自从进入了精准医学时代,蛋白质组学的发展也朝着精准医学临床应用的方向在不断发展。
我们知道,在临床应用领域,常常需要用更多的样品量来进行研究分析,得到更多的结果。比如,用几十上百例的蛋白质组学样品来进行肿瘤分析。2014年Nature上发表过一篇文章,做了95例大肠癌的分析,通过label free结果对95例进行分型。与之前的ATGC方法把大肠癌分成四个型比起来,蛋白质组学的方法可以更精准地分成五个型。这也是蛋白质组学在精准医学领域一个很好的应用实例。
(Bing Zhang, Jing Wang, et al, Proteogenomic characterization of human colon and rectal cancer,nature,2014,3,382)
接下来我们分享两种新方法,都可以实现简单、可重复且自动化的样品前处理效果。
StageTips
第一种方法最早发表于2007年,到今年已经成立了一家公司,将这种方法发展出来的装置很好地商业化了。
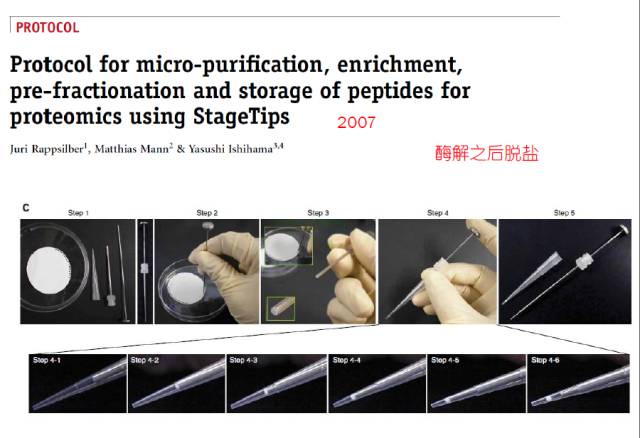
当时,整套装置还需要手工来组装。不过组装的方法也非常简单,根据上面的图,分五步走:
第一步:准备好一张3M的C18过滤膜,一个枪头,一个平口的针头和一个长手柄;
第二步+第三步:在3M膜上取出一个小孔的膜,
第四步:将膜捅到EP管里面,用气把它压紧了,形成一个小的膜系统。
第五步:取出手柄和针头,带膜的枪头就完成了。
C18过滤膜有脱盐的效果,可以把蛋白质或肽段截留在上面,通过水或BUFFER体系把盐洗掉,之后再通过有机相把肽段或蛋白从C18膜上洗脱下来。
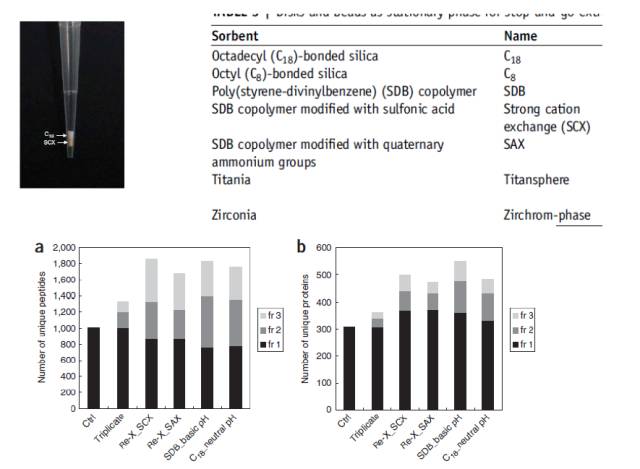
除了C18膜,还有很多种类型的膜,比如强阳离子膜、阴离子膜等。大伙儿看看下面这个图,感受一下这些膜的名字和成分。
这里的柱状图是对比不同的膜处理后能鉴定到的肽段的数量,左图是肽段水平的鉴定,右图是蛋白水平的鉴定,差别都不太大(图里的fr1,2,3是指馏分)。通过这个膜系统,可以进行分级分离,也可以进行脱盐。
时间走到2009年,又出现了一种新的FASP( filter-aided sample preparation)方法。之前的Stagetips只是为了进行分级和富集,而FASP可进行酶解(文献见下图)。
到了2014年,这个团队又将StageTips和FASP方法结合起来,实现了所有的实验都在这个小管子里完成,样品加入后先清洗,然后还原,清洗,烷基化,再清洗,最后酶解。酶解后的肽段一直留在下图的“Reaction chamber”里,然后将肽段通过下方的膜脱盐,洗脱,或者直接通过它进行馏分的分离,收集样品。
四次重复实验检测发现,用这种装置做下来,四次都能被重复的蛋白有92.9%,只有1.6%的蛋白是其中任意一次单独鉴定到的,1.5%是其中两次鉴定到的,4.0%是其中三次鉴定到的。如果我们考虑到这个实验一共鉴定到了9,667个蛋白(human proteins),在保证了较高的鉴定率的前提下,92.9%的四次重复率已经相当不错了!并且信号强度也比较一致。由于管子体积的限制,这套装置很适合少量样品的分析。
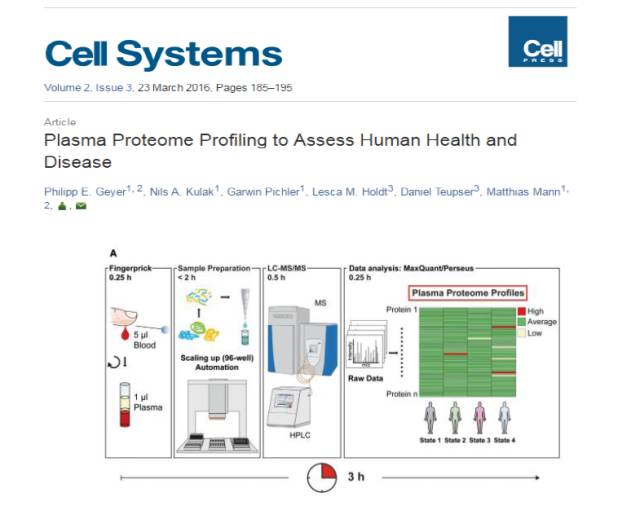
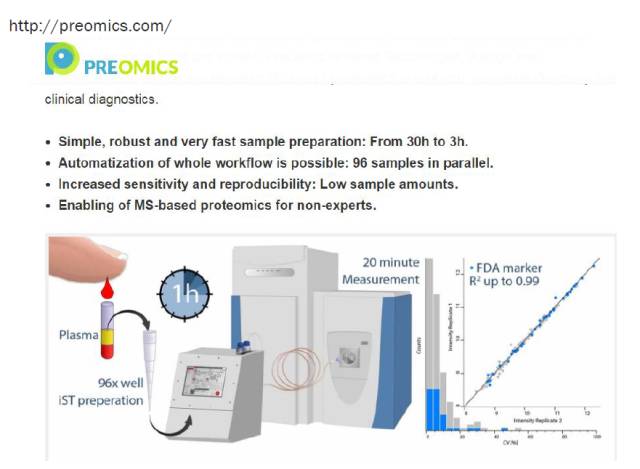
该方法已经商业化。2016年Cell Systems上发表了一篇用这套商业化的装置做的血液样品案例。如下图,把血液样品取出来后,直接加到装备了膜系统的EP管里。通过优化整个酶解系统,整个前处理过程2个小时之内就能完成,其中裂解与还原烷基化是同时完成的。完成之后通过一个自动化仪器,进入质谱,经过0.5小时的质谱实验,以及15分钟的结果分析,最后鉴定到了300多个常规的中高丰度蛋白(这个例子中没有对血液中的高丰度蛋白进行去除)。
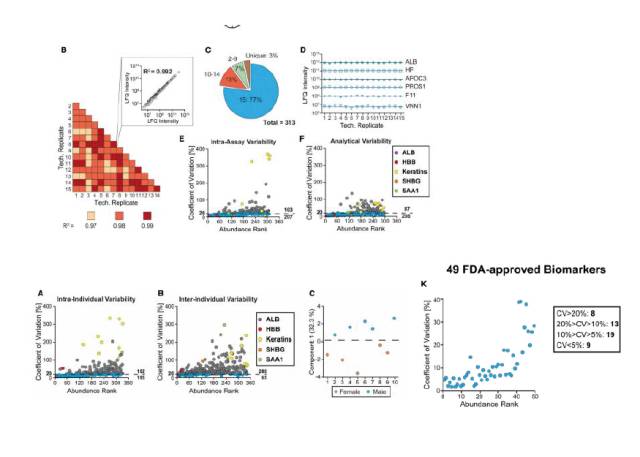
同样的,文章里也对这次实验进行了重复性评估,见下图。
从图上看,鉴定的重复性特别好,尤其是49种FDA批准的Biomarkers中,有41种的CV值都小于20%,说明这些biomarkers可以通过该方法可重复地检测到。这个方法被认为很有希望发展为高通量样品处理的方案。
Tips:
CV值:Coefficient of Variation,反映数据离散程度的绝对值。在进行数据统计分析时,如果变异系数大于15%~20%,则要考虑该数据可能不正常,应该剔除 。
以上是该公司的网址,有兴趣的小伙伴可以登上去看看。目前最新的进展是,重复性可以到0.99,样品处理时间缩短到了1个小时,再加上20分钟的质谱分析,总体实验时间得到了很好地控制,实现了简单快速高效且可重复的要求!我们期待这个方法能早时用到临床样品的检测上。
PCT压力循环系统
第二种新方法叫PCT压力循环系统。
刚才讲到,可以通过压力差来进行样品的破碎和蛋白的提取。另外,我们知道,在高压条件下,很多反应是会提高效率的,比如说酶解、还原烷基化、样品裂解等。下面这篇文章通过分析穿刺的样品(量非常少,大概只有1立方毫米),放到PCT装置里,通过样品的处理,还原烷基化,酶解,酶解之后脱盐,取出,直接进行SWATH分析。
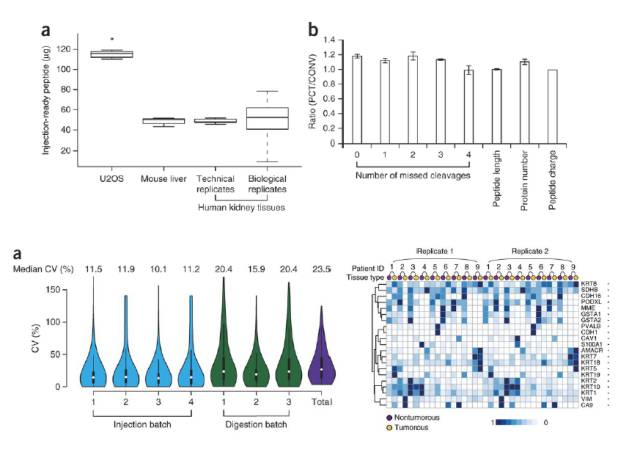
我们来看下这种方法的结果评估。图示上方的a 图表明结果的SD(样品标准差)都很小,说明检测结果很精确;b图表明漏切的位点也很少.
图示下方的a图表明,可重复性CV值基本上都小于20%,只有其中两次的重复性实验中差异大了一点。
文章里用这个方法分析了9对胃癌的癌症与癌旁组织,然后找到了一组蛋白成为癌症的潜在标志物。
以上是两种在蛋白质临床检测方面非常有前途的方法,都实现了快速、高通量、高重现性,自动化的处理,感兴趣的童鞋可以重点关注一下。
第二讲总结
最后,我们对整个第二讲的内容进行一个小结,如下图: