【笔记总结】高中化学——【选四 Ⅰ】原电池&电解池
化学,我弱势学科中的弱势学科 QWQ
笔记酱拜托啦!我的攻坚战就靠你了!
一、原电池
定义:利用氧化还原反应将化学能—>电能的装置
组成:电极 + 导线 + 电解质溶液(+盐桥:持续提供阴阳离子 使装置持续工作)
条件:
①两电极活泼性有差异(不一定都是金属
②电极均与电解质溶液接触
③形成 电极A->溶液->电极B->导线->电极A的闭合回路
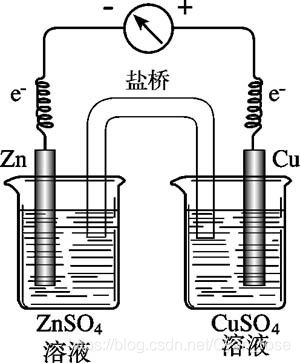
工作现象:
重点考点有三:原电池工作方式,原电池正负极判断,原电池反应式书写。下面一个一个说:
Ⅰ 原电池工作方式
这只是一个笼统的名字,具体说来就是选择题最喜欢考那一套:正负阴阳,粒子移向。
(但注意我们一般原电池讲正负极,电解池讲阴阳极)
说白了也很简单:
①阴极=正极=电子流出=阴离子流向,阳极=负极=电子流入=正离子流向*
②给定电子流向/电流方向,很简单,不多BB
③给定正负,可以直接确定电流方向
④给定阴阳,可以直接确定离子流向
其实到最后熟能生巧,看啥都能直接判断所有,但没完全掌握尤其是容易弄错阴阳正负的,最好还是把所有都写出来~
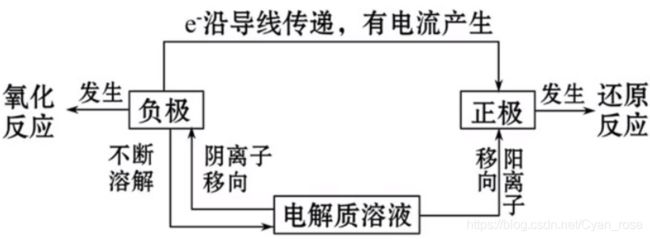
Ⅱ 原电池正负极判断
1、给定正负极和溶液
说白了一句话:反应优先度大的是负极
细分下来:
都可以/都不可以与溶液反应时,比较活泼性大小;
否则,能反应的一方是负极。
2、给定反应方程式
这时候就要用氧化还原来判断了。根据**“升失氧还原剂,降得还氧化剂”**。
由于失去电子=电子流出=负极,所以价态升高的为负极,降低的为正极。
3、给定电流方向/电子流动方向/离子流动方向
一般遇到这个条件,直接构造出电流的循环流动方向:电流方向=电子流动反方向=正离子流动反方向=负离子移动方向
然后就好判断了~
4、特殊条件
①给定生成气体/生成沉淀。这时候要根据溶液成分,判断气体到底怎么来的(得/失电子),然后判断
②有可能是书上出现的实验,这时候根本不说别的只给你名字(所以要牢记书上实验啊QAQ
Ⅲ 原电池反应式书写
1、准备工作
①确认电极材料,分清正负极。这一步用Ⅱ来分析
②确认溶液中酸碱性,若是非水体系就找特殊离子如 C O 3 2 − CO_3^{2-} CO32−。有时会直接给,有时要结合电极材料分析。
③确认到底是在充电还是在放电
其中,起决定性作用的是①,最麻烦的是②,最坑人的是③(废话)
2、如何书写
下面只挑选放电来说,充电的话把正负极写法交换就行:
①放电时负极失电子,正极得电子。反正,先把 ± e − ±e^- ±e−写在那里,留个空写系数
②把电极材料和生成产物先写在两边,然后根据氧化还原的知识先把能配平的配平
③最关键的一步!此时方程式的左侧应该会少一些H+/O2-之类的离子,那么这时候就要根据准备工作②中的信息来处理了:
1、酸性环境,H+较多,又因为H+向正级移动,所以负极方程式用H2O配平,正极方程式用H+配平
2、碱性环境,OH-较多,与上面同理,负极方程式用OH-配平,正极方程式用H2O配平
3、带有特殊粒子,比如CO32-,负极用CO32-,正极用CO2
④根据左边确定下来的用来配平的粒子,右边写点H2,H+,OH-什么的来元素守恒,但一定要根据溶液的酸碱性来写!
⑤如果给了总反应式,加起来看看是不是刚好一致
一般遇到电化学题目的话,原电池考察的重点就是以上环节。至于难点,我没啥发言权(毕竟都不会),但遇到过的体型中,还可以定量/定性的考察某一物质在放电/充电过程中的量的变化,抑或是替换电解质溶液/添加某物质后考察发生的变化/可行性。当然还可以跟电解池梦幻联动。
二、电解池
首先电解:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程,叫做电解。实质是电解质溶液导电的过程
组成的话在原电池的基础上加了电源, 能量转化是电能->化学能
条件也不再要求阴阳极有活泼性的差异,但仍有阳极丢电子,阴级得电子
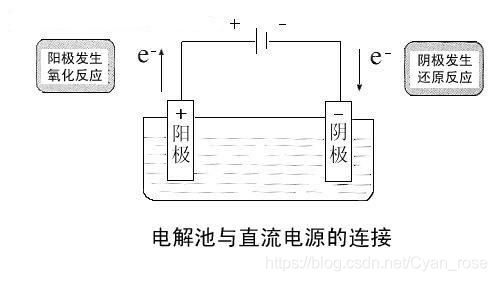
实际上我们仍然可以用原电池的理论解决大多数问题,至少正负阴阳的判断在这里仍然生效
所以我们着重说一下方程式怎么写。(其实个人认为比原电池的方便)
①首先明确一个生成物质的顺序:
阴极:氧化性强的离子先得电子
A g + > H g 2 + > F e 3 + > C u 2 + > H + ( Ag^+>Hg^{2+}>Fe^{3+}>Cu^{2+}>H^+( Ag+>Hg2+>Fe3+>Cu2+>H+(酸溶液 ) > P b 2 + > S n 2 + > F e 2 + )>Pb^{2+}>Sn^{2+}>Fe^{2+} )>Pb2+>Sn2+>Fe2+
> Z n 2 + > H + ( >Zn^{2+}>H^+( >Zn2+>H+(水溶液 ) > A l 3 + > M g 2 + > N a + > C a 2 + > K + )>Al^{3+}>Mg^{2+}>Na^+>Ca^{2+}>K^+ )>Al3+>Mg2+>Na+>Ca2+>K+
这顺序其实基本就是初中背过的金属活泼性表,因为是离子所以按氧化性排序时反过来。
阳极:阳极金属或还原性强的离子先失电子
活性电极 > S 2 − > I − > B r − > C l − > O H − > N > S > F − >S^{2-}>I^->Br^->Cl^->OH^->N>S>F^- >S2−>I−>Br−>Cl−>OH−>N>S>F−
也是初中背过的非金属活泼性表倒过来,不过加入了新的东西
②然后根据反应物对应会生成的物质+溶液性质,写出生成物,然后配平再配平
③写完啦!加起来看看总反应式正不正常就ok
总结上我没有发言权……基本都没做对过多少QVQ……
后面暂时先留白吧,等有空了做了一些题再回来写写题型总结